Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
nowo rozpoznaną przewlekłą białaczką szpikową (CML, ang. chronic myelogenous leukemia) z chromosomem Philadelphia (Ph+, ang. Philadelphia chromosome positive) w fazie przewlekłej,
przewlekłą białaczką szpikową w fazie przewlekłej, w fazie akceleracji lub w fazie przełomu blastycznego w przypadku oporności lub nietolerancji na uprzednie leczenie, w tym leczenie imatynibem,
ostrą białaczką limfoblastyczną (ALL, ang. acute lymphoblastic leukaemia) z chromosomem Philadelphia (Ph+) oraz z limfoblastyczną postacią przełomu blastycznego CML, w przypadku oporności lub nietolerancji wcześniejszej terapii.
Produkt leczniczy Dasatinib Krka jest wskazany w leczeniu dzieci i młodzieży z:
nowo rozpoznaną przewlekłą białaczką szpikową z chromosomem Philadelphia w fazie przewlekłej (Ph+ CML CP, ang. Philadelphia chromosome-positive chronic myelogenous leukaemia in chronic phase) lub Ph+ CML CP w przypadku oporności lub nietolerancji na uprzednie leczenie, w tym leczenie imatynibem,
nowo rozpoznaną Ph+ ALL w skojarzeniu z chemioterapią.
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
pacjentów z opornością lub nietolerancją na imatynib nastąpiła progresja choroby do CML w fazie blastycznej.
U 33 dzieci i młodzieży z nowo rozpoznaną CML CP stosowano dazatynib w postaci proszku do sporządzania zawiesiny doustnej w dawce 72 mg/m2 pc. Ta dawka odpowiada ekspozycji mniejszej o 30% w porównaniu z zalecaną dawką. U tych pacjentów wskaźnik CCyR wynosił 87,9% [95% CI: (71,8-96,6)], a wskaźnik MMR 45,5% [95% CI: (28,1-63,6)] po 12 miesiącach.
Wśród dzieci i młodzieży z CML CP leczonych dazatynibem, którzy wcześniej otrzymywali imatynib, mutacjami wykrywanymi pod koniec leczenia były: T315A, E255K i F317L. Jednak przed leczeniem mutacje E255K i F317L również były wykrywane. U pacjentów z nowo rozpoznaną CML CP nie wykryto żadnych mutacji pod koniec leczenia.
Dzieci i młodzież z ALL
Skuteczność dazytynibu w skojarzeniu z chemioterapią oceniano w badaniu głównym z udziałem dzieci powyżej jednego roku życia i młodzieży z nowo rozpoznaną Ph+ ALL.
W tym wieloośrodkowym badaniu II fazy, z historyczną grupą kontrolną oceniano dazatynib
podawany w uzupełnieniu do chemioterapii standardowej, 106 dzieciom i młodzieży z nowo rozpoznaną Ph+ ALL, z czego 104 pacjentów miało potwierdzoną Ph+ ALL, podawano dazatynib w dawce dobowej 60 mg/m2 w sposób ciągły przez maksymalnie 24 miesiące, w skojarzeniu z chemioterapią. Osiemdziesięciu dwóch pacjentów otrzymywało wyłącznie dazatynib w postaci tabletek, a 24 pacjentów przynajmniej raz przyjęło dazatynib w postaci proszku do sporządzania zawiesiny doustnej, z czego 8 pacjentów stosowało wyłącznie dazatynib w postaci proszku do sporządzania zawiesiny doustnej. Schemat chemioterapii podstawowej był taki sam, jak w badaniu AIEOP-BFM ALL 2000 (protokół standardowej chemioterapii wielolekowej). Pierwszorzędowym punktem końcowym do oceny skuteczności był odsetek 3-letnich przeżyć wolnych od zdarzeń (EFS, ang. event-free survival), który wynosił 65,5% (55,5; 73,7).
Odsetek ujemnych wyników badania w kierunku minimalnej choroby resztkowej (MRD, ang, minimal residual disease) oceniany na podstawie rearanżacji genów Ig/TCR wyniósł 71,7% do końca konsolidacji u wszystkich leczonych pacjentów. Kiedy odsetek ten określono u 85 pacjentów z możliwymi do oceny wynikami badania Ig/TCR, jego szacunkowa wartość wyniosła 89,4%. Odsetek ujemnych wyników badania w kierunku minimalnej choroby resztkowej na koniec indukcji i konsolidacji mierzony metodą cytometrii przepływowej wyniósł odpowiednio 66,0% i 84,0%.
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Dasatinib Krka, 20 mg, tabletki powlekane Dasatinib Krka, 50 mg, tabletki powlekane Dasatinib Krka, 70 mg, tabletki powlekane Dasatinib Krka, 80 mg, tabletki powlekane Dasatinib Krka, 100 mg, tabletki powlekane Dasatinib Krka, 140 mg, tabletki powlekane
Dasatinib Krka, 20 mg, tabletki powlekane
Każda tabletka powlekana zawiera 20 mg dazatynibu.
Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera 26 mg laktozy.
Dasatinib Krka, 50 mg, tabletki powlekane
Każda tabletka powlekana zawiera 50 mg dazatynibu.
Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera 66 mg laktozy.
Dasatinib Krka, 70 mg, tabletki powlekane
Każda tabletka powlekana zawiera 70 mg dazatynibu.
Substancja pomocnicza o znanym działaniu Każda tabletka powlekana zawiera 92 mg laktozy.
Dasatinib Krka, 80 mg, tabletki powlekane
Każda tabletka powlekana zawiera 80 mg dazatynibu.
Substancja pomocnicza o znanym działaniu
Każda tabletka powlekana zawiera 105 mg laktozy.
Dasatinib Krka, 100 mg, tabletki powlekane
Każda tabletka powlekana zawiera 100 mg dazatynibu.
Substancja pomocnicza o znanym działaniu
Każda tabletka powlekana zawiera 131 mg laktozy.
Dasatinib Krka, 140 mg, tabletki powlekane
Każda tabletka powlekana zawiera 140 mg dazatynibu.
Substancja pomocnicza o znanym działaniu
Każda tabletka powlekana zawiera 184 mg laktozy. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka powlekana (tabletka).
Dasatinib Krka, 20 mg, tabletki powlekane
Biała lub biaława, obustronnie wypukła, okrągła tabletka powlekana o średnicy około 5,6 mm, z wytłoczonym „D7SB” po jednej stronie i „20” po drugiej stronie.
Dasatinib Krka, 50 mg, tabletki powlekane
Biała lub biaława, obustronnie wypukła, owalna tabletka powlekana o długości około 11,0 mm i szerokości około 6,0 mm, z wytłoczonym „D7SB” po jednej stronie i „50” po drugiej stronie.
Dasatinib Krka, 70 mg, tabletki powlekane
Biała lub biaława, obustronnie wypukła, okrągła tabletka powlekana o średnicy około 9,1 mm, z wytłoczonym „D7SB” po jednej stronie i „70” po drugiej stronie.
Dasatinib Krka, 80 mg, tabletki powlekane
Biała lub biaława, obustronnie wypukła, trójkątna tabletka powlekana o długości około 10,4 mm i szerokości około 10,6 mm, z wytłoczonym „D7SB” po jednej stronie i „80” po drugiej stronie.
Dasatinib Krka, 100 mg, tabletki powlekane
Biała lub biaława, obustronnie wypukła, owalna tabletka powlekana o długości około 15,1 mm i szerokości około 7,1 mm, z wytłoczonym „D7SB” po jednej stronie i „100” po drugiej stronie.
Dasatinib Krka, 140 mg, tabletki powlekane
Biała lub biaława, obustronnie wypukła, okrągła tabletka powlekana o średnicy około 11,7 mm, z wytłoczonym „D7SB” po jednej stronie i „140” po drugiej stronie.
Produkt leczniczy Dasatinib Krka jest wskazany w leczeniu dorosłych pacjentów z:
Leczenie powinien rozpoczynać lekarz z doświadczeniem w rozpoznawaniu i leczeniu białaczki. Dawkowanie
Dorośli pacjenci
Zalecana dawka początkowa dazatynibu w fazie przewlekłej CML wynosi 100 mg raz na dobę.
Zalecana dawka początkowa dazatynibu w fazie akceleracji, mieloblastycznej lub limfoblastycznej postaci przełomu blastycznego (faza zaawansowana) CML, lub w ostrej białaczce limfoblastycznej z chromosomem Philadelphia (Ph+ ALL) wynosi 140 mg raz na dobę (patrz punkt 4.4).
Dzieci i młodzież (Ph+ CML CP i Ph+ ALL)
Dawkowanie u dzieci i młodzieży ustala się w zależności od masy ciała (patrz Tabela 1). Dazatynib jest podawany doustnie raz na dobę w postaci tabletek powlekanych lub w postaci proszku do sporządzania zawiesiny doustnej. Dawkę należy przeliczać co 3 miesiące z uwzględnieniem zmian masy ciała lub częściej, o ile jest to konieczne. Nie zaleca się stosowania tabletek u pacjentów o masie ciała mniejszej niż 10 kg; u tych pacjentów należy stosować proszek do sporządzania zawiesiny doustnej. Zaleca się zwiększenie lub zmniejszenie dawki w zależności od indywidualnej odpowiedzi pacjenta na leczenie i tolerancji. Nie ma doświadczenia w leczeniu produktem leczniczym Dasatinib Krka u dzieci w wieku poniżej 1 roku.
Dazatynib w postaci tabletek powlekanych i w postaci proszku do sporządzania zawiesiny doustnej nie jest biorównoważny. Pacjenci, którzy są w stanie połykać tabletki i chcą zmienić stosowanie dazatynibu w postaci proszku do sporządzania zawiesiny doustnej na stosowanie dazatynibu w tabletkach lub pacjenci, którzy nie są w stanie połykać tabletek i chcą zamienić tabletki na zawiesinę doustną, mogą to zrobić, pod warunkiem, że będą przestrzegać prawidłowych zaleceń dotyczących dawkowania danej postaci farmaceutycznej.
Zalecane początkowe dawkowanie dobowe produktu leczniczego Dasatinib Krka w postaci tabletek u dzieci i młodzieży przedstawiono w Tabeli 1.
Tabela 1: Dawkowanie produktu leczniczego Dasatinib Krka w postaci tabletek u dzieci i młodzieży z Ph+ CML CP lub Ph+ ALL
Masa ciała (kg)a | Dawka dobowa (mg) |
10 do mniej niż 20 kg | 40 mg |
20 do mniej niż 30 kg | 60 mg |
30 do mniej niż 45 kg | 70 mg |
co najmniej 45 kg | 100 mg |
a Nie zaleca się stosowania tabletek u pacjentów o masie ciała mniejszej niż 10 kg; u tych pacjentów należy stosować proszek do sporządzania zawiesiny doustnej.
Czas trwania leczenia
W badaniach klinicznych, leczenie z użyciem dazatynibu u dorosłych z Ph+ CML CP, w fazie akceleracji, z mieloblastyczną lub limfoblastyczną postacią przełomu blastycznego (faza zaawansowana) CML lub Ph+ ALL oraz u dzieci i młodzieży z Ph+ CML CP prowadzono do czasu progresji choroby lub wystąpienia nietolerancji leczenia przez pacjenta. Nie badano wpływu zaprzestania leczenia po osiągnięciu cytogenetycznej lub molekularnej odpowiedzi [w tym pełnej odpowiedzi cytogenetycznej (CCyR, ang. complete cytogenetic response), większej odpowiedzi molekularnej [MMR, (ang. major molecular response) i MR4.5] na odległe skutki choroby.
W badaniach klinicznych, leczenie z użyciem dazatynibu u dzieci i młodzieży z Ph+ ALL stosowano w sposób ciągły, w uzupełnieniu do kolejnych bloków chemioterapii podstawowej, maksymalnie przez dwa lata. U pacjentów, którzy przechodzą następnie przeszczepienie komórek macierzystych, dazatynib można podawać dodatkowo przez rok po przeszczepieniu.
Produkt leczniczy Dasatinib Krka jest dostępny w postaci tabletek powlekanych o mocy 20 mg, 50 mg, 70 mg, 80 mg, 100 mg i 140 mg, aby umożliwić podanie zalecanej dawki. Zaleca się zwiększenie lub zmniejszenie dawki w zależności od odpowiedzi pacjenta na leczenie i tolerancji.
Zwiększanie dawki
W badaniach klinicznych u dorosłych pacjentów z CML oraz z Ph+ ALL zwiększenie dawki do 140 mg raz na dobę (faza przewlekła CML) lub do 180 mg raz na dobę (faza zaawansowana CML lub Ph+ ALL) dozwolone było u pacjentów, u których po zastosowaniu zalecanej dawki początkowej nie uzyskano odpowiedzi hematologicznej lub cytogenetycznej.
Następujące zwiększanie dawkowania, które przedstawiono w Tabeli 2., zalecane jest u dzieci i młodzieży z Ph+ CML CP, u których nie uzyskano odpowiedzi hematologicznej, cytogenetycznej i molekularnej w zalecanych punktach w czasie, zgodnie z aktualnymi wytycznymi terapeutycznymi, a którzy tolerowali leczenie.
Tabela 2: Zwiększanie dawki u dzieci i młodzieży z Ph+ CML CP
Dawka (maksymalna dawka dobowa) | ||
Dawka początkowa | Zwiększanie dawki | |
Tabletki | 40 mg | 50 mg |
60 mg | 70 mg | |
70 mg | 90 mg | |
100 mg | 120 mg | |
Nie zaleca się zwiększania dawki u dzieci i młodzieży z Ph+ ALL, ponieważ u tych pacjentów dazatynib podaje się w skojarzeniu z chemioterapią.
Zmiana dawkowania ze względu na działania niepożądane Zahamowanie czynności szpiku kostnego
W przypadku wystąpienia zahamowania czynności szpiku kostnego podczas badań klinicznych stosowano przerwy w podawaniu kolejnych dawek, zmniejszenie dawki lub przerwanie leczenia. Jeśli było to wskazane, stosowano także przetoczenia płytek krwi i masy czerwonokrwinkowej. U pacjentów z przedłużającym się zahamowaniem czynności szpiku kostnego stosowano hematopoetyczny czynnik wzrostu.
W Tabeli 3. podsumowano wytyczne dotyczące dostosowania dawki u dorosłych pacjentów, a w Tabeli 4. u dzieci i młodzieży z Ph+ CML CP. Wytyczne dotyczące dzieci i młodzieży z Ph+ ALL leczonych w skojarzeniu z chemioterapią znajdują się w oddzielnym akapicie pod tabelami.
Tabela 3: Dostosowanie dawki w przypadku neutropenii i małopłytkowości u dorosłych
Dorośli z CML w fazie przewlekłej (dawka początkowa 100 mg raz na dobę) | ANC < 0,5 x 109/l i (lub) liczba płytek krwi < 50 x 109/l | ≥ 1,0 x 109/l oraz liczba płytek krwi ≥ 50 x 109/l. < 25 x 109/l i (lub) ANC < 0,5 x 109/l utrzymujących się przez > 7 dni, powtórzyć postępowanie podane w punkcie 1. i wznowić leczenie w mniejszej dawce 80 mg raz na dobę w przypadku drugiego epizodu. W przypadku trzeciego epizodu należy zmniejszyć dawkę do 50 mg raz na dobę (u nowo zdiagnozowanych pacjentów) lub przerwać leczenie (u pacjentów z opornością lub nietolerancją na wcześniejsze leczenie, w tym leczenie imatynibem). |
Dorośli z CML w fazie akceleracji lub fazie przełomu blastycznego i Ph+ ALL (dawka początkowa 140 mg raz na dobę) | ANC < 0,5 x 109/l i (lub) liczba płytek krwi < 10 x 109/l |
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Klinicznie istotne interakcje
Dazatynib jest substratem i inhibitorem cytochromu P450 (CYP3A4). Dlatego istnieje możliwość wystąpienia interakcji z innymi jednocześnie stosowanymi produktami leczniczymi metabolizowanymi głównie przez CYP3A4 lub takimi, które wpływają na jego aktywność (patrz punkt 4.5).
Jednoczesne stosowanie dazatynibu i innych produktów leczniczych lub substancji, które silnie hamują CYP3A4 (np. ketokonazolu, itrakonazolu, erytromycyny, klarytromycyny, rytonawiru, telitromycyny, soku grejpfrutowego) może zwiększać ekspozycję na dazatynib. Dlatego, nie zaleca się stosowania silnych inhibitorów CYP3A4 u pacjentów przyjmujących dazatynib (patrz punkt 4.5).
Jednoczesne stosowanie dazatynibu i produktów leczniczych, które indukują CYP3A4 (np. deksametazonu, fenytoiny, karbamazepiny, ryfampicyny, fenobarbitalu lub produktów roślinnych zawierających ziela dziurawca [Hypericum perforatum]) może znacznie zmniejszyć ekspozycję na dazatynib, zwiększając potencjalnie ryzyko niepowodzenia terapeutycznego. Dlatego u pacjentów otrzymujących dazatynib należy stosować inne, alternatywne produkty lecznicze, o słabszym działaniu indukującym CYP3A4 (patrz punkt 4.5).
Jednoczesne stosowanie dazatynibu i substratów CYP3A4 może zwiększyć ekspozycję na substrat CYP3A4. Dlatego, należy zachować ostrożność stosując dazatynib równocześnie z substratami CYP3A4 o wąskim zakresie terapeutycznym, takimi jak astemizol, terfenadyna, cyzapryd, pimozyd, chinidyna, beprydyl lub alkaloidy sporyszu (ergotamina, dihydroergotamina) (patrz punkt 4.5).
Jednoczesne stosowanie dazatynibu i antagonistów receptora histaminowego typu 2 (H2) (np. famotydyny), inhibitorów pompy protonowej (np. omeprazolu) lub wodorotlenku glinu/wodorotlenku magnezu może zmniejszyć ekspozycję na dazatynib. Dlatego, nie zaleca się stosowania antagonistów receptora H2 i inhibitorów pompy protonowej, a produkty lecznicze zawierające wodorotlenek glinu/wodorotlenek magnezu powinny być podawane do 2 godzin przed lub 2 godziny po podaniu dazatynibu (patrz punkt 4.5).
Szczególne populacje
Na podstawie wyników badań farmakokinetycznych po zastosowaniu pojedynczej dawki, pacjenci z łagodnymi, umiarkowanymi lub ciężkimi zaburzeniami czynności wątroby mogą otrzymywać
zalecaną dawkę początkową (patrz punkt 5.2). Ze względu na ograniczenia tego badania klinicznego, zaleca się zachowanie ostrożności podczas podawania dazatynibu pacjentom z zaburzeniami czynności wątroby.
Ważne działania niepożądane
Zahamowanie czynności szpiku kostnego
Stosowanie dazatynibu wiąże się z wystąpieniem niedokrwistości, neutropenii oraz małopłytkowości. Do ich wystąpienia dochodzi wcześniej i częściej u pacjentów z CML w fazie zaawansowanej lub z Ph+ ALL, niż u pacjentów z CML w fazie przewlekłej. U dorosłych pacjentów z CML w fazie zaawansowanej lub z Ph+ ALL leczonych dazatynibem w monoterapii badanie morfologii krwi z rozmazem (CBCs, ang. complete blood counts) należy wykonywać co tydzień w trakcie pierwszych 2 miesięcy leczenia, a następnie co miesiąc lub zgodnie ze wskazaniami klinicznymi. U dorosłych oraz u dzieci i młodzieży z CML w fazie przewlekłej badanie morfologii krwi z rozmazem należy wykonywać co 2 tygodnie przez 12 tygodni, a następnie co 3 miesiące lub zgodnie ze wskazaniami klinicznymi. U dzieci i młodzieży z Ph+ ALL leczonych dazatynibem w skojarzeniu z chemioterapią badanie CBC należy wykonywać przed rozpoczęciem każdego bloku chemioterapii, a także zgodnie ze wskazaniami klinicznymi. W trakcie konsolidacyjnych bloków chemioterapii badanie CBC należy wykonywać co 2 dni aż do czasu ustąpienia objawów (patrz punkty 4.2 i 4.8). Zahamowanie czynności szpiku kostnego jest zasadniczo odwracalne i ustępowało po tymczasowym wstrzymaniu podawania dazatynibu lub po zmniejszeniu dawki.
Krwawienie
U pacjentów z CML w fazie przewlekłej (n=548), krwawienie 3. lub 4. stopnia wystąpiło u
5 pacjentów (1%) otrzymujących dazatynib. W badaniach klinicznych z udziałem pacjentów z CML w fazie zaawansowanej, otrzymujących zalecaną dawkę dazatynibu (n=304), ciężkie krwawienie w ośrodkowym układzie nerwowym (OUN) wystąpiło u 1% pacjentów. W jednym przypadku nastąpił zgon i był związany z małopłytkowością stopnia 4. według kryteriów CTC (ang. Common Toxicity Criteria). Krwawienie z przewodu pokarmowego stopnia 3. lub 4. wystąpiło u 6% pacjentów z CML w fazie zaawansowanej i w większości przypadków konieczne było przerwanie leczenia i podanie preparatów krwi. Inne krwawienia stopnia 3. lub 4. wystąpiły u 2% pacjentów z CML w fazie zaawansowanej. Większość działań niepożądanych związanych z krwawieniem u tych pacjentów związanych było zazwyczaj z małopłytkowością stopnia 3. lub 4. (patrz punkt 4.8).
Ponadto, badania z zastosowaniem płytek krwi w warunkach in vitro i in vivo sugerują, że stosowanie dazatynibu wpływa w odwracalny sposób na aktywację płytek.
Należy zachować ostrożność u pacjentów, u których konieczne jest stosowanie produktów leczniczych hamujących czynność płytek krwi lub przeciwzakrzepowych.
Retencja płynów
Dazatynib powoduje retencję płynów. W badaniu klinicznym III fazy u pacjentów z nowo rozpoznaną CML w fazie przewlekłej, retencję płynów stopnia 3. lub 4. obserwowano u 13 pacjentów (5%) w badanej grupie stosującej dazatynib i u 2 pacjentów (1%) w badanej grupie stosującej imatynib po co najmniej 60 miesiącach obserwacji (patrz punkt 4.8). Spośród wszystkich pacjentów z CML w fazie przewlekłej leczonych dazatynibem ciężka retencja płynów wystąpiła u 32 pacjentów (6%) otrzymujących dazatynib w zalecanej dawce (n=548). W badaniach klinicznych u pacjentów z CML w fazie zaawansowanej lub Ph+ ALL otrzymujących dazatynib w zalecanej dawce (n=304), retencję płynów stopnia 3. lub 4. obserwowano u 8% pacjentów, włącznie z wysiękiem w jamie opłucnej stopnia 3. lub 4. u 7% oraz do osierdzia u 1% pacjentów. Wśród tych pacjentów obrzęk płuc stopnia 3. lub 4. i nadciśnienie płucne obserwowano u 1% pacjentów.
U pacjentów z objawami wskazującymi na wysięk w jamie opłucnej, takimi jak duszność lub suchy kaszel, należy wykonać zdjęcie radiologiczne klatki piersiowej. W przypadku wysięku w jamie opłucnej stopnia 3. lub 4. konieczny może być drenaż jamy opłucnej i podanie tlenu. W przypadku działań niepożądanych związanych z retencją płynów stosowano zazwyczaj leczenie podtrzymujące obejmujące leki moczopędne i krótkie cykle steroidów (patrz punkty 4.2 i 4.8). U pacjentów w wieku 65 lat i starszych wystąpienie wysięku opłucnowego, duszności, kaszlu, wysięku osierdziowego i zastoinowej niewydolności serca jest bardziej prawdopodobne niż u młodszych pacjentów i dlatego należy dokładnie monitorować ich stan. Zgłaszano również przypadki odmy opłucnowej u pacjentów z wysiękiem w jamie opłucnej (patrz punkt 4.8).
Tętnicze nadciśnienie płucne (TNP)
W związku z leczeniem dazatynibem zgłaszano TNP (przedwłośniczkowe tętnicze nadciśnienie płucne potwierdzone poprzez cewnikowanie prawej komory i przedsionka serca) (patrz punkt 4.8). W tych przypadkach TNP było zgłaszane po rozpoczęciu leczenia dazatynibem, w tym po ponad roku leczenia.
Przed rozpoczęciem leczenia dazatynibem należy ocenić, czy u pacjentów nie występują objawy przedmiotowe i podmiotowe podstawowej choroby sercowo-płucnej. U każdego pacjenta z objawami choroby serca należy wykonać badanie echokardiograficzne na początku leczenia oraz rozważyć jego wykonanie u pacjentów z czynnikami ryzyka choroby serca lub płuc. U pacjentów, u których po rozpoczęciu leczenia wystąpiła duszność i zmęczenie, należy ocenić czynniki etiologiczne, w tym wysięk w jamie opłucnej, obrzęk płuc, niedokrwistość lub nacieki w płucach. Zgodnie z zaleceniami dotyczącymi postępowania w przypadku niehematologicznych działań niepożądanych (patrz punkt 4.2) należy zmniejszyć dawkę dazatynibu lub przerwać leczenie podczas przeprowadzania oceny. W przypadku braku wyjaśnienia przyczyny albo braku poprawy po zmniejszeniu dawki leku lub przerwaniu leczenia, należy rozważyć rozpoznanie TNP. Sposób diagnozowania powinien być zgodny z wytycznymi dotyczącymi standardowego postępowania. W przypadku potwierdzenia TNP, należy na stałe zaprzestać leczenia dazatynibem. Dalszą obserwację należy przeprowadzać zgodnie z wytycznymi dotyczącymi standardowego postępowania. U pacjentów z TNP leczonych dazatynibem obserwowano poprawę parametrów hemodynamicznych i klinicznych po zaprzestaniu leczenia tym lekiem.
Wydłużenie odstępu QT
Dane z badań in vitro wskazują, że dazatynib może wydłużać czas repolaryzacji komór serca (odstęp QT) (patrz punkt 5.3). W badaniu III fazy u pacjentów z nowo rozpoznaną CML w fazie przewlekłej, obejmującym 258 pacjentów leczonych dazatynibem i 258 pacjentów leczonych imatynibem z co najmniej 60-miesięczną obserwacją, wydłużenie odcinka QTc jako działanie niepożądane stwierdzono u 1 pacjenta (< 1%) w każdej z grup. Mediana zmian QTcF w porównaniu z wartościami wyjściowymi wynosiła 3,0 msec u pacjentów leczonych dazatynibem w porównaniu do 8,2 msec u pacjentów leczonych imatynibem. U jednego pacjenta (< 1%) w każdej z grup stwierdzono QTcF > 500 msec. W badaniach klinicznych II fazy przeprowadzonych u 865 chorych na białaczkę, leczonych dazatynibem, średnia zmiana odstępu QTc w porównaniu z wartościami wyjściowymi, obliczonego zgodnie z wzorem Fridericii (QTcF) wynosiła 4 - 6 msec; górna granica 95% przedziału ufności dla wszystkich średnich zmian w porównaniu z wartościami wyjściowymi wynosiła < 7 msec (patrz punkt 4.8).
U 15 (1%) z 2182 pacjentów z opornością lub nietolerancją na wcześniejsze leczenie imatynibem, którzy otrzymywali dazatynib w badaniach klinicznych zgłoszono wydłużenie odstępu QTc jako działanie niepożądane. U dwudziestu jeden z tych pacjentów (1%) obserwowano wydłużenie QTcF > 500 msec.
Dazatynib należy stosować ostrożnie u pacjentów, którzy mają wydłużony odstęp QTc lub, u których może dojść do jego wydłużenia. Ostrzeżenie to dotyczy pacjentów z hipokalemią lub hipomagnezemią, z wrodzonym zespołem wydłużonego odstępu QT, przyjmujących przeciwarytmiczne produkty lecznicze lub inne produkty lecznicze, które powodują wydłużenie odstępu QT oraz pacjentów otrzymujących dużą dawkę skumulowaną antracykliny. Przed podaniem dazatynibu należy wyrównać hipokaliemię lub hipomagnezemię.
Działania niepożądane związane z sercem
Działanie dazatynibu badano w randomizownym badaniu klinicznym z udziałem 519 pacjentów z nowo rozpoznaną CML w fazie przewlekłej, obejmującym pacjentów z chorobami serca w wywiadzie. U pacjentów otrzymujących dazatynib stwierdzono działania niepożądane związane z sercem, takie jak zastoinowa niewydolność serca/zaburzenia czynności serca, wysięk osierdziowy, zaburzenia rytmu serca, kołatanie serca, wydłużenie odstępu QT i zawał serca (w tym zakończony zgonem). Działania niepożądane związane z sercem występowały dużo częściej u pacjentów z czynnikami ryzyka lub chorobą serca w wywiadzie. Pacjentów z czynnikami ryzyka (np. nadciśnienie tętnicze, hiperlipidemia, cukrzyca) lub z chorobą serca w wywiadzie (np. poddawanych wcześniej przezskórnej
interwencji wieńcowej, z udokumentowaną chorobą naczyń wieńcowych) należy dokładnie kontrolować w kierunku objawów podmiotowych i przedmiotowych związanych z niewydolnością serca, takich jak ból w piersiach, skrócenie oddechu i obfite pocenie się.
Jeśli wystąpią ww. objawy podmiotowe i przedmiotowe, zaleca się aby lekarz przerwał podawanie dazatynibu i rozważył konieczność zastosowania alternatywnego, swoistego leczenia CML. Po powrocie do zdrowia, przed wznowieniem podawania dazatynibu, należy wykonać ocenę czynnościową. Dazatynib można podać w niezmienionej dawce w przypadku działań niepożądanych łagodnych do umiarkowanych (≤ stopnia 2.), a w przypadku ciężkich działań niepożądanych (≥ stopnia 3.) w zmniejszonej dawce (patrz punkt 4.2). Pacjentów kontynuujących leczenie należy okresowo badać.
Pacjenci z niewyrównaną lub poważną chorobą układu sercowo-naczyniowego nie byli włączani do badań klinicznych.
Mikroangiopatia zakrzepowa (TMA, ang. thrombotic microangiopathy)
Inhibitory kinazy tyrozynowej BCR-ABL związane były z mikroangiopatią zakrzepową (TMA), w tym zgłoszenia pojedynczych przypadków dla dazatynibu (patrz punkt 4.8). Jeśli u pacjenta stosującego dazatynib wyniki badań laboratoryjnych lub klinicznych wskazują na wystąpienie TMA, należy przerwać leczenie dazatynibem i przeprowadzić dokładną ocenę TMA, w tym oznaczenie aktywności ADAMTS13 i przeciwciał przeciwko ADAMTS13. Nie należy wznawiać leczenia dazatynibem w przypadku zwiększonego miana przeciwciał przeciwko ADAMTS13 w połączeniu z niską aktywnością ADAMTS13.
Reaktywacja wirusowego zapalenia wątroby typu B
U pacjentów będących przewlekłymi nosicielami wirusa zapalenia wątroby typu B dochodziło do reaktywacji zapalenia wątroby po otrzymaniu przez nich inhibitorów kinazy tyrozynowej BCR-ABL. Niektóre przypadki prowadziły do ostrej niewydolności wątroby lub piorunującego zapalenia wątroby, a w konsekwencji do przeszczepienia wątroby lub zgonu pacjenta.
U pacjentów należy wykonać badania pod kątem zakażenia wirusem HBV przed rozpoczęciem leczenia produktem leczniczym Dasatinib Krka. Przed rozpoczęciem leczenia u pacjentów z dodatnim wynikiem badania serologicznego w kierunku wirusowego zapalenia wątroby typu B (w tym u pacjentów z aktywną chorobą) i w przypadku pacjentów z dodatnim wynikiem badania w kierunku zakażenia wirusem HBV w trakcie leczenia należy skonsultować się z ekspertami ds. chorób wątroby i leczenia wirusowego zapalenia wątroby typu B. Nosiciele wirusa HBV, którzy wymagają leczenia produktem leczniczym Dasatinib Krka, powinni być poddawani ścisłej obserwacji pod kątem wystąpienia objawów podmiotowych i przedmiotowych aktywnego zakażenia wirusem HBV w trakcie całego okresu leczenia i przez kilka miesięcy po jego zakończeniu (patrz punkt 4.8).
Wpływ na wzrost i rozwój dzieci i młodzieży
W badaniach z udziałem dzieci i młodzieży oceniających stosowanie dazatynibu u pacjentów z Ph+ CML CP z opornością lub nietolerancją imatynibu oraz u dzieci i młodzieży z Ph+ CML CP dotychczas nieleczonych, po co najmniej 2 latach leczenia zdarzenia niepożądane związane z leczeniem, dotyczące wzrostu kości i rozwoju, zgłoszono u 6 (4,6%) pacjentów, przy czym jedno z nich miało nasilenie ciężkie (opóźnienie wzrostu stopnia 3.). Te 6 przypadków obejmowało opóźnienie zrastania się nasad kości, osteopenię, opóźnienie wzrostu i ginekomastię (patrz punkt 5.1). Wyniki te są trudne do zinterpretowania w kontekście chorób przewlekłych, takich jak CML i wymagają długotrwałej obserwacji.
W badaniach z udziałem dzieci i młodzieży oceniających stosowanie dazatynibu w skojarzeniu z chemioterapią u dzieci i młodzieży z nowo rozpoznaną Ph+ ALL, po maksymalnie 2 latach leczenia zdarzenia niepożądane związane z leczeniem, dotyczące wzrostu kości i rozwoju, zgłoszono u 1 (0,6%) pacjenta. Była to osteopenia stopnia 1.
U dzieci i młodzieży leczonych w badaniach klinicznych dazatynibem obserwowano opóźnienie wzrostu (patrz punkt 4.8) Zaleca się monitorowanie wzrostu i rozwoju kości u dzieci i młodzieży.
Substancje pomocnicze
Ten produkt leczniczy zawiera laktozę. Pacjenci z rzadką dziedziczną nietolerancją galaktozy, brakiem laktazy lub zespołem złego wchłaniania glukozy-galaktozy nie powinni stosować tego produktu leczniczego.
Każda tabletka powlekana zawiera mniej niż 1 mmol (23 mg) sodu, co oznacza, że praktycznie nie zawiera sodu.
Substancje czynne, które mogą zwiększać stężenie dazatynibu w osoczu
Badania in vitro wskazują, że dazatynib jest substratem CYP3A4. Jednoczesne stosowanie dazatynibu i produktów leczniczych lub substancji, które silnie hamują CYP3A4 (np. ketokonazolu, itrakonazolu, erytromycyny, klarytromycyny, rytonawiru, telitromycyny, soku grejpfrutowego) może zwiększać ekspozycję na dazatynib. Dlatego, nie zaleca się ogólnoustrojowego podawania silnych inhibitorów CYP3A4 u pacjentów przyjmujących dazatynib (patrz punkt 4.2).
Z badań in vitro wynika, że dazatynib, w stężeniach istotnych klinicznie, wiąże się z białkami osocza w około 96%. Nie przeprowadzono badań oceniających interakcje dazatynibu z innymi produktami leczniczymi związanymi z białkami. Nieznana jest możliwość wypierania ich z połączeń i kliniczne znaczenie takiego działania.
Substancje czynne, które mogą zmniejszać stężenie dazatynibu w osoczu
W przypadku, gdy dazatynib był podany po uprzednim 8-dniowym podawaniu wieczorem 600 mg ryfampicyny, silnego induktora CYP3A4, pole pod krzywą (AUC) dazatynibu zmniejszyło się o 82%. Inne produkty lecznicze zwiększające aktywność CYP3A4 (np. deksametazon, fenytoina, karbamazepina, fenobarbital lub produkty roślinne zawierające ziele dziurawca [Hypericum perforatum]) mogą także zwiększać metabolizm i zmniejszać stężenie dazatynibu w osoczu. Dlatego, nie zaleca się stosowania silnych induktorów CYP3A4 z dazatynibem. W przypadku pacjentów, u których wskazane jest stosowanie ryfampicyny lub innych induktorów CYP3A4, należy stosować alternatywne produkty lecznicze o słabszym działaniu indukującym aktywność enzymów. Dozwolone jest jednoczesne stosowanie deksametazonu, słabego induktora CYP3A4, z dazatynibem; przewiduje się, że w przypadku jednoczesnego stosowania deksametazonu AUC dla dazatynibu zmniejszy się o około 25%, co prawdopodobnie nie będzie miało znaczenia klinicznego.
Antagoniści receptora histaminowego typu 2 oraz inhibitory pompy protonowej
Długotrwałe zahamowanie wydzielania żołądkowego przez antagonistów receptora H2 lub inhibitory pompy protonowej (np. famotydyna i omeprazol) może, prawdopodobnie, zmniejszać ekspozycję na dazatynib. W badaniu z zastosowaniem pojedynczej dawki leku u zdrowych ochotników wykazano, że podanie famotydyny 10 godzin przed podaniem pojedynczej dawki dazatynibu zmniejszało ekspozycję na dazatynib o 61%. W badaniu z udziałem 14 zdrowych ochotników, którym podawano pojedynczą dawkę 100 mg dazatynibu w 22 godziny po 4-dniowym podawaniu dawki 40 mg omeprazolu w stanie stacjonarnym, stwierdzono zmniejszenie wartości AUC dazatynibu o 43% i wartości Cmax dazatynibu o 42%. U pacjentów leczonych dazatynibem, zamiast stosowania antagonistów receptora H2 lub inhibitorów pompy protonowej należy rozważyć podawanie leków zobojętniających sok żołądkowy (patrz punkt 4.4).
Leki zobojętniające sok żołądkowy
Dane niekliniczne wskazują, że rozpuszczalność dazatynibu zależy od pH. Jednoczesne stosowanie leków zobojętniających zawierających wodorotlenek glinu/wodorotlenek magnezu z dazatynibem u zdrowych ochotników zmniejszało wartość AUC dazatynibu po podaniu pojedynczej dawki o 55%, a wartość Cmax o 58%. Jednakże, w przypadku podawania leków zobojętniających sok żołądkowy 2 godziny przed podaniem pojedynczej dawki dazatynibu nie obserwowano żadnych istotnych zmian w stężeniu lub w ekspozycji na dazatynib. W związku z tym, leki zobojętniające mogą być podawane do 2 godzin przed lub w 2 godziny po podaniu dazatynibu (patrz punkt 4.4).
Substancje czynne, których stężenie w osoczu może ulec zmianie pod wpływem dazatynibu Jednoczesne stosowanie dazatynibu i substratów CYP3A4 może zwiększyć ekspozycję na substrat CYP3A4. W badaniu przeprowadzonym z udziałem zdrowych ochotników, dazatynib w pojedynczej dawce 100 mg zwiększał ekspozycję na symwastatynę, która jest znanym substratem CYP3A4, przez zwiększenie wartości AUC o 20% oraz Cmax o 37%. Nie można wykluczyć, że działanie to jest silniejsze po wielokrotnym podaniu dazatynibu. Dlatego należy zachować ostrożność stosując substraty CYP3A4 o wąskim indeksie terapeutycznym (np. astemizol, terfenadyna, cyzapryd, pimozyd, chinidyna, beprydyl lub alkaloidy sporyszu [ergotamina, dihydroergotamina]) u pacjentów otrzymujących dazatynib (patrz punkt 4.4).
Dane z badań in vitro wskazują na potencjalne ryzyko interakcji z substratami CYP2C8, takimi jak glitazony.
Dzieci i młodzież
Badania dotyczące interakcji przeprowadzono tylko u dorosłych.
Kobiety w wieku rozrodczym/antykoncepcja u mężczyzn i kobiet
Zarówno mężczyźni aktywni seksualnie, jak i kobiety w wieku rozrodczym, w trakcie leczenia powinni stosować skuteczne metody antykoncepcji.
Ciąża
Na podstawie danych dotyczących stosowania u ludzi istnieje podejrzenie, że dazatynib wywołuje wady wrodzone, w tym wady cewy nerwowej i ma szkodliwe działanie farmakologiczne na płód, gdy jest podawany podczas ciąży. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3).
Produktu leczniczego Dasatinib Krka nie wolno stosować w okresie ciąży, chyba że stan kliniczny kobiety wymaga leczenia dazatynibem. W przypadku stosowania produktu Dasatinib Krka w czasie ciąży, pacjentka musi zostać poinformowana o potencjalnym ryzyku dla płodu.
Karmienie piersią
Dane dotyczące przenikania dazatynibu do mleka kobiecego lub mleka zwierząt są niewystarczające/ograniczone. Dane fizykochemiczne oraz dostępne dane farmakodynamiczne/toksykologiczne dotyczące dazatynibu wskazują na przenikanie do mleka kobiecego, w związku z czym nie można wykluczyć ryzyka dla dziecka karmionego piersią.
Podczas leczenia produktem leczniczym Dasatinib Krka należy przerwać karmienie piersią.
Płodność
W badaniach na zwierzętach leczenie dazatynibem nie miało wpływu na płodność samców i samic szczurów (patrz punkt 5.3). Lekarze i inni pracownicy ochrony zdrowia powinni udzielić porad pacjentom płci męskiej w odpowiednim wieku na temat możliwego wpływu produktu leczniczego Dasatinib Krka na płodność, przy czym porady te mogą uwzględniać możliwość oddania nasienia do banku.
Produkt leczniczy Dasatinib Krka wywiera niewielki wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Pacjentów należy poinformować o możliwości wystąpienia działań niepożądanych, takich jak zawroty głowy lub zaburzenia widzenia w czasie leczenia dazatynibem. Dlatego należy zachować ostrożność podczas prowadzenia pojazdów lub obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Dane opisane poniżej dotyczą ekspozycji na dazatynib stosowany w monoterapii, we wszystkich
dawkach ocenianych w badaniach klinicznych (N=2900), w tym u 324 dorosłych pacjentów z nowo rozpoznaną CML w fazie przewlekłej, 2388 dorosłych pacjentów z opornością lub nietolerancją imatynibu z CML w fazie przewlekłej lub zaawansowanej, lub z Ph+ ALL oraz 188 dzieci i młodzieży. U 2712 dorosłych pacjentów z CML w fazie przewlekłej, CML w fazie zaawansowanej lub z Ph+ ALL, mediana czasu leczenia wynosiła 19,2 miesiąca (zakres 0 do 93,2 miesiąca).
W randomizowanym badaniu obejmującym pacjentów z nowo rozpoznaną CML w fazie przewlekłej mediana czasu leczenia wynosiła około 60 miesięcy. U 1618 dorosłych pacjentów z CML w fazie przewlekłej mediana czasu leczenia wynosiła 29 miesięcy (zakres 0 do 92,9 miesiąca). U 1094 dorosłych pacjentów z CML w fazie zaawansowanej lub Ph+ ALL mediana czasu leczenia wynosiła 6,2 miesiąca (zakres 0 do 93,2 miesiąca). Spośród 188 pacjentów w badaniach z udziałem dzieci i młodzieży mediana czasu leczenia wynosiła 26,3 miesiąca (zakres 0 do 99,6 miesiąca). W podgrupie obejmującej 130 dzieci i młodzieży z CML w fazie przewlekłej leczonych dazatynibem mediana czasu leczenia wynosiła 42,3 miesiąca (zakres 0,1 do 99,6 miesiąca).
U większości pacjentów leczonych dazatynibem w pewnym okresie leczenia występowały działania niepożądane. W ogólnej populacji 2712 pacjentów leczonych dazatynibem, u 520 (19%) pacjentów wystąpiły działania niepożądane prowadzące do przerwania leczenia.
Ogólny profil bezpieczeństwa stosowania dazatynibu u dzieci i młodzieży z Ph+ CML CP był podobny do profilu bezpieczeństwa w populacji dorosłych, bez względu na postać farmaceutyczną, z wyjątkiem braku opisanych przypadków wysięku osierdziowego, wysięku opłucnowego, obrzęku płuc czy nadciśnienia płucnego u dzieci i młodzieży. Spośród 130 dzieci i młodzieży z CML CP leczonych dazatynibem u 2 (1,5%) wystąpiły działania niepożądane prowadzące do przerwania leczenia.
Tabelaryczne zestawienie działań niepożądanych
U pacjentów biorących udział w badaniach klinicznych leczonych dazatynibem w monoterapii oraz po wprowadzeniu produktu do obrotu wystąpiły następujące działania niepożądane, z wyjątkiem nieprawidłowości w wynikach badań laboratoryjnych (Tabela 5.). Działania niepożądane przedstawiono według klasyfikacji układów i narządów oraz częstości występowania. Częstości występowania określono następująco: bardzo często (≥ 1/10); często (≥ 1/100 do < 1/10); niezbyt często (≥ 1/1 000 do < 1/100); rzadko (≥ 1/10 000 do < 1/1 000); częstość nieznana (nie może być określona na podstawie dostępnych danych po wprowadzeniu do obrotu).
W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
Tabela 5: Tabelaryczne podsumowanie działań niepożądanych
Zakażenia i zarażenia pasożytnicze | |
Bardzo często | zakażenia (w tym bakteryjne, wirusowe, grzybicze, niespecyficzne) |
Często | zapalenie płuc (w tym bakteryjne, wirusowe oraz grzybicze), zakażenie/zapalenie górnych dróg oddechowych, zakażenia herpeswirusem (w tym cytomegalowirusem - CMV), zakażenia przewodu pokarmowego, posocznica (w tym niezbyt częste przypadki zakończone zgonem) |
Częstość nieznana | reaktywacja wirusowego zapalenia wątroby typu B |
Zaburzenia krwi i układu chłonnego | |
Bardzo często | zahamowanie czynności szpiku kostnego (w tym niedokrwistość, neutropenia, małopłytkowość) |
Często | gorączka neutropeniczna |
Niezbyt często | limfadenopatia (uogólnione powiększenie węzłów chłonnych), limfopenia |
Rzadko | wybiórcza aplazja układu czerwonokrwinkowego |
Zaburzenia układu immunologicznego | |
Niezbyt często | nadwrażliwość (w tym rumień guzowaty) |
Rzadko | wstrząs anafilaktyczny |
Zaburzenia endokrynologiczne | |
Niezbyt często | niedoczynność tarczycy |
Rzadko | nadczynność tarczycy, zapalenie tarczycy |
Zaburzenia metabolizmu i odżywiania | |
Często | zaburzenia łaknieniaa, hiperurykemia |
Niezbyt często | zespół rozpadu guza, odwodnienie, hipoalbuminemia, hipercholesterolemia |
Rzadko | cukrzyca |
Zaburzenia psychiczne | |
Często | depresja, bezsenność |
Niezbyt często | lęk, stan splątania, niestabilność emocjonalna, zmniejszenie libido |
Zaburzenia układu nerwowego | |
Bardzo często | ból głowy |
Często | neuropatia (w tym neuropatia obwodowa), zawroty głowy pochodzenia ośrodkowego, zaburzenia smaku, senność |
Niezbyt często | krwawienie w OUN*b, omdlenie, drżenia, niepamięć, zaburzenia równowagi |
Rzadko | udar naczyniowy mózgu, przemijające napady niedokrwienne, drgawki, zapalenie nerwu wzrokowego, porażenie nerwu VII, otępienie, ataksja |
Zaburzenia oka | |
Często | zaburzenia wzroku (w tym zaburzenia widzenia, niewyraźne widzenie i zmniejszona ostrość wzroku), suchość oka |
Niezbyt często | zaburzenia widzenia, zapalenie spojówek, światłowstręt, zwiększone łzawienie |
Zaburzenia ucha i błędnika | |
Często | szumy uszne |
Niezbyt często | utrata słuchu, zawroty głowy pochodzenia błędnikowego |
Zaburzenia serca | |
Często | zastoinowa niewydolność serca/zaburzenia czynności serca*c, wysięk osierdziowy*, zaburzenia rytmu serca (w tym tachykardia), kołatanie serca |
Niezbyt często | zawał serca (w tym przypadki zakończone zgonem)*, wydłużenie odstępu QT w EKG*, zapalenie osierdzia, arytmia komorowa (w tym częstoskurcz komorowy), dławica piersiowa, powiększenie serca, nieprawidłowości załamka T w EKG, zwiększenie stężenia troponiny |
Rzadko | serce płucne, zapalenia mięśnia sercowego, ostry zespół wieńcowy, zatrzymanie akcji serca, wydłużenie odstępu PR w EKG, choroba wieńcowa, zapalenie opłucnej i osierdzia |
Częstość nieznana | migotanie przedsionków/trzepotanie przedsionków |
Zaburzenia naczyniowe | |
Bardzo często | krwotok*d |
Często | nadciśnienie tętnicze, zaczerwienienie twarzy |
Niezbyt często | niedociśnienie tętnicze, zakrzepowe zapalenie żył, zakrzepica |
Rzadko | zakrzepica żył głębokich, zatorowość, sinica marmurkowata |
Częstość nieznana | mikroangiopatia zakrzepowa |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | |
Bardzo często | wysięk w jamie opłucnej*, duszność |
Często | obrzęk płuc*, nadciśnienie płucne*, nacieki w płucach, zapalenie płuc, kaszel |
Niezbyt często | nadciśnienie tętnicze płucne, skurcz oskrzeli, astma, odma opłucnowa |
Rzadko | zatorowość płucna, zespół ostrej niewydolności oddechowej |
Częstość nieznana | śródmiąższowa choroba płuc |
Zaburzenia żołądka i jelit | |
Bardzo często | biegunka, wymioty, nudności, ból brzucha |
Często | krwawienie z przewodu pokarmowego*, zapalenie okrężnicy (w tym agranulocytowe zapalenie okrężnicy), zapalenie błony śluzowej żołądka, zapalenie błony śluzowej (w tym zapalenie błon śluzowych/zapalenie błony śluzowej jamy ustnej), niestrawność, wzdęcia brzucha, zaparcia, zaburzenia tkanki miękkiej jamy ustnej |
Niezbyt często | zapalenie trzustki (w tym ostre zapalenie trzustki), owrzodzenie górnego odcinka przewodu pokarmowego, zapalenie przełyku, wodobrzusze*, szczelina odbytu, dysfagia, choroba refluksowa przełyku |
Rzadko | gastroenteropatia związana z utratą białka, niedrożność jelita, przetoka odbytu |
Częstość nieznana | krwawienie z przewodu pokarmowego zakończone zgonem* |
Zaburzenia wątroby i dróg żółciowych | |
Niezbyt często | zapalenie wątroby, zapalenie pęcherzyka żółciowego, cholestaza |
Zaburzenia skóry i tkanki podskórnej | |
Bardzo często | wysypka skórnae |
Często | łysienie, zapalenie skóry (w tym wyprysk), świąd, trądzik, suchość skóry, pokrzywka, nadmierna potliwość |
Niezbyt często | agranulocytowe zapalenie skóry, nadwrażliwość na światło, zaburzenia pigmentacji, zapalenie tkanki podskórnej, owrzodzenia skóry, zmiany pęcherzowe, zmiany dotyczące paznokci, zespół erytrodystezji dłoniowo- podeszwowej, zaburzenia dotyczące włosów |
Rzadko | leukoklastyczne zapalenie naczyń, zwłóknienie skóry |
Częstość nieznana | zespół Stevensa-Johnsonaf |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | |
Bardzo często | bóle mięśniowo-kostneg |
Często | bóle stawów, bóle mięśni, osłabienie mięśni, sztywność mięśniowo-szkieletowa, skurcze mięśni |
Niezbyt często | rabdomioliza, martwica kości, zapalenie mięśni, zapalenie ścięgien, zapalenie stawów |
Rzadko | opóźnienie zrastania się nasad kościh, opóźnienie wzrostuh |
Zaburzenia nerek i dróg moczowych | |
Niezbyt często | zaburzenie czynności nerek (w tym niewydolność nerek), częste oddawanie moczu, białkomocz |
Częstość nieznana | zespół nerczycowy |
Ciąża, połóg i okres okołoporodowy | |
Rzadko | aborcja |
Zaburzenia układu rozrodczego i piersi | |
Niezbyt często | ginekomastia, zaburzenia miesiączkowania |
Zaburzenia ogólne i stany w miejscu podania | |
Bardzo często | obrzęk obwodowyi, zmęczenie, gorączka, obrzęk twarzyj |
Często | osłabienie, ból, ból w klatce piersiowej, obrzęk uogólniony*k, dreszcze |
Niezbyt często | złe samopoczucie, inne obrzęki powierzchniowel |
Rzadko | zaburzenia chodu |
Badania diagnostyczne | |
Często | zmniejszenie masy ciała, zwiększenie masy ciała |
Niezbyt często | zwiększona aktywność fosfokinazy kreatynowej we krwi, zwiększona aktywność gamma-glutamylotransferazy |
Urazy, zatrucia i powikłania po zabiegach | |
Często | stłuczenia |
a W tym zmniejszenie apetytu, wczesne uczucie sytości, zwiększenie apetytu.
b W tym krwotok w obrębie ośrodkowego układu nerwowego, krwiak mózgowy, krwotok mózgowy, krwiak nadtwardówkowy, krwotok śródczaszkowy, udar krwotoczny, krwotok podpajęczynówkowy, krwiak podtwardówkowy i krwotok podtwardówkowy.
c W tym zwiększone stężenie mózgowego peptydu natriuretycznego, zaburzenia czynności komór, zaburzenie czynności lewej komory, zaburzenie czynności prawej komory, niewydolność serca, ostra niewydolność serca, przewlekła niewydolność serca, zastoinowa niewydolność serca, kardiomiopatia, kardiomiopatia zastoinowa, niedomoga rozkurczowa, zmniejszenie frakcji wyrzutowej i niewydolność komorowa, niewydolność lewej komory, niewydolność prawej komory, zmniejszona ruchliwość komór.
d Z wyłączeniem krwawień z przewodu pokarmowego i krwawień w OUN; te działania niepożądane wymieniono odpowiednio w „Zaburzeniach żołądka i jelit” i „Zaburzeniach układu nerwowego”.
e W tym wysypka polekowa, rumień, rumień wielopostaciowy, erytroza, wysypka złuszczająca, rumień uogólniony, wysypka narządów płciowych, potówka czerwona, prosaki, potówki, łuszczyca krostkowa, wysypka, wysypka rumieniowa, wysypka pęcherzykowa, wysypka uogólniona, wysypka plamista, wysypka grudkowo-plamista, wysypka grudkowa, swędząca wysypka, wysypka krostkowa, wysypka pęcherzykowa, złuszczanie się skóry, podrażnienie skóry, toksyczne wykwity skórne, pokrzywka pęcherzykowa i wysypka pochodzenia naczyniowego.
f Po wprowadzeniu do obrotu, odnotowano pojedyncze przypadki wystąpienia zespołu Stevensa-Johnsona. Nie można było ustalić, czy te śluzówkowo-skórne działania niepożądane były bezpośrednio związane ze stosowaniem dazatynibu czy z jednocześnie stosowanymi produktami leczniczymi.
g W trakcie leczenia lub po jego przerwaniu odnotowano ból mięśniowo-szkieletowy.
h W badaniach z udziałem dzieci i młodzieży częstość występowania odnotowana jako często.
i Obrzęk opadowy, obrzęk miejscowy, obrzęk obwodowy.
j Obrzęk spojówek, obrzęk oczu, opuchnięcie oka, obrzęk powiek, obrzęk twarzy, obrzęk warg, obrzęk plamki, obrzęk jamy ustnej, obrzęk oczodołu, obrzęk okołooczodołowy, opuchnięcie twarzy.
k Przeciążenie płynami, zatrzymanie płynów, obrzęki w przewodzie pokarmowym, obrzęk uogólniony, obrzęki obwodowe, obrzęk, obrzęk z powodu choroby serca, wysięk okołonerkowy, obrzęk pozabiegowy, obrzęk trzewny.
l Opuchnięcie narządów płciowych, obrzęk w miejscu nacięcia, obrzęk narządów płciowych, obrzęk prącia, opuchnięcie prącia, obrzęk moszny, opuchnięcie skóry, opuchnięcie jądra, opuchnięcie sromu i pochwy.
* Dodatkowe dane, patrz punkt „Opis wybranych działań niepożądanych”.
Opis wybranych działań niepożądanych
Zahamowanie czynności szpiku kostnego
Leczenie produktem leczniczym Dasatinib Krka jest związane z występowaniem niedokrwistości, neutropenii i małopłytkowości. Występują one wcześniej i częściej u pacjentów z CML w fazie zaawansowanej lub z Ph+ ALL niż u pacjentów z CML w fazie przewlekłej (patrz punkt 4.4).
Krwawienie
U pacjentów przyjmujących dazatynib zgłoszono działania niepożądane związane z krwawieniem po stosowanym leczeniu, począwszy od wybroczyn i krwawienia z nosa po krwotoki z przewodu pokarmowego stopnia 3. lub 4. oraz krwawienie w ośrodkowym układzie nerwowym (patrz punkt 4.4).
Retencja płynów
Różne działania niepożądane, takie jak wysięk opłucnowy, wodobrzusze, obrzęk płuc oraz wysięk osierdziowy z obrzękiem powierzchownym lub bez, można określić łącznie jako „zatrzymanie płynów”. W badaniu dotyczącym nowo rozpoznanej CML w fazie przewlekłej, po co najmniej
60 miesiącach obserwacji, działania niepożądane związane z zatrzymaniem płynów po leczeniu dazatynibem obejmowały wysięk opłucnowy (28%), obrzęki powierzchowne (14%), nadciśnienie płucne (5%), obrzęk uogólniony (4%) i wysięk osierdziowy (4%). Zastoinową niewydolność serca/zaburzenia czynności serca i obrzęk płuc odnotowano u < 2% pacjentów.
Skumulowana w czasie częstość występowania wysięku opłucnowego (dowolnego stopnia) u pacjentów leczonych dazatynibem wynosiła 10% po 12 miesiącach, 14% po 24 miesiącach, 19% po
36 miesiącach, 24% po 48 miesiącach i 28% po 60 miesiącach. Nawrotowy wysięk opłucnowy wystąpił łącznie u 46 pacjentów leczonych dazatynibem. U 17 pacjentów wystąpiły 2 osobne działania niepożądane, u 6 wystąpiły 3 działania niepożądane, u 18 od 4 do 8 działań niepożądanych, a u 5 > 8 epizodów wysięku opłucnowego.
Mediana czasu do wystąpienia pierwszego związanego z dazatynibem wysięku opłucnowego stopnia
1. lub 2. wynosiła 114 tygodni (zakres 4 do 299 tygodni). Wysięk opłucnowy związany z dazatynibem oceniono jako ciężki (stopnia 3. lub 4.) u mniej niż 10% pacjentów z wysiękiem opłucnowym. Mediana czasu do wystąpienia pierwszego związanego z dazatynibem wysięku opłucnowego stopnia ≥
3 wynosiła 175 tygodni (zakres 114 do 274 tygodni). Mediana czasu trwania związanego z dazatynibem wysięku opłucnowego (dowolnego stopnia) wynosiła 283 dni (około 40 tygodni). Wysięk opłucnowy był zazwyczaj odwracalny i ustępował po odstawieniu produktu Dasatinib Krka oraz zastosowaniu leków moczopędnych lub innych odpowiednich metod leczenia wspomagającego (patrz punkty 4.2 i 4.4). Wśród pacjentów leczonych dazatynibem, u których wystąpił związany z lekiem wysięk opłucnowy (n=73), u 45 (62%) przerwano podawanie leku, a u 30 (41%) zmniejszono jego dawkę. Dodatkowo 34 (47%) pacjentów otrzymało leki moczopędne, 23 (32%) otrzymało kortykosteroidy, a 20 (27%) otrzymało zarówno kortykosteroidy, jak i leki moczopędne. U 9 (12%) pacjentów wykonano terapeutyczny drenaż jamy opłucnej.
Sześć procent pacjentów leczonych dazatynibem przerwało leczenie z powodu związanego z lekiem wysięku opłucnowego. Wysięk opłucnowy nie miał niekorzystnego wpływu na zdolność pacjentów do uzyskania odpowiedzi. Wśród pacjentów leczonych dazatynibem z wysiękiem opłucnowym u 96% uzyskano odpowiedź cCCyR, u 82% – MMR, a u 50% osiągnięto odpowiedź MR4.5 pomimo przerwania leczenia lub zmodyfikowania dawki.
Dodatkowe informacje na temat pacjentów z CML w fazie przewlekłej oraz z CML w fazie zaawansowanej lub Ph+ ALL przedstawiono w punkcie 4.4.
Zgłaszano przypadki odmy opłucnowej u pacjentów z wysiękiem w jamie opłucnowej. Niektóre przypadki odmy opłucnowej ustąpiły po odstawieniu, przerwaniu lub zmniejszeniu dawki dasatynibu, ale większość przypadków wymagała dodatkowego leczenia.
Tętnicze nadciśnienie płucne (TNP)
TNP (przedwłośniczkowe tętnicze nadciśnienie płucne potwierdzone poprzez cewnikowanie prawej komory i przedsionka serca) zgłaszano w związku z leczeniem dazatynibem. W tych przypadkach TNP było zgłaszane po rozpoczęciu leczenia dazatynibem, w tym po ponad roku leczenia. Pacjenci, u których zgłaszano występowanie TNP podczas leczenia dazatynibem, zwykle przyjmowali inne produkty lecznicze lub występowały u nich choroby współistniejące z podstawową chorobą nowotworową. U pacjentów z TNP obserwowano poprawę parametrów hemodynamicznych i klinicznych po zaprzestaniu leczenia dazatynibem.
Wydłużenie odstępu QT
W badaniu III fazy u pacjentów z nowo rozpoznaną CML w fazie przewlekłej 1 pacjent (< 1%) leczony dazatynibem miał QTcF > 500 msec po co najmniej 12 miesiącach obserwacji (patrz punkt 4.4). Nie zgłoszono żadnych dodatkowych pacjentów z wartością QTcF > 500 msec po co najmniej 60 miesiącach obserwacji.
W 5 badaniach klinicznych II fazy u pacjentów z opornością lub nietolerancją na wcześniejsze leczenie imatynibem, kilkakrotne zapisy EKG wykonywane przed przystąpieniem do leczenia i we wcześniej wyznaczonych odstępach czasowych, wykonano u 865 pacjentów otrzymujących dazatynib w dawce 70 mg dwa razy na dobę. Wyniki badań EKG odczytywano centralnie. Obliczając długość odstępu QT stosowano poprawkę, uwzględniającą częstość rytmu serca, zgodnie ze wzorem Fridericii. We wszystkich punktach czasowych w 8. dniu od rozpoczęcia podawania leku, średnia zmiana odstępu QTcF w porównaniu z wartościami wyjściowymi wynosiła 4 - 6 msec, przy górnym 95% przedziale ufności < 7 msec. W badaniach klinicznych u 15 (1%) z 2182 pacjentów z opornością lub nietolerancją na wcześniejsze leczenie imatynibem, którzy otrzymywali dazatynib zgłoszono wydłużenie odstępu QTc jako działanie niepożądane. U dwudziestu jeden pacjentów (1%) obserwowano wydłużenie odstępu QTcF > 500 msec (patrz punkt 4.4).
Działania niepożądane związane z sercem
Pacjentów z czynnikami ryzyka lub z chorobą serca w wywiadzie należy dokładnie monitorować w kierunku objawów podmiotowych i przedmiotowych związanych z zaburzeniami czynności serca oraz należy w odpowiedni sposób oceniać i leczyć (patrz punkt 4.4).
Reaktywacja wirusowego zapalenia wątroby typu B
Opisywano reaktywację wirusowego zapalenia wątroby typu B powiązaną ze stosowaniem inhibitorów kinazy tyrozynowej BCR-ABL. Niektóre przypadki prowadziły do ostrej niewydolności wątroby lub piorunującego zapalenia wątroby, a w konsekwencji do przeszczepienia wątroby lub zgonu pacjenta (patrz punkt 4.4).
W badaniu III fazy dotyczącym optymalizacji dawkowania u pacjentów w fazie przewlekłej CML z opornością lub nietolerancją na wcześniejsze leczenie imatynibem (mediana czasu leczenia
30 miesięcy), częstość występowania wysięku w jamie opłucnej i zastoinowej niewydolności serca/zaburzenia czynności serca była mniejsza u pacjentów leczonych dazatynibem w dawce 100 mg raz na dobę niż u pacjentów leczonych dazatynibem w dawce 70 mg podawanej dwa razy na dobę.
Zahamowanie czynności szpiku kostnego obserwowano również rzadziej w leczonych grupach po podaniu 100 mg raz na dobę (patrz poniżej Badania diagnostyczne). Mediana czasu leczenia w grupie z zastosowaniem dawki 100 mg raz na dobę wynosiła 37 miesięcy (zakres 1–91 miesięcy).
Skumulowana częstość występowania wybranych działań niepożądanych, które zaobserwowano po zastosowaniu zalecanej dawki początkowej wynoszącej 100 mg raz na dobę, przedstawiono w Tabeli 6a.
Tabela 6a: Wybrane działania niepożądane zgłaszane podczas badania III fazy dotyczącego optymalizacji dawkowania (nietolerancja lub oporność na imatynib w fazie przewlekłej CML)a
Co najmniej 2-letni okres obserwacji | Co najmniej 5-letni okres obserwacji | Co najmniej 7-letni okres obserwacji | |||||
Wszystkie stopnie | Stopień 3/4 | Wszystkie stopnie | Stopień 3/4 | Wszystkie stopnie | Stopień 3/4 | ||
Zalecane określenie | Odsetek pacjentów (%) | ||||||
Biegunka Retencja płynów Obrzęk powierzchowny Wysięk opłucnowy Obrzęk uogólniony Wysięk osierdziowy Nadciśnienie płucne Krwotok Krwawienie z przewodu pokarmowego | 27 34 18 18 3 2 0 11 2 | 2 4 0 2 0 1 0 1 1 | 28 42 21 24 4 2 0 11 2 | 2 6 0 4 0 1 0 1 1 | 28 48 22 28 4 3 2 12 2 | 2 7 0 5 0 1 1 1 1 | |
a Wyniki badania III fazy dotyczącego optymalizacji dawkowania zgłaszane w populacji pacjentów z zastosowaniem zalecanej dawki początkowej 100 mg raz na dobę (n=165).
W badaniu III fazy dotyczącym optymalizacji dawkowania, u pacjentów z CML w fazie zaawansowanej i Ph+ ALL, mediana czasu trwania leczenia wynosiła 14 miesięcy dla fazy akceleracji w CML, 3 miesiące dla mieloblastycznej postaci przełomu blastycznego w CML, 4 miesiące dla limfoblastycznej postaci przełomu blastycznego w CML i 3 miesiące dla Ph+ ALL. Wybrane działania niepożądane, które zaobserwowano po zastosowaniu zalecanej dawki początkowej 140 mg raz na dobę przedstawiono w Tabeli 6b. Oceniano również schemat dawkowania 70 mg dwa razy na dobę.
Schemat dawkowania 140 mg raz na dobę miał profil skuteczności porównywalny ze schematem dawkowania 70 mg dwa razy na dobę, lecz z korzystniejszym profilem bezpieczeństwa.
Tabela 6b: Wybrane działania niepożądane obserwowane w badaniu III fazy dotyczącym optymalizacji dawkowania: CML w fazie zaawansowanej i Ph+ ALLa
140 mg raz na dobę n = 304 | ||
Wszystkie stopnie | Stopień 3/4 | |
Zalecane określenie | Odsetek pacjentów (%) | |
Biegunka | 28 | 3 |
Retencja płynów | 33 | 7 |
Obrzęk powierzchowny | 15 | < 1 |
Wysięk opłucnowy | 20 | 6 |
Obrzęk uogólniony | 2 | 0 |
Zastoinowa niewydolność serca/zaburzenia czynności sercab | 1 | 0 |
Wysięk osierdziowy | 2 | 1 |
Obrzęk płuc | 1 | 1 |
Krwotok | 23 | 8 |
Krwawienie z przewodu pokarmowego | 8 | 6 |
a Wyniki badania III fazy dotyczącego optymalizacji dawkowania zgłaszane w populacji pacjentów z zastosowaniem zalecanej dawki początkowej 140 mg raz na dobę (n=304) w 2-letnim okresie końcowej obserwacji.
b W tym zaburzenia czynności komór, niewydolność serca, zastoinowa niewydolność serca, kardiomiopatia, kardiomiopatia zastoinowa, niedomoga rozkurczowa, zmniejszenie frakcji wyrzutowej i niewydolność komorowa.
Ponadto, przeprowadzono dwa badania z udziałem 161 dzieci i młodzieży z Ph+ ALL, którym podawano dazatynib w skojarzeniu z chemioterapią. W badaniu głównym wzięło udział 106 dzieci i młodzieży, którzy otrzymywali dazatynib w skojarzeniu z chemioterapią w sposób ciągły. W badaniu wspomagającym wzięło udział 55 dzieci i młodzieży, z czego 35 pacjentów otrzymywało dazatynib w skojarzeniu z chemioterapią w schemacie leczenia przerywanego (dwa tygodnie leczenia, a następnie jeden do dwóch tygodni bez leczenia), a 20 pacjentów otrzymywało dazatynib w skojarzeniu z chemioterapią w sposób ciągły. W grupie 126 dzieci i młodzieży z Ph+ ALL leczonych dazatynibem w sposób ciągły, mediana czasu trwania leczenia wynosiła 23,6 miesiąca (zakres 1,4 do 33 miesięcy).
U 2 (1,6%) ze 126 dzieci i młodzieży z Ph+ ALL leczonych w sposób ciągły wystąpiły działania niepożądane prowadzące do przerwania leczenia. W Tabeli 7. wymieniono działania niepożądane zgłaszane w tych dwóch badaniach z udziałem dzieci i młodzieży z częstością > 10% u pacjentów leczonych w sposób ciągły. Warto zauważyć, że wysięk opłucnowy odnotowano u 7 (5,6%) pacjentów w tej grupie i dlatego też nie został ujęty w tabeli.
Tabela 7: Działania niepożądane odnotowane u ≥ 10% dzieci i młodzieży z Ph+ ALL leczonych dazatynibem w sposób ciągły w skojarzeniu z chemioterapią (N=126)a
Odsetek pacjentów (%) | ||
Działanie niepożądane | Wszystkie stopnie | Stopień 3/4 |
Goraczka neutropeniczna | 27,0 | 26,2 |
Nudności | 20,6 | 5,6 |
Wymioty | 20,6 | 4,8 |
Ból brzucha | 14,3 | 3,2 |
Biegunka | 12,7 | 4,8 |
Gorączka | 12,7 | 5,6 |
Ból głowy | 11,1 | 4,8 |
Zmniejszone łaknienie | 10,3 | 4,8 |
Zmęczenie | 10,3 | 0 |
a W badaniu głównym łącznie 24 ze 106 pacjentów stosowało proszek do sporządzania zawiesiny doustnej przynajmniej raz, z czego 8 pacjentów stosowało wyłącznie proszek do sporządzania zawiesiny doustnej.
Nieprawidłowości w wynikach badań laboratoryjnych Hematologia
W badaniu III fazy dotyczącym nowo rozpoznanej CML w fazie przewlekłej, u pacjentów otrzymujących dazatynib, po co najmniej 12 miesiącach obserwacji stwierdzono następujące nieprawidłowości stopnia 3. lub 4. w wynikach badań laboratoryjnych: neutropenia (21%), małopłytkowość (19%) i niedokrwistość (10%). Po co najmniej 60 miesiącach obserwacji łączne wskaźniki występowania neutropenii, małopłytkowości i niedokrwistości wynosiły, odpowiednio 29%, 22% i 13%.
U pacjentów z nowo rozpoznaną CML w fazie przewlekłej leczonych dazatynibem, u których stwierdzono mielosupresję stopnia 3. lub 4., powrót do stanu wyjściowego następował zwykle po
krótkim zaprzestaniu podawania i (lub) zmniejszeniu dawki, natomiast u 1,6% pacjentów, po co najmniej 12 miesiącach obserwacji, zaprzestano leczenia na stałe. Po co najmniej 60 miesiącach obserwacji łączny wskaźnik zaprzestania leczenia na stałe z powodu mielosupresji stopnia 3. lub 4. wynosił 2,3%.
U pacjentów z CML z opornością lub nietolerancją na wcześniejsze leczenie imatynibem stwierdzano zgodnie niedobór krwinek (małopłytkowość, neutropenię oraz niedokrwistość). Jednakże, występowanie niedoboru krwinek było oczywiście zależne od stadium choroby. Częstość występowania zaburzeń hematologicznych stopnia 3. lub 4. przedstawiono w Tabeli 8.
Tabela 8: Zaburzenia hematologiczne stopnia 3./4. wg CTC w badaniach klinicznych u pacjentów z opornością lub nietolerancją na wcześniejsze leczenie imatynibema
Faza przewlekła (n=165)b | Faza akceleracji (n=157)c | Mieloblastyczna postać przełomu blastycznego (n=74)c | Limfoblastyczna postać przełomu blastycznego i Ph+ ALL (n=168)c | |
Odsetek pacjentów (%) | ||||
Wskaźniki hematologiczne | ||||
Neutropenia | 36 | 58 | 77 | 76 |
Małopłytkowość | 23 | 63 | 78 | 74 |
Niedokrwistość | 13 | 47 | 74 | 44 |
a Wyniki badania III fazy dotyczącego optymalizacji dawkowania odnotowane w 2-letnim okresie obserwacji. b Wyniki badania CA180-034 z zastosowaniem zalecanej dawki początkowej wynoszącej 100 mg raz na dobę. c Wyniki badania CA180-035 z zastosowaniem zalecanej dawki początkowej wynoszącej 140 mg raz na dobę.
Stopnie wg CTC: neutropenia (stopień 3. ≥ 0,5 – < 1,0 × 109/l, stopień 4. < 0,5 × 109/l); małopłytkowość (stopień 3. ≥ 25 –
< 50 × 109/l, stopień 4. < 25 × 109/l); niedokrwistość (hemoglobina stopień 3. ≥ 65 – < 80 g/l, stopień 4. < 65 g/l).
Łączne wskaźniki dotyczące cytopenii stopnia 3. lub 4. wśród pacjentów leczonych dawką 100 mg raz na dobę były podobne po 2 i 5 latach, w tym dla: neutropenii (35% vs. 36%), małopłytkowości (23% vs. 24%) i niedokrwistości (13% vs. 13%).
U pacjentów, u których wystąpiło zahamowanie czynności szpiku kostnego stopnia 3. lub 4., powrót do wartości prawidłowych następował w większości przypadków po krótkotrwałym zaprzestaniu podawania leku i (lub) zmniejszeniu dawki. W przypadku 5% pacjentów konieczne było całkowite zakończenie leczenia. W przeważającej części pacjenci kontynuowali leczenie bez nawrotu objawów mielosupresji.
Biochemia
W badaniu dotyczącym nowo rozpoznanej CML w fazie przewlekłej, hipofosfatemię stopnia 3. lub 4. stwierdzono u 4% pacjentów otrzymujących dazatynib, a zwiększenie aktywności aminotransferaz oraz stężenia kreatyniny i bilirubiny stopnia 3. lub 4. stwierdzono u ≤ 1% pacjentów po co najmniej 12 miesiącach obserwacji. Po co najmniej 60 miesiącach obserwacji łączny wskaźnik występowania hipofosfatemii stopnia 3. lub 4. wynosił 7%, zwiększonego stężenia kreatyniny i bilirubiny stopnia 3. lub 4. wynosił 1%, a zwiększenia aktywności aminotransferaz stopnia 3. lub 4. pozostał na poziomie 1%. Nie przerwano leczenia dazatynibem z powodu zmian tych wskaźników biochemicznych.
2-letni okres obserwacji
Podwyższoną aktywność aminotransferaz lub stężenie bilirubiny stopnia 3. lub 4. obserwowano u 1% pacjentów z CML (opornych na lub nietolerujących imatynibu) w fazie przewlekłej, natomiast u
1 do 7% pacjentów z zaawansowanymi postaciami CML oraz z Ph+ ALL. Poziomy te wyrównywały się zazwyczaj po zmniejszeniu dawki lub przerwaniu leczenia. W badaniu III fazy dotyczącym optymalizacji dawkowania w fazie przewlekłej CML podwyższoną aktywność aminotransferaz lub stężenie bilirubiny stopnia 3. lub 4. obserwowano u ≤ 1% pacjentów z podobnie małą częstością w
czterech leczonych grupach. W badaniu III fazy dotyczącym optymalizacji dawkowania w fazie zaawansowanej CML i Ph+ ALL, podwyższoną aktywność aminotransferaz lub stężenie bilirubiny stopnia 3. lub 4. obserwowano u od 1% do 5% pacjentów w grupach badanych.
U około 5% pacjentów leczonych dazatynibem, u których wyjściowe stężenie wapnia w surowicy krwi było prawidłowe, w którymś momencie leczenia występowała przemijająca hipokalcemia stopnia
Doświadczenie z przedawkowaniem dazatynibu w badaniach klinicznych jest ograniczone do pojedynczych przypadków. Największe przedawkowanie po podaniu 280 mg na dobę przez jeden tydzień opisano u dwóch pacjentów i u obu stwierdzono istotne zmniejszenie ilości płytek krwi. Ponieważ podawanie dazatynibu jest związane z zahamowaniem czynności szpiku stopnia 3. lub 4. (patrz punkt 4.4), u pacjentów, którzy przyjęli dawkę większą niż zalecana, należy uważnie kontrolować, czy nie występują objawy zahamowania czynności szpiku i zastosować odpowiednie leczenie podtrzymujące.
Grupa farmakoterapeutyczna: leki przeciwnowotworowe, inhibitory kinazy proteinowej; kod ATC: L01EA02.
Farmakodynamika
Dazatynib hamuje aktywność kinazy BCR-ABL oraz rodziny kinaz SRC równocześnie hamując też inne, liczne, wybrane kinazy onkogenne, w tym c-KIT, kinazy receptora efryny (EPH) oraz receptora PDGFβ. Dazatynib jest silnym, subnanomolarnym inhibitorem kinazy BCR-ABL, działającym w zakresie stężeń 0,6-0,8 nM. Łączy się on zarówno z nieaktywną, jak i aktywną postacią enzymu BCR-ABL.
Mechanizm działania
In vitro, dazatynib wykazuje aktywność w liniach komórek białaczkowych, reprezentujących odmiany zarówno białaczki wrażliwej, jak i opornej na imatynib. Badania przedkliniczne wskazują, że dazatynib może przełamać oporność na imatynib wynikającą ze zwiększonej ekspresji BCR-ABL, z mutacji domeny kinazy BCR-ABL, aktywacji alternatywnych dróg sygnalizacyjnych obejmujących kinazy rodziny SRC (LYN, HCK) oraz zwiększoną ekspresję genu determinującego oporność wielolekową. Dodatkowo, dazatynib hamuje kinazy rodziny SRC w stężeniach subnanomolarnych.
W kilku oddzielnych badaniach in vivo z zastosowaniem mysiego modelu CML, dazatynib zapobiegał progresji fazy przewlekłej CML do fazy blastycznej i przedłużał czas przeżycia myszy z przeniesionymi od pacjentów komórkami CML rozwijającymi się w różnych miejscach, w tym także w ośrodkowym układzie nerwowym.
Skuteczność kliniczna i bezpieczeństwo stosowania
W badaniach I fazy uzyskano odpowiedź hematologiczną i cytogenetyczną we wszystkich fazach CML i w Ph+ ALL u pierwszych 84 pacjentów, którzy byli leczeni i obserwowani aż do 27 miesięcy. Odpowiedź była trwała w przypadku wszystkich faz CML i Ph+ ALL.
Przeprowadzono cztery otwarte badania kliniczne II fazy, z jednym ramieniem, bez grupy kontrolnej, w celu określenia bezpieczeństwa stosowania i skuteczności dazatynibu u pacjentów z CML w fazie przewlekłej, w fazie akceleracji lub w mieloblastycznej postaci przełomu blastycznego, u których stwierdzono oporność lub nietolerancję imatynibu. Przeprowadzono także jedno nieporównawcze badanie z randomizacją pacjentów w fazie przewlekłej, u których nie uzyskano odpowiedzi po wstępnym leczeniu imatynibem w dawce 400 lub 600 mg. Początkowa dawka wynosiła 70 mg dazatynibu dwa razy na dobę. Dopuszczalne były zmiany dawki w celu poprawy skuteczności działania lub opanowania toksyczności (patrz punkt 4.2).
Przeprowadzono dwa randomizowane, otwarte badania III fazy oceniające skuteczność dazatynibu podawanego raz na dobę w porównaniu do dazatynibu podawanego dwa razy na dobę. Ponadto przeprowadzono jedno otwarte, randomizowane, porównawcze badanie III fazy u dorosłych pacjentów z nowo rozpoznaną CML w fazie przewlekłej.
Skuteczność dazatynibu oceniana jest na podstawie współczynnika odpowiedzi hematologicznej i cytogenetycznej.
Trwałość odpowiedzi i szacowany wskaźnik przeżycia stanowią dodatkowe dowody klinicznej skuteczności dazatynibu.
Badaniami klinicznymi objęto 2712 pacjentów, 23% spośród nich miało ≥ 65 lat, a 5% miało ≥ 75 lat.
Faza przewlekła CML - Pacjenci nowo zdiagnozowani
Przeprowadzono międzynarodowe, otwarte, wieloośrodkowe, randomizowane, porównawcze badanie III fazy u dorosłych pacjentów z nowo rozpoznaną CML w fazie przewlekłej. Pacjentów randomizowano do grupy otrzymującej dazatynib w dawce 100 mg raz na dobę lub imatynib w dawce 400 mg raz na dobę. Pierwszorzędowym punktem końcowym był procent potwierdzonej całkowitej odpowiedzi cytogenetycznej (cCCyR, ang. complete cytogenetic response) w ciągu 12 miesięcy. Drugorzędowe punkty końcowe obejmowały czas trwania cCCyR (miara trwałości odpowiedzi), czas do wystąpienia cCCyR, odsetek chorych z większą odpowiedzią molekularną (MMR, ang. major molecular response), czas do wystąpienia MMR, czas przeżycia wolny od progresji (PFS, ang. progression free survival) i całkowite przeżycie (OS, ang. overall survival).
Inne istotne wyniki skuteczności obejmowały odsetek chorych z CCyR i z całkowitą odpowiedzią molekularną (CMR, ang. complete molecular response). Badanie jest w toku.
Do badanych grup zrandomizowano łącznie 519 pacjentów: 259 do grupy otrzymującej dazatynib i 260 do grupy otrzymującej imatynib. Wyjściowa charakterystyka pacjentów w obu badanych grupach była dobrze zrównoważona w odniesieniu do wieku (mediana wieku wynosiła 46 lat w grupie dazatynibu i 49 lat w grupie imatynibu, odpowiednio 10% i 11% stanowili pacjenci w wieku 65 lat i więcej), płci (kobiety odpowiednio 44% i 37%) i rasy (odpowiednio, 51% i 55% rasa kaukaska; 42% i 37% rasa azjatycka). Na początku badania rozkład wg skali Hasforda był podobny w grupach otrzymujących dazatynib i imatynib (odpowiednio, niskie ryzyko: 33% i 34%; pośrednie ryzyko: 48% i 47%; wysokie ryzyko: 19% i 19%).
W minimalnym okresie obserwacji wynoszącym 12 miesięcy, 85% pacjentów randomizowanych do grupy dazatynibu i 81% pacjentów randomizowanych do grupy imatynibu wciąż otrzymywało leczenie pierwszej linii.
Przerwanie leczenia w ciągu 12 miesięcy z powodu progresji choroby wystąpiło u 3% pacjentów leczonych dazatynibem i 5% pacjentów leczonych imatynibem.
W co najmniej 60-miesięcznym okresie obserwacji, 60% pacjentów przydzielonych do grupy otrzymującej dazatynib i 63% pacjentów przydzielonych do grupy otrzymującej imatynib wciąż otrzymywało leczenie pierwszej linii. Przerwanie leczenia w ciągu 60 miesięcy z powodu progresji choroby wystąpiło u 11% pacjentów leczonych dazatynibem i 14% pacjentów leczonych imatynibem.
Wyniki skuteczności przedstawiono w Tabeli 9. W ciągu pierwszych 12 miesięcy leczenia cCCyR osiągnięto u istotnego statystycznie większego odsetka pacjentów w grupie otrzymującej dazatynib w porównaniu do grupy otrzymującej imatynib. Skuteczność dazatynibu konsekwentnie wykazano w różnych podgrupach, w tym dotyczących wieku, płci i stopnia ryzyka wg skali Hasforda przed rozpoczęciem leczenia.
Tabela 9: Wyniki skuteczności uzyskane w badaniu III fazy u pacjentów z nowo rozpoznaną CML w fazie przewlekłej
Dazatynib N=259 | Imatynib N=260 | wartość p |
Odsetek odpowiedzi (95% CI) | ||
Odpowiedź cytogenetyczna w ciągu 12 miesięcy | ||
a cCCyR | 76,8% (71,2-81,8) | 66,2% (60,1-71,9) | p< 0,007* |
b CCyR | 85,3% (80,4-89,4) | 73,5% (67,7-78,7) | ⎯ |
w ciągu 24 miesięcy | |||
a cCCyR | 80,3% | 74,2% | ⎯ |
b CCyR | 87,3% | 82,3% | ⎯ |
w ciągu 36 miesięcy | |||
a cCCyR | 82,6% | 77,3% | ⎯ |
b CCyR | 88,0% | 83,5% | ⎯ |
w ciągu 48 miesięcy | |||
a cCCyR | 82,6% | 78,5% | ⎯ |
b CCyR | 87,6% | 83,8% | ⎯ |
w ciągu 60 miesięcy | |||
a cCCyR | 83,0% | 78,5% | ⎯ |
b CCyR | 88,0% | 83,8% | ⎯ |
c Większa odpowiedź molekularna | |||
12 miesięcy | 52,1% (45,9-58,3) | 33,8% (28,1-39,9) | p< 0,00003* |
24 miesiące | 64,5% (58,3-70,3) | 50% (43,8-56,2) | ⎯ |
36 miesięcy | 69,1% (63,1-74,7) | 56,2% (49,9-62,3) | ⎯ |
48 miesięcy | 75,7% (70,0-80,8) | 62,7% (56,5-68,6) | ⎯ |
60 miesięcy | 76,4% (70,8-81,5) | 64,2% (58,1-70,1) | p=0,0021 |
Współczynnik ryzyka (HR) | |||
w ciągu 12 miesięcy (99,99% CI) | |||
Czas do cCCyR | 1,55 (1,0-2,3) | p< 0,0001* | |
Czas do MMR | 2,01 (1,2-3,4) | p< 0,0001* | |
Trwałość cCCyR | 0,7 (0,4-1,4) | p< 0,035 | |
w ciągu 24 miesięcy (95% CI) | |||
Czas do cCCyR | 1,49 (1,22-1,82) | ⎯ | |
Czas do MMR | 1,69 (1,34-2,12) | ⎯ | |
Trwałość cCCyR | 0,77 (0,55-1,10) w ciągu 36 miesięcy (95% CI) | ⎯ | |
Czas do cCCyR | 1,48 (1,22-1,80) | ⎯ | |
Czas do MMR Trwałość cCCyR Czas do c CCyR Czas do MMR Trwałość cCCyR Czas do cCCyR Czas do MMR Trwałość cCCyR | 1,59 (1,28-1,99) 0,77 (0,53-1,11) w ciągu 48 miesięcy (95% CI) 1,45 (1,20-1,77) 1,55 (1,26-1,91) 0,81 (0,56-1,17) w ciągu 60 miesięcy (95% CI) 1,46 (1,20-1,77) 1,54 (1,25-1,89) 0,79 (0,55-1,13) | ⎯ ⎯ ⎯ ⎯ ⎯ p=0,0001 p< 0,0001 p=0,1983 |
a Potwierdzona pełna odpowiedź cytogenetyczna (cCCyR) jest definiowana jako odpowiedź odnotowana w dwóch kolejnych oznaczeniach (w co najmniej 28-dniowym odstępie czasowym).
b Pełna odpowiedź cytogenetyczna (CCyR) oceniana jest na podstawie jednorazowej oceny cytogenetycznej szpiku kostnego.
c Większa odpowiedź molekularna (w jakimkolwiek czasie) była definiowana wg współczynnika BCR-ABL ≤ 0,1% w oznaczeniu metodą RQ-PCR w próbkach krwi obwodowej ze standaryzacją zgodnie ze skalą międzynarodową. Są to łączne wskaźniki reprezentujące minimalny okres obserwacji w ciągu określonego czasu.
* Dostosowany do skali Hasforda i wskazujący istotność statystyczną w określonym na początku nominalnym poziomie istotności. CI = przedział ufności.
U pacjentów z potwierdzoną CCyR mediana czasu do wystąpienia cCCyR po 60-miesięcznym okresie obserwacji wynosiła 3,1 miesiąca w grupie otrzymującej dazatynib i 5,8 miesiąca w grupie otrzymującej imatynib. U pacjentów z MMR mediana czasu do uzyskania MMR po 60- miesięcznym okresie obserwacji wynosiła 9,3 miesiąca w grupie dazatynibu i 15,0 miesięcy w grupie imatynibu. Wyniki te są zgodne z wartościami uzyskanymi po 12, 24 i 36 miesiącach.
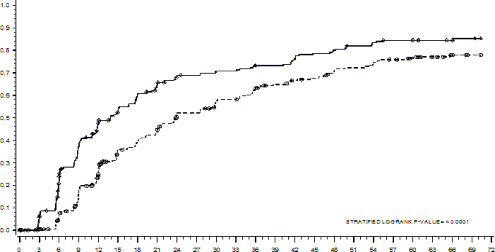
Czas do uzyskania odpowiedzi MMR przedstawiono graficznie na Wykresie 1. Czas do uzyskania MMR był stale krótszy u pacjentów leczonych dazatynibem w porównaniu z pacjentami otrzymującymi imatynib.
ODSETEK ODPOWIADAJĄCYCH
Wykres 1: Estymator czasu Kaplana-Meiera do większej odpowiedzi molekularnej (MMR)
Dazatynib Imatynib
Cenzurowane Cenzurowane
GRUPA # ODPOWIADAJĄCY / # Z RANDOMIZACJĄ WSPÓŁCZYNNIK RYZYKA (95% CI)
Dazatynib | 198/259 |
Imatynib | 167/260 |
Dazatynib wobec imatynibu | 1,54 (1,25 - 1,89) |
Wskaźniki cCCyR, odpowiednio, w grupach leczonych dazatynibem i imatynibem w ciągu
3 miesięcy (54% i 30%), 6 miesięcy (70% i 56%), 9 miesięcy (75% i 63%), 24 miesięcy (80% i 74%),
36 miesięcy (83% i 77%), 48 miesięcy (83% i 79%) i 60 miesięcy (83% i 79%) były zgodne z pierwszorzędowym punktem końcowym. Wskaźniki MMR, odpowiednio, w grupach leczonych dazatynibem i imatynibem w ciągu 3 miesięcy (8% i 0,4%), 6 miesięcy (27% i 8%), 9 miesięcy (39% i
18%), 12 miesięcy (46% i 28%), 24 miesięcy (64% i 46%), 36 miesięcy (67% i 55%), 48 miesięcy
(73% i 60%) i 60 miesięcy (76% i 64%) były zgodne z pierwszorzędowym punktem końcowym.
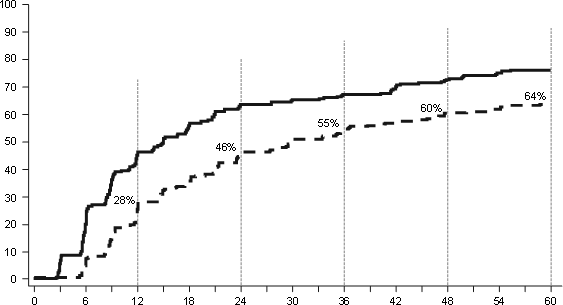
Wskaźniki MMR w poszczególnych punktach czasowych przedstawiono graficznie na Wykresie 2. Wskaźniki MMR były stale wyższe wśród pacjentów leczonych dazatynibem w porównaniu z pacjentami leczonymi imatynibem.
% z MMR
Wykres 2: Wskaźniki MMR w czasie – wszyscy zrandomizowani pacjenci w badaniu III fazy z udziałem pacjentów z nowo rozpoznaną CML w fazie przewlekłej
Przez 2 lata
64%, p<.0001
Przez 3 lata
67%, p<.0055
Przez 4 lata
73%, p<.0021
Przez 5 lat
76%, p<.0022
Przez 1 rok
46%, p<.0001
Miesiące od randomizacji
N
Dazatynib 100 mg raz na dobę 259
--------- Imatynib 400 mg raz na dobę 260
Odsetek pacjentów osiągających współczynnik BCR-ABL o wartości ≤ 0,01% (zmniejszenie 4-log) w dowolnym czasie był większy w grupie leczonych dazatynibem w porównaniu z grupą leczonych imatynibem (54,1% w stosunku do 45%). Odsetek pacjentów osiągających współczynnik BCR-ABL o wartości ≤ 0,0032% (zmniejszenie 4,5-log) w dowolnym czasie był większy w grupie leczonych dazatynibem w porównaniu z grupą leczonych imatynibem (44% w stosunku do 34%).
Wskaźniki MR4.5 w czasie przedstawiono graficznie na Wykresie 3. Odsetki MR4.5 w czasie były stale wyższe wśród pacjentów leczonych dazatynibem w porównaniu z pacjentami leczonymi imatynibem.
% z MMR4.5
Wykres 3: Wskaźniki MR4.5 w czasie - wszyscy zrandomizowani pacjenci w badaniu III fazy z udziałem pacjentów z nowo rozpoznaną CML w fazie przewlekłej
Przez 5 lat
Przez 4 lata
42%, p<.0251
Przez 2 lata
19%, p<.0008
Przez 3 lata
24%, p<.0013
34%, p<.0055
Przez 1 rok
5%, p<.2394
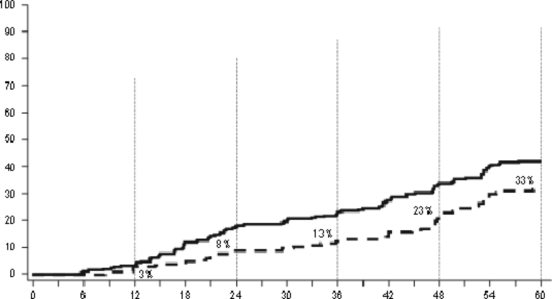
Miesiące od randomizacji
N
Dazatynib 100 mg raz na dobę 259
--------- Imatynib 400 mg raz na dobę 260
Wskaźnik MMR w dowolnym czasie w każdej z grup ryzyka określonych przez wskaźnik Hasforda był większy w grupie leczonych dazatynibem w porównaniu z grupą leczonych imatynibem (niskiego ryzyka: 90% i 69%; pośredniego ryzyka: 71% i 65%; wysokiego ryzyka: 67% i 54%, odpowiednio).
W dodatkowej analizie, więcej pacjentów leczonych dazatynibem (84%) uzyskało wczesną odpowiedź molekularną (definiowaną jako poziom BCR-ABL ≤ 10% po 3 miesiącach) w porównaniu do pacjentów leczonych imatynibem (64%). Pacjenci uzyskujący wczesną odpowiedź molekularną mieli mniejsze ryzyko transformacji, wyższy wskaźnik czasu przeżycia wolnego od progresji (PFS) oraz wyższy wskaźnik całkowitego przeżycia (OS), jak przedstawiono w Tabeli 10.
Tabela 10: Pacjenci leczeni dazatynibem z BCR-ABL ≤ 10% i > 10% po 3 miesiącach
Dazatynib N=235 | Pacjenci z BCR-ABL ≤ 10% po 3 miesiącach | Pacjenci z BCR- ABL > 10% po 3 miesiącach |
Liczba pacjentów (%) Transformacja po 60 miesiącach, n/N (%) Wskaźnik PFS po 60 miesiącach (95% CI) Wskaźnik OS po 60 miesiącach (95% CI) | 198 (84,3) 6/198 (3,0) 92,0% (89,6; 95,2) 93,8% (89,3; 96,4) | 37 (15,7) 5/37 (13,5) 73,8% (52,0; 86,8) 80,6% (63,5; 90,2) |
Wartość OS w poszczególnych punktach czasowych przedstawiono graficznie na Wykresie 4. Wartość OS była stale wyższa wśród pacjentów leczonych dazatynibem, u których osiągnięto poziom BCR- ABL ≤ 10% po 3 miesiącach, niż wśród pacjentów, u których nie osiągnięto takiego poziomu.
ODSETEK ŻYJĄCYCH
Wykres 4: Orientacyjny wykres całkowitego czasu przeżycia dla dazatynibu w zależności od poziomu BCR-ABL (≤ 10% lub > 10%) po 3 miesiącach w badaniu III fazy z udziałem pacjentów z nowo rozpoznaną CML w fazie przewlekłej
MIESIĄCE | |||||||||||||||
Pacjenci z ryzykiem | |||||||||||||||
<=10% 198 198 | 197 | 196 | 195 | 193 | 193 | 191 | 191 | 190 | 188 | 187 187 184 182 | 181 | 180 179 179 177 171 96 | 54 29 | 3 | 0 |
>10% 37 37 | 37 | 35 | 34 | 34 | 34 | 33 | 33 | 31 | 30 | 29 29 29 28 | 28 | 28 27 27 27 26 15 | 10 6 | 0 | 0 |
≤ 10% ------ > 10%
Cenzurowane Cenzurowane
GRUPA | # ZGONY/ # Pacjenci | MEDIANA (95% CI) | WSPÓŁCZYNNIK RYZYKA (95% CI) |
≤ 10% | 14/198 | .(. - .) | |
> 10% | 8/37 | .(. - .) | |
0,29 (0,12 - 0,69) |
Progresję choroby zdefiniowano jako zwiększenie liczby białych krwinek pomimo odpowiedniego leczenia, utratę CHR, częściowej CyR lub CCyR, przejście do fazy akceleracji lub przełomu blastycznego albo zgon. Szacowany 60-miesięczny odsetek przeżyć wolnych od progresji wynosił 88,9% (CI: 84% - 92,4%) zarówno w grupie leczonej dazatynibem, jak i imatynibem. Przejście w ciągu 60 miesięcy do fazy akceleracji lub przełomu blastycznego występowało u mniejszej liczby pacjentów leczonych dazatynibem (n=8; 3%) w porównaniu z pacjentami leczonymi imatynibem (n=15; 5,8%). Szacowany 60-miesięczny odsetek przeżyć pacjentów leczonych dazatynibem i imatynibem wynosił odpowiednio 90,9% (CI: 86,6% - 93,8%) i 89,6% (CI: 85,2% - 92,8%). Nie było różnic w całkowitym czasie przeżycia (OS) (HR 1,01; 95% CI: 0,58 - 1,73; p=0,9800) i czasie przeżycia bez progresji choroby (PFS) (HR 1,00; 95% CI: 0,58 - 1,72; p=0,9998) między dazatynibem a imatynibem.
W przypadku pacjentów, którzy zgłosili progresję choroby lub przerwali leczenie dazatynibem lub imatynibem, przeprowadzono sekwencjonowanie BCR-ABL na próbkach krwi pacjentów, o ile były dostępne. W obu grupach leczenia zaobserwowano podobne wskaźniki mutacji. Mutacje wykryte wśród pacjentów leczonych dazatynibem obejmowały T315I, F317I/L i V299L. W grupie leczonych imatynibem stwierdzono odmienny zakres mutacji. W oparciu o dane in vitro wydaje się, że dazatynib nie jest aktywny przeciw mutacji T315I.
Faza przewlekła CML - Oporność lub nietolerancja na wcześniejsze leczenie imatynibem
U pacjentów z opornością lub nietolerancją imatynibu przeprowadzono dwa badania kliniczne. Pierwszorzędnym punktem końcowym dotyczącym skuteczności w tych badaniach była duża odpowiedź cytogenetyczna (MCyR, ang. major cytogenetic response):
Badanie 1.
Przeprowadzono otwarte, randomizowane, nieporównawcze, wieloośrodkowe badanie u pacjentów po niepowodzeniu wstępnego leczenia imatynibem w dawce 400 lub 600 mg. Pacjenci byli losowo
przydzielani (2:1) do grupy otrzymującej dazatynib (70 mg dwa razy na dobę) lub imatynib (400 mg dwa razy na dobę). Przeniesienie do alternatywnego ramienia badania było dopuszczalne, jeśli u pacjentów stwierdzano progresję choroby lub nietolerancję leczenia mimo zmiany dawkowania.
Pierwszorzędnym punktem końcowym była MCyR w 12 tygodniu. Otrzymane wyniki obejmują grupę 150 pacjentów: 101 było przydzielonych do grupy otrzymującej dazatynib, a 49 do grupy otrzymującej imatynib (wszyscy byli oporni na imatynib). Mediana czasu od momentu rozpoznania do randomizacji wynosiła 64 miesiące dla pacjentów otrzymujących dazatynib i 52 miesiące dla pacjentów otrzymujących imatynib.
Wszyscy pacjenci byli wcześniej intensywnie leczeni. Po wcześniejszym leczeniu imatynibem całkowitą odpowiedź hematologiczną (CHR) po leczeniu uzyskano u 93% spośród wszystkich pacjentów. Wcześniejszą dużą odpowiedź cytogenetyczną (MCyR) po leczeniu imatynibem osiągnęło 28% pacjentów w ramieniu dazatynibu i 29% pacjentów w ramieniu imatynibu.
Mediana czasu leczenia wynosiła 23 miesiące dla dazatynibu (przy 44% pacjentów leczonych > 24 miesiące do chwili obecnej) oraz 3 miesiące dla imatynibu (przy 10% pacjentów leczonych > 24 miesiące do chwili obecnej). Dziewięćdziesiąt trzy procent pacjentów w ramieniu dazatynibu i 82% pacjentów w ramieniu imatynibu osiągnęło całkowitą odpowiedź hematologiczną (CHR) przed przeniesieniem do innego ramienia leczenia.
Po 3 miesiącach dużą odpowiedź cytogenetyczną (MCyR) obserwowano częściej w ramieniu dazatynibu (36%) niż w ramieniu imatynibu (29%). Warto zauważyć, że w ramieniu dazatynibu 22% pacjentów osiągnęło całkowitą odpowiedź cytogenetyczną (CCyR), podczas gdy w ramieniu imatynibu tylko 8% pacjentów osiągnęło taką odpowiedź. Po dłuższym czasie leczenia i okresie obserwacji (mediana 24 miesięcy) MCyR osiągnęło 53% pacjentów leczonych dazatynibem (CCyR u 44%) i 33% pacjentów leczonych imatynibem (CCyR u 18%) przed przeniesieniem do innego ramienia leczenia. Spośród pacjentów, którzy przed włączeniem do badania otrzymywali imatynib w dawce 400 mg, MCyR osiągnęło 61% pacjentów otrzymujących dazatynib i 50% pacjentów otrzymujących imatynib.
Na podstawie oceny wg Kaplana-Meiera, odsetek pacjentów, u których MCyR utrzymała się przez1 rok wynosił 92% (95% CI: [85%-100%]) dla dazatynibu (CCyR 97%, 95% CI: [92%-100%]) i 74% (95% CI: [49%-100%]) dla imatynibu (CCyR 100%). Odsetek pacjentów, u których MCyR utrzymał się przez 18 miesięcy wynosił 90% (95% CI: [82%-98%]) dla dazatynibu (CCyR 94%, 95% CI: [87%-
100%]) i 74% (95% CI: [49%-100%]) dla imatynibu (CCyR 100%).
Na podstawie oceny wg Kaplana-Meiera, odsetek pacjentów, którzy mieli roczny okres przeżycia bez postępu choroby (PFS) wynosił 91% (95% CI: [85%-97%]) dla dazatynibu i 73% (95% CI: [54%- 91%]) dla imatynibu. Procent pacjentów, którzy mieli dwuletni PFS wynosił 86% (95% CI: [78%- 93%]) dla dazatynibu i 65% (95% CI: [43%-87%]) dla imatynibu.
Niepowodzenie leczenia, zdefiniowane jako progresja choroby lub przeniesienie do innego programu leczenia (brak odpowiedzi, nietolerancja badanego produktu leczniczego, itp.), obserwowano u 43% pacjentów otrzymujących dazatynib oraz u 82% pacjentów otrzymujących imatynib.
Procent większej odpowiedzi molekularnej (definiowanej jako BCR-ABL/kontrolowane transkrypty
≤ 0,1% przez RQ-PCR w próbkach krwi obwodowej) przed przeniesieniem do innego ramienia leczenia wynosił 29% dla dazatynibu i 12% dla imatynibu.
Badanie 2.
U pacjentów wykazujących oporność lub nietolerancję na imatynib przeprowadzono wieloośrodkowe, otwarte, jednoramienne badanie (tj. pacjentów, u których w czasie leczenia imatynibem, wystąpiły istotne objawy toksyczności, uniemożliwiające dalsze leczenie).
Łącznie 387 pacjentów otrzymywało dazatynib w dawce 70 mg dwa razy na dobę (288 z opornością oraz 99 z brakiem tolerancji). Mediana czasu od momentu rozpoznania do momentu rozpoczęcia leczenia wynosiła 61 miesięcy. Większość pacjentów (53%) otrzymywała wcześniej imatynib przez ponad 3 lata. Większość pacjentów z opornością (72%) otrzymywała > 600 mg imatynibu. Poza imatynibem 35% pacjentów otrzymywało wcześniej chemioterapię cytotoksyczną, 65% otrzymywało
wcześniej interferon, a 10% poddanych było wcześniej przeszczepieniu komórek macierzystych szpiku. U trzydziestu ośmiu procent pacjentów stwierdzono obecność podstawowych mutacji, o których wiadomo, że są odpowiedzialne za oporność na imatynib. Mediana czasu leczenia dazatynibem wynosiła 24 miesiące, przy 51% pacjentów leczonych > 24 miesięcy do chwili obecnej. Wyniki skuteczności przedstawiono w Tabeli 11. MCyR osiągnięto u 55% pacjentów opornych na imatynib i u 82% pacjentów, którzy nie tolerowali imatynibu. Po minimalnym czasie obserwacji wynoszącym 24 miesiące, u 21 spośród 240 pacjentów, którzy osiągnęli dużą odpowiedź cytogenetyczną (MCyR) stwierdzono progresję choroby i u tych pacjentów nieosiągnięta została mediana czasu trwania dużej odpowiedzi cytogenetycznej (MCyR).
Na podstawie oceny wg Kaplana-Meiera, 95% (95% CI: [92%-98%]) pacjentów utrzymało MCyR przez 1 rok, a 88% (95% CI: [83%-93%]) utrzymało MCyR przez 2 lata. Odsetek pacjentów, u
których CCyR utrzymał się przez 1 rok wynosił 97% (95% CI: [94%-99%]), a przez 2 lata 90% (95% CI: [86%-95%]). Czterdzieści dwa procent pacjentów z opornością na imatynib, którzy nie uzyskali wcześniej MCyR po zastosowaniu imatynibu (n=188), uzyskało MCyR po podaniu dazatynibu.
Stwierdzono 45 różnych typów mutacji BCR-ABL u 38% pacjentów włączonych do tego badania. Całkowitą odpowiedź hematologiczną lub MCyR uzyskano u pacjentów z licznymi typami mutacji BCR-ABL związanymi z opornością na imatynib, z wyjątkiem T315I. Odsetek MCyR w 2. roku był podobny, bez względu czy na początku leczenia pacjenci mieli mutacje BCR-ABL, P-loop mutacje czy nie mieli mutacji (odpowiednio 63%, 61% i 62%).
Dla pacjentów opornych na imatynib, przewidywany PFS wynosił 88% (95% CI: [84%-92%]) dla 1 roku i 75% (95% CI: [69%-81%]) dla 2 lat. Dla pacjentów, którzy nie tolerują imatynibu przewidywany PFS wynosił 98% (95% CI: [95%-100%]) dla 1 roku i 94% (95% CI: [88%-99%]) dla
2 lat.
Większa odpowiedź molekularna po 24 miesiącach wynosiła 45% (35% u pacjentów opornych na imatynib i 74% u pacjentów, którzy nie tolerują imatynibu).
Faza akceleracji CML
U pacjentów wykazujących nietolerancję lub oporność na imatynib przeprowadzono wieloośrodkowe, otwarte, jednoramienne badanie. Łącznie 174 pacjentów otrzymywało dazatynib w dawce 70 mg dwa razy na dobę (161 z opornością oraz 13 z nietolerancją imatynibu). Mediana czasu od momentu rozpoznania do momentu rozpoczęcia leczenia wynosiła 82 miesiące. Mediana czasu leczenia dazatynibem wynosiła 14 miesięcy przy 31% pacjentów leczonych > 24 miesięcy do chwili obecnej. Współczynnik większej odpowiedzi molekularnej po 24 miesiącach wynosił 46% (oceniony u 41 pacjentów z CCyR). Inne wyniki skuteczności przedstawiono w Tabeli 11.
Mieloblastyczna postać przełomu blastycznego CML
U pacjentów wykazujących oporność lub nietolerancję imatynibu przeprowadzono wieloośrodkowe, otwarte, jednoramienne badanie. Łącznie 109 pacjentów otrzymywało dazatynib w dawce 70 mg dwa razy na dobę (99 z opornością oraz 10 z nietolerancją imatynibu). Mediana czasu od momentu rozpoznania do momentu rozpoczęcia leczenia wynosiła 48 miesięcy. Mediana czasu leczenia dazatynibem wynosiła 3,5 miesiąca przy 12% pacjentów leczonych > 24 miesięcy do chwili obecnej. Współczynnik większej odpowiedzi molekularnej po 24 miesiącach wynosił 68% (oceniony u 19 pacjentów z CCyR). Inne wyniki skuteczności przedstawiono w Tabeli 11.
Limfoblastyczna postać przełomu blastycznego CML i Ph+ ALL
U pacjentów z limfoblastyczną postacią przełomu blastycznego CML oraz z Ph+ ALL wykazujących oporność lub nietolerancję na wcześniejsze leczenie imatynibem przeprowadzono wieloośrodkowe, otwarte, jednoramienne badanie. Łącznie 48 pacjentów z limfoblastyczną postacią przełomu blastycznego CML otrzymywało dazatynib w dawce 70 mg dwa razy na dobę (42 z opornością oraz 6 z nietolerancją imatynibu). Mediana czasu od momentu rozpoznania do momentu rozpoczęcia leczenia wynosiła 28 miesięcy. Mediana czasu leczenia dazatynibem wynosiła 3 miesiące przy 2% pacjentów leczonych > 24 miesięcy do chwili obecnej. Współczynnik większej odpowiedzi
molekularnej po 24 miesiącach wynosił 50% (oceniony u wszystkich 22 leczonych pacjentów
z CCyR). Dodatkowo 46 pacjentów z Ph+ ALL otrzymywało dazatynib w dawce 70 mg dwa razy na dobę (44 z opornością oraz 2 z nietolerancją imatynibu). Mediana czasu od momentu rozpoznania do momentu rozpoczęcia leczenia wynosiła 18 miesięcy. Mediana czasu leczenia dazatynibem wynosiła 3 miesiące przy 7% pacjentów leczonych > 24 miesięcy do chwili obecnej.
Współczynnik większej odpowiedzi molekularnej po 24 miesiącach wynosił 52% (oceniony u wszystkich 25 leczonych pacjentów z CCyR). Inne wyniki skuteczności przedstawiono w Tabeli 11. Warto zauważyć, że szybko osiągano dużą odpowiedź hematologiczną (MaHR) (w większości przypadków w ciągu 35 dni od podania pierwszej dawki dazatynibu u pacjentów z limfoblastyczną postacią przełomu blastycznego CML oraz w ciągu 55 dni u pacjentów z Ph+ ALL).
Tabela 11: Skuteczność dazatynibu w jednoramiennych badaniach II fazya
Faza przewlekła (n=387) | Faza akceleracji (n=174) | Mieloblastyc zna postać przełomu blastycznego (n=109) | Limfoblast yczna postać przełomu blastyczneg o (n=48) | Ph+ ALL (n=46) | ||
Odpowiedź hematologicznab (%) | ||||||
MaHR (95% CI) | n/a | 64% (57-72) | 33% (24-43) | 35% (22-51) | 41% (27-57) | |
CHR (95% CI) | 91% (88-94) | 50% (42-58) | 26% (18-35) | 29% (17-44) | 35% (21-50) | |
NEL (95% CI) | n/a | 14% (10-21) | 7% (3-14) | 6% (1-17) | 7% (1-18) | |
Czas trwania MaHR (%; ocena wg Kaplana-Meiera) | ||||||
1 rok | n/a | 79% (71-87) | 71% (55-87) | 29% (3-56) | 32% (8-56) | |
2 lata | n/a | 60% (50-70) | 41% (21-60) | 10% (0-28) | 24% (2-47) | |
Odpowiedź cytogenetycznac (%) | ||||||
MCyR (95% CI) | 62% (57-67) | 40% (33-48) | 34% (25-44) | 52% (37-67) | 57% (41-71) | |
CCyR (95% CI) | 54% (48-59) | 33% (26-41) | 27% (19-36) | 46% (31-61) | 54% (39-69) | |
Przeżycie (%; ocena wg Kaplana-Meiera) | ||||||
Bez postępu choroby 1 rok | 91% (88-94) | 64% (57-72) | 35% (25-45) | 14% (3-25) | 21% (9-34) | |
2 lata | 80% (75-84) | 46% (38-54) | 20% (11-29) | 5% (0-13) | 12% (2-23) | |
Łącznie | ||||||
1 rok | 97% (95-99) | 83% (77-89) | 48% (38-59) | 30% (14-47) | 35% (20-51) | |
2 lata | 94% (91-97) | 72% (64-79) | 38% (27-50) | 26% (10-42) | 31% (16-47) | |
Dane zebrane w tej tabeli pochodzą z badań, w których dawką początkową było 70 mg podawane dwa razy na dobę. Zalecana dawka początkowa, patrz punkt 4.2.
a Wyniki zebrane dla pierwszorzędowych punktów końcowych przedstawiono pogrubionym drukiem.
b Kryteria odpowiedzi hematologicznej (wszystkie odpowiedzi potwierdzone po 4 tygodniach): duża odpowiedź hematologiczna (MaHR - major hematologic response) = całkowita odpowiedź hematologiczna (CHR - complete haematologic response) + brak objawów białaczki (NEL - no evidence of leukemia).
CHR (faza przewlekła CML): krwinki białe (WBC) ≤ GGN laboratoryjnej w danej instytucji, liczba płytek krwi
< 450000/mm3, brak blastów lub promielocytów we krwi obwodowej, < 5% mielocytów oraz metamielocytów we krwi obwodowej, < 20% granulocytów zasadochłonnych we krwi obwodowej oraz brak ognisk białaczkowych poza szpikiem. CHR (zaawansowana CML/Ph+ ALL): WBC ≤ GGN laboratoryjnej w danej instytucji, ANC ≥ 1000/mm3, liczba płytek krwi ≥ 100000/mm3, brak blastów lub promielocytów we krwi obwodowej, liczba blastów w szpiku kostnym ≤ 5%, < 5% mielocytów oraz metamielocytów we krwi obwodowej, < 20% granulocytów zasadochłonnych we krwi obwodowej oraz brak ognisk białaczkowych poza szpikiem.
NEL: te same kryteria jak w przypadku CHR, ale ANC ≥ 500/mm3 i < 1000/mm3, lub płytki krwi ≥ 20000/mm3 i
≤ 100000/mm3.
c Kryteria odpowiedzi cytogenetycznej: całkowita (0% metafaz Ph+) lub częściowa (> 0%‑35%). MCyR (0%-35%) obejmuje zarówno odpowiedź całkowitą, jak i częściową.
n/a = nie dotyczy; CI = przedział ufności; GGN = górna granica normy.
Wyniki u pacjentów z przeszczepem szpiku po leczeniu dazatynibem nie zostały w pełni ocenione.
Badania kliniczne III fazy u pacjentów z CML w fazie przewlekłej, w fazie akceleracji lub w fazie przełomu blastycznego i Ph+ ALL, którzy byli oporni lub nie tolerowali imatynibu Przeprowadzono dwa randomizowane, otwarte badania oceniające skuteczność dazatynibu
podawanego raz na dobę w porównaniu do dazatynibu podawanego dwa razy na dobę. Poniżej opisane wyniki pochodzą z co najmniej 2-letniej i 7-letniej obserwacji od rozpoczęcia leczenia dazatynibem.
Badanie 1.
W badaniu fazy przewlekłej CML, u pacjentów opornych na imatynib, pierwszorzędowym punktem końcowym był MCyR. Głównym drugorzędowym punktem końcowym był MCyR podzielony przez dawkę dobową u pacjentów z opornością na imatynib. Do innych drugorzędowych punktów końcowych należały czas trwania MCyR, PFS i całkowity czas przeżycia. Łącznie 670 pacjentów, z których 497 było opornych na imatynib, randomizowano do grup otrzymujących dazatynib w dawce 100 mg raz na dobę, 140 mg raz na dobę, 50 mg dwa razy na dobę lub 70 mg dwa razy na dobę.
Mediana czasu trwania leczenia dla wszystkich pacjentów nadal leczonych z co najmniej 5-letnim okresem obserwacji (n=205) wynosiła 59 miesięcy (zakres 28-66 miesięcy). Mediana czasu trwania leczenia dla wszystkich pacjentów po 7-letniej obserwacji wynosiła 29,8 miesiąca (zakres < 1–92,9 miesiąca).
Skuteczność osiągnięto we wszystkich grupach leczonych dazatynibem podawanym w schemacie jeden raz na dobę. Dla pierwszorzędowego punktu końcowego (różnica w MCyR 1,9%; z 95% przedziałem ufności [-6,8% - 10,6%]) wykazano porównywalną skuteczność (nie stwierdzono mniejszej) z podawaniem 2 razy na dobę; jednakże przy zastosowaniu schematu dawkowania 100 mg raz na dobę wykazano zwiększone bezpieczeństwo i tolerancję. Wyniki skuteczności przedstawiono w Tabelach 12. i 13.
Tabela 12: Skuteczność dazatynibu w badaniu III fazy dotyczącym optymalizacji dawkowania: oporność lub nietolerancja imatynibu w fazie przewlekłej CML (wyniki po 2 latach)a
Wszyscy pacjenci | n=167 |
Pacjenci z opornością na imatynib | n=124 |
Odsetek odpowiedzi hematologicznej b (%) (95% CI) | |
CHR | 92% (86–95) |
Odpowiedź cytogenetyczne c (%) (95% CI) | |
MCyR | |
Wszyscy pacjenci | 63% (56–71) |
Pacjenci z opornością na imatynib | 59% (50–68) |
CCyR | |
Wszyscy pacjenci | 50% (42–58) |
Pacjenci z opornością na imatynib | 44% (35–53) |
Większa odpowiedź molekularna u pacjentów uzyskujących CCyR d (%) (95% CI) | |
Wszyscy pacjenci | 69% (58–79) |
Pacjenci z opornością na imatynib | 72% (58–83) |
a Wyniki odnotowane po zastosowaniu zalecanej dawki początkowej wynoszącej 100 mg raz na dobę.
b Kryteria odpowiedzi hematologicznej (wszystkie odpowiedzi potwierdzone po 4 tygodniach): całkowita odpowiedź hematologiczna (CHR) (faza przewlekła CML): krwinki białe (WBC) ≤ GGN laboratoryjnej w danej instytucji, liczba płytek krwi < 450000/mm3, brak blastów lub promielocytów we krwi obwodowej, < 5% mielocytów oraz metamielocytów we krwi obwodowej, liczba granulocytów zasadochłonnych we krwi obwodowej < 20% oraz brak ognisk białaczkowych poza szpikiem.
c Kryteria odpowiedzi cytogenetycznej: całkowita (0% metafaz Ph+) lub częściowa (> 0%-35%). Duża odpowiedź cytogenetyczna (MCyR) (0%–35%) obejmuje zarówno odpowiedź całkowitą, jak i częściową.
d Kryteria większej odpowiedzi molekularnej: określona jako współczynnik BCR-ABL/gen kontrolny ≤ 0,1% oznaczony metodą RQ-PCR w próbkach krwi obwodowej.
Tabela 13: Długoterminowa skuteczność dazatynibu w badaniu III fazy dotyczącym optymalizacji dawkowania: pacjenci z CML w fazie przewlekłej z opornością lub nietolerancją na imatyniba
Minimalny okres obserwacji
1 rok | 2 lata | 5 lata | 7 lat | |
Większa odpowiedź molekularna | ||||
Wszyscy pacjenci | NA | 37% (57/154) | 44% (71/160) | 46% (73/160) |
Pacjenci z opornością na imatynib | NA | 35% (41/117) | 42% (50/120) | 43% (51/120) |
Pacjenci z nietolerancją na imatynib | NA | 43% (16/37) | 53% (21/40) | 55% (22/40) |
Przeżycie bez progresji chorobyb | ||||
Wszyscy pacjenci | 90% (86, 95) | 80% (73, 87) | 51% (41, 60) | 42% (33, 51) |
Pacjenci z opornością na imatynib | 88% (82, 94) | 77% (68, 85) | 49% (39, 59) | 39% (29, 49) |
Pacjenci z nietolerancją na imatynib | 97% (92, 100) | 87% (76, 99) | 56% (37, 76) | 51% (32, 67) |
Całkowity czas przeżycia | ||||
Wszyscy pacjenci | 96% (93, 99) | 91% (86, 96) | 78% (72, 85) | 65% (56, 72) |
Pacjenci z opornością na imatynib | 94% (90, 98) | 89% (84, 95) | 77% (69, 85) | 63% (53, 71) |
Pacjenci z nietolerancją na imatynib | 100% (100, 100) | 95% (88, 100) | 82% (70, 94) | 70% (52, 82) |
a Wyniki odnotowane po zastosowaniu zalecanej dawki początkowej wynoszącej 100 mg raz na dobę.
b Progresję definiowano jako zwiększenie liczby białych krwinek (WBC), utratę CHR lub MCyR, ≥ 30% zwiększenie metafaz Ph+, potwierdzoną chorobę AP/BP lub zgon. PFS oceniano według zasad zgodnych z zaplanowanym leczeniem a pacjenci byli obserwowani pod względem zdarzeń łącznie z kolejną terapią.
Na podstawie oceny wg Kaplana-Meiera, odsetek pacjentów utrzymujących MCyR przez 18 miesięcy, leczonych dazatynibem w dawce 100 mg raz na dobę wynosił 93% (95% CI: [88%-98%]).
Skuteczność oceniano również u pacjentów, którzy nie tolerowali imatynibu. W tej populacji pacjentów, którzy otrzymywali 100 mg raz na dobę, MCyR uzyskano u 77% a CCyR u 67%.
Badanie 2.
W badaniu fazy zaawansowanej CML i Ph+ ALL pierwszorzędowym punktem końcowym była MaHR. Łącznie 611 pacjentów przydzielono losowo do grupy otrzymującej dazatynib w dawce 140 mg raz na dobę lub 70 mg dwa razy na dobę. Mediana czasu trwania leczenia wynosiła około 6 miesięcy (zakres 0,03–31 miesięcy).
W odniesieniu do pierwszorzędowego punktu końcowego określającego skuteczność dawkowanie raz na dobę miało porównywalną skuteczność (nie stwierdzono mniejszej) z dawkowaniem dwa razy na dobę (różnica MaHR 0,8%; z 95% przedziałem ufności [-7,1% - 8,7%]); jednakże przy zastosowaniu schematu dawkowania 140 mg raz na dobę wykazano zwiększone bezpieczeństwo i tolerancję.
Wskaźniki odpowiedzi przedstawiono w Tabeli 14.
Tabela 14: Skuteczność dazatynibu w badaniu III fazy dotyczących optymalizacji dawkowania: faza zaawansowana CML i Ph+ ALL (wyniki po 2 latach)a
Faza akceleracji (n=158) | Mieloblastyczna postać przełomu blastycznego (n=75) | Limfoblastyczna postać przełomu blastycznego (n=33) | Ph+ALL (n=40) |
MaHRb (95% CI) | 66% (59-74) | 28% (18-40) | 42% (26-61) | 38% (23-54) |
CHRb (95% CI) | 47% (40-56) | 17% (10-28) | 21% (9-39) | 33% (19-49) |
NELb (95% CI) | 19% (13-26) | 11% (5-20) | 21% (9-39) | 5% (1-17) |
MCyRc (95% CI) | 39% (31-47) | 28% 18-40) | 52% (34-69) | 70% (54-83) |
CCyR (95% CI) | 32% (25-40) | 17% (10-28) | 39% (23-58) | 50% (34-66) |
a Wyniki odnotowane po zastosowaniu zalecanej dawki początkowej wynoszącej 140 mg raz na dobę (patrz punkt 4.2).
b Kryteria odpowiedzi hematologicznej (wszystkie odpowiedzi potwierdzone po 4 tygodniach): duża odpowiedź hematologiczna: (MaHR) = całkowita odpowiedź hematologiczna (CHR) + brak objawów białaczki (NEL).
CHR: krwinki białe (WBC) ≤ GGN laboratoryjnej w danej instytucji, ANC ≥ 1000/mm3, liczba płytek krwi < 100 000/mm3, brak blastów lub promielocytów we krwi obwodowej, liczba blastów w szpiku kostnym ≤ 5%, < 5% mielocytów oraz metamielocytów we krwi obwodowej, < 20% granulocytów zasadochłonnych we krwi obwodowej oraz brak ognisk białaczkowych poza szpikiem.
NEL: te same kryteria jak w przypadku CHR, ale ANC ≥ 500/mm3 i < 1000/mm3, lub liczba płytek krwi ≥ 20000/mm3 i ≤ 100000/mm3.
c MCyR obejmuje zarówno odpowiedź całkowitą (0% Ph+ metaphases), jak i częściową (> 0%-35%). CI = przedział ufności; GGN = górna granica normy.
U pacjentów z CML w fazie akceleracji leczonych schematem 140 mg raz na dobę nie osiągnięto mediany MaHR i mediany całkowitego przeżycia, a mediana PFS wynosiła 25 miesięcy.
U pacjentów z mieloblastyczną postacią przełomu blastycznego CML leczonych schematem 140 mg raz na dobę mediana MaHR wynosiła 8 miesięcy, mediana PFS wynosiła 4 miesiące, a mediana całkowitego przeżycia 8 miesięcy. U pacjentów z limfoblastyczną postacią przełomu blastycznego CML leczonych zgodnie ze schematem 140 mg raz na dobę mediana MaHR wynosiła 5 miesięcy, mediana PFS wynosiła 5 miesięcy, a mediana całkowitego przeżycia wynosiła 11 miesięcy.
U pacjentów z Ph+ ALL leczonych schematem 140 mg raz na dobę mediana MaHR wynosiła 5 miesięcy, mediana PFS wynosiła 4 miesiące, a mediana całkowitego przeżycia 7 miesięcy.
Dzieci i młodzież
Dzieci i młodzież z CML
Spośród 130 pacjentów z CML w fazie przewlekłej (CML CP) leczonych w dwóch badaniach z udziałem dzieci i młodzieży: w badaniu I fazy prowadzonym metodą otwartej próby bez randomizacji, mającym na celu ustalenie właściwej dawki leku, oraz w badaniu II fazy prowadzonym metodą otwartej próby bez randomizacji, 84 pacjentów (wyłącznie z badania II fazy) to pacjenci z nowo rozpoznaną CML CP, a 46 pacjentów (17 z badania I fazy i 29 z badania II fazy) z opornością lub nietolerancją na wcześniejsze leczenie imatynibem. Dziewięćdziesięcioro siedmioro ze 130 dzieci i młodzieży z CML CP leczono dazatynibem w tabletkach w dawce 60 mg/m2 pc. raz na dobę (dawka maksymalna 100 mg raz na dobę u pacjentów z dużą powierzchnią ciała). Pacjenci byli leczeni do chwili wystąpienia progresji choroby lub nieakceptowalnej toksyczności.
Kluczowymi punktami końcowymi dotyczącymi skuteczności były: całkowita odpowiedź cytogenetyczna (CCyR), większa odpowiedź cytogenetyczna (MCyR) i większa odpowiedź molekularna (MMR). Wyniki przedstawiono w Tabeli 15.
Tabela 15: Skuteczność dazatynibu u dzieci i młodzieży z CML CP
Łączna odpowiedź w czasie uwzględniając minimalny okres obserwacji
3 miesiące | 6 miesięcy | 12 miesięcy | 24 miesiące | |
CCyR | ||||
(95% CI) | ||||
Nowo zdiagnozowani | 43,1% | 66,7% | 96,1% | 96,1% |
(N = 51)a | (29,3; 57,8) | (52,1; 79,2) | (86,5; 99,5) | (86,5; 99,5) |
Leczeni wcześniej imatynibem | 45,7% | 71,7% | 78,3% | 82,6% |
(N = 46)b | (30,9; 61,0) | (56,5; 84,0) | (63,6; 89,1) | (68,6; 92,2) |
MCyR | ||||
(95% CI) | ||||
Nowo zdiagnozowani | 60,8% | 90,2% | 98,0% | 98,0% |
(N = 51)a | (46,1; 74,2) | (78,6; 96,7) | (89,6; 100) | (89,6; 100) |
Leczeni wcześniej imatynibem | 60,9% | 82,6% | 89,1% | 89,1% |
(N = 46)b | (45,4; 74,9) | (68,6; 92,2) | (76,4; 96,4) | (76,4; 96,4) |
MMR | ||||
(95% CI) | ||||
Nowo zdiagnozowani | 7,8% | 31,4% | 56,9% | 74,5% |
(N = 51)a | (2,2; 18,9) | (19,1; 45,9) | (42,2; 70,7) | (60,4; 85,7) |
Leczeni wcześniej imatynibem | 15,2% | 26,1% | 39,1% | 52,2% |
(N = 46)b | (6,3; 28,9) | (14,3; 41,1) | (25,1; 54,6) | (36,9; 67,1) |
a Pacjenci z badania II fazy z udziałem dzieci i młodzieży dotyczącego nowo rozpoznanej CML CP, otrzymujący
produkt leczniczy w postaci tabletek doustnych
b Pacjenci z badań I fazy i II fazy z udziałem dzieci i młodzieży, dotyczących CML CP opornej na leczenie imatynibem lub z nietolerancją tego leczenia, otrzymujący produkt w postaci tabletek doustnych
W badaniu I fazy z udziałem dzieci i młodzieży po co najmniej 7 latach obserwacji, u 17 pacjentów z CML CP z opornością lub nietolerancją imatynibu, mediana czasu trwania PFS wynosiła 53,6 miesiąca, a wskaźnik OS wynosił 82,4%.
W badaniu II fazy z udziałem dzieci i młodzieży, u pacjentów otrzymujących produkt leczniczy w postaci tabletek, oszacowany wskaźnik 24-miesięcznych PFS wśród 51 pacjentów z nowo rozpoznaną CML CP wynosił 94,0% (82,6; 98,0), a wśród 29 pacjentów z CML CP z opornością lub nietolerancją imatynibu wynosił 81,7% (61,4; 92,0). Po 24 miesiącach obserwacji wskaźnik OS u pacjentów z nowo rozpoznaną chorobą wynosił 100%, a u pacjentów z opornością lub nietolerancją imatynibu wynosił 96,6%.
W badaniu II fazy z udziałem dzieci i młodzieży u 1 pacjenta z nowo rozpoznaną chorobą i u
Właściwości farmakokinetyczne dazatynibu oceniano w grupie 229 zdrowych, dorosłych ochotników oraz w grupie 84 pacjentów.
Wchłanianie
Dazatynib jest szybko wchłaniany po podaniu doustnym, a maksymalne stężenie osiąga po 0,5–3 godzinach. Po podaniu doustnym, zwiększenie średniej ekspozycji (AUCτ) jest w przybliżeniu proporcjonalne do zwiększenia dawki, w zakresie dawek od 25 mg do 120 mg dwa razy na dobę. Średni końcowy okres półtrwania dazatynibu u pacjentów wynosił w przybliżeniu 5–6 godzin.
Dane uzyskane u zdrowych ochotników po podaniu pojedynczej dawki 100 mg dazantynibu 30 minut po posiłku bogatotłuszczowym wykazały 14% wzrost średniej wartości AUC dazatynibu. Ubogotłuszczowy posiłek podany 30 minut przed dawką dazatynibu powodował 21% wzrost średniej wartości AUC dazatynibu. Obserwowany wpływ pożywienia nie zmienia ekspozycji w sposób klinicznie istotny. Zmienność ekspozycji na dazatynib jest większa w przypadku podawania na czczo (47% CV) w porównaniu do podawania z posiłkiem o małej zawartości tłuszczu (39% CV) i z posiłkiem wysokotłuszczowym (32% CV).
Na podstawie analizy farmakokinetyki populacyjnej pacjentów oszacowano, że zmienność ekspozycji na dazatynib wynika głównie ze zmienności w biodostępności (44% CV), a w mniejszym stopniu ze względu na zmienność osobniczą w biodostępności i zmienność osobniczą wartości klirensu (odpowiednio 30% i 32% CV). Nie należy oczekiwać, że losowa zmienność ekspozycji wpłynie na wartość łącznej ekspozycji oraz skuteczność lub bezpieczeństwo.
Dystrybucja
Objętość dystrybucji dazatynibu u pacjentów jest duża (2505 l), współczynnik zmienności (CV% 93%), co wskazuje, że lek ten jest szeroko rozprowadzany w przestrzeni pozanaczyniowej. Z badań in vitro wynika, że dazatynib w klinicznie istotnych stężeniach wiąże się z białkami osocza w około 96%.
Metabolizm
Dazatynib jest u ludzi w znacznym stopniu metabolizowany, z udziałem licznych enzymów. Po podaniu zdrowym ochotnikom 100 mg dazatynibu znakowanego węglem [14C], dazatynib w postaci niezmienionej stanowił 29% z całości radioaktywnej krążącej w osoczu. Stężenia metabolitów w osoczu oraz ich aktywność oznaczana in vitro wskazują, że mało prawdopodobne jest, aby metabolity dazatynibu odgrywały istotną rolę w obserwowanym działaniu farmakologicznym produktu leczniczego. Głównym enzymem odpowiedzialnym za metabolizm
dazatynibu jest CYP3A4.
Eliminacja
Średni końcowy okres półtrwania dazatynibu wynosi 3 godziny do 5 godzin. Średni pozorny klirens po podaniu doustnym wynosi 363,8 l/h (CV% 81,3%).
Dazatynib wydalany jest w przeważającej części z kałem, głównie w postaci metabolitów. Po doustnym podaniu pojedynczej dawki dazatynibu znakowanego węglem [14C] około 89% tej dawki zostało wydalone w ciągu 10 dni, przy 4% radioaktywności stwierdzanej w moczu i 85% stwierdzanej w kale. Dazatynib w postaci niezmienionej stanowił 0,1% całości wydalanej z moczem i 19% całości wydalanej w kale, zaś pozostałą część stanowiły metabolity.
Zaburzenia czynności wątroby i nerek
Wpływ zaburzeń czynności wątroby na farmakokinetykę dazatynibu po podaniu pojedynczej dawki oceniono u 8 pacjentów z umiarkowanymi zaburzeniami czynności wątroby, którym podano dawkę 50 mg oraz u 5 pacjentów z ciężkimi zaburzeniami czynności wątroby, którym podawano dawkę 20 mg i porównywano z odpowiednio dobranymi zdrowymi osobami, którym podano dawkę 70 mg dazatynibu. U pacjentów z umiarkowanymi zaburzeniami czynności wątroby w porównaniu do osób z prawidłową czynnością wątroby średnie wartości Cmax i AUC dazatynibu, dostosowane do dawki 70 mg, były zmniejszone odpowiednio o 47% i 8%. U pacjentów z ciężkimi zaburzeniami czynności wątroby w porównaniu do osób z prawidłową czynnością wątroby średnie wartości Cmax i AUC dazatynibu, dostosowane do dawki 70 mg, były zmniejszone odpowiednio o 43% i 28% (patrz punkty 4.2 i 4.4).
Dazatynib i jego metabolity są w minimalnym stopniu wydalane przez nerki. Dzieci i młodzież
Farmakokinetykę dazatynibu oceniano u 104 dzieci i młodzieży z białaczką lub guzami litymi (72
z nich otrzymywało produkt w postaci tabletek, a 32 w postaci proszku do sporządzania zawiesiny doustnej).
W badaniu farmakokinetyki z udziałem dzieci i młodzieży ekspozycja na dazatynib z normalizacją dawki (Cavg, Cmin i Cmax) wydawała się być zbliżona u 21 pacjentów z przewlekłą białaczką szpikową w fazie przewlekłej (CML CP) oraz 16 pacjentów z Ph+ ALL.
Farmakokinetykę dazatynibu w postaci tabletek oceniano u 72 dzieci i młodzieży z nawrotową lub oporną na leczenie białaczką lub z guzami litymi. Lek podawano w dawkach doustnych od 60 do 120 mg/m2 pc. raz na dobę i od 50 do 110 mg/m2 pc. dwa razy na dobę. Połączono dane z dwóch badań, które wykazały, że dazatynib był szybko wchłaniany. Średnią wartość Tmax obserwowano po upływie od 0,5 do 6 godzin, a średni okres półtrwania wynosił od 2 do 5 godzin w przypadku wszystkich poziomów dawkowania i wszystkich grup wiekowych. Farmakokinetyka dazatynibu była proporcjonalna do dawki, stwierdzono zależne od dawki zwiększenie ekspozycji u dzieci i młodzieży. Nie stwierdzono istotnych różnic dotyczących farmakokinetyki dazatynibu pomiędzy dziećmi a młodzieżą. Średnia geometryczna wartości Cmax, AUC (0-T) i AUC (INF) znormalizowanych względem dawki dazatynibu okazała się podobna u dzieci i młodzieży po zastosowaniu różnych poziomów dawkowania. Na podstawie symulacji opartej na modelu farmakokinetyki populacyjnej przewidziano, że zalecane dawkowanie zależne od przedziałów masy ciała, opisane dla tabletek w punkcie 4.2, powinno zapewnić podobną ekspozycję, jak dawka tabletek wynosząca 60 mg/m2 pc.
Dane te należy wziąć pod uwagę, jeśli u pacjentów planuje się zmianę z tabletek na proszek do sporządzania zawiesiny doustnej lub odwrotnie.
Profil bezpieczeństwa stosowania dazatynibu oceniano w szeregu nieklinicznych badań in vitro
oraz in vivo przeprowadzonych na myszach, szczurach, małpach oraz królikach.
Główne działanie toksyczne dotyczyło przewodu pokarmowego, krwiotwórczego i limfatycznego. Toksyczne działanie na przewód pokarmowy u szczurów i małp było czynnikiem ograniczającym dawkę, gdyż u obu gatunków jelito było narządem docelowym. U szczurów minimalne do lekkiego zmniejszenie wartości parametrów czerwonokrwinkowych przebiegało ze zmianami dotyczącymi szpiku kostnego; podobne zmiany występowały, choć rzadziej, u małp. Toksyczne działanie na układ limfatyczny u szczurów obejmowało zmniejszenie liczby limfocytów w węzłach chłonnych, śledzionie i grasicy oraz zmniejszenie masy narządów limfoidalnych. Zmiany dotyczące przewodu pokarmowego, krwiotwórczego i limfatycznego były odwracalne i ustępowały po przerwaniu leczenia.
Zmiany w nerkach u małp otrzymujących dazatynib przez okres do 9 miesięcy ograniczały się do zwiększenia śródmiąższowej mineralizacji nerek. W badaniu ostrej toksyczności po doustnym podaniu pojedynczej dawki u małp zaobserwowano krwotok skórny. Działania tego nie odnotowano w badaniach po podaniu wielokrotnym u małp lub u szczurów. U szczurów dazatynib hamował agregację płytek krwi in vitro i wydłużał czas krwawienia in vivo, lecz nie powodował samoistnych krwotoków.
Badania działania dazatynibu in vitro na kanał potasowy hERG i na włókna Purkinjego wskazują na możliwość wydłużania czasu repolaryzacji komór (odstęp QT). Jednak w badaniu in vivo po podaniu pojedynczej dawki dazatynibu małpom z zachowaną świadomością nie stwierdzono zmian odstępu QT ani innych zmian w telemetrycznie uzyskanym zapisie EKG.
Nie wykazano działania mutagennego dazatynibu w badaniach in vitro na komórkach bakteryjnych (test Amesa) ani działania genotoksycznego w teście mikrojądrowym in vivo u szczurów. Dazatynib wywoływał in vitro efekt klastogenny na dzielące się komórki jajnika chomika chińskiego (CHO, ang. Chinese Hamster Ovary).
Dazatynib nie wpływał na płodność samców i samic w standardowych badaniach płodności i rozwoju wczesnopłodowego u szczurów, ale w dawkach powodujących ekspozycję zbliżoną do ekspozycji uzyskiwanej u ludzi w warunkach klinicznych indukował obumieranie płodów. W badaniach dotyczących rozwoju embrionalno-płodowego, dazatynib powodował również obumieranie zarodków oraz związaną z tym mniejszą liczebność miotów u szczurów, jak też zmiany kośćca płodu u szczurów i u królików. Zmiany te występowały po dawkach, które nie powodowały toksyczności u matek wskazując, że dazatynib wykazuje selektywną toksyczność w okresie od implantacji do zakończenia organogenezy.
U myszy dazatynib powodował zależną od dawki immunosupresję, którą można było skutecznie kontrolować zmniejszając dawkę i (lub) zmieniając schemat dawkowania. Dazatynib wykazywał działanie fototoksyczne w badaniach in vitro na mysich fibroblastach, w których oceniano fototoksyczność w oparciu o wychwyt neutralnego promieniowania czerwonego. Stwierdzono, że dazatynib nie ma działania fototoksycznego in vivo po jednorazowym podaniu samicom bezwłosych myszy dawek powodujących narażenie do 3 razy większe niż narażenie występujące u ludzi po podaniu zalecanych dawek leczniczych (na podstawie AUC).
W trwającym dwa lata badaniu działania rakotwórczego dazatynib podawano doustnie szczurom w dawkach 0,3; 1 i 3 mg/kg/dobę. Największa dawka powodowała ekspozycję w osoczu (AUC) zasadniczo równoważną z ekspozycją u ludzi po podaniu dawki początkowej z zalecanego zakresu od 100 mg do 140 mg na dobę. Zaobserwowano statystycznie istotny wzrost łącznej częstości występowania raka płaskonabłonkowego oraz brodawczaków w macicy i szyjce macicy u samic otrzymujących duże dawki, a także gruczolaka prostaty u samców otrzymujących małe dawki. Nie wiadomo, jakie znaczenie dla ludzi mają wyniki badań rakotwórczości u szczurów.
Rdzeń tabletki
Laktoza jednowodna (200)
Celuloza mikrokrystaliczna (typ 101 i 102) Kroskarmeloza sodowa Hydroksypropyloceluloza (MW 80,000) Magnezu stearynian
Otoczka
Laktoza jednowodna Hypromeloza (15 mPas) Tytanu dwutlenek (E 171) Triacetyna
Nie dotyczy.
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Blister z folii OPA/Aluminium/PVC/Aluminium: 30 lub 60 tabletek powlekanych. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Tabletki powlekane składają się z rdzenia tabletki pokrytego otoczką, która chroni personel medyczny przed narażeniem na substancję czynną. Zaleca się stosowanie rękawiczek lateksowych lub nitrylowych podczas usuwania tabletek, które zostały nieumyślnie zgniecione lub przełamane, w celu zminimalizowania ryzyka narażenia skóry.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
KRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Słowenia
Dasatinib Krka, 20 mg, tabletki powlekane Pozwolenie nr 25758
Dasatinib Krka, 50 mg, tabletki powlekane Pozwolenie nr 25759
Dasatinib Krka, 70 mg, tabletki powlekane Pozwolenie nr 25760
Dasatinib Krka, 80 mg, tabletki powlekane Pozwolenie nr 25761
Dasatinib Krka, 100 mg, tabletki powlekane Pozwolenie nr 25762
Dasatinib Krka, 140 mg, tabletki powlekane Pozwolenie nr 25763
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 21.02.2020 r.
15.09.2022











