Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Należy sprawdzić wygląd strzykawki podczas jej przechylania. Pęcherzyk powietrza w strzykawce przesunie się podczas przechylania, jeżeli produkt jest w stanie płynnym, gotowym do użycia. Jeśli pęcherzyk powietrza nie porusza się, produkt przyjął postać żelu – należy umieścić go w lodówce do czasu, aż ponownie stanie się płynny.
Przymocować tłok i aplikator do strzykawki i upewnić się, że są one ściśle połączone.

Wytłoczyć pęcherzyk powietrza i napełnić aplikator żelem, ostrożnie naciskając tłok strzykawki.
Do określenia zawartości produktu leczniczego Lidbree należy użyć centymetrowej skali aplikatora.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Pacjentki z częściową lub całkowitą blokadą przewodnictwa serca - ze względu na fakt, że środki miejscowo znieczulające mogą powodować depresję przewodnictwa mięśnia sercowego.
Pacjentki przyjmujące leki przeciwarytmiczne klasy III (np. amiodaron) powinny znajdować się pod ścisłą obserwacją i należy rozważyć u nich monitorowanie zapisu EKG, ponieważ działania
lidokainy i leków przeciwarytmicznych klasy III mogą się sumować.
Pacjentki z ostrą porfirią. Lidokaina jest prawdopodobnie porfirynogenna i powinna być
przepisywana tylko pacjentom z ostrą porfirią w przypadku poważnych lub pilnych wskazań. Należy podjąć odpowiednie środki ostrożności w przypadku wszystkich pacjentek z porfirią.
Pacjentki w złym stanie ogólnym.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Lidbree, 42 mg/ml, żel domaciczny
Lidokaina 42 mg/ml
Substancje pomocnicze o znanym działaniu:
Każdy ml żelu zawiera 284 mg makrogologlicerolu rycynooleinianu (polioksylenowany olej rycynowy) oraz do 28 mikrogramów butylohydroksytoluenu (E321)
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Żel domaciczny. Sterylna, klarowna lub prawie klarowna, lekko brązowożółta lepka ciecz, która jest żelem w temperaturze ciała.
Produkt leczniczy Lidbree jest wskazany do znieczulenia miejscowego w przypadku ostrego bólu o umiarkowanym nasileniu podczas zabiegów szyjki macicy i wewnątrzmacicznych, u dorosłych i młodzieży w wieku powyżej 15 lat. Patrz punkt 5.1.
Dawkowanie
Zabiegi szyjki macicy
Nałożyć 2 do 3 ml grubej warstwy na część pochwową szyjki macicy i 3 ml do kanału szyjki macicy za pomocą sterylnego aplikatora na 5 minut przed rozpoczęciem zabiegu.
Zabiegi wewnątrzmaciczne
Za pomocą sterylnego aplikatora należy nałożyć 1 do 2 ml na przednią wargę części pochwowej szyjki macicy i 2 do 3 ml do kanału szyjki macicy. Należy odczekać 2 minuty do pojawienia się efektu w
wewnętrznej tkance mięśniowej. Następnie wprowadzić aplikator do jamy macicy i zaaplikować od 3 do 5 ml na 5 minut przed zabiegiem. Aplikator jest oznaczony skalą centymetrową. Mniejsza objętość może być podawana np. u pacjentek, które nigdy nie rodziły, jeżeli pacjentka odczuwa dyskomfort przed
podaniem całej objętości. Pojedyncza dawka domaciczna nie powinna być większa niż łącznie 10 ml.
Dzieci i młodzież w wieku powyżej 15 lat
U młodzieży o małej masie ciała, poniżej 30 kg masy ciała (mc.), dawka powinna być proporcjonalnie zmniejszona, a pojedyncza dawka nie powinna być większa niż maksymalna zalecana dawka pozajelitowa (6 mg/kg mc. lidokainy chlorowodorku, co odpowiada 5,2 mg/kg mc. lidokainy zawartej w produkcie leczniczym Lidbree, tj. 1,2 ml na 10 kg mc.). U młodzieży o masie ciała 30 kg maksymalna dawka produktu leczniczego Lidbree wynosi łącznie 3,6 ml.
1
Bezpieczeństwo i skuteczność produktu leczniczego Lidbree u niemowląt i dzieci w wieku poniżej 15 lat nie zostały ustalone. Ze względów bezpieczeństwa nie należy stosować produktu leczniczego Lidbree u dzieci w wieku poniżej 15 lat (patrz punkt 4.4 i 5.1).
Pacjenci w podeszłym wieku
U pacjentów w podeszłym wieku nie jest konieczna redukcja dawki (patrz punkt 5.2).
Pacjenci z zaburzeniem czynności wątroby
Redukcja pojedynczej dawki nie jest konieczna u pacjentów z zaburzeniem czynności wątroby (patrz punkt 5.2).
Pacjenci z zaburzeniem czynności nerek
Redukcja dawki nie jest konieczna u pacjentów z zaburzeniem czynności nerek.
Sposób podawania
Wyłącznie podanie w szyjkę macicy i wewnątrzmaciczne.
Podczas podania produkt leczniczy Lidbree powinien mieć postać płynną. Jeśli utworzył się żel, produkt leczniczy należy umieścić w lodówce do czasu, aż ponownie stanie się płynny. W strzykawce będzie wtedy widoczny pęcherzyk powietrza, który będzie się przemieszczał, gdy strzykawka zostanie przechylona.
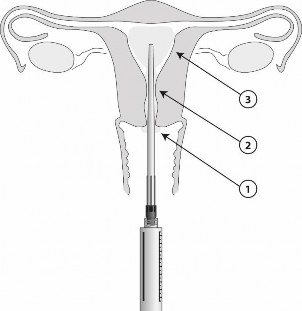
Produkt należy złożyć krok po kroku i nałożyć lepki płyn za pomocą dołączonego sterylnego aplikatora:
Po umieszczeniu aplikatora w miejscu podania, ze strzykawki można podać 8,5 ml żelu. Jeden ml zawiera 42 mg lidokainy. Żel należy wprowadzać stopniowo (od 1 do 3), jak pokazano na rysunku.
Nadwrażliwość na substancję czynną lub którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Wyłącznie podanie w szyjkę macicy i wewnątrzmaciczne. Mogą wystąpić ostre objawy toksyczności
znieczulenia miejscowego i zagrażające życiu powikłania zatorowe, jeżeli lepki płyn termożelujący zostanie przypadkowo wstrzyknięty donaczyniowo (w przypadku leczenia ogólnoustrojowych reakcji toksycznych patrz punkt 4.9). Niezamierzone podanie inną drogą pozajelitową może powodować miejscową toksyczność tkankową.
W przypadku trudności z wprowadzeniem domacicznych środków antykoncepcyjnych i (lub) nadmiernego bólu lub krwawienia podczas lub po wprowadzeniu, należy natychmiast wykonać badanie przedmiotowe i USG w celu wykluczenia perforacji trzonu macicy lub szyjki macicy, gdyż podczas skutecznego
znieczulenia miejscowego pacjentka może nie odczuwać bólu w przypadku perforacji.
Niektóre pacjentki wymagają szczególnej uwagi:
Dzieci i młodzież
Nie należy podawać produktu leczniczego Lidbree na błony śluzowe niemowląt i dzieci w wieku poniżej 15 lat, ponieważ stężenie lidokainy w osoczu może przekroczyć próg toksyczności (patrz punkt 5.1).
Substancje pomocnicze
Produkt leczniczy zawiera makrogologlicerolu rycynooleinian (polioksylenowany olej rycynowy) i butylohydroksytoluen (E 321).
Makrogologlicerolu rycynooleinian może powodować ciężkie reakcje alergiczne. Butylohydroksytoluen (E 321) może powodować podrażnienia błon śluzowych.
W przypadku jednoczesnego stosowania produktu leczniczego Lidbree oraz innych produktów
zawierających lidokainę należy zachować szczególne środki ostrożności w przypadku stosowania dużych dawek lidokainy u pacjentek przyjmujących inne leki miejscowo znieczulające lub produkty lecznicze strukturalnie spokrewnione z anestetykami miejscowymi, np. niektóre leki przeciwarytmiczne, takie jak meksyletyna, ponieważ działania toksyczne tych leków mogą się sumować. Badania interakcji lidokainy z lekami przeciwarytmicznymi klasy III (np. amiodaron) nie były prowadzone, jednak podczas
jednoczesnego stosowania obu leków należy zachować ostrożność (patrz punkt 4.4).
Ciąża
Nie przeprowadzono badań określających toksyczność reprodukcyjną i rozwojową produktu leczniczego Lidbree. Lidokaina przenika przez łożysko. Rozsądnym jest przyjęcie założenia, że lidokaina była dotąd stosowana u wielu kobiet w ciąży oraz kobiet w wieku rozrodczym. Nie ma dowodów na to, że lidokaina powoduje zaburzenia rozrodu, takie jak zwiększona częstość występowania wad rozwojowych. Jednakże nie zbadano w pełni ryzyka dla ludzi. Toksyczność reprodukcyjna lidokainy została zbadana w modelach
nieklinicznych, które nie wykazały żadnego zagrożenia dla płodu.
Karmienie piersią
Lidokaina może przedostawać się do mleka matki, ale w tak małych ilościach, że na ogół nie ma ryzyka, że wpłynie to na noworodka. W związku z tym w przypadku leczenia produktem Lidbree można kontynuować karmienie piersią.
Płodność
Nie ma wystarczających danych na temat wpływu produktu leczniczego Lidbree na płodność. Nie jest znany wpływ lidokainy na płodność lub wczesny rozwój zarodka.
Produkt leczniczy Lidbree nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Działania niepożądane zgłaszane w badaniach klinicznych były podobne pod względem rodzaju i częstości występowania u kobiet otrzymujących produkt leczniczy Lidbree oraz u kobiet otrzymujących żel placebo i były charakterystyczne dla przemijających działań niepożądanych związanych z założeniem
wewnątrzmacicznych systemów antykoncepcyjnych. Nie zgłoszono żadnych ciężkich zdarzeń niepożądanych.
Tabelaryczne zestawienie działań niepożądanych
Częstości występowania działań niepożądanych są podane według klasyfikacji układów i narządów.
Kategorie częstości są określone zgodnie z następującą konwencją: Bardzo często (≥ 1/10); Często (≥ 1/100 do < 1/10); Niezbyt często (≥ 1/1 000 do < 1/100); Rzadko (≥ 1/10 000 do < 1/1 000); Bardzo rzadko
(< 1/10 000); Nieznana (nie może być określona na podstawie dostępnych danych). Po podaniu produktu leczniczego Lidbree wystąpiły następujące działania niepożądane z 2% lub większą częstością.
Klasyfikacja narządów | Częstość | Działanie niepożądane |
Zaburzenia układu nerwowego | Często | Zawroty głowy, ból głowy |
Zaburzenia żołądka i jelit | Bardzo często | Nudności |
Często | Inne zaburzenia żołądkowo-jelitowe |
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych,
Al. Jerozolimskie 181C, 02-222 Warszawa,
Tel.: + 48 22 49 21 301,
Faks: + 48 22 49 21 309,
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Jest mało prawdopodobne, aby produkt leczniczy Lidbree stosowany zgodnie z zaleceniami mógł powodować toksyczne stężenie lidokainy w osoczu. Jeśli jednak inne anestetyki miejscowe są podawane
jednocześnie, ich działanie jest addytywne i podobnie jak przypadkowe wstrzyknięcie donaczyniowe (patrz punkt 4.4) może powodować przedawkowanie z ogólnoustrojowymi reakcjami toksycznymi.
Objawy
Ogólnoustrojowe objawy toksyczności dotyczą przede wszystkim ośrodkowego układu nerwowego (OUN) i układu krążenia i stają się coraz bardziej widoczne przy wzroście stężenia w osoczu z 5 000 do 10 000 ng/ml. Objawy toksyczności ze strony OUN zazwyczaj poprzedzają działania toksyczne dla układu sercowo- naczyniowego.
Toksyczność OUN jest stopniowo narastającą odpowiedzią z objawami o nasilającej się ciężkości. Pierwszymi objawami są zazwyczaj: drętwienie wokół ust, drętwienie języka, uczucie pustki w głowie, przeczulica słuchowa, szumy w uszach i zaburzenia widzenia. Zaburzenia artykulacji, skurcze i drżenia mięśniowe są poważniejsze i poprzedzają wystąpienie uogólnionych drgawek. Może dojść do utraty przytomności i drgawek typu grand mal, które mogą trwać od kilku sekund do kilku minut. W następstwie drgawek spowodowanych zwiększoną aktywnością mięśniową oraz zaburzeń oddychania z możliwością utraty czynności dróg oddechowych, szybko dochodzi do hipoksji i hiperkapnii. W ciężkich przypadkach może dojść do zatrzymania oddechu. Kwasica, hiperkaliemia, hipokalcemia i niedotlenienie nasilają
działanie toksyczne środków miejscowo znieczulających.
Objawy ustępują po redystrybucji leku miejscowo znieczulającego z ośrodkowego układu nerwowego oraz w wyniku jego metabolizmu i wydalania.
Objawy toksyczności ze strony układu sercowo-naczyniowego mogą wystąpić w ciężkich przypadkach i zazwyczaj są poprzedzone objawami toksyczności ze strony centralnego układu nerwowego. Hipotensja, bradykardia, arytmia, a nawet zatrzymanie akcji serca mogą wystąpić w wyniku dużego ogólnoustrojowego
stężenia środków miejscowo znieczulających, ale w rzadkich przypadkach zatrzymanie akcji serca wystąpiło bez objawów prodromalnych ze strony OUN.
Leczenie
W przypadku ciężkich objawów ze strony OUN (drgawki, depresja OUN) należy natychmiast zastosować leczenie z zastosowaniem odpowiedniego wspomagania układu oddechowego/dróg oddechowych i podaniem leków przeciwdrgawkowych.
W przypadku wystąpienia depresji sercowo-naczyniowej (hipotensja, bradykardia) należy rozważyć odpowiednie leczenie za pomocą leków o działaniu wazopresyjnym, chronotropowym i (lub) inotropowym.
W razie zatrzymania czynności serca należy natychmiast rozpocząć resuscytację krążeniowo-oddechową. Zapewnienie optymalnego utlenowania i wentylacji oraz wspomaganie krążenia, a także leczenie kwasicy mają kluczowe znaczenie.
Grupa farmakoterapeutyczna: środki znieczulające; środki znieczulające działające miejscowo, kod ATC: N01BB02.
Mechanizm działania
Lidokaina jest amidowym środkiem miejscowo znieczulającym. Lidokaina powoduje odwracalną
stabilizację błony neuronów oraz zapobiega inicjacji i przewodzeniu impulsów nerwowych, zapewniając tym samym znieczulenie miejscowe. Przy wysokich stężeniach w osoczu, lidokaina może również zmniejszać przewodnictwo w pobudliwych błonach komórek nerwowych mózgu i mięśnia sercowego.
Działanie farmakodynamiczne
Produkt leczniczy Lidbree jest termożelującym, wolnym od konserwantów, lepkim płynem znieczulającym miejscowo. Preparat tworzy żel, gdy jego temperatura wzrasta do temperatury ciała, dzięki czemu przylega do tkanek błony śluzowej kanału szyjki macicy i macicy (ograniczając wyciek, który miałby miejsce w przypadku preparatu płynnego). Postać termożelu ogranicza rozcieńczenie go wydzielanym śluzem, a środek miejscowo znieczulający działa jak system buforowy.
Czas rozpoczęcia działania znieczulającego produktu leczniczego Lidbree po zastosowaniu miejscowym na błony śluzowe szyjki macicy wynosi 2 minuty. Znieczulenie miejscowe trzonu macicy do zabiegów
wewnątrzmacicznych uzyskuje się w ciągu 5 minut od podania do jamy macicy. Czas trwania efektu wynosi co najmniej 30 minut, natomiast po 60 minutach nie obserwuje się żadnego wpływu na ból pooperacyjny w porównaniu z żelem placebo.
Widoczność podczas histeroskopii nie jest zaburzona. Skuteczność kliniczna i bezpieczeństwo stosowania
Skuteczność i bezpieczeństwo stosowania produktu leczniczego Lidbree, jako środka miejscowo
znieczulającego w zabiegach szyjki macicy i zabiegach wewnątrzmacicznych, zostały wykazane w modelu bólu: wieloośrodkowym, kontrolowanym placebo badaniu przeprowadzonym z udziałem 218 kobiet, które nigdy nie rodziły, wymagających umieszczenia antykoncepcyjnej wkładki wewnątrzmacicznej (ang. intrauterine device, IUD). Ten model bólu jest odzwierciedleniem bólu odczuwanego podczas zabiegów wewnątrzmacicznych, takich jak histeroskopia diagnostyczna oraz biopsje szyjki macicy i endometrium, które obejmują te same bodźce bólowe (chwytanie szyjki macicy za pomocą haczyka chirurgicznego,
manipulacja szyjką macicy i rozciąganie macicy). W badaniu kontrolnym placebo żel był nakładany na część pochwową szyjki macicy, do kanału szyjki macicy i do trzonu macicy, do którego wprowadzono żel na 5 minut przed założeniem wkładki wewnątrzmacicznej. Pełnej objętości wynoszącej 8,5 ml nie można było podać 72 z 218 kobiet, w tym u kobiet, które nigdy nie rodziły, często mających mniejszą macicę.
Maksymalne natężenie bólu odczuwanego w trakcie i 10 minut po rozpoczęciu wprowadzania wkładki wewnątrzmacicznej, oceniane w 100 mm wizualnej skali analogowej (ang. visual analogue scale, VAS),
było istotnie niższe u kobiet, którym podano produkt leczniczy Lidbree (p<0,0001), z szacowaną wielkością efektu wynoszącą 16 mm (średnia różnica), co odpowiada 36% niższej średniej wartości VAS w porównaniu
z kobietami, którym podano żel placebo. Odsetek pacjentów w grupie otrzymującej produkt leczniczy Lidbree i grupie placebo z punktacją wskazującą na brak odczuwania bólu (0-10) oraz odsetek z wysoką punktacją wskazującą na umiarkowany lub silny ból (51-100) wynosił odpowiednio 31% vs. 9,7% i 18% vs. 40%. Odsetek pacjentów z punktacją wskazującą na silny ból (71-100) wyniósł 9,4% vs. 19,4%.
Konieczność zastosowania leków przeciwbólowych w pierwszej godzinie po zakończeniu zakładania
wkładki wewnątrzmacicznej w grupie otrzymującej produkt leczniczy Lidbree i w grupie placebo wynosiła odpowiednio 15,4% i 30,5%. Odsetek pacjentów w grupie otrzymującej produkt leczniczy Lidbree i w grupie placebo z punktacją wskazującą na brak odczuwania bólu (VAS 0-10) po 30 min. wynosił odpowiednio 34,5% i 16,1% (p < 0,01), a po 60 min. 38,7% i 32,4%.
W żadnym przypadku nie stwierdzono perforacji macicy w badaniu ultrasonograficznym. Nie stwierdzono żadnych ciężkich zdarzeń niepożądanych.
Dzieci i młodzież
Produkt leczniczy Lidbree nie był badany wśród dzieci i młodzieży w wieku poniżej 18 lat. Lidokaina jest skutecznym środkiem miejscowo znieczulającym u dzieci, młodzieży i dorosłych. Dawkowanie dla młodzieży podano na podstawie badania skuteczności u dorosłych (patrz punkt 4.2). Podawanie produktu leczniczego Lidbree na błony śluzowe niemowląt i dzieci w wieku poniżej 15 lat nie jest wskazane (patrz punkt 4.2) i może powodować toksyczność układową środków miejscowo znieczulających u osób o masie ciała poniżej 30 kg, jeśli stosowana dawka lidokainy jest większa niż maksymalna zalecana dawka
pozajelitowa (6 mg/kg masy ciała chlorowodorku lidokainy, co odpowiada 5,2 mg/kg mc. lidokainy zawartej w produkcie leczniczym Lidbree, tj. 1,2 ml produktu leczniczego Lidbree na 10 kg mc.).
Wchłanianie
Wchłanianie ogólnoustrojowe lidokainy z produktu leczniczego Lidbree jest zależne od zastosowanej dawki. W badaniach nieklinicznych stężenia w osoczu krwi po podaniu domacicznym wykazywały wzrost stężenia szczytowego mniejszy od proporcjonalnego do dawki.
Wysokie stężenie lidokainy może przejściowo zwiększać pH wydzielanego śluzu w miejscu aplikacji, co zwiększa szybkość wchłaniania środka miejscowo znieczulającego.
Wchłanianie lidokainy badano po podaniu do szyjki macicy i wewnątrzmacicznie pojedynczej dawki 8,5 ml produktu leczniczego Lidbree u piętnastu kobiet w wieku od 20 do 36 lat, u kilku w 1 do 6 dniu cyklu
miesiączkowego, przed założeniem wkładki wewnątrzmacicznej. U wszystkich pacjentek lidokainę wykryto w osoczu w ciągu 5 do 10 minut od domacicznego podania żelu. Maksymalne stężenia w osoczu obserwowano po 30 do 180, średnio 68 minutach. Średnie (SD) szczytowe stężenie w osoczu krwi (Cmax) wynosiło 351 (205) ng/ml i mieściło się w zakresie 65-725 ng/ml. Objawy toksyczności znieczulenia
miejscowego stawały się coraz bardziej widoczne przy wzroście stężenia w osoczu z 5 000 do 10 000 ng/ml, a obserwowane średnie Cmax wynosiło mniej niż 10% górnego limitu początkowych objawów toksyczności ze strony OUN. W ciągu 3 godzin stężenie zmniejszyło się do 30-50% wartości maksymalnych u większości pacjentów.
Biotransformacja, eliminacja
Głównym szlakiem eliminacji lidokainy jest metabolizm wątrobowy z udziałem CYP 1A2 i 3A4 tworzących monoetyloglicynoksylidyd (MEGX), który ma działanie farmakologiczne podobne do lidokainy. MEGX jest dalej metabolizowany przez CYP2A6, a powstałe metabolity są wydalane przez nerki. Po podaniu dożylnym klirens ogólnoustrojowy lidokainy wynosi od 10 do 20 ml/min/kg, a okres półtrwania w fazie eliminacji wynosi od 1,5 do 2 godzin. Szybkość metabolizmu i eliminacji środka miejscowo znieczulającego po
zastosowaniu miejscowym produktu leczniczego Lidbree zależy jednak od szybkości wchłaniania. Dlatego też zmniejszenie klirensu, np. u pacjentów z ciężkim upośledzeniem czynności wątroby, ma ograniczony wpływ na ogólnoustrojowe stężenie w osoczu po podaniu pojedynczej dawki.
Szczególne grupy pacjentów
Pacjenci w podeszłym wieku
Klirens lidokainy po podaniu zewnątrzoponowym zmniejsza się o około 40% u kobiet średnio w wieku 77 lat w porównaniu z kobietami w wieku średnio 42 lat, natomiast nie ma istotnych różnic w stężeniach lidokainy w osoczu. Ponieważ szybkość metabolizmu i eliminacji środka miejscowo znieczulającego po
podaniu miejscowym produktu leczniczego Lidbree zależy od szybkości wchłaniania, zmniejszenie klirensu ma ograniczony wpływ na stężenie w osoczu po podaniu pojedynczej dawki.
Nie są dostępne dane farmakokinetyczne dotyczące stosowania lidokainy wewnątrzmacicznego i stosowania w szyjce macicy u kobiet po menopauzie. Dane dotyczące bezpieczeństwa nie wykazały zwiększonego ryzyka po podaniu pojedynczej dawki lidokainy domacicznie i do szyjki macicy u kobiet w okresie pomenopauzalnym.
Badano miejscową i ogólnoustrojową toksyczność produktu leczniczego Lidbree zawierającego 40 lub 50 mg/ml lidokainy przy maksymalnej objętości dawki domacicznej wynoszącej 1 ml/kg u samic psa rasy beagle przez 28 dni. Ze względu na obecność rycynooleinianu makrogologlicerolu w preparacie i niewielkie zmiany wskazujące na neuropatię obwodową w badaniu 28-dniowym, przeprowadzono badanie pojedynczej dawki produktu leczniczego Lidbree oceniające nerwy obwodowe przy maksymalnej objętości 1 ml/kg produktu leczniczego Lidbree. Dawka lidokainy w dawce 40 lub 50 mg/kg była 7-10 razy większa od dawki stosowanej u ludzi w celach terapeutycznych. Wewnątrzmaciczne stosowanie produktu leczniczego Lidbree u samic rasy beagle wskazywało na szybkie, ogólnoustrojowe wchłanianie lidokainy. Przy tej dawce produktu leczniczego Lidbree nie stwierdzono ogólnoustrojowej toksyczności lidokainy, ani reakcji
miejscowych w błonach śluzowych pochwy, szyjki macicy lub macicy. Żadne wyniki badań pojedynczej dawki 40 mg/kg lidokainy nie wykazały ryzyka ogólnoustrojowej toksyczności lub obwodowej neurotoksyczności po podaniu pojedynczej dawki u ludzi.
Toksyczność reprodukcyjna
Nie przeprowadzono żadnych nieklinicznych badań z użyciem produktu leczniczego Lidbree nad płodnością, rozwojem w okresie embrionalno-płodowym lub toksycznością przed- i poporodową. W badaniach nad lidokainą nie stwierdzono zaburzeń płodności samców i samic szczurów.
Lidokaina przenika przez barierę łożyskową na drodze prostej dyfuzji. Embriotoksyczne lub toksyczne dla płodu działanie lidokainy zostało wykryte u królika, ale tylko przy dawkach toksycznych dla matki, które są wyższe niż dawka kliniczna.
Genotoksyczność i rakotwórczość
Badania nad genotoksycznością lub rakotwórczością nie zostały przeprowadzone z użyciem produktu leczniczego Lidbree.
Badania genotoksyczności z użyciem lidokainy nie wykazały potencjału mutagennego. Metabolit lidokainy, 2,6 dimetyloanilina, wykazał słabe dowody na aktywność w niektórych badaniach genotoksyczności. W przedklinicznych badaniach toksykologicznych oceniających długotrwałe narażenie wykazano, że metabolit 2,6 dimetyloanilina ma potencjał rakotwórczy. Oceny ryzyka porównujące oszacowane maksymalne
narażenie ludzi wynikające z okresowego stosowania lidokainy z narażeniem występującym w badaniach przedklinicznych wskazują na duży margines bezpieczeństwa w przypadku stosowania klinicznego. Badania nad nowotworami nie zostały przeprowadzone w odniesieniu do lidokainy ze względu na zasięg i czas
trwania stosowania tego leku do celów leczniczych.
Makrogologlicerolu rycynooleinian (polioksylenowany olej rycynowy) Poloksamer (zawiera butylohydroksytoluen (E 321))
Sodu askorbinian (E 301)
Kwas solny stężony (do ustalenia pH) Sodu wodoroltlenek (do ustalenia pH) Woda do wstrzykiwań
Nie dotyczy
3 lata
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Lidbree, 42 mg/ml, żel domaciczny jest dostępny w sterylnej 10 ml ampułko-strzykawce wykonanej z cyklicznego kopolimeru olefinowego z nasadką typu Tip-Cap i korkiem z gumy bromobutylowej zapakowanej z tłokiem PP w blister PP/Papier. Sterylny aplikator z PP, z łącznikiem Luer lock kompatybilnym z ampułko-strzykawką zapakowany w blister PP/Papier. Całość w tekturowym pudełku. Z aplikatora strzykawkowego można wycisnąć 8,5 ml żelu.
Wielkość opakowania: 1x10 ml żelu domacicznego w ampułko-strzykawce
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Gedeon Richter Plc.
Gyömrői út 19-21
1103 Budapeszt Węgry
26265
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 23.02.2021 r.
08.07.2021 r.











