Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI
Thioctic acid Zentiva, 600 mg, tabletki powlekane
Jedna tabletka powlekana zawiera 600 mg kwasu tioktynowego (Acidum thiocticum).
Substancje pomocnicze o znanym działaniu:
Jedna tabletka powlekana zawiera 3,125 mg laktozy.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka powlekana.
Thioctic acid Zentiva to żółta, owalna, dwuwypukła tabletka powlekana, gładka po obydwu stronach o następujących wymiarach: grubość: 6,4 mm ± 0,2 mm, długość: 21,0 mm ± 0,4 mm, szerokość: 9,7 mm ± 0,4 mm.
Produkt leczniczy Thioctic acid Zentiva jest wskazany w leczeniu zaburzenia czucia związanego
z polineuropatią cukrzycową.
Leczenie polineuropatii cukrzycowej powinno być rozpoczęte i nadzorowane przez lekarzy specjalistów doświadczonych w rozpoznawaniu i leczeniu neuropatii, według obowiązujących standardów.
Dawkowanie
Zalecana dawka dobowa to 1 tabletka powlekana (600 mg kwasu tioktynowego) na dobę.
W przypadku polineuropatii obwodowej o ciężkich objawach zaleca się początkową terapię parenteralną.
Dzieci i młodzież:
W związku z brakiem wystarczającego doświadczenia klinicznego, nie zaleca się stosowania produktu
leczniczego Thioctic Acid Zentiva u dzieci i młodzieży.
Zaburzenia czynności nerek:
Produktu leczniczego Thioctic acid Zentiva nie powinno się stosować u pacjentów z zaburzeniami czynności nerek. Brak wystarczających danych.
Zaburzenia czynności wątroby:
Produktu leczniczego Thioctic acid Zentiva nie powinno się stosować u pacjentów z zaburzeniem
czynności wątroby. Brak wystarczających danych.
Sposób podawania
Produkt leczniczy Thioctic acid Zentiva 600 mg tabletki powlekane należy połykać w całości, popijając niewielką ilością płynu, na czczo. Podanie z posiłkiem może zmniejszyć wchłanianie kwasu alfa- liponowego. Dlatego, zaleca się aby całkowita dawka dobowa została przyjęta pól godziny przed śniadaniem, w szczególności u pacjentów z wydłużonym czasem trawienia.
Ponieważ polineuropatia obwodowa jest chorobą przewlekłą, może wymagać długotrwałego leczenia. Leczenie polineuropatii cukrzycowej opiera się na optymalnej kontroli glikemii.
Produkt leczniczy Thioctic acid Zentiva jest przeciwwskazany u pacjentów z:
- nadwrażliwością na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną
w punkcie 6.1.
Nietypowy zapach moczu można wyczuć po przyjęciu kwasu tioktynowego, ale fakt ten nie jest klinicznie istotny.
Podczas leczenia kwasem tioktynowym notowano przypadki autoimmunologicznego zespołu insulinowego (IAS, ang. Insulin Autoimmune Syndrome). Bardziej podatni na wystąpienie IAS w trakcie leczenia kwasem tioktynowym są pacjenci z genotypem ludzkich antygenów
leukocytarnych, takim jak allele HLA-DRB1*04:06 i HLA-DRB1*04:03. Allel HLA-DRB1*04:03
(iloraz szans wystąpienia IAS: 1,6) występuje głównie u przedstawicieli rasy kaukaskiej, liczniej
w Europie południowej niż w północnej, natomiast allel HLA-DRB1*04:06 (iloraz szans wystąpienia IAS: 56,6) jest spotykany zwłaszcza u pacjentów pochodzących z Japonii i Korei.
Zespół IAS należy brać pod uwagę w rozpoznaniu różnicowym samoistnej hipoglikemii u pacjentów przyjmujących kwas tioktynowy (patrz punkt 4.8).
Ten produkt leczniczy zawiera laktozę. Pacjenci z rzadkimi, dziedzicznymi zaburzeniami związanymi z nietolerancją galaktozy, niedoborem laktazy typu Lapp lub zespołem złego wchłaniania glukozy- galaktozy, nie powinni przyjmować tego produktu leczniczego.
Produkt leczniczy Thioctic acid Zentiva, 600 mg, tabletki powlekane, stosowany jednocześnie
z cisplatyną obniża jej skuteczność.
Kwas tioktynowy ma zdolność do chelatowania jonów metali i nie powinien być stosowany jednocześnie z produktami zawierającymi metale (np. produkty zawierające żelazo, magnez, produkty mleczne z powodu zawartego w nich wapnia). Jeśli całkowita dawka dobowa produktu leczniczego Thioctic acid Zentiva przyjmowana jest 30 minut przed śniadaniem, produkty zawierające żelazo
i magnez mogą być przyjmowane podczas obiadu lub wieczorem.
Ponieważ działanie produktu leczniczego Thioctic acid Zentiva może nasilać działanie obniżające stężenie cukru we krwi leków przeciwcukrzycowych (insulina i inne doustne leki przeciwcukrzycowe), wskazana jest ścisła kontrola glikemii, szczególnie w początkowej fazie leczenia produktem leczniczym Thioctic acid Zentiva. W celu uniknięcia objawów hipoglikemii, w niektórych przypadkach może okazać się konieczne zmniejszenie dawki insuliny lub doustnego leku przeciwcukrzycowego.
Uwaga:
Regularne spożywanie alkoholu stanowi znaczący czynnik ryzyka wystąpienia i nasilenia klinicznych objawów neuropatii i tym samym może zaburzyć skuteczność leczenia produktem leczniczym Thioctic acid Zentiva, 600 mg, tabletki powlekane. Pacjenci z cukrzycową polineuropatią powinni wstrzymywać się od spożywania alkoholu na ile to możliwe, także w przerwach w stosowaniu produktu leczniczego.
Ciąża
Badania na zwierzętach nie wykazały żadnego bezpośredniego ani pośredniego szkodliwego wpływu na reprodukcję (patrz punkt 5.3). Produkt leczniczy Thioctic acid Zentiva powinien być stosowany
w ciąży wyłącznie po dokładnym przeanalizowaniu stosunku korzyści do ryzyka. Kobiety ciężarne mogą być leczone produktem leczniczym Thioctic acid Zentiva wyłącznie w wyjątkowych sytuacjach oraz wyłącznie pod nadzorem lekarza.
Karmienie piersią
Nie wiadomo, czy kwas tioktynowy lub jego metabolity przenikają do mleka ludzkiego. Decyzję dotyczącą przerwania karmienia piersią lub przerwania leczenia produktem leczniczym Thioctic acid Zentiva należy podjąć na podstawie starannej oceny korzyści dla dziecka wynikającej z karmienia piersią oraz korzyści z leczenia dla kobiety.
Płodność
Badania toksycznego wpływu na reprodukcję nie wykazały żadnych działań, które mogłyby wpływać na płodność.
Produkt leczniczy Thioctic acid Zentiva nie ma wpływu na zdolność prowadzenia pojazdów ani obsługiwania maszyn.
W razie wystąpienia działania niepożądanego, takiego jak zawroty głowy lub inne zaburzenia ośrodkowego układu nerwowego, zaleca się unikania czynności wymagających zwiększonej uwagi, takich jak prowadzenie pojazdów i obsługa maszyn lub niebezpiecznych narzędzi.
Częstość występowania działań niepożądanych jest klasyfikowana jak poniżej: Bardzo często (≥1/10)
Często (≥1/100 to <1/10)
Niezbyt często (≥1/1,000 to <1/100) Rzadko (≥1/10,000 to <1/1,000) Bardzo rzadko (<1/10,000)
Częstość nieznana (nie może być określona na podstawie dostępnych danych)
Zaburzenia żołądka i jelit Często: nudności
Bardzo rzadko: objawy ze strony układu pokarmowego, np.: wymioty, ból żołądka i biegunka.
Zaburzenia skóry i tkanki podskórnej
Bardzo rzadko: alergiczne reakcje skórne, jak wysypka skórna, pokrzywka i świąd.
Zaburzenia układu nerwowego Często: zawroty głowy
Bardzo rzadko: zaburzenia smaku, bóle głowy*, nadmierna potliwość*
Zaburzenia oka
Bardzo rzadko: Niewyraźne widzenie*
Zaburzenia układu immunologicznego
Częstość nieznana: autoimmunologiczny zespół insulinowy (patrz punkt 4.4)
Zaburzenia ogólne i stany w miejscu podania
Bardzo rzadko: zmniejszenie stężenia cukru we krwi w związku z polepszeniem metabolizmu
glukozy.
*w takich przypadkach obserwowano podobne objawy, jak hipoglikemia, w tym zawroty głowy, pocenie się, ból głowy i zaburzenia widzenia.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań produktów Leczniczych Urzędu Rejestracji produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel. +48 22 49 29 301
Faks: +48 22 49 29 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
W przypadku przedawkowania, mogą wystąpić nudności, wymioty i bóle głowy.
Objawy
Obserwowano ciężkie zatrucia, niektóre zakończone zgonem po przypadkowym (lub podczas próby samobójczej) przyjęciu doustnej dawki równej od 10 do 40 gramów kwasu tioktynowego
w połączeniu z alkoholem. Pierwotnymi objawami klinicznymi zatrucia są niepokój psychoruchowy lub zaburzenia świadomości, towarzyszące napady uogólnione drgawek oraz rozwój kwasicy mleczanowej.
Dodatkowo obserwowano hipoglikemię, wstrząs, rabdomiolizę, hemolizę, zespół rozsianego wykrzepiania wewnątrznaczyniowego (DIC), zahamowanie czynności szpiku kostnego i niewydolność wielonarządową jako konsekwencję przedawkowania kwasu alfa-liponowego w zwiększonych dawkach.
Leczenie w przypadku przedawkowania
W razie najmniejszego domniemania zatrucia produktem leczniczym Thioctic acid Zentiva (np. >10 tabletek po 600 mg u dorosłych i > 50 mg/kg masy ciała u dzieci), pacjenta należy natychmiast hospitalizować i zastosować ogólne procedury stosowane w przypadku zatrucia (np. wywołanie wymiotów, płukanie żołądka, podanie węgla aktywowanego). Należy podjąć leczenie drgawek, kwasicy mleczanowej i innych zagrażających życiu objawów zatrucia z uwzględnieniem technik intensywnej opieki medycznej i leczenia objawowego. Dotychczas nie potwierdzono pozytywnego wpływu hemodializy, hemoperfuzji lub technik filtracji na usunięcie z organizmu kwasu tioktynowego.
Grupa farmakoterapeutyczna: Pozostałe leki stosowane w chorobach układu pokarmowego
i zaburzeniach metabolizmu; kod ATC: A16AX01
Mechanizm działania
Kwas tioktynowy jest substancją witaminopodobną wytwarzaną endogennie, pełniącą rolę koenzymu w procesach dekarboksylacji oksydacyjnej alfa-ketokwasów. Hiperglikemia spowodowana cukrzycą powoduje kumulację glukozy w białkach podstawowych w naczyniach krwionośnych i prowadzi do tworzenia tzw. końcowych produktów zaawansowanej glikacji (ang. Advanced Glycosylation End Products – AGEP). Proces ten prowadzi do spowolnienia endoneuralnego przepływu krwi oraz niedokrwienia prowadzącego do zwiększonej produkcji wolnych rodników tlenu uszkadzających nerwy obwodowe. Ponadto wykazano zmniejszenie działania antyoksydantów, takich jak glutation
w nerwach obwodowych.
Właściwości farmakodynamiczne
W badaniach na szczurach dowiedziono, że kwas alfa-liponowy oddziałuje na następujące procesy biochemiczne w cukrzycy wywoływane przez streptozotocynę: zmniejszona produkcja końcowych produktów glikacji, wzmaga endoneuronalny przepływ krwi, zwiększa fizjologiczne stężenie antyoksydantów glutationu i zmniejsza stężenie wolnych rodników tlenu w nerwach pacjentów z cukrzycą poprzez działanie antyoksydacyjne. Efekty te zaobserwowano w warunkach doświadczalnych wskazujących na działanie kwasu alfa-liponowego poprawiające funkcję nerwów obwodowych. Typowymi objawami zaburzeń czucia charakterystycznymi dla cukrzycowej polineuropatii są parestezje (takie jak pieczenie, ból, drętwienie i mrowienie).
Bezpieczeństwo i skuteczność kliniczna
Poza uprzednimi doświadczeniami klinicznymi w leczeniu polineuropatii cukrzycowej kwasem alfa- liponowym, przeprowadzono również wieloośrodkowe, niekliniczne badanie kontrolowane placebo w 1995 roku. Na podstawie wyników tego badania wykazano, że kwas alfa-liponowy oddziałuje korzystnie w łagodzeniu obserwowanych objawów, takich jak pieczenie, ból, drętwienie, mrowienie.
Wchłanianie
U ludzi kwas tioktynowy po podaniu doustnym jest wchłaniany natychmiast. Z powodu silnego efektu pierwszego przejścia, całkowita biodostępność kwasu tioktynowego po podaniu doustnym (intubacji) wynosi około 20% w porównaniu z podaniem dożylnym.
Biodostępność kwasu tioktynowego w postaci tabletek po podaniu doustnym (intubacji) wynosi więcej niż 60% w porównaniu z roztworem doustnym. Maksymalne stężenie w surowicy mierzone pól godziny po podaniu doustnym w dawce 600 mg wynosi około 4 μg/ml.
Dystrybucja
Kwas tioktynowy ulega natychmiastowej dystrybucji tkankowej.
Metabolizm
Biotransformacja kwasu tioktynowego odbywa się głównie poprzez skrócenie bocznego łańcucha (β- oksydację) i (lub) S-metylację odpowiednich tioli.
Eliminacja
Badania ze znacznikiem radioaktywnym podanym zwierzętom (szczurom, psom) wykazały wydalanie nerkowe (80% - 90%) w formie metabolitów. Nawet u ludzi jedynie mała ilość niezmienionej substancji została wydalona z moczem. Okres półtrwania kwasu tioktynowego w osoczu wynosi
u ludzi około 25 minut.
Badanie porównawcze biorównoważności (otwarte, naprzemienne) przeprowadzone na 24 osobach ( w wieku 22 do 40 lat) z 1997 roku wykazało następujące wartości stężeń dwóch enancjomerów po pojedynczym podaniu jednej tabletki kwasu tioktynowego o mocy 600 mg i kwasu tioktynowego
w postaci płynu doustnego (odpowiadającego 600 mg kwasu tioktynowego):
Tabela - Parametry farmakokinetyczne osiągnięte dla dwóch enencjomerów kwasu tioktynowego
w badaniu porównawczym biorównoważności. Wyniki są przedstawione jako średni (CV%) dla Cmax
i AUC0-inf i jako średni (zakres) dla tmax.
Test | Wartość referencyjna | |||
R-kwas tioktynowy | S- kwas tioktynowy | R- kwas tioktynowy | S- kwas tioktynowy | |
Cmax [ng/ml] CV (%) | 2796,96 60,59 | 1282,57 54,04 | 8946,44 44,90 | 4201,41 44,50 |
tmax [h] (Min – Max) | 0,507 (0,333 – 1,50) | 0,458 (0,167 – 1,50) | 0,292 (0,167 – 0,50) | 0,271 (0,167 – 0,333) |
AUC0 – ∞ [ng h/ml] CV (%) | 2335,14 43,91 | 1086,23 43,55 | 3912,90 36,97 | 1748,52 39,14 |
Krzywe profilu farmakokinetycznego enancjomerów po podaniu doustnym jednej tabletki powlekanej
kwasu tioktynowego o mocy 600 mg są przedstawione poniżej:
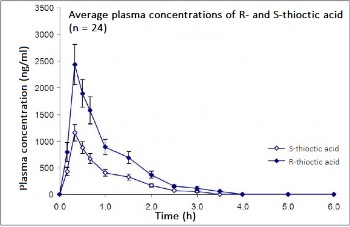
Rys. 1 Średnie stężenie w surowicy (średnia arytmetyczna ± SEM) dla kwasu S- i R- tioktynowego u 24 zdrowych ochotników (12 kobiet i 12 mężczyzn) po pojedynczym podaniu doustnym dawki 600 mg racematu kwasu tioktynowego w postaci tabletek powlekanych.
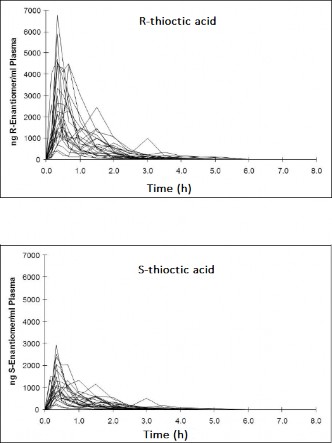
Rys. 2 Profil farmakokinetyczny w surowicy u 24 pacjentów (12 kobiet i 12 mężczyzn) po pojedynczym podaniu doustnym dawki 600 mg racemicznego kwasu tioktynowego w postaci tabletek powlekanych.
Interakcje
Kwas tioktynowy reaguje z kompleksami jonów metali (np. z cisplatyną). Kwas tioktynowy tworzy trudno rozpuszczalne związki z cząsteczkami cukrów.
Toksyczność po podaniu jednorazowym i wielokrotnym
Profil toksyczności charakteryzuje się objawami dotyczącymi zarówno ośrodkowego, jak wegetatywnego układu nerwowego (patrz punkt 4.9). Innymi organami, na które wielokrotnie podawanie działa toksycznie są wątroba i nerki.
Działanie mutagenne i karcynogenne
Badania mutagenności nie wykazały mutagenności genetycznej ani chromosomalanej.
Badania nad działaniem rakotwórczym po podaniu doustnym kwasu tioktynowego u szczurów nie wykazały działania rakotwórczego. Badania dotyczące działania rakotwórczego kwasu tioktynowego w połączeniu z rakotwórczą substancją N-nitrozo-dimetyloaminą (NDEA) dały wynik negatywny.
Toksyczny wpływ na reprodukcję
Kwas tioktynowy w maksymalnej doustnej dawce 68,1 mg/kg nie miał wpływu na płodność ani wczesny rozwój zarodków szczurów. Po podaniu dożylnym dawki toksycznej dla matki nie wykazano właściwości powodujących deformacje płodu u królików.
Rdzeń tabletki:
Celuloza mikrokrystaliczna Hydroksypropyloceluloza niskopodstawiona Magnezu stearynian
Krzemionka koloidalna bezwodna Talk
Otoczka tabletki (Insta coat aqua III IA –III 40382 yellow):
Hypromeloza 2910
Makrogol 6000 Laktoza jednowodna
Tytanu dwutlenek (E171) Talk
Żółcień chinolinowa (E104)
Kwas tioktynowy reaguje w warunkach in vitro z kompleksami jonów metali (np.: z cisplatyną). Postacie kwasu tioktynowego tworzą trudno rozpuszczalne kompleksy z cząsteczkami cukrów.
2 lata
Nie przechowywać w temperaturze powyżej 25°C.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Tabletki są pakowane w 3 lub 6 przezroczystych blistrów z folii PVC/PVDC/Aluminium zawierających 10 tabletek, w odpowiedniej wielkości tekturowym pudelku, z dołączoną instrukcją dla pacjenta.
Wielkość opakowań: 30, 60, 90.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
stosowania
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z
lokalnymi przepisami.
OBROTU
Zentiva k.s.
U kabelovny 130 Dolní Měcholupy 102 37 Praga 10, Republika Czeska
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











