Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NADOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności przy przechowywaniu
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NADOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
SILDEROS MAX, 50 mg, tabletki powlekane
Każda tabletka powlekana zawiera 50 mg syldenafilu w postaci cytrynianu syldenafilu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Lek zawiera mniej niż 1 mmol (23 mg) sodu na tabletkę, to znaczy lek uznaje się za „wolny od sodu”.
Tabletka powlekana.
Niebieska, okrągła, obustronnie wypukła tabletka powlekana o średnicy 9,2 mm, z wytłoczonym „50” po jednej stronie tabletki oraz „H” i „J” po drugiej stronie, z linią podziału służącą do przełamania.
Tabletkę można podzielić na równe dawki.
Produkt leczniczy SILDEROS MAX jest wskazany do stosowania u dorosłych mężczyzn z
zaburzeniami erekcji, czyli niezdolnością uzyskania lub utrzymania erekcji prącia wystarczającej do odbycia stosunku płciowego.
W celu skutecznego działania produktu leczniczego SILDEROS MAX niezbędna jest stymulacja seksualna.
Dawkowanie
Stosowanie u dorosłych
Zalecana dawka to 50 mg syldenafilu, przyjmowane w zależności od potrzeb około godzinę przed planowaną aktywnością seksualną. W zależności od skuteczności i tolerancji produktu leczniczego, dawkę można zwiększyć do 100 mg lub zmniejszyć do 25 mg. Maksymalna zalecana dawka wynosi 100 mg. Nie zaleca się stosowania produktu leczniczego SILDEROS MAX częściej niż raz na dobę.
Jeżeli produkt leczniczy SILDEROS MAX jest przyjmowany podczas posiłku, początek działania produktu leczniczego może być opóźniony w porównaniu do przyjęcia produktu leczniczego na czczo (patrz punkt 5.2).
Szczególne populacje pacjentów
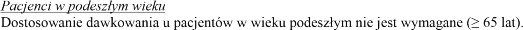
Zaburzenia czynności nerek
Zalecenia dotyczące dawkowania opisane w punkcie „Stosowanie u dorosłych” dotyczą także pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności nerek (klirens kreatyniny 30-80 ml/min).
U pacjentów z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny < 30 ml/min), ze względu na zmniejszony klirens syldenafilu należy rozważyć zastosowanie dawki 25 mg. W zależności od
skuteczności i tolerancji produktu leczniczego, dawka może być stopniowo zwiększona do 50 mg, maksymalnie do 100 mg (w razie konieczności).
Zaburzenia czynności wątroby
U pacjentów z niewydolnością wątroby (np. z marskością wątroby), ze względu na zmniejszony klirens syldenafilu należy rozważyć zastosowanie dawki 25 mg. W zależności od skuteczności i tolerancji produktu leczniczego, dawka może być stopniowo zwiększona do 50 mg, maksymalnie do 100 mg (w razie konieczności).
Dzieci i młodzież
Produkt leczniczy SILDEROS MAX nie jest wskazany dla osób w wieku poniżej 18 lat.
Stosowanie u pacjentów przyjmujących inne produkty lecznicze
U pacjentów stosujących jednocześnie inhibitory izoenzymu CYP3A4, należy rozważyć podanie dawki początkowej 25 mg (patrz punkt 4.5). Wyjątkiem jest rytonawir, którego nie zaleca się stosować jednocześnie z syldenafilem (patrz punkt 4.4).
W celu zmniejszenia ryzyka wystąpienia niedociśnienia ortostatycznego u pacjentów przyjmujących leki alfa-adrenolityczne, stan takich pacjentów powinien być ustabilizowany przed rozpoczęciem
leczenia syldenafilem. Dodatkowo należy rozważyć rozpoczęcie terapii od 25 mg syldenafilu (patrz punkt 4.4 i 4.5).
Sposób podawania
Podanie doustne.
Stwierdzona nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Ze względu na wpływ syldenafilu na przemiany metaboliczne, w których biorą udział tlenek azotu i cykliczny guanozynomonofosforan (cGMP) (patrz punkt 5.1), syldenafil nasila hipotensyjne działanie azotanów. Dlatego przeciwwskazane jest jego równoczesne stosowanie syldenafilu z lekami
uwalniającymi tlenek azotu (np. azotynem amylu) lub azotanami w jakiejkolwiek postaci.
Jednoczesne stosowanie inhibitorów PDE5, w tym syldenafilu, i leków pobudzających cyklazę guanylową, takich jak riocyguat, jest przeciwwskazane, ponieważ może prowadzić do objawowego niedociśnienia tętniczego (patrz punkt 4.5).
Produktów leczniczych przeznaczonych do leczenia zaburzeń erekcji, w tym syldenafilu, nie należy stosować u mężczyzn, u których aktywność seksualna nie jest wskazana (np. pacjenci z ciężkimi schorzeniami układu sercowo-naczyniowego, takimi jak niestabilna dławica piersiowa lub ciężka niewydolność serca).
Produkt leczniczy SILDEROS MAX jest przeciwwskazany u pacjentów, którzy utracili wzrok w
jednym oku w wyniku niezwiązanej z zapaleniem tętnic przedniej niedokrwiennej neuropatii nerwu wzrokowego (ang. Non-arteritic anterior ischaemic optic neuropathy, NAION) niezależnie od tego, czy miało to związek, czy nie miało związku z wcześniejszą ekspozycją na inhibitor PDE5 (patrz punkt 4.4).
Nie badano bezpieczeństwa stosowania syldenafilu w następujących grupach pacjentów: pacjentów z ciężką niewydolnością wątroby, hipotonią (ciśnienie krwi < 90/50 mmHg), po niedawno przebytym udarze lub zawale serca oraz ze stwierdzonymi dziedzicznymi zmianami degeneracyjnymi siatkówki, takimi jak retinitis pigmentosa (niewielka część tych pacjentów ma genetycznie uwarunkowane
nieprawidłowości fosfodiesterazy siatkówki). Stosowanie syldenafilu u tych pacjentów jest przeciwwskazane.
Przed zastosowaniem leczenia farmakologicznego należy przeprowadzić badanie podmiotowe i przedmiotowe pacjenta w celu rozpoznania zaburzenia erekcji i określenia jego przyczyn.
Sercowo-naczyniowe czynniki ryzyka
Ponieważ z aktywnością seksualną wiąże się ryzyko wystąpienia zaburzeń czynności układu krążenia, przed rozpoczęciem jakiegokolwiek leczenia zaburzeń erekcji zalecana jest ocena stanu układu sercowo-naczyniowego pacjenta. Syldenafil, wykazując właściwość rozszerzania naczyń, powoduje niewielkie, przemijające obniżenie ciśnienia krwi (patrz punkt 5.1). Przed przepisaniem syldenafilu
lekarz powinien ocenić, czy pacjent może być podatny na działanie rozszerzające naczynia, szczególnie w czasie aktywności seksualnej. Zwiększoną wrażliwość na środki rozszerzające naczynia krwionośne wykazują pacjenci z utrudnieniem odpływu krwi z lewej komory serca (np. zwężeniem ujścia aorty czy kardiomiopatią przerostową z zawężeniem drogi odpływu) oraz z rzadkim zespołem atrofii
wielonarządowej charakteryzującym się silnym zaburzeniem kontroli ciśnienia tętniczego krwi przez autonomiczny układ nerwowy.
Produkt leczniczy SILDEROS MAX nasila hipotensyjne działanie azotanów (patrz punkt 4.3).
Po wprowadzeniu produktu leczniczego na rynek zgłaszano przypadki, związanych z czasem stosowania syldenafilu, ciężkich zaburzeń czynności układu sercowo-naczyniowego, takich jak zawał mięśnia sercowego, niestabilna dławica piersiowa, nagła śmierć sercowa, niemiarowość komorowa, krwotok mózgowo-naczyniowy, przemijający napad niedokrwienny, nadciśnienie czy niedociśnienie.
Większość z tych pacjentów, u których wystąpiły powyższe zaburzenia, należała do grupy z czynnikami ryzyka wystąpienia chorób sercowo-naczyniowych. Wiele działań niepożądanych wystąpiło w czasie stosunku seksualnego lub wkrótce po jego zakończeniu. W pojedynczych przypadkach byli to pacjenci, u których powyższe zaburzenia wystąpiły wkrótce po zastosowaniu syldenafilu, zanim doszło do aktywności seksualnej. Nie jest możliwe jednoznaczne określenie zależności pomiędzy powyższymi
zdarzeniami a czynnikami, które je mogły wywołać.
Priapizm
Produkty lecznicze przeznaczone do leczenia zaburzeń erekcji, w tym syldenafil, należy stosować ostrożnie u pacjentów z anatomicznymi deformacjami prącia (takimi jak zagięcie, zwłóknienie ciał jamistych lub choroba Peyroniego) oraz z chorobami predysponującymi do wystąpienia priapizmu (np. niedokrwistość sierpowatokrwinkowa, szpiczak mnogi lub białaczka).
Po dopuszczeniu syldenafilu do obrotu zgłaszano przypadki przedłużonych erekcji i priapizmu. W przypadku erekcji utrzymującej się dłużej niż 4 godziny, pacjent powinien natychmiast zwrócić się po pomoc medyczną. Jeśli priapizm nie będzie natychmiast leczony, może dojść do uszkodzenia tkanki prącia i trwałej utraty potencji.
Jednoczesne stosowanie z innymi inhibitorami PDE5 lub innymi metodami leczenia zaburzeń erekcji
Dotychczas nie zbadano bezpieczeństwa oraz skuteczności jednoczesnego stosowania syldenafilu z innymi inhibitorami PDE5, terapiami tętniczego nadciśnienia płucnego (TNP) z zastosowaniem syldenafilu (REVATIO) czy innymi metodami leczenia zaburzeń erekcji. Nie zaleca się stosowania takich połączeń.
Zaburzenia widzenia
W związku z przyjmowaniem syldenafilu i innych inhibitorów PDE5 zgłaszano spontaniczne
przypadki zaburzeń widzenia (patrz punkt 4.8). Przypadki niezwiązanej z zapaleniem tętnic przedniej niedokrwiennej neuropatii nerwu wzrokowego, rzadko występującej choroby, były zgłaszane spontanicznie i w badaniach obserwacyjnych w związku z przyjmowaniem syldenafilu i innych inhibitorów PDE5 (patrz punkt 4.8). Pacjentom należy zalecić, aby w przypadku wystąpienia
jakichkolwiek nagłych zaburzeń widzenia przerwali przyjmowanie produktu leczniczego SILDEROS MAX i niezwłocznie skonsultowali się z lekarzem (patrz punkt 4.3).
Jednoczesne stosowanie z rytonawirem
Nie zaleca się jednoczesnego stosowania syldenafilu i rytonawiru (patrz punkt 4.5).
Jednoczesne stosowanie z lekami α-adrenolitycznymi
Należy zachować ostrożność przy podawaniu syldenafilu pacjentom przyjmującym leki α- adrenolityczne, ponieważ jednoczesne ich stosowanie może prowadzić do objawowego niedociśnienia u nielicznych, podatnych chorych (patrz punkt 4.5). Najczęściej występuje to w ciągu
4 godzin od podania syldenafilu. W celu zmniejszenia ryzyka wystąpienia niedociśnienia ortostatycznego, stan pacjenta przyjmującego leki α-adrenolityczne powinien być hemodynamicznie stabilny przed rozpoczęciem leczenia syldenafilem. Należy rozważyć rozpoczęcie terapii od 25 mg syldenafilu (patrz punkt 4.2). Ponadto lekarz powinien poinformować pacjenta, co należy uczynić w razie wystąpienia objawów niedociśnienia ortostatycznego.
Wpływ na krwawienie
Badania in vitro przeprowadzone na ludzkich płytkach krwi wykazały, że syldenafil nasila
przeciwagregacyjne działanie nitroprusydku sodu. Nie ma informacji dotyczących bezpieczeństwa stosowania syldenafilu u pacjentów z zaburzeniami krzepnięcia lub czynną chorobą wrzodową. U tych pacjentów syldenafil należy stosować jedynie po dokładnym rozważeniu możliwych korzyści i
zagrożeń.
Kobiety
Produkt leczniczy SILDEROS MAX nie jest wskazany do stosowania u kobiet.
Wpływ innych produktów leczniczych na działanie syldenafilu
Badania in vitro
Syldenafil metabolizowany jest przez układ enzymatyczny cytochromu P450, głównie jego izoenzym 3A4 i w mniejszym stopniu 2C9. Dlatego inhibitory tych izoenzymów mogą zmniejszać klirens syldenafilu, zaś induktory tych izoenzymów mogą zwiększać klirens syldenafilu.
Badania in vivo
Analiza populacyjna danych farmakokinetycznych uzyskanych z badań klinicznych wykazała zmniejszenie klirensu syldenafilu podczas jednoczesnego stosowania z inhibitorami izoenzymu CYP3A4 (takimi jak: ketokonazol, erytromycyna, cymetydyna). Pomimo iż u tych pacjentów nie
zaobserwowano zwiększenia częstości występowania działań niepożądanych, w czasie jednoczesnego
stosowania syldenafilu z inhibitorami CYP3A4, należy rozważyć zastosowanie dawki początkowej 25 mg.
Jednoczesne zastosowanie rytonawiru, inhibitora proteazy HIV będącego bardzo silnym
inhibitorem P450, w stanie równowagi (500 mg 2 razy na dobę) z syldenafilem (w pojedynczej dawce 100 mg), powodowało zwiększenie Cmax syldenafilu o 300% (4-krotny wzrost) i wzrost AUC syldenafilu w surowicy o 1000% (11-krotne zwiększenie). Po upływie 24 godzin stężenie syldenafilu w surowicy wynosiło wciąż ok. 200 ng/ml w porównaniu ze stężeniem ok. 5 ng/ml po podaniu samego syldenafilu. Wyniki te są zgodne z wpływem rytonawiru na układ enzymatyczny cytochromu P450.
Syldenafil nie wpływał na parametry farmakokinetyczne rytonawiru. Na podstawie powyższych danych farmakokinetycznych nie zaleca się jednoczesnego stosowania syldenafilu i rytonawiru (patrz punkt 4.4). Maksymalna dawka syldenafilu nie powinna przekroczyć w tych warunkach 25 mg w ciągu 48 godzin.
Jednoczesne zastosowanie sakwinawiru (inhibitora proteazy HIV), będącego również inhibitorem CYP3A4 w stanie równowagi (1200 mg 3 razy na dobę) z syldenafilem (pojedyncza dawka 100 mg), powodowało zwiększenie Cmax syldenafilu o 140% i wzrost AUC syldenafilu o 210%. Syldenafil nie wpływał na parametry farmakokinetyczne sakwinawiru (patrz punkt 4.2). Można spodziewać się, że zastosowanie silniejszych inhibitorów CYP3A4, takich jak ketokonazol i itrakonazol, mogłoby wywierać silniejszy wpływ.
Podanie jednorazowej dawki 100 mg syldenafilu jednocześnie z erytromycyną, umiarkowanym inhibitorem CYP3A4, w stanie równowagi (500 mg 2 razy na dobę przez 5 dni), powodowało
zwiększenie AUC syldenafilu o 182%. W badaniach u zdrowych mężczyzn, ochotników, nie wykazano wpływu stosowania azytromycyny (500 mg dziennie przez 3 dni) na AUC, Cmax, tmax, stałą eliminacji i okres półtrwania syldenafilu oraz jego głównego krążącego metabolitu. Zastosowanie cymetydyny (w dawce 800 mg) będącej inhibitorem cytochromu P450 i nieswoistym inhibitorem CYP3A4, u zdrowych ochotników jednocześnie z syldenafilem (50 mg) powodowało zwiększenie stężenia syldenafilu w surowicy o 56%.
Sok grejpfrutowy będący słabym inhibitorem CYP3A4 w ścianie jelit, może powodować niewielkie zwiększenie stężenia syldenafilu w surowicy.
Jednorazowe dawki leków zobojętniających kwas solny (wodorotlenek magnezu, wodorotlenek glinu) nie wpływały na dostępność biologiczną syldenafilu.
Pomimo, że nie przeprowadzono badań dotyczących swoistych interakcji produktu leczniczego SILDEROS MAX ze wszystkimi innymi produktami leczniczymi, to analiza populacyjna danych farmakokinetycznych nie wykazała jednak wpływu na farmakokinetykę syldenafilu podczas
jednoczesnego stosowania leków z grupy inhibitorów CYP2C9 (takich jak: tolbutamid, warfaryna,
fenytoina), inhibitorów CYP2D6 (takich jak: selektywne inhibitory wychwytu zwrotnego serotoniny, trójpierścieniowe leki przeciwdepresyjne), tiazydowych leków moczopędnych i leków pokrewnych, diuretyków pętlowych i oszczędzających potas, inhibitorów konwertazy angiotensyny, antagonistów wapnia, leków beta-adrenolitycznych czy indukujących enzymy układu CYP450 (takich jak: ryfampicyna, barbiturany). W badaniu z udziałem zdrowych ochotników płci męskiej, równoczesne podawanie antagonisty endoteliny – bozentanu (induktor CYP3A4 [umiarkowany], CYP2C9 oraz
prawdopodobnie CYP2C19), w stanie stacjonarnym (125 mg dwa razy na dobę) z syldenafilem w stanie stacjonarnym (80 mg trzy razy na dobę), powodowało zmniejszenie wartości AUC syldenafilu o 62,6% i Cmax syldenafilu o 55,4%. Zatem równoczesne podawanie silnych induktorów CYP3A4, takich jak ryfampicyna, spowoduje znaczne zmniejszenie stężenia syldenafilu w osoczu.
Nikorandyl – jest połączeniem aktywatora kanału potasowego i azotanu. Ze względu na zawartość azotanu może powodować poważne interakcje z syldenafilem.
Wpływ syldenafilu na inne produkty lecznicze
Badania in vitro
Syldenafil jest słabym inhibitorem następujących izoenzymów cytochromu P450: 1A2, 2C9, 2C19, 2D6, 2E1 i 3A4 (IC50 > 150 µM). Biorąc pod uwagę, że największe stężenia syldenafilu w surowicy (po zastosowaniu zalecanych dawek) wynoszą około 1 µM, jest mało prawdopodobne, by produkt leczniczy SILDEROS MAX wpływał na klirens substratów tych izoenzymów.
Nie ma danych dotyczących interakcji syldenafilu z nieswoistymi inhibitorami fosfodiesterazy, takimi jak teofilina lub dipirydamol.
Badania in vivo
W wyniku stwierdzonego wpływu syldenafilu na przemiany metaboliczne, w których biorą udział tlenek azotu i cykliczny guanozynomonofosforan (cGMP) (patrz punkt 5.1) wykazano, że syldenafil nasila hipotensyjne działanie azotanów i dlatego jednoczesne stosowanie syldenafilu i leków
uwalniających tlenek azotu lub azotanów w jakiejkolwiek postaci jest przeciwwskazane (patrz punkt 4.3).
Riocyguat: Badania przedkliniczne wykazały nasilone działanie obniżające ciśnienie krwi w przypadku jednoczesnego stosowania inhibitorów PDE5 i riocyguatu. W badaniach klinicznych wykazano
nasilanie działania hipotensyjnego inhibitorów PDE5 przez riocyguat. W badanej populacji nie wykazano korzystnego działania klinicznego takiego skojarzenia. Jednoczesne stosowanie riocyguatu i inhibitorów PDE5, w tym syldenafilu, jest przeciwwskazane (patrz punkt 4.3).
Jednoczesne podawanie syldenafilu pacjentom przyjmującym leki α-adrenolityczne może prowadzić do objawowego niedociśnienia u nielicznych, podatnych chorych. Najczęściej występuje to w ciągu 4 godzin od podania syldenafilu (patrz punkt 4.2 i 4.4). W trzech specyficznych badaniach dotyczących interakcji międzylekowych, lek α-adrenolityczny doksazosyna (4 mg i 8 mg) i syldenafil (25 mg, 50 mg i 100 mg) były jednocześnie podawane pacjentom z łagodnym rozrostem gruczołu krokowego (ang.
Benign prostatic hyperplasia, BPH), ustabilizowanych w wyniku leczenia doksazosyną.
W badanych populacjach średnie dodatkowe obniżenie wartości ciśnienia krwi w pozycji leżącej wyniosło 7/7 mmHg, 9/5 mmHg i 8/4 mmHg, a średnie dodatkowe obniżenie wartości ciśnienia krwi w pozycji stojącej wyniosło odpowiednio 6/6 mmHg, 11/4 mmHg i 4/5 mmHg. W trakcie jednoczesnego podawania syldenafilu i doksazosyny pacjentom uprzednio ustabilizowanym w wyniku leczenia doksazosyną w nielicznych przypadkach występowały objawy niedociśnienia ortostatycznego.
Obejmowały one zawroty głowy oraz zamroczenie, ale nie dochodziło do omdleń.
Nie wykazano istotnych interakcji podczas stosowania syldenafilu (50 mg) jednocześnie z metabolizowanymi przez CYP2C9 tolbutamidem (250 mg) lub warfaryną (40 mg).
Syldenafil (50 mg) nie nasilał wydłużenia czasu krwawienia po zastosowaniu kwasu acetylosalicylowego (150 mg).
Syldenafil (50 mg) nie nasilał obniżającego ciśnienie krwi działania alkoholu u zdrowych ochotników, u których przeciętne największe stężenie alkoholu we krwi wynosiło 80 mg/dl.
Nie stwierdzono różnic w występowaniu objawów niepożądanych u pacjentów przyjmujących syldenafil (w porównaniu do stosujących placebo) jednocześnie z następującymi lekami
przeciwnadciśnieniowymi: lekami moczopędnymi, lekami beta-adrenolitycznymi, inhibitorami konwertazy angiotensyny, antagonistami angiotensyny II, preparatami przeciwnadciśnieniowymi (działającymi rozszerzająco na naczynia i ośrodkowo), lekami blokującymi neurony adrenergiczne, antagonistami kanału wapniowego. U pacjentów z nadciśnieniem tętniczym, podczas jednoczesnego stosowania syldenafilu (100 mg) i amlodypiny stwierdzono dodatkowe obniżenie skurczowego
ciśnienia tętniczego krwi, mierzonego w pozycji leżącej, o 8 mmHg. Dodatkowe obniżenie ciśnienia
rozkurczowego (w pozycji leżącej) wynosiło 7 mmHg. Wartości dodatkowego obniżenia ciśnienia krwi były podobne do obserwowanych po podaniu zdrowym ochotnikom samego syldenafilu (patrz punkt 5.1).
Syldenafil (100 mg) nie wpływał w stanie równowagi stężeń na farmakokinetykę inhibitorów proteazy HIV: sakwinawiru i rytonawiru, które są substratami CYP3A4.
U zdrowych ochotników płci męskiej syldenafil w stanie stacjonarnym (80 mg trzy razy na dobę) powodował zwiększenie wartości AUC bozentanu o 49,8% oraz Cmax bozentanu o 42% (125 mg dwa razy na dobę).
Przyjęcie pojedynczej dawki syldenafilu w stanie stabilnego wysycenia sakubitrylem z walsartanem u pacjentów z nadciśnieniem tętniczym było związane z istotnie większym obniżeniem ciśnienia krwi niż w przypadku podawania sakubitrylu z walsartanem w monoterapii. W związku z tym należy
zachować ostrożność, rozpoczynając leczenie syldenafilem u pacjentów leczonych sakubitrylem z walsartanem.
Produkt leczniczy SILDEROS MAX nie jest przeznaczony do stosowania przez kobiety.
Nie przeprowadzono odpowiednich, dobrze kontrolowanych badań z udziałem kobiet w okresie ciąży lub karmienia piersią.
W badaniach nad rozrodczością przeprowadzonych na szczurach i królikach, po zastosowaniu syldenafilu podanego doustnie nie stwierdzono działań niepożądanych w tym zakresie.
Po podaniu jednorazowej doustnej dawki 100 mg syldenafilu u zdrowych ochotników nie stwierdzono zmian w ruchliwości i morfologii plemników (patrz punkt 5.1).
Nie przeprowadzono badań nad wpływem na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych.
Ze względu na doniesienia z badań klinicznych nad syldenafilem o występowaniu zawrotów głowy i zaburzeniach widzenia, pacjenci powinni poznać swoją reakcję na przyjęcie produktu leczniczego SILDEROS MAX zanim przystąpią do prowadzenia samochodu bądź obsługiwania urządzeń mechanicznych.
Podsumowanie profilu bezpieczeństwa
Profil bezpieczeństwa syldenafilu oparto na danych dotyczących 9570 pacjentów w 74 badaniach klinicznych prowadzonych metodą podwójnie ślepej próby i kontrolowanych placebo. Do działań niepożądanych najczęściej zgłaszanych przez pacjentów przyjmujących syldenafil w badaniach klinicznych należały: ból głowy, nagłe zaczerwienienie twarzy, niestrawność, zatkany nos, zawroty głowy, nudności, uderzenia gorąca, zaburzenia widzenia, widzenie na niebiesko oraz niewyraźne widzenie.
Dane dotyczące działań niepożądanych gromadzone w ramach monitorowania bezpieczeństwa
farmakoterapii po dopuszczeniu leku do obrotu dotyczą okresu ponad 10 lat. Ponieważ nie wszystkie działania niepożądane są zgłaszane podmiotowi odpowiedzialnemu i wprowadzane do bazy danych
dotyczących bezpieczeństwa, nie jest możliwe rzetelne ustalenie częstości występowania tychże działań.
Tabelaryczne zestawienie działań niepożądanych
W poniższej tabeli wymieniono wszystkie istotne z medycznego punktu widzenia działania
niepożądane, których częstość występowania przewyższała częstość występowania analogicznych
zdarzeń u pacjentów przyjmujących placebo w badaniach klinicznych. Działania te pogrupowano ze względu na klasyfikację układów i narządów i częstości ich występowania (bardzo często (≥1/10),
często (≥1/100 do <1/10), niezbyt często (≥1/1000 do <1/100) i rzadko (≥1/10 000 do <1/1000). W obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
Tabela 1. Istotne z medycznego punktu widzenia działania niepożądane zgłaszane z częstością większą niż u pacjentów przyjmujących placebo w badaniach klinicznych kontrolowanych placebo, oraz istotne z medycznego punktu widzenia działania niepożądane, zgłaszane po dopuszczeniu produktu leczniczego do obrotu.
Klasyfikacja układów i narządów | Bardzo często (1/10) | Często (1/100 do <1/10 | Niezbyt często (1/1 000 do <1/100) | Rzadko (1/10 000 do <1/1 000) |
Zakażenia i zarażenia pasożytnicze | Nieżyt nosa | |||
Zaburzenia układu immunologicznego | Nadwrażliwość | |||
Zaburzenia układu nerwowego | Ból głowy | Zawroty głowy | Senność, niedoczulica | Udar naczyniowy mózgu, przemijający napad niedokrwienny, drgawki*, drgawki nawracające*, omdlenie |
Zaburzenia oka | Zaburzenia widzenia barwnego**, zaburzenia widzenia, niewyraźne widzenie | Zaburzenia łzawienia***, ból oczu, światłowstręt, fotopsja, przekrwienie oka, jaskrawe widzenie, zapalenie spojówek | Przednia niedokrwienna neuropatia nerwu wzrokowego niezwiązana z zapaleniem tętnic (NAION)*, zamknięcie naczyń siatkówki*, krwotok siatkówkowy, retinopatia miażdżycowa, zaburzenia siatkówki, jaskra, ubytki pola widzenia, |
widzenie podwójne, zmniejszona ostrość widzenia, krótkowzroczność, niedomoga widzenia, zmętnienie ciała szklistego, zaburzenie tęczówki, rozszerzenie źrenicy, widzenie obwódek wokół źródeł światła (ang. halo vision), obrzęk oka, obrzmienie oka, zaburzenia oka, przekrwienie spojówek, podrażnienie oka, nieprawidłowe odczucia we wnętrzu oka, obrzęk powieki, odbarwienie twardówki | ||||
Zaburzenia ucha i błędnika | Zawroty głowy pochodzenia ośrodkowego, szum w uszach | Utrata słuchu | ||
Zaburzenia serca | Tachykardia, kołatania serca | Nagła śmierć sercowa*, zawał mięśnia sercowego, arytmia komorowa*, migotanie przedsionków, niestabilna dławica | ||
Zaburzenia naczyniowe | Nagłe zaczerwienienia, uderzenia gorąca | Nadciśnienie tętnicze, niedociśnienie |
Zaburzenia układu | Uczucie | Krwawienie | Uczucie ucisku w | ||
oddechowego, klatki | zatkanego nosa | z nosa, | gardle, | ||
piersiowej i | zatkanie zatok | obrzęk nosa, | |||
śródpiersia | suchość nosa | ||||
Zaburzenia żołądka | Nudności, | Choroba | Niedoczulica | ||
i jelit | niestrawność | refluksowa | jamy ustnej | ||
przełyku, | |||||
wymioty, | |||||
ból w górnej części | |||||
jamy brzusznej, | |||||
suchość w ustach | |||||
Zaburzenia skóry i tkanki podskórnej | Wysypka | Zespół StevensaJohnsona (ang. Stevens Johnson Syndrome, SJS)*, martwica toksyczna naskórka (ang. Toxic Epidermal | |||
Necrolysis, TEN)* | |||||
Zaburzenia mięśniowoszkieletowe i tkanki łącznej | Ból mięśni, ból w kończynie | ||||
Zaburzenia nerek i dróg moczowych | Krwiomocz | ||||
Zaburzenia układu | Krwawienie | ||||
rozrodczego i piersi | z prącia, | ||||
priapizm*, | |||||
krwawa sperma, | |||||
nasilona erekcja | |||||
Zaburzenia ogólne i | Ból w klatce | Drażliwość | |||
stany w miejscu | piersiowej, | ||||
podania | zmęczenie, | ||||
uczucie gorąca | |||||
Badania diagnostyczne | Przyspieszona akcja serca | ||||
*Zgłaszane tylko po dopuszczeniu produktu leczniczego do obrotu.
**Zaburzenia widzenia barwnego: widzenie na zielono, chromatopsja, widzenie na niebiesko, widzenie na czerwono, widzenie na żółto.
***Zaburzenia łzawienia: zespół suchego oka, zaburzenie łzawienia, zwiększone łzawienie.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa,
tel.: +48 22 49 21 301, faks: +48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
W badaniach przeprowadzonych na zdrowych ochotnikach, u których stosowano jednorazowe dawki produktu leczniczego dochodzące do 800 mg, działania niepożądane były podobne do działań obserwowanych po podaniu mniejszych dawek, występowały one jednak z większą częstością i były bardziej nasilone. Zastosowanie dawki 200 mg nie powodowało większej skuteczności, natomiast
częstość występowania działań niepożądanych (bóle głowy, uderzenia gorąca, zawroty głowy, dolegliwości dyspeptyczne, uczucie zatkanego nosa, zmiany widzenia) była zwiększona.
W przypadkach przedawkowania, w zależności od objawów należy stosować standardowe leczenie podtrzymujące. Syldenafil silnie wiąże się z białkami osocza i nie jest wydalany z moczem, zatem przypuszcza się, że zastosowanie dializy nie spowoduje przyspieszenia klirensu leku.
Grupa farmakoterapeutyczna: leki urologiczne, leki stosowane w leczeniu zaburzeń erekcji, kod ATC: G04B E03.
Mechanizm działania
Syldenafil jest przeznaczony do stosowania doustnego w leczeniu zaburzeń erekcji. W naturalnych warunkach, tzn. w odpowiedzi na pobudzenie seksualne, przywraca on zaburzony mechanizm erekcji poprzez zwiększenie dopływu krwi do prącia.
Fizjologicznym mechanizmem odpowiedzialnym za erekcję prącia jest uwalnianie tlenku azotu (NO) w ciałach jamistych w czasie pobudzenia seksualnego. Tlenek azotu następnie aktywuje enzym cyklazę guanylową, co zwiększa poziom cyklicznego guanozynomonofosforanu (cGMP). Powoduje to rozkurcz mięśni gładkich w ciałach jamistych i umożliwia napływ krwi do prącia.
Syldenafil jest silnym selektywnym inhibitorem swoistej dla cGMP fosfodiesterazy typu 5. (PDE5), która jest odpowiedzialna za rozkład cGMP w ciałach jamistych. Syldenafil wywołuje erekcję poprzez swoje działanie obwodowe. Syldenafil nie wykazuje bezpośredniego działania zwiotczającego na
izolowane ludzkie ciała jamiste, natomiast znacznie nasila rozkurczający wpływ tlenku azotu na tę tkankę. W czasie pobudzenia seksualnego, gdy dochodzi do aktywacji przemian metabolicznych, w których biorą udział tlenek azotu i cGMP, zahamowanie aktywności PDE5 przez syldenafil powoduje wzrost poziomu cGMP w ciałach jamistych. Pobudzenie seksualne jest zatem niezbędne, aby syldenafil mógł wywierać zamierzone korzystne działanie farmakologiczne.
Działanie farmakodynamiczne
Badania in vitro wykazały, że syldenafil działa selektywnie na izoenzym PDE5, biorący udział w mechanizmie erekcji. Wpływa na PDE5 silniej niż na inne znane fosfodiesterazy. Działa 10-krotnie bardziej selektywnie niż na PDE6, izoenzym biorący udział w przekazywaniu bodźców świetlnych
przez siatkówkę oka. Stosowany w maksymalnych zalecanych dawkach, syldenafil działa na PDE5 80- krotnie bardziej selektywnie niż na PDE1 oraz ponad 700-krotnie bardziej selektywnie na PDE2, 3, 4, 7, 8, 9, 10 i 11. W szczególności syldenafil działa ponad 4000 razy bardziej selektywnie na PDE5 niż na PDE3, izoenzym fosfodiesterazy swoistej względem cAMP, wpływającej na kurczliwość mięśnia sercowego.
Skuteczność kliniczna i bezpieczeństwo stosowania
Aby ocenić przedział czasowy, w jakim syldenafil wywołuje erekcję w odpowiedzi na pobudzenie seksualne, przeprowadzono dwa badania kliniczne. W badaniu metodą pletyzmografii penisa (RigiScan) u pacjentów otrzymujących syldenafil (będących na czczo) stwierdzono, że średni czas osiągnięcia erekcji o sztywności 60% (wystarczającej do odbycia stosunku płciowego) wynosił 25 minut (zakres od 12 do 37 minut). W innym badaniu przeprowadzonym metodą RigiScan wykazano, że syldenafil po 4-5 godzinach po podaniu nadal mógł wywoływać erekcję w odpowiedzi na pobudzenie seksualne.
Syldenafil powoduje niewielkie i przemijające obniżenie ciśnienia krwi, w większości przypadków bez istotnego znaczenia klinicznego. Średnie maksymalne obniżenie skurczowego ciśnienia krwi
(mierzonego w pozycji leżącej) po doustnej dawce 100 mg wynosiło 8,4 mmHg. Odpowiadająca temu zmiana ciśnienia rozkurczowego (w pozycji leżącej) wynosiła 5,5 mmHg. Obniżenie ciśnienia
tętniczego krwi wiąże się z rozszerzającym naczynia krwionośne działaniem syldenafilu,
prawdopodobnie wynikającym ze wzrostu poziomu cGMP w mięśniówce naczyń krwionośnych. Jednorazowe dawki syldenafilu do 100 mg nie powodowały u zdrowych ochotników klinicznie istotnych zmian w zapisie EKG.
W badaniu wpływu na hemodynamikę pojedynczej doustnej dawki syldenafilu 100 mg podanej 14 pacjentom z ciężką chorobą niedokrwienną serca (CAD) (>70% zwężenia, co najmniej jednej tętnicy wieńcowej) średnie ciśnienia skurczowe i rozkurczowe w spoczynku obniżały się odpowiednio o 7% i 6% w porównaniu do wartości wyjściowych. Średnie ciśnienie skurczowe w tętnicy płucnej obniżyło się o 9%. Syldenafil nie wpływał na pojemność minutową serca, nie pogarszał przepływu krwi przez zwężone tętnice wieńcowe.
W podwójnie zaślepionym, kontrolowanym placebo badaniu wysiłkowym oceniono 144 pacjentów z zaburzeniami erekcji i stabilną dławicą piersiową, którzy stale przyjmowali leki przeciwdławicowe (za wyjątkiem azotanów). Wyniki badania nie wykazały istotnych klinicznie różnic w zakresie czasu wystąpienia objawów dławicy piersiowej pomiędzy pacjentami przyjmującymi syldenafil i placebo.
U niektórych osób godzinę po zastosowaniu dawki 100 mg produktu leczniczego, za pomocą testu rozróżniania barw Farnsworth-Munsell’a 100, stwierdzono niewielkie, przejściowe utrudnienie rozróżniania kolorów (niebieskiego/zielonego). Działania tego nie obserwowano już po upływie 2 godzin od przyjęcia produktu leczniczego. Postuluje się, że mechanizmem odpowiedzialnym za zaburzenia rozróżniania kolorów jest zahamowanie aktywności izoenzymu PDE6 biorącego udział w kaskadzie przewodzenia bodźca świetlnego w siatkówce. Syldenafil nie wpływa na ostrość ani kontrastowość widzenia.
W niewielkim badaniu klinicznym (9 pacjentów) kontrolowanym placebo u pacjentów z udokumentowanymi, wczesnymi, związanymi z wiekiem zmianami zwyrodnieniowymi plamki,
syldenafil w pojedynczej dawce 100 mg nie wpływał istotnie na przeprowadzone testy okulistyczne (ostrość widzenia, siatka Amslera, test rozróżniania kolorów symulujący światła uliczne, perymetr Humphreya oraz wrażliwość na światło).
Po podaniu jednorazowej dawki 100 mg syldenafilu u zdrowych ochotników nie stwierdzono zmian w ruchliwości i morfologii plemników (patrz punkt 4.6).
Dalsze informacje z badań klinicznych
W badaniach klinicznych syldenafil zastosowano u ponad 8000 pacjentów w wieku od 19 do 87 lat. Wzięły w nich udział następujące grupy pacjentów: pacjenci w podeszłym wieku (19,9%), z nadciśnieniem tętniczym (30,9%), cukrzycą (20,3%), chorobą niedokrwienną serca (19,8%), hiperlipidemią (19,8%), po urazach rdzenia kręgowego (0,6%), z depresją (5.2%), po przebytej przezcewkowej resekcji gruczołu krokowego (3,7%), po radykalnej prostatektomii (3,3%). Z badań klinicznych były wykluczone lub nie były wystarczająco reprezentowane następujące grupy
pacjentów: pacjenci po zabiegach chirurgicznych w obrębie miednicy, po radioterapii, z ciężką
niewydolnością nerek lub wątroby oraz pacjenci z niektórymi chorobami układu sercowonaczyniowego (patrz punkt 4.3).
W badaniach, w których zastosowano stałą dawkę leku, poprawę erekcji stwierdzono u 62%
pacjentów (dla dawki 25 mg), 74% (dla dawki 50 mg) oraz 82% (dla dawki 100 mg) w porównaniu do 25% pacjentów, u których zastosowano placebo. W kontrolowanych badaniach klinicznych stwierdzono, że częstość przerwania terapii syldenafilem była mała i podobna do obserwowanej w grupie placebo. Biorąc pod uwagę wyniki wszystkich badań klinicznych, odsetek pacjentów
zgłaszających poprawę po zastosowaniu syldenafilu był następujący w poszczególnych grupach: pacjenci z zaburzeniami erekcji o podłożu psychogennym (84%), pacjenci z zaburzeniami erekcji o przyczynie mieszanej (77%), pacjenci z zaburzeniami erekcji o podłożu organicznym (68%), osoby w wieku podeszłym (67%), pacjenci z cukrzycą (59%), pacjenci z chorobą niedokrwienną serca (69%), pacjenci z nadciśnieniem tętniczym (68%), pacjenci po przezcewkowej resekcji gruczołu krokowego (TURP) (61%), pacjenci po radykalnej prostatektomii (43%), pacjenci po urazie rdzenia kręgowego (83%), pacjenci z depresją (75%). W badaniach długookresowych, bezpieczeństwo i skuteczność syldenafilu utrzymywały się na niezmienionym poziomie.
Dzieci i młodzież
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań referencyjnego produktu leczniczego zawierającego syldenafil we wszystkich podgrupach populacji dzieci i młodzieży w
leczeniu zaburzeń erekcji (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
Wchłanianie
Syldenafil jest wchłaniany szybko. Po podaniu doustnym na czczo, maksymalne stężenia w osoczu występują po 30-120 min (średnio 60 min). Średnia całkowita biodostępność po zastosowaniu doustnym wynosi 41% (zakres wartości 25-63%). W zakresie zalecanych dawek (25-100 mg) po podaniu doustnym, wartości AUC i Cmax syldenafilu zwiększają się proporcjonalnie do dawki.
Stosowanie syldenafilu podczas posiłku zmniejsza szybkość jego absorpcji; średnie opóźnienie tmax syldenafilu wynosi 60 minut, a średnie zmniejszenie Cmax - 29%.
Dystrybucja
Średnia objętość dystrybucji syldenafilu w stanie stacjonarnym (Vd) wynosi 105 l, co wskazuje na
przenikanie produktu leczniczego do tkanek. Po podaniu doustnym pojedynczej dawki 100 mg, średnie maksymalne stężenie syldenafilu w osoczu wynosiło około 440 ng/ml (CV 40%). Ponieważ syldenafil i jego główny krążący N-demetylo metabolit wiążą się z białkami osocza w około 96%; powoduje to, że średnie maksymalne stężenie wolnej postaci syldenafilu w osoczu wynosi 18 ng/ml (38 nM). Stopień wiązania z białkami nie zależy od całkowitych stężeń produktu leczniczego.
W ejakulacie zdrowych ochotników, którym podano jednorazowo 100 mg syldenafilu, po 90 minutach znajdowało się mniej niż 0,0002% podanej dawki (średnio 188 ng).
Metabolizm
Syldenafil jest metabolizowany przez układ enzymów mikrosomalnych wątroby - głównie przez CYP3A4 i w mniejszym stopniu przez CYP2C9. Główny metabolit syldenafilu powstaje w wyniku jego N-demetylacji. Wykazuje on podobną do syldenafilu selektywność w stosunku do fosfodiesteraz.
Działanie metabolitu na PDE5 określono in vitro na 50% siły działania leku macierzystego, natomiast jego stężenie w osoczu odpowiada 40% stężenia syldenafilu. N-demetylo metabolit syldenafilu podlega dalszym przemianom; jego okres półtrwania wynosi około 4 godziny.
Eliminacja
Całkowity klirens syldenafilu wynosi 41 l/godz., co daje okres półtrwania 3 – 5 godz. Syldenafil zarówno po podaniu doustnym, jak i dożylnym, wydalany jest w postaci metabolitów, głównie z kałem (około 80% dawki doustnej) oraz w mniejszym stopniu z moczem (około 13% dawki doustnej).
Farmakokinetyka w szczególnych grupach pacjentów
Osoby w podeszłym wieku
U zdrowych ochotników (w wieku ≥ 65 lat) stwierdzono zmniejszony klirens syldenafilu, co powodowało, że stężenie leku i jego aktywnego N-demetylo metabolitu w osoczu było w przybliżeniu o 90% większe od obserwowanego u ochotników w młodszym wieku (18 – 45 lat). Z uwagi na
zmieniający się z wiekiem stopień wiązania z białkami osocza, stężenie wolnego syldenafilu w osoczu zwiększyło się w przybliżeniu o 40%.
Zaburzenia czynności nerek
U ochotników z niewielkimi lub umiarkowanymi zaburzeniami czynności nerek (klirens kreatyniny 30- 80 ml/min) farmakokinetyka syldenafilu po zastosowaniu jednorazowej dawki doustnej 50 mg nie
zmieniła się. W porównaniu do wartości u ochotników w tym samym wieku, bez współistniejących zaburzeń czynności nerek, średnie wartości AUC i Cmax N-demetylo metabolitu zwiększały się odpowiednio o 126% i 73%. Pomimo tego, z uwagi na dużą zmienność osobniczą, różnice te nie okazały się statystycznie istotne. U ochotników z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny ≤ 30 ml/min) klirens syldenafilu zmniejszał się, co powodowało wzrost AUC i Cmax syldenafilu odpowiednio o 100% i 88% w porównaniu do osób w tym samym wieku i bez
niewydolności nerek. Znamiennie zwiększały się ponadto wartości AUC (o 79%) i Cmax (o 200%) N- demetylo metabolitu.
Zaburzenia czynności wątroby
U ochotników z łagodną i umiarkowaną marskością wątroby (A i B wg. Child-Pugh’a), klirens syldenafilu ulegał zmniejszeniu, co powodowało wzrost AUC (o 84%) i Cmax (o 47%) w porównaniu do tych wartości u osób w tym samym wieku bez zaburzeń czynności wątroby. Nie badano
farmakokinetyki syldenafilu u pacjentów z ciężkimi zaburzeniami czynności wątroby.
Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących
bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności, rakotwórczości oraz toksycznego wpływu na rozród i rozwój potomstwa, nie ujawniają szczególnego zagrożenia dla
człowieka.
Rdzeń tabletki
Celuloza mikrokrystaliczna Wapnia wodorofosforan Kroskarmeloza sodowa Magnezu stearynian
Otoczka
Opadry II blue 85F505164:
Alkohol poliwinylowy – częściowo zhydrolizowany Tytanu dwutlenek (E171)
Makrogol 3350 Talk
Indygokarmin, lak (E132) Opadry clear 02K19253:
Hypromeloza 5 cP (typ 2910) Triacetyna
Nie dotyczy.
3 lata
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
SILDEROS MAX, 50 mg, tabletki powlekane
Blistry z PVC/Aluminium w tekturowym pudełku po 2, 4 lub 8 tabletek. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań.
Synoptis Pharma Sp. z o.o. ul. Krakowiaków 65
02-255 Warszawa
26939
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 28.02.2022 Data ostatniego przedłużenia pozwolenia:











