Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
ml roztworu do wstrzykiwań / do infuzji zawiera 32,7 mg sodu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Ostry silny ból po urazie lub operacji,
Kolki,
Ból nowotworowy,
Inny ostry lub przewlekły silny ból, gdy zastosowanie innych metod leczenia jest przeciwwskazane,
Wysoka gorączka, gdy inne produkty lecznicze są nieskuteczne.
Podanie pozajelitowe jest wskazane tylko w przypadku, gdy podanie doustne nie jest możliwe.
Dawkowanie i sposób podawania
Przeciwwskazania
nadwrażliwość na substancję czynną, inne pirazolony lub pirazolidyny (dotyczy to także pacjentów, u których po zastosowaniu tych substancji wystąpiła agranulocytoza), lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1,
pacjenci z rozpoznanym zespołem astmy analgetycznej lub znaną nietolerancją na leki przeciwbólowe objawiającą się pokrzywką i (lub) obrzękiem naczynioruchowym, tj. pacjenci, którzy reagują skurczem oskrzeli lub innymi reakcjami anafilaktoidalnymi (np. pokrzywką, zapaleniem błony śluzowej nosa, obrzękiem naczynioruchowym) na salicylany, paracetamol lub inne nieopioidowe leki przeciwbólowe, takie jak diklofenak, ibuprofen, indometacyna lub naproksen,
zaburzenia czynności szpiku kostnego (np. po leczeniu cytostatykami) lub zaburzenia hematopoezy,
wrodzony niedobór dehydrogenazy glukozo-6-fosforanowej (ryzyko hemolizy),
ostra przerywana porfiria wątrobowa (ryzyko wystąpienia napadu porfirii),
trzeci trymestr ciąży (patrz punkt 4.6),
niedociśnienie i niestabilność krążenia.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Zespołem astmy analgetycznej lub nietolerancją na leki przeciwbólowe objawiającą się pokrzywką i (lub) obrzękiem naczynioruchowym (patrz punkt 4.3),
Astmą oskrzelową, szczególnie u pacjentów z jednocześnie występującym zapaleniem zatok przynosowych i polipami nosa,
Przewlekłą pokrzywką,
Nietolerancją barwników (np. tartrazyna) lub konserwantów (np. benzoesany),
Nietolerancją alkoholu. Tacy pacjenci reagują nawet na niewielkie ilości napojów alkoholowych takimi objawami, jak kichanie, łzawienie oczu i silne zaczerwienienie twarzy. Taka nietolerancja alkoholu może wskazywać na nierozpoznany wcześniej zespół astmy analgetycznej (patrz punkt 4.3).
Wstrząs anafilaktyczny może wystąpić głównie u pacjentów z uczuleniem, dlatego należy zachować szczególną ostrożność w przypadku stosowania produktu u pacjentów z astmą i atopią.
Przed podaniem produktu leczniczego Metamizol Krka należy przeprowadzić dokładny wywiad z pacjentem. U pacjentów ze zwiększonym ryzykiem wystąpienia reakcji anafilaktoidalnych, produkt leczniczy Metamizol Krka należy stosować wyłącznie po dokładnym rozważeniu potencjalnego ryzyka w stosunku do oczekiwanych korzyści (patrz także punkt 4.3). Jeśli produkt leczniczy Metamizol Krka jest podawany w takich przypadkach, pacjenta należy objąć ścisłą obserwacją medyczną oraz zapewnić dostępność sprzętu ratowniczego.
Ciężkie reakcje skórne
Podczas leczenia metamizolem notowano występowanie ciężkich niepożądanych reakcji skórnych (SCAR, ang. severe cutaneous adverse reactions), w tym zespołu Stevensa-Johnsona (SJS), toksycznego martwiczego oddzielania się naskórka (TEN) i reakcji polekowej z eozynofilią i objawami ogólnymi (zespół DRESS), mogących zagrażać życiu lub prowadzić do zgonu.
Należy poinformować pacjenta o objawach przedmiotowych i podmiotowych oraz ściśle obserwować, czy nie występują u niego reakcje skórne.
W przypadku pojawienia się objawów przedmiotowych i podmiotowych świadczących o wystąpieniu tych reakcji należy natychmiast odstawić leczenie metamizolem — ponowne stosowanie leczenia metamizolem w przyszłości jest niedopuszczone (patrz punkt 4.3).
Izolowane reakcje hipotensyjne
Metamizol może powodować reakcje hipotensyjne (patrz także punkt 4.8). Reakcje te mogą być zależne od dawki, a ryzyko ich wystąpienia jest bardziej prawdopodobne w przypadku podawania pozajelitowego aniżeli dojelitowego.
Ryzyko wystąpienia takich reakcji jest również zwiększone:
jeśli wstrzyknięcie dożylne jest wykonywane zbyt szybko (patrz punkt 4.2),
u pacjentów z występującym wcześniej niedociśnieniem tętniczym, hipowolemią lub odwodnieniem, niestabilnym krążeniem lub początkową niewydolnością krążenia (np. u pacjentów z zawałem serca lub urazem wielonarządowym),
u pacjentów z wysoką gorączką.
Z tego względu należy dokładnie rozważyć potrzebę podania produktu leczniczego takim pacjentom, a w razie jego zastosowania prowadzić ścisły nadzór. Aby zmniejszyć ryzyko wystąpienia reakcji hipotensyjnych, konieczne może okazać się podjęcie działań zapobiegawczych (np. wyrównanie zaburzeń krążenia).
Polekowe uszkodzenie wątroby
U pacjentów leczonych metamizolem notowano przypadki ostrego zapalenia wątroby, przebiegającego głównie z uszkodzeniem komórek wątrobowych i pojawiającego się w okresie od kilku dni do kilku miesięcy po rozpoczęciu leczenia. Objawy przedmiotowe i podmiotowe obejmują zwiększenie aktywności enzymów wątrobowych w surowicy, w tym z żółtaczką, często w kontekście reakcji nadwrażliwości na inne leki (np. wysypka skórna, dyskrazje komórek krwi, gorączka i eozynofilia) lub z jednoczesnymi cechami zapalenia wątroby na podłożu autoimmunologicznym. U większości pacjentów objawy ustępowały po przerwaniu leczenia metamizolem, jednak w pojedynczych przypadkach notowano progresję do ostrej niewydolności wątroby z koniecznością przeszczepienia tego narządu.
Mechanizm powstawania uszkodzenia wątroby na skutek stosowania metamizolu nie jest jasno określony, ale dane wskazują na występowanie mechanizmu immunologicznoalergicznego.
Pacjentów należy informować o konieczności kontaktu z lekarzem w przypadku wystąpienia objawów świadczących o uszkodzeniu wątroby. U takiego pacjenta należy przerwać leczenie metamizolem i wykonać badania czynności wątroby.
Jeśli u pacjenta nastąpiło uszkodzenie wątroby podczas stosowania metamizolu, nie należy ponownie wdrażać leczenia metamizolem, jeśli nie stwierdzono innych przyczyn uszkodzenia wątroby.
U pacjentów, u których należy bezwzględnie unikać obniżenia ciśnienia krwi, np. w przypadku ciężkiej choroby wieńcowej lub istotnych zwężeń naczyń domózgowych, produkt leczniczy Metamizol Krka można stosować tylko pod ścisłą kontrolą parametrów hemodynamicznych.
U pacjentów z zaburzeniami czynności nerek lub wątroby produkt leczniczy Metamizol Krka należy stosować wyłącznie po starannym rozważeniu stosunku korzyści do ryzyka i tylko w przypadku podjęcia odpowiednich środków ostrożności (patrz punkt 4.2).
Ten produkt leczniczy zawiera 32,7 mg sodu w 1 ml roztworu do wstrzykiwań / do infuzji, co odpowiada 1,635% zalecanej przez WHO maksymalnej dobowej dawki sodu u osób dorosłych, wynoszącej 2 g.
Wpływ na badania laboratoryjne
U pacjentów leczonych metamizolem zgłaszano wpływ na wyniki badań laboratoryjnych i diagnostycznych opartych na reakcji Trindera lub reakcjach podobnych do reakcji Trindera (np. oznaczenie poziomu kreatyniny, triglicerydów, cholesterolu HDL lub kwasu moczowego w surowicy).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Bardzo często (1/10)
- Często (1/100 do <1/10)
Niezbyt często (1/1 000 do <1/100)
- Rzadko (1/10 000 do <1/1 000)
Bardzo rzadko (<1/10 000)
Nieznana (częstość nie może być określona na podstawie dostępnych danych)
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Metamizol Krka, 500 mg/ml, roztwór do wstrzykiwań / do infuzji
1 ml roztworu do wstrzykiwań / do infuzji zawiera 500 mg metamizolu sodowego jednowodnego (Metamizolum natricum monohydricum).
Jedna ampułka po 2 ml roztworu do wstrzykiwań / do infuzji zawiera 1000 mg metamizolu sodowego jednowodnego.
Jedna ampułka po 5 ml roztworu do wstrzykiwań / do infuzji zawiera 2500 mg metamizolu sodowego jednowodnego.
Substancja pomocnicza o znanym działaniu
Roztwór do wstrzykiwań / do infuzji
Roztwór do wstrzykiwań / do infuzji jest klarownym, bezbarwnym do jasnożółtego roztworem.
Dawkowanie
Dawkowanie zależy od natężenia bólu lub gorączki oraz indywidualnej wrażliwości pacjenta na produkt leczniczy Metamizol Krka. Zasadnicze znaczenie ma wybór najmniejszej dawki umożliwiającej opanowanie bólu i gorączki.
U dzieci i młodzieży w wieku do 14 lat można podawać metamizol w pojedynczej dawce wynoszącej 8-16 mg na kilogram masy ciała. W przypadku gorączki u dzieci na ogół wystarczająca jest dawka
metamizolu wynosząca 10 mg na kilogram masy ciała. Dorosłym i młodzieży w wieku od 15 lat (o masie ciała >53 kg) można podawać maksymalnie 1000 mg metamizolu w pojedynczej dawce.
W zależności od maksymalnej dawki dobowej pojedynczą dawkę można przyjmować nie częściej niż 4 razy na dobę w odstępach wynoszących 6-8 godzin.
Wyraźnego działania można spodziewać się w ciągu 30 minut od podania pozajelitowego.
Aby zminimalizować ryzyko reakcji hipotensyjnej, wstrzyknięcie dożylne musi być podawane bardzo powoli.
W tabeli poniżej podano zalecane dawki pojedyncze oraz maksymalne dawki dobowe zależne od masy ciała lub wieku:
Masa ciała | Dawka pojedyncza | Maksymalna dawka dobowa | |||
kg | wiek | ml | mg | ml | mg |
5-8 | 3-11 miesięcy | 0,1-0,2 | 50-100 | 0,4-0,8 | 200-400 |
9-15 | 1-3 lata | 0,2-0,5 | 100-250 | 0,8-2,0 | 400-1000 |
16-23 | 4-6 lat | 0,3-0,8 | 150-400 | 1,2-3,2 | 600-1600 |
24-30 | 7-9 lat | 0,4-1,0 | 200-500 | 1,6-4,0 | 800-2000 |
31-45 | 10-12 lat | 0,5-1,4 | 250-700 | 2,0-5,6 | 1000-2800 |
46-53 | 13-14 lat | 0,8-1,8 | 400-900 | 3,2-7,2 | 1600-3600 |
>53 | ≥15 lat | 1,0-2,0* | 500-1000* | 4,0-8,0* | 2000-4000* |
*) W razie potrzeby dawkę pojedynczą można zwiększyć do 5 ml (co odpowiada 2500 mg metamizolu), a dawkę dobową do 10 ml (co odpowiada 5000 mg metamizolu).
Nie zaleca się stosowania produktu leczniczego Metamizol Krka w postaci roztworu do wstrzykiwań / do infuzji u niemowląt w wieku poniżej 3 miesięcy. Dostępne są inne postaci farmaceutyczne właściwe do stosowania u dzieci w wieku poniżej 3 miesiąca życia.
Czas trwania leczenia
Czas trwania leczenia zależy od rodzaju i nasilenia choroby. Podczas długotrwałego leczenia produktem leczniczym Metamizol Krka należy przeprowadzać regularne badania krwi, w tym morfologię krwi z rozmazem.
Szczególne grupy pacjentów
Osoby w podeszłym wieku, pacjenci osłabieni oraz pacjenci ze zmniejszoną wartością klirensu kreatyniny
U osób w podeszłym wieku, pacjentów osłabionych i pacjentów ze zmniejszoną wartością klirensu kreatyniny dawkę należy zmniejszyć ze względu na możliwość wydłużenia czasu eliminacji z organizmu produktów metabolizmu metamizolu.
Zaburzenia czynności wątroby lub nerek
W przypadku zaburzenia czynności nerek lub wątroby szybkość eliminacji jest zmniejszona, dlatego należy unikać wielokrotnego podawania dużych dawek. Nie ma konieczności zmniejszenia dawki, gdy produkt stosowany jest przez krótki czas. Dotychczasowe doświadczenia związane z długotrwałym stosowaniem metamizolu u pacjentów z ciężkimi zaburzeniami czynności wątroby i nerek są niewystarczające.
Sposób podawania
Podanie dożylne lub domięśniowe
Produkt leczniczy Metamizol Krka podawany jest dożylnie lub domięśniowo.
We wstrzyknięciu domięśniowym należy zawsze stosować roztwór ogrzany do temperatury ciała.
Środki ostrożności, które należy podjąć podczas podawania produktu leczniczego
Należy określić ścisłe wskazanie do stosowania oraz zachować szczególną ostrożność podczas podawania pojedynczej dawki produktu leczniczego Metamizol Krka większej niż 2 ml (co odpowiada 1000 mg metamizolu sodowego jednowodnego), ponieważ istnieje podejrzenie, iż krytyczny spadek ciśnienia krwi po podaniu produktu (niezwiązany z wystąpieniem reakcji alergicznej) jest zależny od zastosowanej dawki.
Podczas podawania produktu leczniczego Metamizol Krka drogą pozajelitową pacjent powinien znajdować się w pozycji leżącej i pod ścisłym nadzorem lekarza.
W celu zminimalizowania ryzyka reakcji hipotensyjnej oraz zapewnienia możliwości przerwania podawania produktu leczniczego po pojawieniu się pierwszych objawów reakcji anafilaktycznej lub anafilaktoidalnej, wstrzyknięcie dożylne należy wykonywać bardzo powoli, tj. nie szybciej niż 1 ml (500 mg metamizolu sodowego jednowodnego) na minutę.
Produkt leczniczy Metamizol Krka zawiera pochodną pirazolonu – metamizol i jego stosowanie wiąże się z rzadkim, ale zagrażającym życiu ryzykiem wystąpienia wstrząsu i agranulocytozy (patrz punkt 4.8).
U pacjentów, u których po zastosowaniu produktu Metamizol Krka wystąpiła reakcja anafilaktoidalna, istnieje szczególnie wysokie ryzyko wystąpienia podobnej reakcji po zastosowaniu innych nieopioidowych leków przeciwbólowych.
Pacjenci, u których wystąpiła reakcja anafilaktyczna lub inna reakcja o podłożu immunologicznym (np. agranulocytoza) na produkt leczniczy Metamizol Krka, są szczególnie narażeni na ryzyko wystąpienia podobnej reakcji po zastosowaniu innych pirazolonów i pirazolidyn.
U pacjentów, u których wystąpiła reakcja anafilaktyczna lub inna reakcja o podłożu immunologicznym na inne pirazolony, pirazolidyny lub inne nieopioidowe leki przeciwbólowe,
istnieje wysokie ryzyko wystąpienia podobnych reakcji także po zastosowaniu produktu leczniczego Metamizol Krka.
Agranulocytoza
W przypadku wystąpienia neutropenii (<1500 neutrofili/mm3) należy natychmiast przerwać leczenie i monitorować parametry morfologii krwi (morfologia krwi z rozmazem) aż do momentu powrotu do wartości prawidłowych.
Należy zalecić pacjentom natychmiastowe przerwanie leczenia i konsultację z lekarzem, w razie wystąpienia następujących objawów przedmiotowych i podmiotowych agranulocytozy: nieoczekiwane pogorszenie ogólnego stanu pacjenta (objawy, takie jak gorączka, dreszcze, ból gardła, trudności w połykaniu), utrzymująca się lub nawracająca gorączka i bolesne zmiany w obrębie błon śluzowych, zwłaszcza błony śluzowej jamy ustnej, nosa i gardła lub okolicy narządów płciowych oraz odbytu. W przypadku wystąpienia takich objawów należy natychmiast przerwać stosowanie produktu leczniczego Metamizol Krka i monitorować liczbę krwinek (w tym morfologię krwi z rozmazem).
Leczenie musi zostać przerwane, zanim jeszcze uzyska się wyniki badań laboratoryjnych (patrz punkt 4.8).
Małopłytkowość
W razie wystąpienia objawów małopłytkowości, takich jak zwiększona skłonność do krwawień oraz powstawanie wybroczyn na skórze i błonach śluzowych (patrz punkt 4.8), należy natychmiast przerwać stosowanie produktu leczniczego Metamizol Krka i monitorować liczbę krwinek (w tym morfologię krwi z rozmazem). Leczenie musi zostać przerwane, zanim jeszcze uzyska się wyniki badań laboratoryjnych.
Pancytopenia
W przypadku wystąpienia pancytopenii należy natychmiast przerwać leczenie i monitorować parametry pełnej morfologii krwi, aż do czasu ich unormowania (patrz punkt 4.8). Należy zalecić pacjentom, aby natychmiast zgłosili się do lekarza, jeżeli podczas leczenia wystąpią objawy przedmiotowe i podmiotowe wskazujące na dyskrazję krwi (np. ogólne złe samopoczucie, zakażenie, utrzymująca się gorączka, krwiaki, krwawienie, bladość).
Reakcje anafilaktyczne i (lub) anafilaktoidalne
Podczas wyboru sposobu podawania, należy wziąć pod uwagę, że podawanie pozajelitowe produktu leczniczego Metamizol Krka wiąże się z większym ryzykiem wystąpienia reakcji anafilaktycznych lub anafilaktoidalnych (patrz punkt 4.2 „Środki ostrożności, które należy podjąć podczas podawania produktu leczniczego”).
Ryzyko wystąpienia ciężkich reakcji anafilaktoidalnych po podaniu produktu leczniczego Metamizol Krka jest znacznie podwyższone u pacjentów z:
Farmakokinetyczna indukcja enzymów metabolizujących:
Metamizol może indukować enzymy metabolizujące, w tym CYP2B6 i CYP3A4. Jednoczesne podawanie metamizolu i bupropionu, efawirenzu, metadonu, walproinianu,
cyklosporyny, takrolimusu lub sertraliny może zmniejszyć stężenie tych leków w osoczu i ograniczyć ich skuteczność kliniczną. Dlatego też zaleca się ostrożność podczas jednoczesnego podawania z metamizolem; w stosownych przypadkach należy monitorować odpowiedź kliniczną i (lub) stężenie leku.
Jednoczesne stosowanie metamizolu i chloropromazyny może wywołać ciężką hipotermię.
Jednoczesne stosowanie metamizolu i metotreksatu może nasilać hemotoksyczność metotreksatu, szczególnie u pacjentów w podeszłym wieku. Z tego względu należy unikać jednoczesnego stosowania obu tych leków.
W przypadku jednoczesnego stosowania, metamizol może zmniejszać wpływ kwasu acetylosalicylowego na agregację płytek krwi. Z tego względu należy zachować ostrożność stosując metamizol u pacjentów przyjmujących kwas acetylosalicylowy w małych dawkach w celu ochronnego działania na układ sercowo-naczyniowy.
Metamizol może obniżać stężenia bupropionu we krwi. Z tego względu należy zachować ostrożność podczas jednoczesnego stosowania metamizolu i bupropionu.
Substancje czynne należące do grupy pirazolonów wykazują znany potencjał powodowania interakcji z doustnymi lekami przeciwzakrzepowymi, kaptoprylem, litem i triamterenem oraz wpływają na skuteczność leków przeciwnadciśnieniowych i moczopędnych. Nie ustalono, w jakim stopniu metamizol powoduje takie interakcje.
Ciąża
Dostępne są tylko ograniczone dane dotyczące stosowania metamizolu u kobiet w ciąży.
Na podstawie opublikowanych danych dotyczących kobiet w ciąży narażonych na działanie metamizolu w pierwszym trymestrze (n=568), nie zidentyfikowano dowodów na występowania działania teratogennego lub toksycznego na zarodek. W wybranych przypadkach dopuszczalne może być podanie metamizolu w pojedynczych dawkach w pierwszym i drugim trymestrze ciąży, gdy nie ma innej możliwości leczenia. Zasadniczo jednak nie zaleca się stosowania metamizolu w pierwszym i drugim trymestrze ciąży. Stosowanie w trzecim trymestrze jest związane z ryzykiem toksycznego działania na płód (zaburzenia czynności nerek i zwężenie przewodu tętniczego), a zatem stosowanie metamizolu jest przeciwwskazane w trzecim trymestrze ciąży (patrz punkt 4.3). W razie niezamierzonego przyjęcia metamizolu w trzecim trymestrze ciąży, należy kontrolować płyn owodniowy i przewód tętniczy w badaniach ultrasonograficznych i echokardiograficznych. Chociaż metamizol jest słabym inhibitorem syntezy prostaglandyn, nie można wykluczyć możliwości wystąpienia powikłań okołoporodowych spowodowanych zmniejszeniem agregacji płytek krwi u matki i dziecka.
Metamizol przenika przez barierę łożyska.
W badaniach na zwierzętach metamizol miał szkodliwy wpływ na rozrodczość, ale nie wykazał działania teratogennego (patrz punkt 5.3).
Karmienie piersią
Produkty rozkładu metamizolu przenikają do mleka matki w znacznych ilościach i nie można wykluczyć ryzyka dla karmionego piersią niemowlęcia. W związku z tym, należy unikać zwłaszcza wielokrotnego stosowania metamizolu w okresie karmienia piersią. W przypadku jednorazowego przyjęcia metamizolu, zaleca się matkom odciąganie i wylewanie pokarmu przez 48 godzin od podania produktu leczniczego.
W zalecanym zakresie dawkowania nie zaobserwowano zaburzenia koncentracji i zdolności do reagowania. Ze względów ostrożności należy jednak, przynajmniej w razie stosowania większych dawek, uwzględnić możliwość zaburzenia tych zdolności i zrezygnować z obsługi maszyn, prowadzenia pojazdów lub wykonywania czynności obciążonych ryzykiem. Dotyczy to szczególnie stosowania w połączeniu z alkoholem.
Częstość występowania działań niepożądanych przedstawiono zgodnie z poniższą konwencją:
Niezbyt często | Rzadko | Bardzo rzadko | Nieznana | |
Zaburzenia krwi i układu chłonnego *1 | Leukopenia. | Agranulocytoza, w tym przypadki zakończone zgonem, małopłytkowość. | Niedokrwistość aplastyczna, pancytopenia, w tym przypadki zakończone zgonem. | |
Zaburzenia układu | Reakcje | Zespół astmy | Wstrząs |
immunologicznego *3 | anafilakoidalne i anafilaktyczne*. | analgetycznej. U pacjentów z zespołem astmy analgetycznej, reakcje nietolerancji zwykle przybierają postać napadów astmy. | anafilaktyczny*2. | |
Zaburzenia serca | Zespół Kounisa. | |||
Zaburzenia naczyniowe | Reakcje hipotensyjne występujące podczas lub po podaniu produktu, które mogą być uwarunkowane farmakologicznie i nie towarzyszą im objawy reakcji anafilaktoidalnych lub anafilaktycznych. Mogą one prowadzić do nadmiernego obniżenia ciśnienia tętniczego. Szybkie wstrzyknięcie dożylne zwiększa ryzyko wystąpienia reakcji hipotensyjnej.*4 | |||
Zaburzenia żołądka i jelit | Zgłaszano przypadki występowania krwawienia z przewodu pokarmowego. | |||
Zaburzenia wątroby i dróg żółciowych | Polekowe uszkodzenie wątroby, w tym ostre zapalenie wątroby, żółtaczka, zwiększenie aktywności enzymów wątrobowych (patrz punkt 4.4). |
Zaburzenia skóry i tkanki podskórnej | Wysypka polekowa. | Wysypka (np. wysypka plamkowo- grudkowa). | Zespół Stevensa- Johnsona lub toksyczne martwicze oddzielanie się naskórka (leczenie musi zostać przerwane, patrz punkt 4.4).*5 | Reakcja polekowa z eozynofilią i objawami ogólnymi (zespół DRESS).*5 |
Zaburzenia nerek i dróg moczowych | Ostre pogorszenie czynności nerek (bardzo rzadko może rozwinąć się białkomocz, skąpomocz, bezmocz lub ostra niewydolność nerek), ostre śródmiąższowe zapalenie nerek. | |||
Zaburzenia ogólne i stany w miejscu podania | Może wystąpić ból w miejscu wstrzyknięcia i odczyny miejscowe, w bardzo rzadkich przypadkach w postaci zapalenia żył. Może wystąpić czerwone zabarwienie moczu, które może być spowodowane obecnością w moczu nieszkodliwego metabolitu metamizolu - kwasu rubazonowego o bardzo niskim stężeniu. |
*1 Reakcje te mogą wystąpić także u osób, u których metamizol był wcześniej stosowany bez powikłań. Pojedyncze doniesienia wskazują, że ryzyko wystąpienia agranulocytozy może się zwiększyć w przypadku podawania metamizolu przez okres dłuższy niż jeden tydzień. Reakcja ta nie zależy od dawki i może wystąpić w dowolnym momencie leczenia. Do typowych objawów należą wysoka gorączka, dreszcze, bóle gardła, trudności w połykaniu oraz stany zapalne błony śluzowej jamy ustnej, nosa, gardła lub okolicy odbytu. U pacjentów otrzymujących antybiotyki te objawy mogą
mieć niewielkie nasilenie. Węzły chłonne oraz śledziona mogą pozostać bez zmian lub być tylko nieznacznie powiększone. Opadanie krwinek czerwonych jest znacznie przyspieszone, ilość granulocytów znacznie się zmniejsza lub są one całkowicie nieobecne. Na ogół, lecz nie zawsze, wartości hemoglobiny, erytrocytów i płytek krwi są prawidłowe (patrz punkt 4.4). Natychmiastowe przerwanie stosowania ma kluczowe znaczenie dla wyzdrowienia. Dlatego stanowczo zaleca się natychmiastowe przerwanie stosowania produktu leczniczego Metamizol Krka, bez oczekiwania na wyniki badań laboratoryjno‑diagnostycznych, w razie pogorszenia się ogólnego stanu pacjenta, pojawienia się lub nawrotu gorączki i wystąpienia bolesnych zmian w obrębie błon śluzowych, zwłaszcza błony śluzowej jamy ustnej, nosa i gardła. W przypadku wystąpienia pancytopenii należy natychmiast przerwać leczenie i monitorować parametry pełnej morfologii krwi, aż do czasu ich unormowania (patrz punkt 4.4).
*2 Takie reakcje na produkty lecznicze mogą wystąpić podczas wstrzyknięcia, natychmiast po podaniu lub mogą również rozwinąć się kilka godzin później. W większości przypadków występują one jednak w ciągu pierwszej godziny po podaniu. Łagodniejsze reakcje zwykle przyjmują postać zmian skórnych i zmian w obrębie błon śluzowych (np. świąd, uczucie pieczenia, zaczerwienienie, pokrzywka, obrzęk), duszności i, rzadziej, zaburzeń żołądka i jelit. Takie łagodne reakcje mogą przechodzić w cięższe formy z uogólnioną pokrzywką, ciężkim obrzękiem naczynioruchowym (w tym obrzękiem krtani), ciężkim skurczem oskrzeli, zaburzeniami rytmu serca, spadkiem ciśnienia tętniczego (niekiedy również poprzedzonym jego wzrostem) i wstrząsem krążeniowym. Jeśli wystąpią reakcje skórne, należy natychmiast przerwać stosowanie produktu leczniczego Metamizol Krka.
*3 Te reakcje mogą być ciężkie i zagrażać życiu, szczególnie po pozajelitowym podaniu metamizolu, a czasem mogą zakończyć się zgonem. Reakcje te mogą także wystąpić nawet wtedy, gdy wcześniejsze podanie metamizolu przebiegało bez powikłań.
*4 W przypadku bardzo wysokiej gorączki może wystąpić, zależne od dawki, krytyczne zmniejszenie ciśnienia krwi bez objawów nadwrażliwości.
*5 W związku z leczeniem metamizolem zgłaszano ciężkie niepożądane reakcje skórne (SCAR), w tym zespół Stevensa-Johnsona (SJS), toksyczną nekrolizę naskórka (TEN) i reakcję polekową z eozynofilią i objawami ogólnymi (zespół DRESS) (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem
Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych
Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy
W przypadku ostrego przedawkowania obserwowano nudności, wymioty, ból brzucha, zaburzenie czynności nerek i (lub) ostrą niewydolność nerek (np. w postaci śródmiąższowego zapalenia nerek) oraz, rzadziej, objawy ze strony ośrodkowego układu nerwowego (zawroty głowy, senność, śpiączka, drgawki) i spadek ciśnienia tętniczego, który może przejść we wstrząs i tachykardię.
Po przyjęciu bardzo dużych dawek wydalanie kwasu rubazonowego może powodować czerwone zabarwienie moczu.
Leczenie
Nie jest znana specyficzna odtrutka na metamizol. Krótko po przyjęciu metamizolu można próbować ograniczyć wchłanianie leku za pomocą podstawowych środków detoksykacyjnych (np. płukanie żołądka) lub środków zmniejszających absorpcję (podanie węgla aktywnego). Główny metabolit (4-N- metyloaminoantypiryna) można wyeliminować za pomocą hemodializy, hemofiltracji, hemoperfuzji lub filtracji osocza.
Leczenie intoksykacji i zapobieganie ciężkim powikłaniom może wymagać zastosowania ogólnej i specjalistycznej opieki medycznej na oddziale intensywnej terapii.
Natychmiastowe działania podejmowane w przypadku wystąpienia ciężkich reakcji nadwrażliwości (wstrząs)
Wstrzyknięcie należy przerwać przy wystąpieniu pierwszych objawów nadwrażliwości (np. reakcje skórne, takie jak pokrzywka i nagłe zaczerwienienie, zwłaszcza twarzy, niepokój, ból głowy, potliwość, nudności). Należy pozostawić kaniule w żyle lub stworzyć dostęp do żyły. Oprócz standardowych środków ratunkowych, takich jak ułożenie pacjenta w pozycji Trendelenburga, utrzymanie drożnych dróg oddechowych i podawanie tlenu, konieczne może być zastosowanie sympatykomimetyków, środków zwiększających objętość krwi lub glikokortykosteroidów.
Grupa farmakoterapeutyczna: leki przeciwbólowe, inne leki przeciwbólowe i przeciwgorączkowe; pirazolony; kod ATC: N02BB02.
Metamizol jest pochodną pirazolonu o działaniu przeciwbólowym, przeciwgorączkowym oraz spazmolitycznym. Mechanizm jego działania nie jest do końca poznany. Niektóre wyniki badań wskazują, że metamizol i jego główny metabolit (4-N-metyloaminoantypiryna) działają prawdopodobnie zarówno poprzez ośrodkowy, jak i obwodowy układ nerwowy.
Po podaniu doustnym metamizol ulega całkowitej hydrolizie do czynnego farmakologicznie metabolitu 4-N-metyloaminoantypyriny (MAA), którego biodostępność wynosi około 90% i jest nieco większa po podaniu doustnym niż pozajelitowym. Jednoczesne przyjmowanie posiłków nie ma istotnego wpływu na kinetykę metamizolu.
Główny metabolit metamizolu, MAA, ulega dalszemu metabolizmowi w wątrobie poprzez utlenianie, demetylację, a następnie acetylację.
Działanie kliniczne wykazuje głównie MAA, a w pewnym stopniu także jej metabolit, 4- aminoantypiryna (AA). Wartość pola pod krzywą (AUC) dla AA wynosi około 25% pola pod krzywą dla MAA. Metabolity 4-N-acetyloaminoantypiryna (AAA) i 4-N-formyloaminoantypiryna (FAA) są prawdopodobnie farmakologicznie nieaktywne.
Farmakokinetyka wszystkich metabolitów metamizolu ma charakter nieliniowy. Kliniczne znaczenie tego zjawiska nie jest dotychczas poznane. Podczas krótkotrwałego leczenia kumulacja metabolitów ma niewielkie znaczenie.
Metamizol przenika przez łożysko. Metabolity metamizolu są wydzielane do mleka kobiecego. Wiązanie z białkami wynosi: 58% dla MAA, 48% dla AA, 18% dla FAA i 14% dla AAA.
Po podaniu dożylnym okres półtrwania w fazie eliminacji z surowicy wynosi dla metamizolu
około 14 minut. Około 96% znakowanej izotopem promieniotwórczym dawki wykrywane jest w moczu, a około 6% w kale.
Po doustnym podaniu pojedynczej dawki można było zidentyfikować 85% wydalonych z moczem metabolitów, z czego 3 ± 1% stanowiła MAA, 6 ± 3% AA, 26 ± 8% AAA i 23 ± 4% FAA. Klirens nerkowy po pojedynczej doustnej dawce 1 g metamizolu wynosił dla MAA 5 ± 2 ml/min, dla AA 38 ± 13 ml/min, dla AAA 61 ± 8 ml/min i dla FAA 49 ± 5 ml/min. Okres półtrwania w fazie eliminacji z surowicy wynosił odpowiednio 2,7 ± 0,5 godziny dla MAA, 3,7 ± 1,3 godziny dla AA, 9,5 ± 1,5 godziny dla AAA i 11,2 ± 1,5 godziny dla FAA.
Pacjenci w podeszłym wieku i z zaburzeniami czynności wątroby
U pacjentów w podeszłym wieku AUC wzrasta 2-3-krotnie. U pacjentów z marskością wątroby okres półtrwania w fazie eliminacji MAA i FAA po podaniu pojedynczej dawki doustnej zwiększa się około 3-krotnie, natomiast w przypadku AA i AAA okres półtrwania nie wzrósł w tym samym stopniu. U tych pacjentów należy unikać stosowania dużych dawek leku.
Zaburzenia czynności nerek
Dostępne dane na temat pacjentów z zaburzeniami czynności nerek wskazują na zmniejszoną szybkość eliminacji niektórych metabolitów (AAA i FAA). U pacjentów z zaburzeniami czynności nerek należy unikać stosowania dużych dawek.
Biodostępność
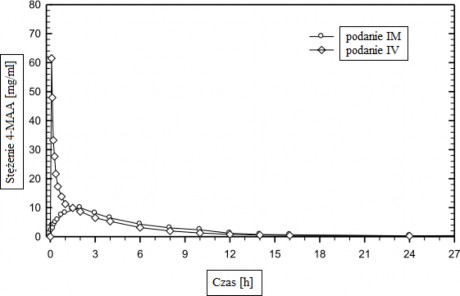
Przeprowadzone w 1989 roku badanie biodostępności roztworu podanego domięśniowo u 12 osób wykazało, w porównaniu do produktu referencyjnego (podanie dożylne w ciągu 2 minut), dla 4- MAA:
Podanie im. (1 g) | Podanie iv. (1 g) | |
Maksymalne stężenie w surowicy(Cmax) [mg/l] Czas osiągnięcia maksymalnego stężenia w surowicy (tmax) [h] Powierzchnia pod krzywą stężenie/czas (AUC) [mg x h/l] (wartości podane jako średnie i odchylenia standardowe) | 11,4 ± 3,12 1,67 ± 0,69 64,1 ± 14,8 | 62,1 ± 15,9 0,009 ± 0,02 67,8 ± 16,1 |
Całkowita dostępność biologiczna roztworu podanego domięśniowo mierzona jako AUC dla stężenia 4-MAA w osoczu wynosi 87%.
Średnie zmiany stężenia w osoczu w porównaniu do produktu referencyjnego na wykresie przedstawiającym zależność stężenia od czasu:
Dzieci i młodzież
U dzieci obserwuje się szybszą eliminację metabolitów niż u dorosłych.
Toksyczność podprzewlekła/przewlekła
Badania toksyczności podprzewlekłej i przewlekłej były przeprowadzane na różnych gatunkach zwierząt. Szczury otrzymywały doustnie przez 6 miesięcy po 100-900 mg metamizolu na kilogram masy ciała. W największej dawce (900 mg na kilogram masy ciała) po 13 tygodniach zaobserwowano zwiększenie liczby retykulocytów oraz ciałek Heinza.
Psy otrzymywały przez 6 miesięcy metamizol w dawkach dobowych od 30 mg do 600 mg na kilogram masy ciała. W zależności od dawki od 300 mg na kilogram masy ciała zaobserwowano niedokrwistość hemolityczną oraz zaburzenia czynności nerek i wątroby.
Działanie mutagenne i rakotwórcze
Dla metamizolu dostępne są badania mutagenności in vitro i in vivo ze sprzecznymi wynikami w identycznych systemach testowych.
Długookresowe badania na szczurach nie wykazały rakotwórczego potencjału. W dwóch z trzech badań długookresowych na myszach przy podawaniu dużych dawek zaobserwowano zwiększone występowanie gruczolaków komórek wątroby.
Toksyczny wpływ na reprodukcję
Badania nad embriotoksycznością na szczurach i królikach nie wykazały działania teratogennego.
Śmierć zarodków zaobserwowano u królików już przy dawce dobowej 100 mg na kilogram masy ciała, która nie jest śmiertelna dla matki. U szczurów obserwowano śmierć zarodków po podaniu dawek z zakresu toksycznego dla matki. Dawki dobowe powyżej 100 mg na kilogram masy ciała prowadziły u szczurów do wydłużenia czasu trwania ciąży i upośledzenia przebiegu porodu ze zwiększoną śmiertelnością matek i młodych.
Badania nad płodnością wykazały nieznacznie obniżoną częstość zachodzenia w ciążę w pokoleniu rodziców przy dawce dobowej powyżej 250 mg na kilogram masy ciała. Płodność pokolenia F1 nie została upośledzona.
Metabolity metamizolu przenikają do mleka matki. Nie poznano ich wpływu na niemowlę.
Woda do wstrzykiwań
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 6.6.
Po pierwszym otwarciu i (lub) po rozcieńczeniu produkt leczniczy należy natychmiast zużyć.
Brak specjalnych zaleceń dotyczących temperatury przechowywania produktu leczniczego. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem.
Warunki przechowywania produktu leczniczego po pierwszym otwarciu i (lub) po rozcieńczeniu, patrz punkt 6.3.
Ampułka oznaczona białym punktem z żółtą i czerwoną obwódką (ze szkła oranżowego typu I):
5, 10, 20, 25, 50 lub 100 ampułek po 2 ml roztworu do wstrzykiwań / do infuzji, pakowanych w blister PVC/Aluminium, w tekturowym pudełku.
Ampułka oznaczona białym punktem z żółtą obwódką (ze szkła oranżowego typu I):
5, 10, 20, 25, 50 lub 100 ampułek po 5 ml roztworu do wstrzykiwań / do infuzji, pakowanych w blister PVC/Aluminium, w tekturowym pudełku.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Produkt leczniczy Metamizol Krka można mieszać lub rozcieńczać z 5% roztworem glukozy (50 mg/ml), 0,9% roztworem NaCl (9 mg/ml), roztworem Ringera z mleczanami lub roztworem Ringera.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
KRKA, d.d., Novo mesto, Šmarješka cesta 6, 8501 Novo mesto, Słowenia
Pozwolenie nr 25825
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 17.04.2020 r.
13.04.2022 r.











