Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
u pacjentów z nadwrażliwością na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1;
u pacjentów z ciężkim nadciśnieniem lub chorobą naczyń obwodowych, z powodu ryzyka zgorzeli niedokrwiennej lub zakrzepicy naczyń;
w skojarzeniu z nieselektywnymi inhibitorami monoaminooksydazy (MAO) (lub w ciągu 2 tygodni od zaprzestania ich podawania) ze względu na ryzyko wystąpienia napadowego nadciśnienia tętniczego i hipertermii potencjalnie zakończonej zgonem (patrz punkt 4.5);
u pacjentów z ciężką nadczynnością tarczycy.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
cukrzycą;
nadciśnieniem tętniczym;
niekontrolowaną nadczynnością tarczycy;
chorobą wieńcową i przewlekłymi chorobami serca;
niewydolnością naczyń obwodowych (która nie jest ciężka);
bradykardią;
częściowym blokiem serca;
tachykardią;
zaburzeniami rytmu serca;
dławicą piersiową (fenylefryna może wywoływać lub nasilać napady dławicowe u pacjentów z chorobą wieńcową i dławicą piersiową w wywiadzie);
tętniakiem;
jaskrą zamkniętego kąta.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Nieselektywne inhibitory monoaminooksydazy (MAO) (iproniazyd, nialamid): napadowe nadciśnienie tętnicze, hipertermia, potencjalnie zakończona zgonem. Ze względu na długi czas działania inhibitorów MAO, ta interakcja jest możliwa nawet 15 dni po odstawieniu inhibitorów MAO.
Leczenie skojarzone niezalecane
Alkaloidy sporyszu o działaniu dopaminergicznym (bromokryptyna, kabergolina, lizuryd, pergolid): ryzyko zwężenia naczyń krwionośnych i (lub) przełomu nadciśnieniowego.
Alkaloidy sporyszu powodujące skurcz naczyń krwionośnych (dihydroergotamina, ergotamina, metyloergometryna, metysergid): ryzyko zwężenia naczyń krwionośnych i (lub) przełomu nadciśnieniowego.
Trójpierścieniowe leki przeciwdepresyjne (np. imipramina): napadowe nadciśnienie tętnicze z możliwością zaburzeń rytmu serca (hamowanie wnikania adrenaliny lub noradrenaliny do włókien współczulnych).
Leki przeciwdepresyjne o działaniu noradrenergiczno-serotoninergicznym (minalcypram, wenlafaksyna): napadowe nadciśnienie tętnicze z możliwością zaburzeń rytmu serca (hamowanie wnikania adrenaliny lub noradrenaliny do włókien współczulnych).
Selektywne inhibitory monoaminooksydazy typu A (MAO) (moklobemid, toloksaton): ryzyko zwężenia naczyń krwionośnych i (lub) przełomu nadciśnieniowego.
Linezolid: ryzyko zwężenia naczyń krwionośnych i (lub) przełomu nadciśnieniowego.
Guanetydyna i produkty pokrewne: znaczne zwiększenie ciśnienia tętniczego (nadreaktywność związana ze zmniejszeniem napięcia układu współczulnego i (lub) hamowaniem wnikania adrenaliny lub noradrenaliny do włókien współczulnych). Jeśli nie da się uniknąć takiego leczenia skojarzonego, należy zachować ostrożność stosując mniejsze dawki sympatykomimetyków.
Glikozydy nasercowe, chinidyna: zwiększone ryzyko wystąpienia arytmii.
Sybutramina: napadowe nadciśnienie tętnicze z możliwością zaburzeń rytmu serca (hamowanie wnikania adrenaliny lub noradrenaliny do włókien współczulnych).
Halogenowe wziewne środki znieczulające (desfluran, enfluran, halotan, izofluran, metoksyfluran, sewofluran): ryzyko okołooperacyjnego przełomu nadciśnieniowego i arytmii.
Leczenie skojarzone, wymagające zachowania ostrożności
Środki pobudzające skurcze macicy: działanie zwiększające ciśnienie tętnicze amin sympatykomimetycznych może być nasilone. Dlatego niektóre leki pobudzające skurcze macicy mogą powodować ciężkie, utrzymujące się nadciśnienie tętnicze i może wystąpić udar w okresie po porodzie.
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Wyjąć ampułko-strzykawkę ze sterylnego blistra.
2
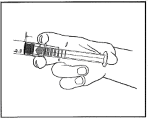

Nacisnąć tłok, aby uwolnić tłoczek gumowy. Proces sterylizacji mógł spowodować przyleganie tłoczka gumowego do korpusu strzykawki.
3
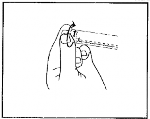
Odkręcić nakrętkę końcową, aby zerwać zabezpieczenie końcówki strzykawki. Nie należy dotykać odsłoniętego złącza luer, aby uniknąć zanieczyszczenia.
4
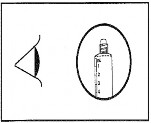
Sprawdzić, czy zabezpieczenie końcówki strzykawki zostało całkowicie usunięte. Jeśli nie, należy założyć nakrętkę końcową i przekręcić ją ponownie.
5

Wypchnąć powietrze delikatnie naciskając tłok.
Podłączyć strzykawkę do urządzenia z dostępem do żyły. Powoli naciskać tłok, aby wstrzyknąć wymaganą objętość.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Phenylephrine Aguettant, 50 mikrogramów/ml, roztwór do wstrzykiwań w ampułko-strzykawce
Każdy ml roztworu do wstrzykiwań zawiera fenylefryny chlorowodorek w ilości odpowiadającej 50 mikrogramom (0,05 mg) fenylefryny.
Każda 10 ml ampułko-strzykawka zawiera fenylefryny chlorowodorek w ilości odpowiadającej 500 mikrogramom (0,5 mg) fenylefryny.
Substancje pomocnicze o znanym działaniu:
Ten produkt leczniczy zawiera sód.
Każdy ml roztworu do wstrzykiwań zawiera 3,72 mg (0,162 mmol) sodu. Każda 10 ml ampułko-strzykawka zawiera 37,2 mg (1,62 mmol) sodu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań w ampułko-strzykawce (Płyn do wstrzykiwań). Przezroczysty, bezbarwny roztwór.
pH: 4,7–5,3
Osmolalność: 270–300 mOsm/kg
Leczenie niedociśnienia tętniczego podczas znieczulenia podpajęczynówkowego, zewnątrzoponowego lub ogólnego.
Dawkowanie
Dorośli
Zazwyczaj stosowana dawka wynosi od 50 do 100 mikrogramów i może być powtarzana, aż zostanie osiągnięte pożądane działanie. Pojedyncza dawka podawana w bolusie nie powinna być większa niż 100 mikrogramów.
Zaburzenia czynności nerek
U pacjentów z zaburzeniami czynności nerek konieczne może być stosowanie mniejszych dawek fenylefryny.
Zaburzenia czynności wątroby
U pacjentów z marskością wątroby konieczne może być stosowanie większych dawek fenylefryny.
Osoby w podeszłym wieku
Należy zachować ostrożność podczas leczenia osób w podeszłym wieku.
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności fenylefryny u dzieci. Dane nie są dostępne.
Sposób podawania
Dożylne wstrzyknięcie w bolusie.
Fenylefryna w postaci roztworu do wstrzykiwań o stężeniu 50 mikrogramów/ml może być podawana wyłącznie przez personel medyczny po odpowiednim przeszkoleniu i z wystarczającym doświadczeniem. Ampułko-strzykawka nie nadaje się do użycia w pompach infuzyjnych.
Fenylefryny nie wolno stosować:
Podczas leczenia należy monitorować ciśnienie tętnicze. Należy zachować ostrożność podając fenylefrynę pacjentom z:
Fenylefryna może powodować zmniejszenie pojemności minutowej serca. Dlatego, należy zachować ostrożność podczas stosowania u pacjentów z miażdżycą, osób w podeszłym wieku oraz u pacjentów z zaburzeniami przepływów mózgowych lub wieńcowych.
U pacjentów ze zmniejszoną pojemnością minutową serca lub z chorobą naczyń wieńcowych, należy ściśle kontrolować parametry życiowe oraz należy rozważyć zmniejszenie dawki produktu leczniczego, jeśli ciśnienie tętnicze jest zbliżone do dolnej granicy zakresu docelowego.
U pacjentów z ciężką niewydolnością serca lub we wstrząsie kardiogennym, fenylefryna może powodować nasilenie niewydolności serca, ponieważ powoduje zwężenie naczyń (zwiększenie obciążenia następczego).
Podczas wstrzykiwania fenylefryny należy zachować szczególną ostrożność, aby uniknąć wynaczynienia, ponieważ może to spowodować martwicę tkanek.
Ten produkt leczniczy zawiera 37,2 mg sodu na ampułko-strzykawkę, co odpowiada 1,9% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u dorosłych.
Leczenie skojarzone przeciwwskazane (patrz punkt 4.3)
Ciąża
Badania na zwierzętach dotyczące szkodliwego wpływu na reprodukcję i działania teratogennego są niewystarczające (patrz punkt 5.3).
Podawanie fenylefryny w późnym okresie ciąży lub w czasie porodu może spowodować niedotlenienie i bradykardię u płodu. Zastosowanie fenylefryny we wstrzyknięciu jest możliwe w okresie ciąży, zgodnie ze wskazaniami.
Zastosowanie z lekami pobudzającymi skurcze macicy może spowodować ciężkie nadciśnienie tętnicze (patrz punkt 4.5).
Karmienie piersią
Niewielka ilości fenylefryny przenika do mleka kobiecego i biodostępność po podaniu doustnym może być mała.
Podanie matce leków o działaniu zwężającym naczynia krwionośne teoretycznie naraża dziecko na ryzyko wpływu na układ sercowo-naczyniowy i nerwowy. Jednakże, w przypadku podania w pojedynczym bolusie podczas porodu, karmienie piersią jest możliwe.
Płodność
Nie ma dostępnych danych dotyczących płodności po podaniu fenylefryny (patrz punkt 5.3).
Nie dotyczy.
Podsumowanie profilu bezpieczeństwa
Najczęstszymi działaniami niepożądanymi fenylefryny są: bradykardia, epizody nadciśnienia tętniczego, nudności i wymioty. Nadciśnienie tętnicze występuje częściej podczas podawania dużych dawek.
Najczęściej zgłaszanym działaniem niepożądanym dotyczącym układu sercowo-naczyniowego jest bradykardia, prawdopodobnie ze względu na stymulację nerwu błędnego za pośrednictwem baroreceptorów, co jest zgodne z działaniem farmakologicznym fenylefryny.
Lista działań niepożądanych
Częstość: Nieznana (częstość nie może być określona na podstawie dostępnych danych)
Zaburzenia układu immunologicznego
Nieznana: nadwrażliwość.
Zaburzenia psychiczne
Nieznana: lęk, drażliwość, pobudzenie, stany psychotyczne, dezorientacja.
Zaburzenia układu nerwowego
Nieznana: ból głowy, nerwowość, bezsenność, parestezja, drżenie.
Zaburzenia oka
Nieznana: rozszerzenie źrenic, zaostrzenie wcześniej występującej jaskry zamkniętego kąta.
Zaburzenia serca
Nieznana: odruchowa bradykardia, tachykardia, kołatanie serca, nadciśnienie tętnicze, zaburzenia rytmu serca, dławica piersiowa, niedokrwienie mięśnia sercowego.
Zaburzenia naczyniowe
Nieznana: krwotok mózgowy, przełom nadciśnieniowy.
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia
Nieznana: duszność, obrzęk płuc.
Zaburzenia żołądka i jelit
Nieznana: nudności, wymioty.
Zaburzenia skóry i tkanki podskórnej
Nieznana: pocenie się, bladość skóry, skurcz mięśni przywłosowych (tzw. „gęsia skórka”), martwica skóry po wynaczynieniu.
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej
Nieznana: osłabienie mięśni.
Zaburzenia nerek i dróg moczowych
Nieznana: trudności w oddawaniu moczu i zatrzymanie moczu.
Opis wybranych działań niepożądanych
Ponieważ fenylefryna jest często stosowana w warunkach intensywnej terapii u pacjentów z niedociśnieniem i we wstrząsie, niektóre ze zgłoszonych ciężkich działań niepożądanych (w tym zgony) są prawdopodobnie związane z chorobą podstawową i nie są związane z zastosowaniem fenylefryny.
Inne szczególne grupy pacjentów
Osoby w podeszłym wieku: ryzyko toksyczności fenylefryny zwiększa się u pacjentów w podeszłym wieku (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane do
Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych
Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C
PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można również zgłaszać podmiotowi odpowiedzialnemu.
Objawy przedawkowania to: ból głowy, nudności, wymioty, psychozy paranoidalne, omamy, nadciśnienie i odruchowa bradykardia. Mogą wystąpić zaburzenia rytmu serca, takie jak dodatkowe skurcze komorowe i krótkie epizody napadowej tachykardii komorowej.
Należy zastosować leczenie objawowe i podtrzymujące. Nadciśnienie można leczyć lekami blokującymi receptory alfa-adrenergiczne, takimi jak fentolamina.
Grupa farmakoterapeutyczna: leki adrenergiczne i dopaminergiczne, kod ATC: C01CA06
Fenylefryna jest silnym lekiem zwężającym naczynia krwionośne, który działa prawie wyłącznie przez pobudzenie receptorów alfa1-adrenergicznych. Takiemu zwężeniu naczyń tętniczych towarzyszy również zwężenie naczyń żylnych. Powoduje to wzrost ciśnienia tętniczego i odruchową bradykardię. Silne zwężenie naczyń tętniczych powoduje zwiększenie obwodowego oporu naczyniowego (zwiększenie obciążenia następczego). Ogólnym skutkiem jest zmniejszenie pojemności minutowej serca. Jest to mniej widoczne u osób zdrowych, ale może się nasilić w przypadku wcześniej występującej niewydolności serca. Ponieważ działanie fenylefryny jest powiązane z jej właściwościami farmakologicznymi, można je kontrolować za pomocą znanych antidotów.
Objętość dystrybucji po podaniu pojedynczej dawki wynosi 340 litrów. Fenylefryna jest metabolizowana w wątrobie przez monoaminooksydazę.
Fenylefryna jest wydalana głównie przez nerki w postaci kwasu m-hydroksymigdałowego i związków sprzężonych z grupą fenolową.
Działanie utrzymuje się 20 minut po podaniu dożylnym.
Końcowy okres półtrwania fenylefryny podanej we wstrzyknięciu wynosi około 3 godzin. Stopień wiązania z białkami osocza jest nieznany.
Brak danych dotyczących farmakokinetyki w szczególnych grupach pacjentów.
Nie ma dowodów na genotoksyczność lub rakotwórczość fenylefryny. Badania na zwierzętach są niewystarczające do oceny wpływu na płodność i reprodukcję.
Sodu chlorek
Sodu cytrynian dwuwodny Kwas cytrynowy jednowodny Sodu wodorotlenek
Woda do wstrzykiwań
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonywano badań dotyczących zgodności.
3 lata
Brak specjalnych wymagań dotyczących temperatury przechowywania. Przed zastosowaniem strzykawkę przechowywać w nieotwartym blistrze. Blister przechowywać w opakowaniu zewnętrznym w celu ochrony przed światłem.
10 ml roztworu do wstrzykiwań w ampułko-strzykawce (z polipropylenu) z tłokiem (z chlorobutylu), bez igły, ze skalowaną od 0 do 10 ml, samoprzylepną etykietą.
Ampułko-strzykawka z polipropylenu jest pakowana pojedynczo w przezroczysty blister.
Ampułko-strzykawki są dostępne w blistrze z polipropylenu, w opakowaniach po 1 lub 10 strzykawek. Całość w tekturowym pudełku.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Instrukcja stosowania:
Należy przygotować strzykawkę ostrożnie, w następujący sposób
Ampułko-strzykawka jest przeznaczona tylko dla jednego pacjenta. Należy wyrzucić strzykawkę po użyciu. NIE WOLNO WYKORZYSTYWAĆ PONOWNIE.
Zawartość nieotwartego i nieuszkodzonego blistra jest sterylna i nie może być otwierana wcześniej, niż w momencie użycia.
Przed podaniem produktu należy przeprowadzić ocenę wzrokową, czy nie są obecne cząsteczki i przebarwienia. Należy stosować wyłącznie klarowny, bezbarwny roztwór, wolny od cząsteczek lub osadów.
Nie należy używać produktu, jeśli zabezpieczenie na nakrętce końcowej strzykawki jest naruszone. Zewnętrzna powierzchnia strzykawki jest sterylna do momentu otwarcia blistra.
W przypadku stosowania metody aseptycznej, Phenylephrine Aguettant, 50 mikrogramów/ml, roztwór do wstrzykiwań można umieścić na sterylnym polu.
Laboratoire Aguettant
1 rue Alexander Fleming 69007 Lyon
Francja
Pozwolenie











