Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
do objawowego leczenia zaawansowanego hormonozależnego raka gruczołu krokowego,
do miejscowego leczenia hormonozależnego raka gruczołu krokowego; jako leczenie uzupełniające
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość́ na octan leuproreliny i na innych analogów GnRH lub na którąkolwiek
substancję pomocniczą wymienioną w punkcie 6.1.
Potwierdzony brak zależności raka od działania hormonów.
Produkt leczniczy LIBREXA nie jest wskazany do stosowania u kobiet oraz przeciwwskazany
w ciąży i podczas karmienia piersią.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
LIBREXA, 11,25 mg, implant w ampułko-strzykawce
Jeden implant zawiera 10.72 mg leuproreliny (Leuprorelinum), co odpowiada 11,25 mg leuproreliny octanu .
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Implant w ampułko-strzykawce.
Biały lub prawie biały cylindryczny pręcik (przybliżone wymiary: długość 17,8 mm, średnica 1,5 mm)
Produkt leczniczy LIBREXA jest wskazany do stosowania u mężczyzn:
podczas i po zakończeniu radioterapii.
Produkt leczniczy LIBREXA powinien być podawany wyłącznie przez fachowy personel medyczny,
który zna te procedury.
Dawkowanie
Implant powinien być podawany raz na trzy miesiące.
Z badań na zwierzętach wynika, że należy unikać przypadkowego wstrzyknięcia do tętnic (zakrzepica
małych naczyń odległych od miejsca podania).
Zazwyczaj po okresie 3 miesięcy można ocenić, czy zaawansowany rak gruczołu krokowego jest wrażliwy na androgeny. Głównym parametrem diagnostycznym jest stężenie antygenu specyficznego dla prostaty (PSA) w surowicy, które jest zwykle większe niż 10 ng/ml w zaawansowanym stadium nowotworu. Test bada poziom PSA po indukowanej deprywacji androgenów produktem leczniczym LIBREXA. Z tego względu zarówno poziom PSA, jak i całkowite stężenie testosteronu w surowicy muszą zostać oznaczone na przed i po 3 miesiącach stosowania produktu leczniczego LIBREXA.
Wynik testu jest pozytywny, gdy po 3 miesiącach stężenie testosteronu są na poziomie kastracji (<0,5 ng/ml), a poziom PSA zmniejszył się. Wcześniej występujący znaczne zmniejszenie poziomu PSA (około 80% poziomu wyjściowego) można uznać za dobry wskaźnik prognostyczny długotrwałej odpowiedzi klinicznej na deprywację androgenów. Wówczas jest wskazana hormonalna terapia ablacyjna (np. produktem leczniczym LIBREXA).
Test jest ujemny, gdy poziom PSA pozostaje niezmieniony lub zwiększył się u pacjentów ze
zmniejszonym poziomem testosteronu.
Jednakże, jeśli pacjent wykazuje odpowiedź kliniczną (na przykład poprawę w zakresie bólu i zmniejszenia trudności w oddawaniu moczu, zmniejszenia wielkości gruczołu krokowego), należy rozważyć wynik fałszywie ujemny. W tych rzadkich przypadkach podawanie produktu leczniczego LIBREXA powinno być kontynuowane, a poziom PSA powinien zostać ponownie ustalony po 3 miesiącach; ponadto pacjent powinien być uważnie obserwowany w kierunku objawów klinicznych.
Leczenie pacjentów z rakiem gruczołu krokowego analogami hormonu uwalniającego gonadotropiny (GnRH) może być kontynuowane nawet po pojawieniu się oporności na kastrację, zgodnie z odpowiednimi wytycznymi.
Leczenie zaawansowanego, zależnego od hormonów raka prostaty za pomocą produktu leczniczego LIBREXA jest zwykle długotrwałym leczeniem.
Dane kliniczne wykazały, że 3-letnia terapia deprywacji androgenów stosowana jednocześnie z radioterapią, jak i po niej jest korzystniejsza niż sześciomiesięczny cykl deprywacji androgenów w miejscowo zaawansowanym hormonozależnym raku gruczołu krokowego (patrz także punkt 5.1). Obowiązujące wytyczne zalecają 2- do 3-letnie stosowanie deprywacji androgenów u pacjentów (T3 - T4) otrzymujących radioterapię.
Sposób podawania
Produkt leczniczy LIBREXA wstrzykuje się podskórnie, w przednią ścianę jamy brzusznej. Instrukcja użycia przedstawiona jest w punkcie 6.6
Należy uważnie monitorować stan pacjentów z nadciśnieniem tętniczym
U pacjentów leczonych agonistami GnRH (agonistami hormonu uwalniającego gonadotropinę̨ ), takimi jak leuprorelina, istnieje zwiększone ryzyko depresji (również ciężkiej). Pacjentów należy poinformować o takim zagrożeniu i w razie wystąpienia objawów zastosować właściwe leczenie.
Po wprowadzeniu octanu leuproreliny do obrotu zgłaszano występowanie drgawek u pacjentów zarówno dorosłych jak i dzieci, niezależnie od padaczki, zaburzeń padaczkowych lub czynników predysponujących do wystąpienia drgawek w wywiadzie.
Zastosowanie produktu leczniczego LIBREXA może dać pozytywne wyniki w testach
antydopingowych.
U mężczyzn poddanych uprzednio kastracji chirurgicznej LIBREXA nie powoduje dalszego zmniejszenia stężenia testosteronu w surowicy.
Ze względu na krótkotrwałe zwiększenie stężenia testosteronu w surowicy na początku leczenia, co może przemijająco nasilić objawy choroby, stan pacjentów z ryzykiem powikłań neurologicznych, przerzutów do kręgosłupa i zwężenia dróg moczowych należy poddawać stałej kontroli w pierwszych tygodniach leczenia, w miarę możliwości w ramach leczenia szpitalnego.
Należy rozważyć dodatkowe podawanie odpowiedniego leku hamującego wydzielanie androgenów w początkowym etapie leczenia w celu złagodzenia możliwych następstw początkowego zwiększenia stężenia testosteronu i nasilenia objawów klinicznych.
Powodzenie leczenia należy oceniać w regularnych odstępach czasu (zwłaszcza w razie oznak postępu choroby mimo odpowiedniego leczenia) przez badanie kliniczne (palpacyjne badanie per rectum gruczołu krokowego, badanie ultrasonograficzne, densytometrię kości, tomografię komputerową)
i kontrolowanie aktywności fosfataz i (lub) stężenia PSA oraz testosteronu w surowicy.
Długotrwałe leczenie analogami GnRH i (lub) usunięcie jąder (orchidektomii) może prowadzić do zwiększonego ryzyka demineralizacji kości, które u pacjentów wysokiego ryzyka, może prowadzić do wystąpienia osteoporozy ze zwiększonym ryzykiem złamań.
Zmiany metaboliczne i ryzyko sercowo-naczyniowe:
Dane epidemiologiczne pokazują, że leczenie analogami GnRH wiąże się ze zmianami metabolizmu (zmniejszenie tolerancji glukozy lub nasileniem stwierdzonej wcześniej cukrzycy) i może prowadzić do zwiększonego ryzyka chorób sercowo-naczyniowych. Jednak dane prospektywne nie potwierdziły związku między leczeniem analogami GnRH a zwiększeniem śmiertelności z przyczyn sercowo- naczyniowych. Pacjenci z cukrzycą i osobami o podwyższonym ryzyku chorób metabolicznych lub sercowo-naczyniowych powinni być odpowiednio monitorowani podczas leczenia produktem leczniczym LIBREXA.
Leczenie antyandrogenowe może spowodować wydłużenie odstępu QT.
U pacjentów z czynnikami ryzyka wydłużenia odstępu QT w wywiadzie oraz u pacjentów otrzymujących jednocześnie produkty lecznicze, które mogą wydłużyć odstęp QT (patrz punkt 4.5), lekarz powinien ocenić stosunek korzyści do ryzyka przed rozpoczęciem stosowania produktu leczniczego LIBREXA wyłącznie z możliwością wystąpienia zaburzeń rytmu serca typu torsade de pointes.
Ponieważ leczenie deprywacją androgenów może wydłużać odstęp QT, należy dokładnie ocenić jednoczesne stosowanie produktu leczniczego LIBREXA z produktami o znanym działaniu wydłużającym odstęp QT lub z produktami, które mogą wywołać częstoskurcz komorowy typu torsade de pointes, należącymi do klasy IA (np. chinidyna, dizopiramid) lub klasy III (np. amiodaron, sotalol, dofetylid, ibutylid) przeciwarytmicznych produktów leczniczych, metadonem, moksyfloksacyną, lekami przeciwpsychotycznymi, itd. (patrz punkt 4.4).
Produkt leczniczy LIBREXA nie jest przeznaczony do stosowania u kobiet oraz jest przeciwwskazany do stosowania w okresie ciąży i karmienia piersią.
Zmęczenie jest częstym działaniem niepożądanym, które pojawia się zwłaszcza na początku leczenia i może być również związane z chorobą nowotworową. Należy zatem rozważyć następujące środki ostrożności do czasu uzyskania dalszych dowodów:
Produkt leczniczy, nawet stosowany zgodnie z zaleceniami, może zmieniać reakcje pacjenta w sposób zaburzający zdolność prowadzenia pojazdów lub obsługiwania maszyn. Dotyczy to w większym stopniu sytuacji, gdy podczas stosowania leku spożywa się alkohol.
Na początku leczenia leuprorelina powoduje krótkotrwałe zwiększenie stężenia testosteronu w surowicy, które może spowodować przemijające nasilenie niektórych objawów choroby
(wystąpienie lub nasilenie bólu kości, zwężenie dróg moczowych z jego skutkami, ucisk rdzenia kręgowego, osłabienie mięśni nóg, obrzęk limfatyczny). Nasilenie tych objawów zmniejsza się zazwyczaj samoistnie bez konieczności przerwania stosowania produktu leczniczego LIBREXA.
Niedobór hormonów płciowych może powodować niepożądane reakcje. Działania niepożądane
wymieniono zgodnie z klasyfikacją układów i narządów MedDRA oraz częstością̨: bardzo często: ≥1/10
często: ≥1/100 do <1/10
niezbyt często: ≥1/1000 do <1/100 rzadko: ≥1/10 000 do <1/1000 bardzo rzadko: <1/10 000
częstość nieznana (nie może być określona na podstawie dostępnych danych).
Tabela 1. Działania niepożądane
Zaburzenia układu immunologicznego | |
Niezbyt często | Ogólnoustrojowe reakcje alergiczne (gorączka, świąd, eozynofilia, wysypka) |
Bardzo rzadko | Reakcje anafilaktyczne |
Zaburzenia metabolizmu i odżywiania | |
Często | Zmniejszenie apetytu, zwiększenie apetytu, |
Rzadko | Zmiany w cukrzycowym statusie metabolicznym (zwiększenie lub zmniejszenie stężenia glukozy we krwi) |
Zaburzenia psychiczne | |
Często | Depresja, zaburzenia snu, zmiany nastroju, |
Zaburzenia układu nerwowego | |
Często | Bóle głowy, parestezje |
Rzadko | Zawroty głowy pochodzenia błędnikowego, przemijające zaburzenia smaku |
Bardzo rzadko | Krwotok do przysadki mózgowej po początkowym podaniu leuproreliny pacjentom z gruczolakiem przysadki* |
częstość nieznana | Drgawki |
Zaburzenia serca | |
częstość nieznana | Wydłużenie odstępu QT (patrz punkty 4.4 i 4.5) |
Zaburzenia naczyniowe | |
Bardzo często | Uderzenia gorąca |
Rzadko | Zmiany ciśnienia tętniczego (nadciśnienie lub niedociśnienie tętnicze), |
Zaburzenia żołądka i jelit | |
Bardzo często | Nudności/wymioty |
Niezbyt często | Biegunka |
Zaburzenia skóry i tkanki podskórnej | |
Niezbyt często | Suchość skóry lub błon śluzowych, nocne poty |
Rzadko | Łysienie |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | |
Bardzo często | Ból kości |
Często | Ból stawów i (lub) pleców, miastenia, ból krocza, ból w nadbrzuszu |
Częstość nieznana | Demineralizacja kości (patrz punkt 4.4) |
Zaburzenia nerek i dróg moczowych |
Często | Oddawanie moczu w nocy, bolesne oddawanie moczu, częstomocz |
Bardzo rzadko | Zatrzymanie moczu |
Zaburzenia układu rozrodczego i piersi | |
Bardzo często | Zmniejszenie lub utrata libido i potencji, zmniejszenie wielkości jąder |
Często | Ginekomastia |
Niezbyt często | Ból jąder |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | |
Częstość nieznana | Śródmiąższowa choroba płuc. |
Zaburzenia ogólne i stany w miejscu podania | |
Bardzo często | Nasilone pocenie się, reakcje w miejscu wkłucia np. zaczerwienienie, ból, obrzęk, świąd, które zazwyczaj ustępują nawet w razie kontynuowania leczenia |
Często | Odczucie zmęczenia, obrzęki obwodowe, |
Badania diagnostyczne | |
Bardzo często | Zwiększenie masy ciała |
Często | Utrata masy ciała, wzrost LDH, transaminaz, gamma-GT i fosfatazy alkalicznej, które mogą jednak być objawami choroby podstawowej. |
Odpowiedź na leczenie produktem leczniczym LIBREXA powinno być kontrolowane poprzez pomiar stężenia testosteronu w surowicy po 28 dniach po każdym wstrzyknięciu i przed każdym ponownym podaniem produktu leczniczego LIBREXA oraz dodatkowo na podstawie innych badań laboratoryjnych, takich jak pomiar fosfatazy kwaśnej i PSA. W początkowej fazie leczenia stężenie testosteronu najpierw zwiększa się, po czym zmniejsza w czasie 2 tygodni. Po upływie 2 do 4 tygodni stężenia testosteronu są porównywalne do obserwowanych po obustronnym usunięciu jąder i pozostają stałe przez cały okres leczenia.
W początkowej fazie leczenia może wystąpić przemijające zwiększenie aktywności fosfatazy kwaśnej. Powrót do fizjologicznych lub prawie fizjologicznych wartości następuje po kilku tygodniach.
Ropień w miejscu wstrzyknięcia jest rzadkim powikłaniem. Odnotowano przypadek wystąpienia ropnia w miejscu wstrzyknięcia, który był związany ze zmniejszonym wchłanianiem się leuproreliny. W takich przypadkach zaleca się oznaczenie poziomu testosteronu.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dotychczas nie obserwowano objawów zatrucia.
Nawet stosowanie octanu leuproreliny w dobowej dawce do 20 mg przez 2 lata (dawka stosowana w pierwszych badaniach klinicznych) nie obserwowano żadnych innych lub nowych działań niepożądanych, które różniłyby się od obserwowanych po zastosowaniu octanu leuproreliny
raz na dobę w dawce 1 mg lub w dawce 11,25 mg co 3 miesiące.
Grupa farmakoterapeutyczna: hormony i ich pochodne; analogi hormonu uwalniającego
gonadotropinę̨ (GnRH). Kod ATC: L02AE02
Octan leuproreliny jest syntetycznym nonapeptydem, analogiem naturalnie występującego hormonu uwalniającego gonadotropinę (GnRH), który kontroluje uwalnianie z przedniego płata przysadki gonadotropowego hormonu luteinizującego LH i hormonu folikulotropowego FSH. Hormony te z kolei stymulują syntezę steroidów gonadalnych.
W przeciwieństwie do fizjologicznego GnRH), który jest uwalniany z podwzgórza w sposób pulsujący, octan leuproreliny (znany również jako agonista GnRH),) blokuje podczas długotrwałego leczenia w sposób ciągły receptory GnRH w przysadce, a po początkowej krótkotrwałej stymulacji powoduje ich niewrażliwość („regulacja w dół”, ang. down-regulation).
Mężczyźni
W wyniku tego następuje przemijające zahamowanie uwalniania gonadotropin z przysadki, po którym zmniejsza się stężenie testosteronu. Zmniejszone stężenie testosteronu wpływa na wzrost nowotworowej tkanki gruczołu krokowego, która fizjologicznie stymulowana jest przez dihydrotestosteron, wytwarzany przez redukcję testosteronu w komórkach gruczołu krokowego.
Ciągłe podawanie octanu leuproreliny prowadzi do zmniejszenia liczby i (lub) wrażliwości (tzw.
„regulacja w dół”) receptorów znajdujących się w przysadce mózgowej i w konsekwencji do zmniejszenia stężenia LH, FSH, i DHT. W trakcie tego procesu stężenie testosteronu zmniejsza się do poziomu kastracyjnego.
Działanie przeciwandrogenowe oraz zahamowanie wzrostu raka gruczołu krokowego wykazano również w badaniach na zwierzętach.
Zgodnie z badaniami nieklinicznymi i klinicznymi, octan leuproreliny podawany co 3 miesiące
hamuje uwalnianie gonadotropin po początkowej stymulacji.
U ludzi podskórne podanie octanu leuproreliny powoduje początkowe zwiększenie stężenia LH i FSH,
charakteryzujące się przemijającym zwiększeniem stężenia testosteronu i dihydrotestosteronu.
Ponieważ w pojedynczych przypadkach podczas pierwszych 3 tygodni leczenia obserwowano krótkotrwałe nasilenie objawów klinicznych choroby, u mężczyzn z rakiem gruczołu krokowego należy rozważyć podanie antyandrogenów, jako leczenie wspomagające.
Przeciwnie, długotrwałe leczenie octanem leuproreliny powoduje zmniejszenie stężenia LH i FSH u wszystkich pacjentów. Androgeny uzyskują u mężczyzn stężenie podobne do obserwowanego po obustronnym usunięciu jąder. Zmiany te występują zazwyczaj w 2 do 3 tygodni po rozpoczęciu
leczenia i utrzymują się przez cały okres leczenia. Dlatego stosując octan leuproreliny można również badać wrażliwość hormonalną raka gruczołu krokowego oraz możliwą wartość terapeutyczną usunięcia obustronnego jąder. Jeśli to konieczne, usuniecie jąder można zastąpić podawaniem octanu leuproreliny co 3 miesiące. Aktualnie możliwe jest utrzymanie stężenia testosteronu na poziomie kastracyjnym po podawaniu octanu leuproreliny w sposób ciągły przez 5 lat.
Skuteczność kliniczna
W randomizowanym badaniu klinicznym III fazy udział wzięło 263 pacjentów z miejscowo zaawansowanym rakiem gruczołu krokowego o stopniu zaawansowania T3-T4 lub pT3, N0, M0. 133 pacjentów przydzielono do grupy poddanej długotrwałemu leczeniu (3 lata) w połączeniu z radioterapią, a 130 pacjentów do grupy poddanej 3 letniej terapii deprywacji androgenami prowadzonej octanem leuproreliny.
W oparciu o kryteria ASTRO (Phoenix), w okresie 5-letnim, przeżycie bez progresji choroby wyniosło 60,9% (64,7%) w grupie leczonej terapią skojarzoną w porównaniu do 8,5% (15,4%) w grupie otrzymującej tylko hormonoterapię [p = 0,0001; (p = 0,0005)]. Na podstawie kryteriów ASTRO ryzyko progresji choroby było 3,8-krotnie większe w grupie leczonej tylko hormonalnie (95% CI [2,17; 6.49]).
Średnie przeżycie kliniczne lub biochemiczne bez progresji choroby, zgodnie z definicją ASTRO, wynosiło 641 dni (95% CI [626; 812]) w grupie leczonej tylko deprywacją androgenów w porównaniu do 2,804 dni (95% CI [2,090; -]; p <0,0001) w grupie leczonej terapią skojarzoną.
Ponadto, zaobserwowano inne, istotne statystycznie różnice: współczynnik locoregionalnej progresji [HR 3,6 (95% CI [1.9, 6.8], p <0,0001), progresji przerzutów (p <0,018) i przeżycia wolnego od przerzutów (p = 0,018) pacjentów leczonych radioterapią w połączeniu z deprywacją androgenami w porównaniu grupy leczonej tylko deprywacją androgenów.
Wyniki badania pokazały, że 3 letnia deprywacja androgenów octanem leuproreliny w połączeniu z radioterapią zapewnia lepsze przeżycie w porównaniu do 3 lat terapii deprywacji androgenów z samym octanem leuproreliny.
Wyniki badań klinicznych wśród pacjentów z przerzutowym rakiem gruczołu krokowego, opornym na kastrację, pokazały korzyści z dodatkowego leczenia inhibitorami androgenów (np. octan abirateronu), antyandrogenami (np. enzalutamid), taksanami (np. docetaksel lub kabazytaksel) lub radioterapeutykami (np. rad-223) oprócz agonistów GnRH, takich jak octan leuproreliny.
Wchłanianie
Po wstrzyknięciu implantu, octan leuproreliny uwalniany jest w sposób ciągły z polimeru przez okres 3 miesięcy. Polimer jest wchłaniany w taki sam sposób, jak materiał, z którego wykonuje się szwy chirurgiczne.
Dystrybucja
Na wykresie 1 przedstawione są poziomy leuproreliny w osoczu u pacjentów płci męskiej po podskórnym podaniu produktu leczniczego LIBREXA (podanie pojedyncze). Po 3 dniach zmierzone poziomy w osoczu wynosiły 2,39 ± 1,15 ng/ml. Oznaczalne stężenie leuproreliny w surowicy utrzymuje się przez cały okres stosowania.
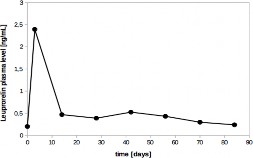
Wykres 1: Poziom leuproreliny w osoczu [ng/ml] po podskórnym podaniu produktu leczniczego LIBREXA u mężczyzn
Metabolizm i eliminacja
Objętość dystrybucji leuproreliny u mężczyzn wynosi 36 litrów; całkowity klirens ma wartość 139,6
ml/min (oznaczony przy użyciu octanu leuproreliny w postaci o przedłużonym uwalnianiu depot).
Wielokrotne podanie powoduje utrzymujące się zmniejszenie stężenia testosteronu do poziomu kastracji, przy czym nie obserwuje się przejściowego zwiększenia stężenia testosteronu po pierwszym podaniu.
Pacjenci z zaburzeniami czynności nerek/wątroby
U pacjentów z zaburzeniami czynności nerek i (lub) wątroby stężenia leuproreliny były na podobnym poziomie w porównaniu do pacjentów z prawidłową czynnością nerek i (lub) wątroby. U niektórych pacjentów z przewlekłą chorobą nerek obserwowano większe stężenia leuproreliny w surowicy.
Wydaje się, że obserwacje te nie mają istotnego znaczenia klinicznego.
Biodostępność
Względna biodostępność po 84 dniach obliczona na podstawie porównania z AUC po dożylnym
podaniu 1 mg octanu leuproreliny, dla produktu leczniczego LIBREXA wynosi 84,6%.
Toksyczność ostra (LD50)
W badaniach toksyczności ostrej podawano lek samcom oraz samicom myszy i szczurów, dożylnie, domięśniowo, podskórnie i doustnie. Zgon następował dopiero po podaniu dawek 2 000 mg lub
5 000 mg octanu leuproreliny.
Toksyczność po wielokrotnym podaniu
Badania toksyczności po wielokrotnym podaniu przeprowadzono na szczurach i psach, którym przez 13 tygodni podawano podskórne lub domięśniowo do 8 mg octanu leuproreliny/kg masy ciała na tydzień) i przez 12 miesięcy, podskórnie do 32 mg octanu leuproreliny/kg masy ciała na miesiąc.
Wszystkie zastosowane dawki (najniższa dawka badana wynosiła 0,8 mg octanu leuproreliny / kg masy ciała na miesiąc) związane były z wystąpieniem miejscowych zmian skórnych w miejscu podania i zmianami zanikowymi w narządach rozrodczych. U szczurów zaobserwowano wakuole w komórkach wątroby i komórkach nabłonka kanalików nerkowych przy wszystkich poziomach dawek. Zmiany narządu rodnego spowodowane były hormonalnym działaniem substancji.
Rakotwórczość, mutagenność, wpływ na płodność
Rakotwórczość
Przeprowadzono dwuletnie badania na szczurach i myszach, dotyczące działania rakotwórczego. U szczurów po podskórnym wstrzyknięciu dawek od 0,6 do 4 mg ma dobę przez 24 miesiące obserwowano zależne od dawki zwiększenie częstości powstawania gruczolaków przysadki.
U myszy po podaniu dawki 60 mg / kg / dobę przez dwa lata nie zaobserwowano zwiększenia częstości powstawania gruczolaków przysadki.
Genotoksyczność
W badaniach in vitro i in vivo dotyczących możliwości wywoływania przez octan leuproreliny mutacji genetycznych i chromosomowych nie stwierdzono potencjalnego działania mutagennego.
Płodność
Badania na dojrzałych płciowo samicach szczurów, którym podskórnie podawano dwa razy na dobę octan leuproreliny w dawce 10 μg przez 14 dni lub 40 μg przez 13 dni wykazały zwiększenie masy narządów rodnych macicy i jajników, podwyższone poziomy hormonów oraz pojawienie się ciałek żółtych po odstawieniu substancji.
Trzy-miesięczne badania na niedojrzałych płciowo szczurach płci żeńskiej i męskiej, którym w sposób ciągły podawano 200 μg/kg masy ciała/dobę lub sporadycznie podawano 0,8 lub 2,4 mg/kg masy ciała/miesiąc nie wykazały nieprawidłowości w zachowaniach reprodukcyjnych zwierząt po
zakończeniu leczenia. Generacja F1 nie wykazywała żadnych nieprawidłowości. Zachowania
reprodukcyjne generacji F1 nie były badane.
W badania klinicznych i farmakologicznych przeprowadzonych na mężczyznach, wykazano, że zahamowanie płodności było w pełni odwracalne do 24 tygodni, po odstawieniu ciągłego przyjmowania octanu leuproreliny.
Toksyczny wpływ na reprodukcję
Badania na szczurach i królikach nie wykazały działania teratogennego. U królików obserwowano działanie embriotoksyczne / embriofoliczne w dawkach większych niż 0,24 μg/kg.
kopolimer DL-laktydu i glikolidu (1:1) polimer DL-laktydu
Nie dotyczy.
4 lata.
Ampułko-strzykawkę należy zużyć natychmiast po otwarciu jałowej torebki.
Nie przechowywać w temperaturze powyżej 30°C. Ampułko-strzykawkę przechowywać
w zamkniętym oryginalnym opakowaniu w celu ochrony przed wilgocią.
Ampułko-strzykawka z polimeru MMBS (Methyl Methacrylate Butadiene Styrene), z tłokiem i igłą ze stali nierdzewnej, umieszczona w torebce z folii PETP/Aluminium/PE, zawierającej środek pochłaniający wilgoć, w tekturowym pudełku.
Wielkości opakowań:
1 ampułko-strzykawka zawierająca 1 implant
Instrukcja użycia
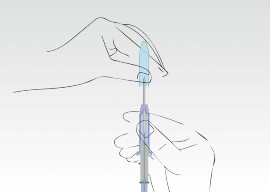
Obraz 1
Wyjąć aplikator ze sterylnego opakowania
Sprawdzić, czy wewnątrz widoczny implant znajduje się we właściwej pozycji w aplikatorze
Usunąć pierścień zabezpieczający.
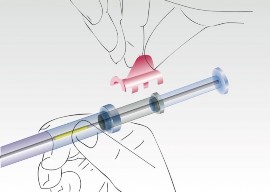
Obraz 2
Ująć aplikator, znajdujący się na cylindrze strzykawki i zdjąć nasadkę.
Obraz 3
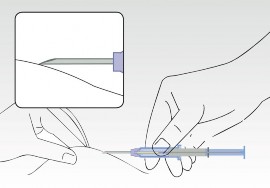
Jednocześnie ścisnąć skórę pacjenta i trzymając cylinder strzykawki, wsunąć igłę ukośnie (prawie równolegle do skóry) z ostrzem igły skierowanym do góry.
Wprowadzić igłę do tkanki podskórnej (nie do mięśni lub do jamy brzusznej) przedniej ściany jamy brzusznej pod linią pępkową, aż cylinder strzykawki dotknie skóry pacjenta.
Cylinder strzykawki musi pozostać w kontakcie ze skórą podczas całego procesu aplikacji!
Obraz 4
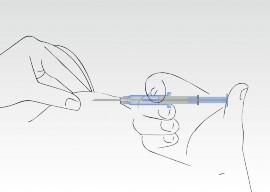
Nacisnąć tłok strzykawki. Implant przemieszcza się do końca igły.
Nie należy wyciągać strzykawki z powrotem. Podczas procesu aplikacji cylinder strzykawki musi
dotykać skóry pacjenta.
Obraz 5
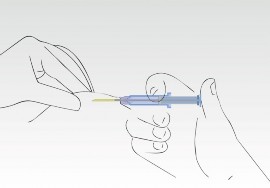
Gdy tłok jest wciśnięty, igła cofa się automatycznie.
Obraz 6
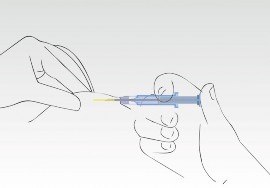
Igła wycofuje się z tkanki do cylindra strzykawki. Cylinder strzykawki musi pozostać w kontakcie ze skórą pacjenta. Zazwyczaj wciśnięcie tłoka i cofanie się igły odbywa się jednym płynnym ruchem.
Obraz 7
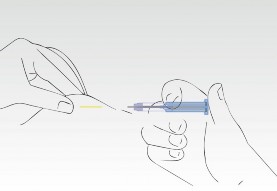
Proces aplikacji został zakończony. Igła została całkowicie wsunięta do cylindra strzykawki.
Trzon z supernatantem chroni przed urazami zakończeniem igły.
Obraz 8
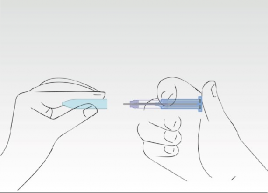
Ponownie nałożyć nasadkę.
Strzykawkę należy wyrzucić do wyznaczonego pojemnika.
DOPUSZCZENIE DO OBROTU
Przedsiębiorstwo Farmaceutyczne LEK-AM Sp. z o.o. ul. Ostrzykowizna 14A
05-170 Zakroczym Polska
Pozwolenie nr 26071
I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 03.11.2020
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
05.04.2022











