Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
zespołami mielodysplastycznymi (ang. myelodysplastic syndromes, MDS) o pośrednim-2 i wysokim ryzyku, zgodnie z Międzynarodowym Punktowym Systemem Rokowniczym (ang. International Prognostic Scoring System, IPSS)
przewlekłą białaczką mielomonocytową (ang. chronic myelomonocytic leukaemia, CMML) z od 10 % do 29 % blastów w szpiku, bez choroby mieloproliferacyjnej,
ostrą białaczką szpikową (ang. acute myeloid leukaemia, AML) z 20 % do 30 % blastów i wieloliniową dysplazją, zgodnie z klasyfikacją Światowej Organizacji Zdrowia (WHO),
AML z > 30 % blastów w szpiku, zgodnie z klasyfikacją WHO.
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
Gerodaza, 25 mg/ml, proszek do sporządzania zawiesiny do wstrzykiwań
Jedna fiolka zawiera 100 mg azacytydyny.
Po przygotowaniu 1 ml zawiesiny zawiera 25 mg azacytydyny.
Jedna fiolka zawiera 150 mg azacytydyny.
Po przygotowaniu 1 ml zawiesiny zawiera 25 mg azacytydyny. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Proszek do sporządzania zawiesiny do wstrzykiwań. Biały liofilizowany proszek.
Azacytydyna jest wskazana do leczenia pacjentów dorosłych, niekwalifikujących się do przeszczepienia krwiotwórczych komórek macierzystych (ang. haematopoietic stem cell transplantation, HSCT), z:
Leczenie azacytydyną powinno zostać rozpoczęte, a następnie kontrolowane, przez lekarza posiadającego doświadczenie w stosowaniu chemioterapeutyków. Pacjentom należy podać premedykację w postaci leków przeciwwymiotnych, w celu zapobieżenia nudnościom i wymiotom.
Dawkowanie
Zalecana dawka początkowa w pierwszym cyklu leczenia dla wszystkich pacjentów, bez względu na początkowe hematologiczne wartości laboratoryjne, to 75 mg/m2 powierzchni ciała, podawane jako wstrzyknięcie podskórne, codziennie przez 7 dni, po czym następuje okres odpoczynku trwający 21 dni (28-dniowy cykl leczenia).
Zalecane jest leczenie pacjentów przez co najmniej 6 cykli. Leczenie należy kontynuować tak długo, jak pacjent odnosi z niego korzyści lub do progresji choroby.
Należy obserwować pacjentów w kierunku odpowiedzi/toksyczności hematologicznej oraz nefrotoksyczności (patrz punkt 4.4); może być konieczne opóźnienie rozpoczęcia następnego cyklu lub zmniejszenie dawki w sposób opisany poniżej.
Testy laboratoryjne
Przed rozpoczęciem leczenia i przed każdym cyklem leczenia należy wykonać próby czynnościowe wątroby, oznaczyć stężenie kreatyniny oraz dwuwęglanów w surowicy. Pełną morfologię krwi należy wykonywać przed rozpoczęciem leczenia oraz tak często, jak to jest konieczne, aby obserwować odpowiedź i toksyczność, lecz nie rzadziej niż przed każdym cyklem leczenia.
Dostosowanie dawki z powodu toksyczności hematologicznej
Toksyczność hematologiczna jest zdefiniowana jako najniższa wartość osiągnięta w danym cyklu (nadir), jeśli liczba płytek ≤ 50,0 × 109/l i (lub) liczba bezwzględna neutrofili (ang. Absolute Neutrophil Count, ANC) ≤ 1 × 109/l.
Regeneracja jest zdefiniowana jako zwiększenie linii komórkowej (-ych), dla których zaobserwowano toksyczność hematologiczną, przynajmniej o połowę różnicy między nadirem a liczbą początkową plus wartości nadiru (tzn. liczba krwinek w momencie regeneracji ≥ wartość nadiru + (0,5 × [liczba początkowa – wartość nadiru]).
Pacjenci bez obniżonej początkowej liczby krwinek (tzn. liczba krwinek białych (ang. white blood cells,
WBC) ≥ 3,0 × 109/l i ANC ≥ 1,5 × 109/l oraz płytki ≥ 75,0 × 109/l) przed pierwszym leczeniem
W przypadku zaobserwowania toksyczności hematologicznej po leczeniu produktem Gerodaza, należy opóźnić następny cykl leczenia do osiągnięcia regeneracji liczby płytek i ANC. Jeśli regeneracja nastąpiła w ciągu 14 dni, dostosowanie dawki nie jest konieczne. Jednak, jeśli regeneracja nie nastąpiła w ciągu 14 dni, należy obniżyć dawkę zgodnie z poniższą tabelą. Po zmodyfikowaniu dawki, czas trwania cyklu powinien wynosić ponownie 28 dni.
Wartości nadiru | % dawki w następnym cyklu, jeśli regeneracja* nie nastąpiła w ciągu 14 dni | |
ANC (× 109/l) | Płytki krwi (× 109/l) | |
≤ 1,0 | ≤ 50,0 | 50 % |
> 1,0 | > 50,0 | 100 % |
*Regeneracja = wartości ≥ wartość nadiru + (0,5 × [liczba początkowa – wartość nadiru])
Pacjenci z obniżoną początkową liczbą krwinek (tzn. WBC < 3,0 × 109/l lub ANC < 1,5 × 109/l lub płytki < 75,0 × 109/l) przed pierwszym leczeniem
Po leczeniu produktem Gerodaza, jeśli zmniejszenie WBC lub ANC, lub płytek, w porównaniu z wartościami przed leczeniem, wynosi ≤ 50 %, lub więcej niż 50 %, ale z poprawą w różnicowaniu którejkolwiek z linii komórkowych, nie należy opóźniać następnego cyklu ani dostosowywać dawki.
Jeśli zmniejszenie WBC lub ANC lub płytek, w porównaniu z wartościami przed leczeniem, wynosi więcej niż 50 %, bez poprawy w różnicowaniu linii komórkowych, należy opóźnić następny cykl leczenia produktem Gerodaza do osiągnięcia regeneracji liczby płytek i ANC. Jeśli regeneracja nastąpiła w ciągu 14 dni, dostosowanie dawki nie jest konieczne. Jednak, jeśli regeneracja nie nastąpiła w ciągu 14 dni, należy oznaczyć komórkowość szpiku kostnego. Jeśli komórkowość szpiku kostnego wynosi > 50 %, nie należy dostosowywać dawki. Jeśli komórkowość szpiku kostnego wynosi ≤ 50 %, należy opóźnić leczenie i obniżyć dawkę zgodnie z poniższą tabelą:
Komórkowość szpiku kostnego | % dawki w następnym cyklu, jeśli regeneracja nie jest osiągnięta w ciągu 14 dni | |
Regeneracja* ≤ 21 dni | Regeneracja* > 21 dni | |
15-50 % | 100 % | 50 % |
< 15 % | 100 % | 33 % |
*Regeneracja = liczby ≥ wartość nadiru + (0,5 × [liczba początkowa – wartość nadiru]) Po modyfikacji dawki czas trwania cyklu powinien wynosić ponownie 28 dni.
Szczególne grupy pacjentów Pacjenci w podeszłym wieku
W przypadku pacjentów w podeszłym wieku nie zaleca się szczególnego dostosowywania dawki. Ponieważ w przypadku pacjentów w podeszłym wieku jest bardziej prawdopodobne występowanie zmniejszonej czynności nerek, u tych pacjentów użyteczne może być kontrolowanie czynności nerek.
Pacjenci z zaburzeniami czynności nerek
Azacytydyna może być podawana pacjentom z zaburzeniami czynności nerek bez dostosowywania dawki początkowej (patrz punkt 5.2). W przypadku wystąpienia niewyjaśnionego zmniejszenia się stężenia dwuwęglanów w surowicy do poziomu poniżej 20 mmol/l, należy obniżyć dawkę o 50 % w następnym cyklu. W przypadku wystąpienia niewyjaśnionego wzrostu stężenia kreatyniny w surowicy lub azotu mocznikowego we krwi [ang. Blood Urea Nitrogen, BUN] do poziomu ≥ 2-krotności wartości początkowych i powyżej górnej granicy normy, należy opóźnić następny cykl do czasu, gdy wartości osiągną z powrotem poziom prawidłowy lub początkowy, oraz obniżyć dawkę o 50 % w następnym cyklu leczenia (patrz punkt 4.4).
Pacjenci z zaburzeniami czynności wątroby
Nie przeprowadzono formalnych badań z udziałem pacjentów z zaburzeniami czynności wątroby (patrz punkt 4.4). Pacjentów z ciężką niewydolnością narządową wątroby należy uważnie obserwować pod kątem wystąpienia zdarzeń niepożądanych. W przypadku pacjentów z zaburzeniami czynności wątroby występującymi przed rozpoczęciem leczenia, nie zaleca się szczególnej modyfikacji dawki początkowej; późniejsze modyfikacje dawek powinny być oparte na hematologicznych wartościach laboratoryjnych. Produkt Gerodaza jest przeciwwskazany dla pacjentów z zaawansowanymi nowotworami złośliwymi wątroby (patrz punkty 4.3 i 4.4).
Dzieci i młodzież
Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego Gerodaza u dzieci w wieku od 0 do 17 lat. Dane nie są dostępne.
Sposób podawania
Produkt leczniczy Gerodaza jest przeznaczony do podawania podskórnego. Przygotowany produkt Gerodaza należy wstrzykiwać podskórnie w ramię, udo lub brzuch. Należy zmieniać miejsca wstrzyknięcia. Nowe wstrzyknięcia należy podawać przynajmniej 2,5 cm od poprzedniego miejsca i nigdy nie wstrzykiwać w miejsca drażliwe, zasiniaczone, zaczerwienione lub stwardniałe.
Po sporządzeniu, zawiesina nie powinna być filtrowana. Instrukcja dotycząca rekonstytucji produktu leczniczego przed podaniem, patrz punkt 6.6.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Zaawansowane nowotwory złośliwe wątroby (patrz punkt 4.4). Karmienie piersią (patrz punkt 4.6).
Toksyczność hematologiczna
Leczenie azacytydyną jest związane z występowaniem niedokrwistości, neutropenii i trombocytopenii, szczególnie w czasie pierwszych 2 cykli (patrz punkt 4.8). Należy wykonywać pełną morfologię krwi tak często jak to jest konieczne, aby obserwować odpowiedź i toksyczność, jednak co najmniej przed każdym cyklem leczenia. Po podaniu zalecanej dawki dla pierwszego cyklu, należy obniżyć dawkę dla następnych cykli lub opóźnić jej podanie w oparciu o wartości nadiru i odpowiedź hematologiczną (patrz punkt 4.2). Należy poinstruować pacjenta, aby niezwłocznie zgłaszał epizody gorączkowe.
Pacjenci i lekarze powinni być również poinstruowani, by zwracali uwagę na objawy przedmiotowe i podmiotowe krwawienia.
Zaburzenia czynności wątroby
Nie przeprowadzono formalnych badań z udziałem pacjentów z zaburzeniami czynności wątroby. U pacjentów z rozległym obciążeniem nowotworem z powodu choroby przerzutowej, zgłaszano występowanie postępującej choroby wątroby prowadzącej do śpiączki wątrobowej i śmierci podczas leczenia azacytydyną, w szczególności u pacjentów z początkowym stężeniem albuminy w surowicy < 30 g/l. Azacytydyna jest przeciwwskazana dla pacjentów z zaawansowanymi nowotworami złośliwymi wątroby (patrz punkt 4.3).
Niewydolność nerek
Zaburzenia czynności nerek, począwszy od podwyższonego stężenia kreatyniny w surowicy aż po niewydolność nerek i śmierć, były zgłaszane u pacjentów leczonych dożylnie azacytydyną w skojarzeniu z innymi chemioterapeutykami. Dodatkowo, u 5 pacjentów z przewlekłą białaczką szpikową (ang. Chronic Myelogenous Leukaemia, CML), leczonych azacytydyną i etopozydem, rozwinęła się nerkowa kwasica cewkowa, zdefiniowana jako obniżenie stężenia dwuwęglanów w surowicy do < 20 mmol/l, któremu towarzyszyły mocz zasadowy i hipokaliemia (stężenie potasu w surowicy < 3 mmol/l). W przypadku wystąpienia niewyjaśnionego obniżenia stężenia dwuwęglanów w surowicy (< 20 mmol/l) lub wzrostów stężenia kreatyniny w surowicy lub BUN, należy zmniejszyć dawkę lub opóźnić podanie leku (patrz punkt 4.2).
Należy poinstruować pacjentów, aby natychmiast zgłaszali pracownikom służby zdrowia wystąpienie skąpomoczu i bezmoczu.
Chociaż nie zaobserwowano klinicznie istotnych różnic w częstości występowania działań niepożądanych między pacjentami z prawidłową czynnością nerek a pacjentami z niewydolnością nerek, należy ściśle obserwować pacjentów z niewydolnością nerek w celu wykrycia toksyczności, ponieważ azacytydyna i(lub) jej metabolity są wydalane głównie przez nerki (patrz punkt 4.2).
Testy laboratoryjne
Przed rozpoczęciem leczenia i przed każdym cyklem leczenia należy wykonać próby czynnościowe wątroby, oznaczyć stężenie kreatyniny oraz dwuwęglanów w surowicy. Pełną morfologię krwi należy wykonywać przed rozpoczęciem leczenia oraz tak często jak to jest konieczne, aby obserwować odpowiedź i toksyczność, lecz nie rzadziej niż przed każdym cyklem leczenia, patrz punkt 4.8.
Choroby serca i płuc
Pacjenci z ciężką zastoinową niewydolnością serca, klinicznie niestabilną chorobą serca lub chorobą płuc w wywiadzie, byli wykluczeni z głównych badań rejestracyjnych (AZA PH GL 2003 CL 001 oraz AZA-AML-001), i z tego powodu nie ustalono bezpieczeństwa stosowania ani skuteczności azacytydyny u tych pacjentów. Najnowsze dane z badań klinicznych u pacjentów z chorobami serca i płuc w wywiadzie wykazały istotne zwiększenie częstości zdarzeń dotyczących serca związanych ze stosowaniem azacytydyny (patrz punkt 4.8). Dlatego zaleca się zachowanie ostrożności przy przepisywaniu azacytydyny tym pacjentom. Przed leczeniem oraz w trakcie leczenia należy rozważyć przeprowadzenie oceny wydolności krążeniowo-oddechowej.
Martwicze zapalenie powięzi
U pacjentów leczonych azacytydyną zgłaszano przypadki martwiczego zapalenia powięzi, w tym przypadki zakończone zgonem. W pacjentów, u których wystąpi martwicze zapalenie powięzi należy przerwać podawanie azacytydyny oraz bezzwłocznie wdrożyć właściwe leczenie.
Zespół rozpadu guza
Ryzyko zespołu rozpadu guza dotyczy pacjentów z dużym rozmiarem guza przed zastosowaniem leczenia. Tacy pacjenci powinni być starannie monitorowani i należy podjąć u nich odpowiednie środki ostrożności.
W oparciu o dane z badań in vitro, nie wydaje się, by w metabolizmie azacytydyny uczestniczyły izoenzymy cytochromu P450 (CYP), UDP-glukuronozylotransferazy (UGT), sulfotransferazy (SULT) ani transferazy glutationowe (GST). Z tego powodu uznaje się, że interakcje in vivo związane z tymi enzymami metabolizującymi są mało prawdopodobne.
Klinicznie istotne działania hamujące lub indukujące azacytydyny na enzymy cytochromu P450 są mało prawdopodobne (patrz punkt 5.2).
Nie przeprowadzono badań interakcji.
Kobiety w wieku rozrodczym / Antykoncepcja u mężczyzn i kobiet
Kobiety w wieku rozrodczym i mężczyźni muszą stosować skuteczną metodę antykoncepcji w trakcie leczenia i do 3 miesięcy po okresie leczenia.
Ciąża
Brak danych lub istnieją tylko ograniczone dane dotyczące stosowania azacytydyny u kobiet w okresie ciąży. Badania na myszach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3). Zagrożenie dla człowieka nie jest znane. W oparciu o wyniki z badań na zwierzętach i mechanizm działania azacytydyny, nie zaleca się stosowania jej w okresie ciąży, szczególnie w pierwszym trymestrze chyba, że stan kliniczny kobiety wymaga podawania azacytydyny. W każdym indywidualnym przypadku należy rozważyć stosunek korzyści z leczenia do możliwego zagrożenia dla płodu.
Karmienie piersią
Nie wiadomo, czy azacytydyna lub jej metabolity przenikają do mleka ludzkiego. Ze względu na potencjalne ciężkie działania niepożądane u noworodka/dziecka karmionego piersią, karmienie piersią jest przeciwwskazane podczas leczenia azacytydyną.
Płodność
Brak danych dotyczących wpływu azacytydyny na płodność u ludzi. U zwierząt udokumentowano działania niepożądane azacytydyny na męską płodność (patrz punkt 5.3). Należy poinstruować mężczyzn, aby podczas leczenia nie spłodzili dziecka oraz by stosowali skuteczną antykoncepcję w trakcie leczenia i do 3 miesięcy po okresie leczenia. Przed rozpoczęciem leczenia należy doradzić pacjentom płci męskiej, aby zasięgnęli porady na temat przechowywania nasienia.
Azacytydyna wywiera niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Podczas stosowania azacytydyny zgłaszano przypadki zmęczenia. Z tego powodu zaleca się ostrożność podczas prowadzenia pojazdów lub obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Dorośli pacjenci z MDS, CMML oraz AML (20 % do 30 % blastów w szpiku)
Działania niepożądane, uznawane za możliwie lub prawdopodobnie związane z podawaniem azacytydyny, wystąpiły u 97% pacjentów.
Najczęściej występujące ciężkie działania niepożądane, zaobserwowane w kluczowym badaniu (AZA PH GL 2003 CL 001) to neutropenia z gorączką (8,0 %) oraz niedokrwistość (2,3 %), działanie te zgłaszano również w badaniach wspomagających (CALGB 9221 oraz CALGB 8921). Inne ciężkie działania niepożądane w tych 3 badaniach to zakażenia, takie jak posocznica neutropeniczna (0,8 %) i zapalenie płuc (2,5 %) (w niektórych przypadkach prowadzące do śmierci), trombocytopenia (3,5 %),
reakcje nadwrażliwości (0,25 %) i zdarzenia krwotoczne (np. krwotok mózgowy [0,5 %], krwotok
żołądkowo-jelitowy [0,8 %] oraz krwotok śródczaszkowy [0,5 %]).
Najczęściej zgłaszanymi działaniami niepożądanymi w czasie leczenia azacytydyną były reakcje hematologiczne (71,4 %), w tym trombocytopenia, neutropenia i leukopenia (zazwyczaj od 3. stopnia do 4. stopnia), zdarzenia żołądkowo-jelitowe (60,6 %), w tym nudności, wymioty (zazwyczaj od 1. stopnia do 2. stopnia) lub odczyny w miejscu podania (77,1 %, zazwyczaj od 1. stopnia do 2. stopnia).
Dorośli pacjenci w wieku 65 lat lub powyżej z AML z > 30 % blastów w szpiku
Najczęściej występujące ciężkie działania niepożądane (≥ 10 %), zaobserwowane w badaniu AZA- AML-001 w grupie azacytydyny to: gorączka neutropeniczna (25,0 %), zapalenie płuc (20,3 %) oraz gorączka (10,6 %). Inne, rzadziej występujące, ciężkie działania niepożądane w grupie azacytydyny to: posocznica (5,1 %), niedokrwistość (4,2 %), posocznica neutropeniczna (3,0 %), zakażenie dróg moczowych (3,0 %), trombocytopenia (2,5 %), neutropenia (2,1 %), zapalenie tkanki łącznej (2,1 %), zawroty głowy (2,1 %) oraz duszność (2,1 %).
Najczęściej zgłaszanymi (≥ 30 %) działaniami niepożądanymi w czasie leczenia azacytydyną były zdarzenia żołądkowo-jelitowe, w tym zaparcia (41,9 %), nudności (39,8 %) oraz biegunka (36,9 %), (zazwyczaj od 1. stopnia do -2. stopnia), zaburzenia ogólne i stany w miejscu podania, w tym gorączka (37,7 %, zazwyczaj od 1. stopnia do 2. stopnia), oraz zdarzenia hematologiczne, w tym gorączka neutropeniczna (32,2 %) oraz neutropenia (30,1 %) (zazwyczaj od 3. stopnia 3. do 4. stopnia).
Tabelaryczne zestawienie działań niepożądanych
Tabela 1 poniżej przedstawia działania niepożądane związane z leczeniem azacytydyną, zaobserwowane w głównych badaniach klinicznych dotyczących MDS i AML oraz po wprowadzeniu produktu do obrotu.
Częstość występowania jest określona jako: bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10), niezbyt często (≥ 1/1 000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1 000), bardzo rzadko (< 1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych). W obrębie każdej grupy o określonej częstości występowania, objawy niepożądane są wymienione zgodnie ze zmniejszającym się ciężkością. Działania niepożądane przedstawiono w poniższej tabeli zgodnie z największą częstością występowania obserwowaną w którymkolwiek spośród głównych badań klinicznych.
Tabela 1: Działania niepożądane zgłaszane u pacjentów z MDS lub AML leczonych azacytydyną (w badaniach klinicznych oraz po wprowadzeniu do obrotu)
Klasyfikacja układów i narządów | Bardzo często | Często | Niezbyt często | Rzadko | Częstość nieznana |
Zakażenia i za- rażenia pasożyt- nicze | zapalenie płuc* (w tym bakteryjne, wirusowe i | posocznica* (w tym bakteryjna, wirusowa i grzybicza), | martwi- cze za- palenie powięzi* | ||
grzybicze), | posocznica | ||||
zapalenie jamy nosowo- | neutropeniczna*, zakażenie dróg | ||||
gardłowej | oddechowych (w | ||||
tym górnych | |||||
dróg | |||||
oddechowych i | |||||
oskrzeli), zaka- żenie dróg mo- | |||||
czowych, za- | |||||
palenie tkanki łącznej, |
zapalenie uchyłków, grzybica jamy ustnej, zapalenie zatok, zapalenie gardła, zapalenie błony śluzowej nosa, opryszczka pospolita, zaka- żenie skóry | |||||
Zaburzenia krwi i układu chłonnego | gorączka neu- tropeniczna*, neutropenia, leukopenia, trombocytope- nia, niedo- krwistość | pancytopenia*, niewydolność szpiku kostnego | |||
Zaburzenia układu immunologicznego | reakcje nad- wrażliwości | ||||
Zaburzenia metabolizmu i odżywiania | anoreksja, zmniejszone łaknienie, hipokaliemia | odwodnienie | zespół rozpadu guza | ||
Zaburzenia psychiczne | bezsenność | stan splątania, lęk | |||
Zaburzenia układu nerwowego | zawroty głowy, ból głowy | krwotok śród- czaszkowy*, omdlenie, sen- ność, letarg | |||
Zaburzenia oka | krwotok oczny, krwotok spo- jówkowy | ||||
Zaburzenia serca | wysięk osier- dziowy | zapalenie osierdzia | |||
Zaburzenia naczyniowe | niedociśnienie tętnicze*, nadci- śnienie tętnicze, niedociśnienie ortostatyczne, krwiaki | ||||
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | duszność, krwawienie z nosa | wysięk opłuc- nowy, duszność wysiłkowa, ból gardła i krtani | choroba śród- miąższowa płuc | ||
Zaburzenia żołądka i jelit | biegunka, wymioty, za- parcia, nudno- ści, ból brzu- cha (w tym dyskomfort brzucha i nad- brzusza) | Krwotok żołąd- kowo-jelitowy* (w tym krwotok z jamy ustnej), krwotok hemo- roidalny, zapale- nie jamy ustnej, krwawienie dzią- seł, dyspepsja | |||
Zaburzenia | niewydolność |
wątroby i dróg żółciowych | wątroby*, postępująca choroba wą- troby, która może prowa- dzić do śpiączki wą- trobowej | ||||
Zaburzenia skóry i tkanki podskórnej | wybroczyny punktowe, świąd (w tym uogólniony świąd), wy- sypka, pod- skórne wy- lewy krwawe | plamica, łysienie, pokrzywka, ru- mień, wybro- czyny plamkowe | ostra gorącz- kowa derma- toza neutrofi- lowa, ropne zgorzelinowe zapalenie skóry (łac. pyoderma gangrenosum) | ||
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | bóle stawów, bóle mię- śniowo- szkieletowe (w tym ból pleców, ból kości i ból w kończynie) | skurcze mięśni, bóle mięśniowe | |||
Zaburzenia nerek i dróg moczowych | niewydolność nerek*, krwio- mocz, podwyższone stężenie kreatyniny w surowicy | nerkowa kwa- sica cewkowa | |||
Zaburzenia ogólne i stany w miejscu podania | gorączka*, zmęczenie, osłabienie, bóle klatki piersiowej, rumień w miejscu poda- nia, ból w miejscu poda- nia, odczyn w miejscu poda- nia (nieokre- ślony) | reakcje w miej- scu wstrzyknięcia (w tym siniaki, krwiaki, stward- nienie, wysypka, świąd, stan za- palny, odbarwie- nie, guzki i krwotok), złe samopoczucie, dreszcze, krwa- wienie w miejscu wkłucia cewnika | martwica miejsca wstrzyknięcia | ||
Badania diagnostyczne | zmniejszenie masy ciała |
*= zgłaszano rzadko przypadki zgonów
Opis wybranych działań niepożądanych
Hematologiczne działania niepożądane
Najczęściej zgłaszane (≥ 10 %) hematologiczne działania niepożądane związane z leczeniem azacytydyną to: niedokrwistość, trombocytopenia, neutropenia, gorączka neutropeniczna i leukopenia, które były zazwyczaj stopnia 3. lub 4. Ryzyko wystąpienia tych zdarzeń jest większe podczas pierwszych 2 cykli, po czym u pacjentów z przywróconą czynnością układu krwiotwórczego występują one z mniejszą częstością. W przypadku większości hematologicznych działań
niepożądanych, zastosowano rutynowe kontrole pełnej morfologii krwi i opóźnienie podawania azacytydyny w następnym cyklu, profilaktyczne podanie antybiotyków i (lub) w razie konieczności wspomaganie czynnikami wzrostu (np. G-CSF) w neutropenii, oraz przetoczenia krwi w niedokrwistości lub trombocytopenii.
Zakażenia
Mielosupresja może prowadzić do neutropenii i zwiększonego ryzyka wystąpienia zakażeń. U pacjentów otrzymujących azacytydynę były zgłaszane ciężkie działania niepożądane, takie jak posocznica, w tym posocznica neutropeniczna i zapalenie płuc, w niektórych przypadkach zakończone zgonem. Zakażenia można leczyć stosując leki przeciwzakaźne oraz wspomaganie czynnikami wzrostu (np. G-CSF) w przypadku neutropenii.
Krwawienia
U pacjentów otrzymujących azacytydynę może wystąpić krwawienie. Zgłaszano ciężkie działania niepożądane, takie jak krwotok żołądkowo-jelitowy i krwotok śródczaszkowy. Pacjentów należy obserwować pod kątem objawów przedmiotowych i podmiotowych krwawienia, w szczególności pacjentów z istniejącą uprzednio bądź związaną z leczeniem trombocytopenią.
Nadwrażliwość
U pacjentów otrzymujących azacytydynę zgłaszano ciężkie reakcje nadwrażliwości. W przypadku reakcji rzekomoanafilaktycznych leczenie azacytydyną należy niezwłocznie przerwać i rozpocząć odpowiednie leczenie objawowe.
Działania niepożądane dotyczące skóry i tkanki podskórnej
Większość działań niepożądanych dotyczących skóry i tkanki podskórnej była związana z miejscem podania. W badaniach głównych żadne z tych działań niepożądanych nie prowadziło do przerwania podawania azacytydyny ani do obniżenia dawki azacytydyny. Większość działań niepożądanych wystąpiła podczas pierwszych 2 cykli i zwykle zmniejszała się w następnych cyklach. Działania niepożądane dotyczące tkanki podskórnej, takie jak wysypka/stan zapalny/świąd w miejscu podania, wysypka, rumień i uszkodzenie skóry, mogą wymagać równoczesnego zastosowania produktów leczniczych, takich jak leki przeciwhistaminowe, kortykosteroidy i niesteroidowe przeciwzapalne produkty lecznicze (NLPZ). Tego typu reakcje skórne należy odróżniać od zakażeń tkanek miękkich, występujących niekiedy w miejscu wkłucia. Po wprowadzeniu azacytydyny do obrotu zgłaszano występowanie zakażeń tkanek miękkich, w tym zapalenia tkanki łącznej i martwiczego zapalenia powięzi, w rzadkich przypadkach wiodącego do zgonu. Leczenie zakaźnych działań niepożądanych, patrz punkt 4.8 Zakażenia.
Działania niepożądane żołądkowo-jelitowe
Najczęściej zgłaszane działania niepożądane dotyczące żołądka i jelit, związane z leczeniem azacytydyną, obejmowały zaparcia, biegunkę, nudności i wymioty. Te działania niepożądane leczono objawowo lekami przeciwwymiotnymi na nudności i wymioty, lekami przeciwbiegunkowymi na biegunkę oraz lekami przeczyszczającymi i(lub) środkami zmiękczającymi stolec na zaparcia.
Działania niepożądane dotyczące nerek
Zaburzenia czynności nerek, począwszy od podwyższonego stężenia kreatyniny w surowicy oraz krwiomoczu, aż po nerkową kwasicę cewkową, niewydolność nerek i śmierć, były zgłaszane u pacjentów leczonych azacytydyną (patrz punkt 4.4).
Działania niepożądane dotyczące wątroby
U pacjentów z rozległym obciążeniem nowotworem z powodu choroby przerzutowej zgłaszano występowanie niewydolności wątroby, postępującej choroby wątroby prowadzącej do śpiączki wątrobowej i przypadki śmierci podczas leczenia azacytydyną (patrz punkt 4.4).
Zdarzenia dotyczące serca
Dane z badania klinicznego, do którego możliwe było włączenie pacjentów z chorobą układu sercowo-naczyniowego lub chorobą płuc, wykazały statystycznie istotne zwiększenie częstości
zdarzeń dotyczących serca u pacjentów z noworozpoznaną ostrą białaczką szpikową (AML) leczonych azacytydyną (patrz punkt 4.4).
Pacjenci w podeszłym wieku
Informacje dotyczące bezpieczeństwa stosowania azacytydyny u pacjentów w wieku ≥ 85 lat są ograniczone (w badaniu AZA-AML-001 wzięło udział 14 [5,9 %] pacjentów w wieku ≥ 85 lat).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem
Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa
tel.: + 48 22 49 21 301
faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
W czasie badań klinicznych zgłoszono jeden przypadek przedawkowania azacytydyny. U pacjenta wystąpiła biegunka, nudności i wymioty po otrzymaniu pojedynczej dawki dożylnej około 290 mg/m2, co stanowi prawie 4-krotność zalecanej dawki początkowej.
W przypadku przedawkowania, pacjenta należy obserwować wykonując odpowiednie badania krwi, oraz w razie konieczności podać mu leczenie wspomagające. Nie jest znane antidotum na przedawkowanie azacytydyny.
Grupa farmakoterapeutyczna: Lek przeciwnowotworowy, analogi pirymidyn; kod ATC: L01BC07 Mechanizm działania
Uważa się, że azacytydyna działa przeciwnowotworowo poprzez wiele mechanizmów, w tym
cytotoksyczność wobec nieprawidłowych komórek krwiotwórczych w szpiku kostnym i hipometylację DNA. Działania cytotoksyczne azacytydyny mogą wynikać z wielu mechanizmów, w tym zahamowania syntezy DNA, RNA i białek, włączania jej do RNA i DNA oraz aktywacji szlaków odpowiedzi na uszkodzenie DNA. Komórki nieproliferujące są względnie niewrażliwe na azacytydynę. Włączenie azacytydyny do DNA powoduje dezaktywację metylotransferaz DNA, co prowadzi do hipometylacji DNA. Hipometylacja DNA nieprawidłowo metylowanych genów zaangażowanych w normalną regulację cyklu komórkowego, różnicowanie i szlaki śmierci komórkowej, może prowadzić do ponownej ekspresji genów oraz przywrócenia komórkom nowotworowym zdolności do supresji nowotworu. Względne znaczenie hipometylacji DNA dla wyników klinicznych, w porównaniu z cytotoksycznością lub innymi aktywnościami azacytydyny, nie zostało ustalone.
Skuteczność kliniczna i bezpieczeństwo stosowania
Dorośli pacjenci (MDS, CMML oraz AML [20 % do 30 % blastów w szpiku])
Skuteczność i bezpieczeństwo stosowania azacytydyny były badane w międzynarodowym, wieloośrodkowym, kontrolowanym, prowadzonym metodą otwartej próby, randomizowanym badaniu porównawczym fazy 3. w grupach równoległych (AZA PH GL 2003 CL 001) z udziałem dorosłych
pacjentów z: MDS o pośrednim-2 i wysokim ryzyku zgodnie z Międzynarodowym Punktowym Systemem Rokowniczym (IPSS), niedokrwistością oporną na leczenie z nadmiarem blastów (ang. refractory anaemia with excess blasts, RAEB), niedokrwistością oporną na leczenie z nadmiarem blastów w okresie transformacji (ang. refractory anaemia with excess blasts in transformation, RAEB- T) oraz zmodyfikowaną przewlekłą białaczką mielomonocytową (ang. modified chronic myelomonocytic leukaemia, mCMML) zgodnie z systemem klasyfikacji French American British (FAB). Pacjenci z RAEB-T (21 % do 30 % blastów) są obecnie uznawani według aktualnej klasyfikacji WHO za pacjentów z ostrą białaczką szpikową (AML). Azacytydynę i najlepsze leczenie objawowe (ang. best supportive care, BSC) (n = 179) porównywano z tradycyjnymi metodami leczenia (ang. conventional care regimens, CCR). CCR składało się z samego BSC (n = 105), cytarabiny w małych dawkach i BSC (n = 49), lub standardowej chemioterapii indukcyjnej i BSC (n = 25). Przed randomizacją pacjenci byli wstępnie przydzielani przez lekarza prowadzącego do jednej z 3 metod CCR. Pacjenci, którzy nie zostali przydzieleni losowo do grupy otrzymującej azacytydynę, otrzymywali leczenie wstępnie wybrane przez lekarza prowadzącego. Jednym z kryteriów włączenia było wymaganie, by stan pacjentów wg. Eastern Cooperative Oncology Group (ECOG) był w zakresie 0 do 2. Pacjenci z wtórnym MDS byli wykluczeni z badania. Pierwszorzędowym parametrem końcowym badania był całkowity czas przeżycia (OS). Azacytydyna była podawana podskórnie w dawce 75 mg/m2 na dobę przez 7 dni, po czym następuje okres odpoczynku trwający 21 dni (28- dniowy cykl leczenia), przez mediana 9 cykli (zakres = 1 do 39) i średnia 10,2 cyklu. W populacji włączonej do badania (ang. Intent to Treat, ITT) mediana wieku wynosiła 69 lat (zakres 38 do 88 lat).
W analizie ITT 358 pacjentów (179 otrzymujących azacytydynę i 179 otrzymujących CCR), leczenie azacytydyną było związane z medianą czasu przeżycia wynoszącą 24,46 miesiąca w porównaniu z 15,02 miesiąca w przypadku pacjentów otrzymujących leczenie CCR, czyli różnica wynosiła 9,4 miesiąca, z wartością p wynoszącą 0,0001 w stratyfikowanym teście log-rank. Współczynnik ryzyka dla efektu leczenia wynosił 0,58 (95 % CI: 0,43; 0,77). Dwuletni czas przeżycia wynosił 50,8 % dla pacjentów otrzymujących azacytydynę wobec 26,2 % dla pacjentów otrzymujących CCR (p < 0,0001).
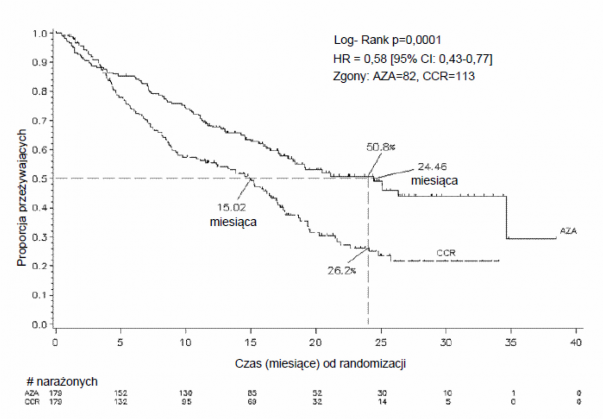
AZA = azacytydyna; CCR = tradycyjne metody leczenia; CI (ang. confidence interval) = przedział ufności; HR (ang. hazard ratio) = współczynnik ryzyka
Korzyści w zakresie czasu przeżycia po podawaniu azacytydyny były zgodne, niezależnie od opcji leczenia CCR (samo BSC, cytarabina w niskiej dawce i BSC lub standardowa chemioterapia indukcyjna i BSC) zastosowanej w grupie kontrolnej.
Podczas analizy podgrup cytogenetycznych IPSS zaobserwowano podobne wyniki w odniesieniu do mediany całkowitego czasu przeżycia we wszystkich grupach (dobra, pośrednia, zła cytogenetyka, w tym monosomia 7).
W analizach podgrup wiekowych zaobserwowano zwiększenie mediany całkowitego czasu przeżycia dla wszystkich grup (< 65 lat, ≥ 65 lat i ≥ 75 lat).
Leczenie azacytydyną było związane z medianą czasu do zgonu lub transformacji w AML wynoszącą 13,0 miesięcy, wobec 7,6 miesiąca w przypadku pacjentów otrzymujących leczenie CCR; poprawa wynosiła 5,4 miesiąca z wartością p wynoszącą 0,0025 w stratyfikowanym teście log-rank.
Leczenie azacytydyną było również związane ze zmniejszeniem częstości występowania cytopenii i związanych z nimi objawów. Leczenie azacytydyną prowadziło do obniżenia potrzeby przetoczeń czerwonych krwinek (ang. red blood cells, RBC) i płytek krwi. Spośród pacjentów w grupie otrzymującej azacytydynę, zależnych od przetoczeń czerwonych krwinek na początku badania, 45,0% uniezależniło się od przetoczeń czerwonych krwinek podczas okresu leczenia, w porównaniu z 11,4% pacjentów w złożonej grupie leczonej CCR (statystycznie istotna (p < 0,0001) różnica wynosząca 33,6
% (95 % CI: 22,4; 44,6)). U pacjentów, którzy na początku badania byli zależni od przetoczeń czerwonych krwinek i uniezależnili się od nich, mediana czasu trwania niezależności od przetoczeń czerwonych krwinek, w grupie otrzymującej azacytydynę wynosiła 13 miesięcy.
Odpowiedź była oceniana przez badacza lub niezależną komisję rewizyjną (ang. Independent Review Committee, IRC). Odpowiedź ogółem (remisja całkowita [ang. complete remission, CR] + remisja częściowa [ang. partial remission, PR]) według ustaleń badacza wynosiła 29 % w grupie otrzymującej azacytydynę i 12 % w złożonej grupie leczonej CCR (p = 0,0001). Odpowiedź ogółem (CR + PR) według ustaleń IRC w badaniu AZA PH GL 2003 CL 001 wynosiła 7 % (12/179) w grupie otrzymującej azacytydynę w porównaniu z 1 % (2/179) w złożonej grupie leczonej CCR (p = 0,0113). Różnice między oceną odpowiedzi przez IRC i badacza wynikały z kryteriów Międzynarodowej Grupy Roboczej (ang. International Working Group, IWG), według których wymagana jest poprawa morfologii krwi obwodowej i utrzymanie poprawy przez co najmniej 56 dni. Korzyści odnośnie czasu przeżycia wykazano również u pacjentów, którzy nie uzyskali całkowitej/częściowej odpowiedzi po leczeniu azacytydyną. Poprawa hematologiczna (większa lub mniejsza) według ustaleń IRC była uzyskana u 49 % pacjentów otrzymujących azacytydynę w porównaniu z 29 % pacjentów w złożonej grupie leczonej CCR (p < 0,0001).
U pacjentów z jedną lub kilkoma nieprawidłowościami cytogenetycznymi na początku badania, procent pacjentów z większą odpowiedzią cytogenetyczną był podobny w grupie otrzymującej azacytydynę i w złożonej grupie leczonej CCR. Mniejsza odpowiedź cytogenetyczna była statystycznie istotnie (p = 0,0015) wyższa w grupie otrzymującej azacytydynę (34 %) w porównaniu ze złożoną grupą leczoną CCR (10 %).
Dorośli pacjenci w wieku 65 lat lub powyżej z AML z > 30 % blastów w szpiku Przedstawione poniżej wyniki dotyczą populacji ITT badania AZA-AML-001 (zatwierdzone wskazania znajdują się w punkcie 4.1).
Skuteczność oraz bezpieczeństwo stosowania azacytydyny oceniono w międzynarodowym, wieloośrodkowym, kontrolowanym, otwartym badaniu klinicznym fazy 3. z grupami równoległymi, w grupie pacjentów w wieku 65 lat lub powyżej z noworozpoznaną pierwotną lub wtórną AML z > 30% blastów w szpiku zgodnie z klasyfikacją WHO, niekwalifikujących się do przeszczepienia krwiotwórczych komórek macierzystych. Azacytydyna z BSC (n = 241) porównywano z CCR. CCR zawierającego tylko BSC (n = 45), z cytarabiną w małych dawkach z BSC (n = 158) lub ze standardową intensywną chemioterapią złożoną z cytarabiny i antracykliny oraz BSC (n = 44). Przed randomizacją pacjenci byli wstępnie przydzielani przez lekarza prowadzącego do jednej z 3 metod CCR. Pacjenci, którzy nie zostali przydzieleni losowo do grupy otrzymującej azacytydynę,
otrzymywali leczenie wstępnie wybrane przez lekarza prowadzącego. Wśród kryteriów włączenia były wymagania, by stan pacjentów wg ECOG był w zakresie 0 do 2 oraz aby ryzyko wynikające z nieprawidłowości cytogenetycznych było umiarkowane lub duże. Pierwszorzędowym parametrem końcowym badania była przeżywalność ogółem.
Azacytydyna była podawana podskórnie w dawce 75 mg/m2 pc. na dobę przez 7 dni, po czym następował okres odpoczynku trwający 21 dni (28-dniowy cykl leczenia), przez medianę 6 cykli (zakres 1 do 28), u pacjentów z grupy wyłącznie BSC medianę 3 cykli (zakres 1 do 20), u pacjentów otrzymujących cytarabinę w małych dawkach medianę 4 cykli (zakres 1 do 25) oraz u pacjentów otrzymujących standardową intensywną chemioterapię medianę 2 cykli (zakres 1 do 3, cykl indukcyjny plus 1 lub 2 cykle konsolidacyjne).
Indywidualne parametry początkowe były porównywalne między grupą otrzymującą azacytydynę a grupami CCR. Mediana wieku pacjentów wynosiła 75,0 lat (zakres 64 do 91 lat), 75,2 % było rasy kaukaskiej, 59,0 % stanowili mężczyźni. Na początku badania, u 60,7 % pacjentów stwierdzono bliżej nieokreśloną AML, u 32,4 % AML ze zmianami mielodysplastycznymi, u 4,1 % nowotwory szpiku związane z leczeniem, natomiast u 2,9 % AML z nawracającymi nieprawidłowościami genetycznymi, zgodnie z klasyfikacją WHO.
W analizie ITT 488 pacjentów (241 otrzymujących azacytydynę oraz 247 otrzymujących CCR), leczenie azacytydyną było związane z medianą przeżywalności wynoszącą 10,4 miesiąca w porównaniu z 6,5 miesiąca w przypadku pacjentów otrzymujących CCR, czyli różnica wynosiła 3,8 miesiąca, z wartością p wynoszącą 0,1009 w stratyfikowanym teście log-rank (dwustronnie).
Współczynnik ryzyka dla efektu leczenia wynosił 0,85 (95 % CI: 0,69; 1,03). Wskaźnik rocznego przeżycia wynosił 46,5 % dla pacjentów otrzymujących azacytydynę wobec 34,3 % dla pacjentów otrzymujących CCR.
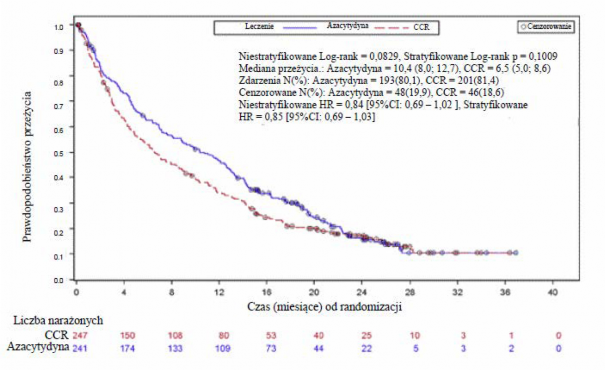
Model hazardu proporcjonalnego Cox’a adjustowany dla predefiniowanych na wejściu czynników prognostycznych określił wskaźnik ryzyka dla azacytydyny wobec CCR na poziomie 0,80 (95 % CI: 0,66; 0,99; p = 0,0355).
Ponadto, pomimo tego, że badanie nie wykazało statystycznie istotnej różnicy pomiędzy grupą azacytydyny a wybranymi wstępnie grupami CCR, czas przeżycia pacjentów leczonych azacytydyną był dłuższy w porównaniu do wariantów CCR, wyłącznie BSC, cytarabiny w małych dawkach z BSC oraz porównywalny do standardowej, intensywnej chemioterapii z BSC.
We wszystkich określonych przed rozpoczęciem badania podgrupach [(wiek < 75 lat oraz ≥ 75 lat), płeć, rasa, wynik w skali ECOG (0, 1 lub 2), wyjściowe ryzyko cytogenetyczne (umiarkowane lub duże), region geograficzny, klasyfikacja AML wg WHO (w tym AML ze zmianami mielodysplastycznymi), początkowa liczba białych krwinek (≤ 5 × 109/l lub > 5 × 109/l), początkowy odsetek blastów w szpiku (≤ 50 % lub > 50 %) i MDS w wywiadzie] obserwowano tendencję do większej korzyści w odniesieniu do przeżywalności ogółem w grupie otrzymującej azacytydynę. W kilku predefiniowanych grupach współczynnik ryzyka przeżywalności ogółem osiągnął wartość istotną statystycznie, w tym u pacjentów z dużym ryzykiem cytogenetycznym, pacjentów z AML ze zmianami mielodysplastycznymi, pacjentów w wieku < 75 lat, u kobiet oraz u pacjentów rasy białej.
Odpowiedzi hematologiczna oraz cytogenetyczna były podobnie oceniane przez badacza oraz IRC. Współczynnik odpowiedzi ogółem (remisja całkowita [CR] i remisja całkowita z niepełną regeneracją morfologii krwi [CRi]) określony przez IRC wynosił 27,8 % w grupie otrzymującej azacytydynę oraz 25,1 % w złożonej grupie CCR (p = 0,5384). U pacjentów, którzy osiągnęli CR lub CRi, mediana trwania remisji wynosiła 10,4 miesiąca (95 % CI = 7,2; 15,2) u pacjentów otrzymujących azacytydynę oraz 12,3 miesiąca (95 % CI = 9,0; 17,0) u pacjentów otrzymujących CCR. Korzyści odnośnie czasu przeżycia wykazano również u pacjentów, którzy nie uzyskali całkowitej odpowiedzi po leczeniu azacytydyną w porównaniu do CCR.
Leczenie azacytydyną wpływało na poprawę wyników morfologii krwi obwodowej oraz prowadziło do obniżenia potrzeby przetoczeń czerwonych krwinek i płytek krwi. Pacjenta określano jako zależnego od przetoczeń czerwonych krwinek lub płytek krwi na początku badania, podlegał jednemu przetoczeniu lub więcej przetoczeniom czerwonych krwinek lub płytek krwi w ciągu 56 dni (8 tygodni) przed randomizacją. Pacjenta określano jako niezależnego od przetoczeń czerwonych krwinek lub płytek krwi w okresie leczenia, jeśli u pacjenta nie przeprowadzono żadnego przetoczenia czerwonych krwinek lub płytek krwi w okresie 56 dni.
Spośród pacjentów w grupie otrzymującej azacytydyną zależnych od przetoczeń czerwonych krwinek na początku badania, 38,5 % (95 % CI = 31,1; 46,2) uniezależniło się od przetoczeń czerwonych krwinek podczas okresu leczenia, w porównaniu z 27,6 % (95 % CI = 20,9; 35,1) pacjentów w złożonej grupie CCR. U pacjentów, którzy na początku badania byli zależni od przetoczeń czerwonych krwinek i uniezależnili się od nich podczas leczenia, mediana czasu trwania niezależności od przetoczeń czerwonych krwinek w grupie otrzymującej azacytydynę wynosiła 13,9 miesiąca, a nie została osiągnięta w grupie CCR.
Spośród pacjentów w grupie otrzymującej azacytydynę, zależnych od przetoczeń płytek krwi na początku badania, 40,6 % (95 % CI = 30,9; 50,8) uniezależniło się od przetoczeń płytek krwi podczas okresu leczenia, w porównaniu z 29,3 % (95 % CI = 19,7; 40,4) pacjentów w złożonej grupie leczonej CCR. U pacjentów, którzy na początku badania byli zależni od przetoczeń płytek krwi i uniezależnili się od nich podczas leczenia, mediana czasu trwania niezależności od przetoczeń płytek krwi, w grupie otrzymującej azacytydynę wynosiła 10,8 miesiąca oraz 19,2 miesiąca w grupie CCR.
Zależna od zdrowia jakość życia (ang. Health-Related Quality of Life, HRQoL) została oceniona za pomocą kwestionariusza European Organization for Research and Treatment of Cancer Core Quality of Life Questionnaire (EORTC QLQ-C30). Dane dotyczące HRQoL mogą być analizowane dla części lub całej populacji objętej badaniem. Pomimo ograniczeń analizy, z dostępnych danych wynika, że pacjenci nie doświadczają znaczącego pogorszenia jakości życia podczas leczenia azacytydyną.
Wchłanianie
Azacytydyna była szybko wchłaniana po pojedynczym podaniu podskórnym dawki 75 mg/m2 pc. z maksymalnymi stężeniami w osoczu wynoszącymi 750 ng/ml ± 403 ng/ml występującymi 0,5 h po podaniu dawki (pierwszy punkt pobierania próbek). Bezwzględna dostępność biologiczna azacytydyny po podaniu podskórnym względem podania dożylnego (pojedyncze dawki 75 mg/m2 pc.) wynosiła około 89 % w oparciu o pole pod krzywą (ang. area under the curve, AUC).
Pole powierzchni pod krzywą oraz maksymalne stężenie w osoczu (Cmax) po podaniu podskórnym azacytydyny były w przybliżeniu proporcjonalne w zakresie dawek od 25 do 100 mg/m2 pc.
Dystrybucja
Po dożylnym podaniu dawki średnia objętość dystrybucji wynosiła 76 l ± 26 l, a klirens układowy wynosił 147 l/h ± 47 l/h.
Metabolizm
W oparciu o dane z badań in vitro, nie wydaje się, by w metabolizmie azacytydyny uczestniczyły izoenzymy cytochromu P450 (CYP), UDP-glukuronozylotransferazy (UGT), sulfotransferazy (SULT) ani transferazy glutationowe (GST).
Azacytydyna ulega spontanicznej hydrolizie oraz deaminacji z udziałem deaminazy cytydynowej. W ludzkich frakcjach wątrobowych S9, tworzenie metabolitów było niezależne od NADPH, co wskazuje, że w metabolizmie azacytydyny nie uczestniczą izoenzymy cytochromu P450. Badanie in vitro azacytydyny z hodowlami ludzkich hepatocytów wskazało, że przy stężeniach od 1,0 µM do 100 µM (tzn. do około 30-krotnie większych niż stężenia osiągane klinicznie), azacytydyna nie indukuje CYP 1A2, 2C19 ani 3A4 lub 3A5. W badaniach mających na celu ocenę hamowania szeregu izoenzymów P450 (CYP 1A2, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 i 3A4) azacytydyna w stężeniu do 100 µM nie powodowała ich hamowania. Dlatego indukcja lub hamowanie enzymu CYP przez azacytydynę w stężeniach klinicznie osiągalnych w osoczu jest mało prawdopodobne.
Eliminacja
Azacytydyna jest szybko usuwana z osocza ze średnim okresem półtrwania w fazie eliminacji (t½) po podaniu podskórnym wynoszącym 41 ± 8 minut. Przy podskórnym podawaniu azacytydyny w dawce 75 mg/m2 raz na dobę przez 7 dni nie występuje kumulacja. Wydalanie z moczem jest główną drogą eliminacji azacytydyny i (lub) jej metabolitów. Po podaniu dożylnym i podskórnym 14C-azacytydyny, odpowiednio 85 i 50 % podanej radioaktywności było wykrywane w moczu, podczas gdy < 1 % było wykrywane w kale.
Szczególne grupy pacjentów
Nie badano formalnie wpływu niewydolności wątroby (patrz punkt 4.2), płci, wieku ani rasy na farmakokinetykę azacytydyny.
Niewydolność nerek
Niewydolność nerek nie ma istotnego wpływu na ekspozycję na azacytydynę po pojedynczym ani wielokrotnym podaniu podskórnym. Po podaniu podskórnym pojedynczej dawki 75 mg/m2 pc., średnie wartości ekspozycji (AUC oraz Cmax) u pacjentów z łagodną, umiarkowaną oraz ciężką niewydolnością nerek zwiększyły się o odpowiednio od 11 % do 21 %, od 15 % do 27 % oraz od 41 % do 66 %, w porównaniu do pacjentów z prawidłową czynnością nerek. Jednakże ekspozycja mieściła się w zakresie wartości obserwowanych u pacjentów z prawidłową czynnością nerek. Azacytydyna może być podawana pacjentom z niewydolnością nerek bez początkowego dostosowania dawki, pod warunkiem obserwacji pacjentów w celu wykrycia toksyczności, ponieważ azacytydyna i (lub) jej metabolity są wydalane głównie przez nerki.
Farmakogenomika
Nie badano formalnie wpływu znanych polimorfizmów deaminazy cytydynowej na metabolizm azacytydyny.
Azacytydyna indukuje mutacje genów i aberracje chromosomowe w układach komórkowych in vitro
bakterii i ssaków. Potencjalne działanie rakotwórcze było oceniane na myszach i szczurach. Azacytydyna wywoływała powstawanie nowotworów układu krwiotwórczego u samic myszy po podawaniu dootrzewnowym 3 razy na tydzień przez 52 tygodnie. U myszy, którym podawano azacytydynę dootrzewnowo przez 50 tygodni, obserwowano zwiększoną częstość występowania
guzów w układzie chłonno-siateczkowym, płucach, sutkach i skórze. Badanie zdolności rakotwórczej na szczurach wykazało zwiększoną częstość występowania guzów jądra.
Badania wczesnej embriotoksyczności wykazały częstość występowania wewnątrzmacicznej śmierci płodu wynoszącą 44 % (zwiększona resorpcja) po pojedynczym wstrzyknięciu dootrzewnowym azacytydyny podczas organogenezy. U myszy, którym podano azacytydynę podczas lub przed zamknięciem podniebienia twardego wykryto nieprawidłowości rozwojowe w mózgu. U szczurów azacytydyna nie powodowała działań niepożądanych, gdy była podawana przed implantacją, ale była wyraźnie embriotoksyczna, gdy była podawana podczas organogenezy. Nieprawidłowości płodu podczas organogenezy u szczurów obejmowały: nieprawidłowości OUN (egzencefalia / przepuklina mózgowa), anomalie kończyn (mikromelia, stopa zdeformowana, syndaktylia, oligodaktylia) i inne (mikroftalmia, mikrognatia, wytrzewienie, obrzęk i nieprawidłowości dotyczące żeber).
Podanie azacytydyny samcom myszy przed kopulacją z samicami myszy nienarażonymi na działanie azacytydyny prowadziło do obniżonej płodności i utraty potomstwa podczas późniejszego rozwoju płodowego i pourodzeniowego. Podanie azacytydyny samcom szczurów prowadziło do utraty masy jąder i najądrza, obniżonej liczby plemników, obniżonego współczynnika ciąż, zwiększenia liczby płodów nieprawidłowych i zwiększonej liczby straconych płodów przez pokryte samice (patrz punkt 4.4).
Mannitol
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 6.6.
Nieotwarta fiolka z proszkiem: 3 lata.
Po przygotowaniu:
Dla roztworu azacytydyny przygotowanego w nieschłodzonej wodzie do wstrzykiwań wykazano chemiczną i fizyczną stabilność użytkową przygotowanego produktu leczniczego przez 45 minut w temperaturze 25 °C i przez 8 godzin w temperaturze 2°C do 8°C.
Okres ważności przygotowanego produktu leczniczego może zostać wydłużony poprzez rozpuszczenie produktu z wykorzystaniem schłodzonej (2°C do 8°C) wody do wstrzykiwań. Dla roztworu azacytydyny przygotowanego w schłodzonej (2°C do 8°C) wodzie do wstrzykiwań wykazano chemiczną i fizyczną stabilność użytkową przygotowanego produktu leczniczego przez 32 godziny w temperaturze 2°C do 8°C.
Ze względów mikrobiologicznych przygotowany produkt należy użyć natychmiast. Jeśli produkt nie został zużyty natychmiast, użytkownik jest odpowiedzialny za okres użycia i warunki przechowywania przed użyciem, które nie mogą być dłuższe niż 8 godzin w temperaturze 2°C do 8°C dla produktu przygotowanego w nieschłodzonej wodzie do wstrzykiwań lub 32 godziny dla produktu przygotowanego w schłodzonej (2°C do 8°C) wodzie do wstrzykiwań.
Nieotwarte fiolki
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Przygotowana zawiesina
Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt 6.3.
Fiolka z bezbarwnego szkła typu I zamknięta korkiem z gumy bromobutylowej powlekanym ETFE (wierzch korka powlekany dodatkowo polimeryzowanym silikonem RB2-40) i aluminiowym uszczelnieniem (białym dla 100 mg i pomarańczowym dla 150 mg).
Wielkość opakowania:
1 fiolka zawierająca 100 mg azacytydyny.
1 fiolka zawierająca 150 mg azacytydyny.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Zalecenia dotyczące bezpiecznego postępowania
Azacytydyna jest cytotoksycznym produktem leczniczym i, jak w przypadku innych potencjalnie toksycznych związków, należy zachować ostrożność podczas sporządzania i obchodzenia się z zawiesiną azacytydyny. Należy stosować się do procedur właściwego obchodzenia się i usuwania przeciwnowotworowych produktów leczniczych.
W przypadku styczności przygotowanej azacytydyny ze skórą, należy ją natychmiast dokładnie przemyć wodą z mydłem. W przypadku kontaktu z błonami śluzowymi, należy je dokładnie przepłukać wodą.
Kobiety w ciąży należące do personelu medycznego nie powinny przygotowywać tego produktu leczniczego.
Procedura przygotowania
Azacytydyna powinna zostać poddana rekonstytucji w wodzie do wstrzykiwań. Okres ważności przygotowanego produktu leczniczego może zostać wydłużony poprzez rekonstytucję produktu z wykorzystaniem schłodzonej (2 °C do 8 °C) wody do wstrzykiwań. Szczegóły dotyczące przechowywania przygotowanego produktu zostały podane w punkcie 6.3.
Dawki większe niż 4 ml należy wstrzykiwać w dwa różne miejsca.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Należy zmieniać miejsca wstrzyknięcia. Nowe wstrzyknięcia należy podawać przynajmniej 2,5 cm od poprzedniego miejsca i nigdy nie wstrzykiwać w miejsca drażliwe, zasiniaczone, zaczerwienione lub stwardniałe.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
G.L. Pharma GmbH Schlossplatz 1
8502 Lannach
Austria
Pozwolenie nr:
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











