Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Obrzęk mózgu wywołany guzem mózgu, interwencją neurochirurgiczną, ropniem mózgu, bakteryjnym zapaleniem opon mózgowych
Wstrząs pourazowy i zapobieganie zespołowi pourazowej ostrej niewydolności oddechowej
(ARDS)
Choroba wywołana przez koronawirusa 2019 (COVID-19)
Leczenie COVID-19 u pacjentów dorosłych i młodzieży (w wieku 12 lat i starszych, o masie ciała wynoszącej co najmniej 40 kg), wymagających tlenoterapii.
Wstrząs anafilaktyczny (spowodowany początkowym podaniem epinefryny)
Ciężki ostry napad astmy
Początkowy etap pozajelitowego leczenia rozległych, ostrych chorób skóry o ciężkim przebiegu, takich jak erytrodermia, pęcherzyca zwykła, ostra egzema
Początkowy etap pozajelitowego leczenia chorób autoimmunologicznych, takich jak układowy toczeń rumieniowaty (zwłaszcza jego postacie trzewne)
Ciężki postępujący przebieg aktywnego reumatoidalnego zapalenia stawów, np. szybko postępujące destrukcyjne postacie choroby i (lub) objawy pozastawowe
Ciężkie choroby zakaźne ze stanami toksycznymi (np. gruźlica, dur brzuszny, bruceloza) tylko z odpowiednią terapią przeciwinfekcyjną
Leczenie paliatywne nowotworów złośliwych
Profilaktyka i leczenie wymiotów pooperacyjnych lub wywołanych stosowaniem cytostatyków, w ramach terapii przeciwwymiotnej
Podanie podskórne
Leczenie paliatywne nowotworów złośliwych, zapobieganie i leczenie nudności i wymiotów wywołanych chemioterapią (CINV)
W opiece paliatywnej, u pacjentów otrzymujących kortykosteroidy z powodu takich objawów, jak zmęczenie, anoreksja, oporne na leczenie nudności i wymioty lub leczenie uzupełniające
przeciwbólowe i objawowe leczenie ucisku pępowiny lub podwyższonego ciśnienia
wewnątrzczaszkowego, produkt leczniczy Dexamethasone hameln można podawać podskórnie (patrz punkt 4.2) jako alternatywę do podania doustnego, gdy jest ono niedopuszczalne lub już niemożliwe.
Podanie miejscowe
wstrzyknięcie dostawowe: utrzymujące się zapalenie jednego lub kilku stawów po leczeniu ogólnoustrojowym przewlekłych chorób zapalnych stawów, aktywna choroba
zwyrodnieniowa stawów (w fazie postępu), ostre postaci zespołu bolesnego barku;
podanie nasiękowe (tylko, gdy jest to ściśle wskazane): niebakteryjne zapalenie pochewki ścięgnistej i zapalenie kaletki maziowej, zapalenie okołostawowe, zaburzenia ścięgien obejmujące przyczepy ścięgien;
Dawkowanie i sposób podawania
Obrzęk mózgu
Dawka początkowa 8-10 mg (do 80 mg) dożylnie, następnie podaje się 16-24 mg (do 48 mg)/na dobę dożylnie w 3-4 (6) pojedynczych dawkach przez 4-8 dni. W przypadku naświetlań lub
leczenia zachowawczego nieoperacyjnego guza mózgu może być potrzebne dłuższe podawanie mniejszych dawek produktu leczniczego.
Obrzęk mózgu wywołany bakteryjnym zapaleniem opon mózgowych: 0,15 mg/kg masy ciała co 6 godzin, przez 4 dni
Wstrząs pourazowy i zapobieganie zespołowi pourazowej ostrej niewydolności oddechowej ARDS
Dawka początkowa 40-100 mg dożylnie powtórzona po 12 godzinach. Alternatywnie 16- 40 mg co 6 godzin przez 2-3 dni.
Leczenie COVID-19
6 mg dożylnie raz na dobę przez maksymalnie 10 dni. Czas trwania leczenia powinien zależeć od odpowiedzi klinicznej i indywidualnych wymagań pacjenta.
Pacjenci w podeszłym wieku, pacjenci z zaburzeniami czynności nerek, pacjenci z zaburzeniami czynności wątroby: nie ma konieczności dostosowywania dawki.
Wstrząs anafilaktyczny
40-100 mg dożylnie po początkowym dożylnym wstrzyknięciu epinefryny. W razie potrzeby dawkę można powtórzyć.
Ciężki ostry napad astmy
8-20 mg dożylnie, podane w możliwie najkrótszym czasie. W razie potrzeby podanie można powtórzyć w dawce 8 mg co 4 godziny. Dodatkowo można podawać aminofilinę dożylnie.
Ostre choroby skóry
Dobowa dawka 8-40 mg dożylnie, w indywidualnych przypadkach do 100 mg, a następnie leczenie doustne w zmniejszających się dawkach.
Aktywna faza układowych chorób reumatycznych, taka jak układowy toczeń rumieniowaty
6-16 mg na dobę.
Aktywne reumatoidalne zapalenie stawów o ciężkim, postępującym przebiegu
12-16 mg na dobę w leczeniu w szybko postępującej postaci choroby. W przypadku wystąpienia objawów pozastawowych zaleca się stosowanie 6-12 mg na dobę.
Ciężkie choroby zakaźne z objawami zatrucia (np. gruźlica, dur brzuszny) wyłącznie w połączeniu z terapią przeciwinfekcyjną)
4-20 mg dożylnie na dobę. W pojedynczych przypadkach (np. tyfus) początkowo w dawce do 200 mg.
Leczenie paliatywne nowotworów złośliwych
Początkowo 8-16 mg/dobę, w przypadku długotrwałej terapii, 4-12 mg/dobę.
Profilaktyka i leczenie wymiotów wywołanych stosowaniem cytostatyków w ramach terapii przeciwwymiotnej
10-20 mg dożylnie przed rozpoczęciem chemioterapii, a następnie, w razie potrzeby 2 do 3 razy na dobę 4-8 mg przez 1-3 dni (chemioterapia umiarkowanie emetogenna) lub do 6 dni (chemioterapia wysoce emetogenna).
Profilaktyka i leczenie wymiotów pooperacyjnych
Dawka pojedyncza 8-20 mg dożylnie przed rozpoczęciem operacji
Podanie podskórne
Leczenie paliatywne nowotworów złośliwych, zapobieganie i leczenie nudności i wymiotów wywołanych chemioterapią (CINV)
W opiece paliatywnej Dexamethasone hameln można podawać podskórnie we wstrzyknięciu lub w ciągłej infuzji podskórnej (ang. Continuous Subcutaneous Infusion, CSCI). Dawki zwykle mieszczą się w zakresie od 4,8 mg do 19,3 mg w ciągu 24 godzin, biorąc pod uwagę lokalne wytyczne kliniczne, i należy je dostosowywać w zależności od stanu pacjenta.
Dzieci i młodzież
Obrzęk mózgu wywołany bakteryjnym zapaleniem opon mózgowych
0,4 mg/kg masy ciała u dzieci co 12 godzin przez 2 dni, zaczynając przed podaniem pierwszej dawki antybiotyku.
Wstrząs pourazowy i zapobieganie zespołowi pourazowej ostrej niewydolności oddechowej ARDS
U dzieci dawka początkowa 40 mg dożylnie powtórzona po 12 godzinach.
Leczenie COVID-19
U młodzieży (w wieku 12 lat i starszych) zaleca się stosowanie 6 mg na dawkę dożylnie raz na dobę, przez maksymalnie 10 dni.
Czas trwania leczenia powinien zależeć od odpowiedzi klinicznej i indywidualnych wymagań pacjenta.
Wstrząs anafilaktyczny
40 mg dożylnie po początkowym dożylnym wstrzyknięciu epinefryny, w razie potrzeby dawkę można powtórzyć.
Ciężki ostry napad astmy
0,15-0,3 mg/kg masy ciała dożylnie lub 1,2 mg/kg masy ciała w bolusie, następnie 0,3 mg/kg co 4-6 godzin. Dodatkowo można podawać aminofilinę dożylnie.
Profilaktyka i leczenie wymiotów pooperacyjnych
0,15-0,5mg/kg masy ciała u dzieci powyżej dwóch lat, maksymalnie do 16 mg.
Produktu leczniczego Dexamethasone hameln nie zaleca się stosować generalnie u wcześniaków lub noworodków urodzonych w terminie (patrz punkty 2 i 4.4).
Produkt leczniczy Dexamethasone hameln zawiera glikol propylenowy (20 mg na ml), dlatego należy stosować ostrożnie u niemowląt i dzieci w wieku poniżej 5 lat, zwłaszcza jeśli wymagane są duże dawki lub zalecane jest długotrwałe leczenie (patrz punkty 2 i 4.4).
Podanie miejscowe
Zwykle zalecana dawka w przypadku podania nasiękowego lub podawania dostawowego wynosi 4-8 mg. Dawka 2 mg jest zazwyczaj wystarczająca w przypadku wstrzyknięcia do małego stawu.
Pacjenci z zaburzeniami czynności wątroby i zaburzeniami czynności nerek
Ze względu na zawartość glikolu propylenowego konieczna jest obserwacja pacjentów z zaburzeniami czynności wątroby lub nerek (patrz punkt 2 i 4.4).
W przypadku niedoczynności tarczycy lub marskości wątroby małe dawki mogą być wystarczające lub może być konieczne zmniejszenie dawki.
Sposób podawania
Czas trwania podawania zależy od wskazania.
Dexamethasone hameln można być podawany bez mieszania lub rozcieńczania. Podanie dożylne, domięśniowe, dostawowe lub nasiękowo.
Alternatywnie, Dexamethasone hameln można dodać, bez utraty mocy, do 0,9% sodu chlorku, 5% glukozy lub roztworu Ringera i podać we wlewie dożylnym:
w sposób ciągły lub przerywany lub w kroplówce u dorosłych
powyżej 15 - 20 minut u dzieci.
W opiece paliatywnej produkt Dexamethasone hameln może być rozcieńczony 0,9% roztworem chlorku sodu i podawany w ciągłej infuzji podskórnej (CSCI).
Mieszaniny do infuzji należy zużyć w ciągu 24 godzin i należy przestrzegać zwykłych technik aseptycznych stosowanych przy wstrzyknięciach.
Wstrzyknięcie dostawowe należy przeprowadzać wyłącznie w warunkach jałowych. Pojedyncze wstrzyknięcie dostawowe jest na ogół wystarczające do skutecznego złagodzenia objawów. Jeśli konieczne okaże się kolejne wstrzyknięcie, nie należy go podawać wcześniej niż po 3-4 tygodniach. Ilość wstrzyknięć do jednego stawu powinna być ograniczona do 3-4 razy. Wskazane jest badanie lekarskie stawów, szczególnie po wielokrotnych wstrzyknięciach.
Podanie nasiękowe należy przeprowadzić z rygorystycznym zachowaniem warunków jałowych w okolice najbardziej bolesne lub okolice przyczepów ścięgna. Należy zachować ostrożność, aby nie wykonywać wstrzyknięcia bezpośrednio w ścięgno. Należy unikać wykonywania wstrzyknięć w krótkich odstępach czasu.
Jeśli konieczne jest podawanie dużych dawek jednorazowo, należy rozważyć zastosowanie produktu leczniczego zawierającego deksametazon o większej mocy na jednostkę objętości.
Instrukcja dotycząca rozcieńczania produktu leczniczego przed podaniem, patrz punkt 6.6.
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Wstrzyknięcie dostawowe: zakażenie w obrębie stawu lub w bezpośrednim sąsiedztwie
leczonego stawu, bakteryjne zapalenie stawów, niestabilność stawu, zaburzenia krwawienia (samoistne lub spowodowane przez leki przeciwzakrzepowe), zwapnienia okołostawowe, pozanaczyniowa martwica kości, zerwanie ścięgna, staw Charcota.
Podanie nasiękowe: bez dodatkowego leczenia przyczynowego w przypadku występowania zakażeń w miejscu podania.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Ostre zakażenia wirusowe (wirusowe zapalenie wątroby typu B, Herpes zoster, Herpes simplex, ospa wietrzna, opryszczkowe zapalenie rogówki),
Przewlekłe aktywne zapalenie wątroby z obecnością antygenu HbsAg,
Od około 8 tygodni przed i do 2 tygodni po szczepieniu z użyciem żywej szczepionki,
Ogólnoustrojowe zakażenia grzybiczne
Parazytozy (np. nicienie)
U pacjentów ze diagnozowaną lub podejrzewaną węgorczycą (zarażenie owsikami), leczenie glikokortykosteroidami może prowadzić do aktywacji i masywnego namnażania tych pasożytów,
Poliomyelitis
Zapalenie węzłów chłonnych po szczepieniu BCG
Ostre i przewlekłe zakażenia bakteryjne
W przypadku przebytej gruźlicy stosować tylko pod osłoną leków przeciwgruźliczych.
Ponadto leczenie produktem Dexamethasone hameln powinno być brane pod uwagę wtedy, gdy jest to absolutnie konieczne, przy zastosowaniu dodatkowego specyficznego sposobu leczenia w przypadku:
Wrzodów układu pokarmowego
Osteoporozy
Ciężkiej niewydolności serca
Nieuregulowanego nadciśnienia tętniczego
Nieuregulowanej cukrzycy
Zaburzeń psychicznych (także w wywiadzie), w tym myśli samobójczych: zalecany jest nadzór neurologa lub psychiatry.
Jaskry zamkniętego kąta i jaskry otwartego kąta: zalecana jest jednoczesna terapia i kontrola okulistyczna.
Owrzodzeń i uszkodzeń rogówki: zalecana jest jednoczesna terapia i kontrola okulistyczna.
Zaburzenia widzenia
Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania glikokortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy, jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn. Może należeć do nich zaćma, jaskra lub rzadkie choroby, takie jak centralna
chorioretinopatia surowicza (CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu glikokortykosteroidów.
Ze względu na ryzyko perforacji jelita produkt Dexamethasone hameln może być stosowany tylko w razie zdecydowanej konieczności, a w przypadku wystąpienia następujących stanów jednoczesnych należy zapewnić staranne monitorowanie:
ciężkiego wrzodziejącego zapalenia jelita grubego z ryzykiem perforacji, możliwego nawet bez podrażnienia otrzewnej,
zapalenia uchyłków,
zespolenia jelitowo-jelitowego (bezpośrednio po zabiegu).
Oznaki podrażnienia otrzewnej po perforacji żołądkowo-jelitowej mogą nie wystąpić u pacjentów otrzymujących duże dawki glikokortykosteroidów.
Podczas podawania produktu Dexamethasone hameln pacjentom z cukrzycą należy wziąć pod uwagę większe zapotrzebowanie na insulinę lub doustne leki przeciwcukrzycowe.
Podczas leczenia produktem Dexamethasone hameln konieczna jest regularna kontrola ciśnienia krwi, zwłaszcza podczas podawania dużych dawek oraz u pacjentów z nieuregulowanym nadciśnieniem
tętniczym.
Ze względu na ryzyko zaostrzenia objawów choroby pacjenci z ciężką niewydolnością serca muszą pozostawać pod uważną obserwacją.
U pacjentów leczonych dużymi dawkami deksametazonu może wystąpić bradykardia. Mogą wystąpić ciężkie reakcje anafilaktyczne.
Ryzyko wystąpienia tendinopatii, zapalenia ścięgna i zerwania ścięgna zwiększa się u pacjentów leczonych jednocześnie glikokortykosteroidami i fluorochinolonami.
Myasthenia gravis obecna przed rozpoczęciem leczenia produktem leczniczym Dexamethasone hameln może ulec zaostrzeniu.
Zasadniczo można wykonywać szczepienia z użyciem szczepionek inaktywowanych (zawierających zabite drobnoustroje). Jednakże należy pamiętać, że w przypadku podawania wyższych dawek kortykosteroidów odpowiedź immunologiczna i w konsekwencji skuteczność szczepionki może być osłabiona.
W przypadku stosowania dużych dawek należy zapewnić odpowiednią podaż potasu i ograniczyć ilość sodu przyjmowanego przez pacjenta. Należy monitorować stężenie potasu w surowicy.
Przewiduje się, że jednoczesne leczenie inhibitorami CYP3A, w tym produktami zawierającymi kobicystat, zwiększy ryzyko wystąpienia ogólnoustrojowych działań niepożądanych. Należy unikać takiego połączenia, chyba że korzyści przewyższają zwiększone ryzyko wystąpienia ogólnoustrojowych działań niepożądanych kortykosteroidów, w przypadku jednoczesnego
zastosowania pacjenci powinni być monitorowani pod kątem ogólnoustrojowych działań niepożądanych kortykosteroidów.
Nagłe odstawienie produktu leczniczego Dexamethasone hameln po około 10 dniach stosowania może prowadzić do zaostrzenia lub nawrotu choroby podstawowej, ostrej niewydolności kory nadnerczy i (lub) zespołu odstawienia kortyzonu. Z tego względu, jeśli stosowanie leku ma zostać przerwane, dawkę należy zmniejszać stopniowo.
U pacjentów leczonych glikokortykosteroidami przebieg niektórych chorób wirusowych, takich jak ospa wietrzna, odra, może być cięższy. Na szczególne ryzyko narażeni są pacjenci z obniżoną odpornością, którzy nie przechodzili ospy wietrznej lub odry. Jeśli podczas leczenia produktem
Dexamethasone hameln pacjenci tacy mają kontakt z osobami chorymi na ospę wietrzną lub odrę, należy w razie potrzeby zastosować u nich leczenie zapobiegawcze.
Po wprowadzeniu produktu leczniczego do obrotu zgłaszano przypadki zespołu rozpadu guza (TLS- tumour lysis syndrome). Dotyczyło to pacjentów z nowotworami układu krwiotwórczego, leczonych deksametazonem w monoterapii lub w skojarzeniu z innymi chemioterapeutykami. Należy podjąć odpowiednie środki ostrożności i ściśle kontrolować pacjentów z grupy dużego ryzyka zespołu rozpadu guza, do której należą pacjenci z wysokim indeksem proliferacyjnym, dużym rozmiarem guza oraz o dużej wrażliwości na leki cytotoksyczne.
W przypadku podawania dożylnego wstrzyknięcie powinno być podawane powoli, w ciągu 2-3 minut. Po zbyt szybkim podaniu mogą wystąpić krótkotrwałe i w zasadzie niegroźne działania niepożądane w postaci nieprzyjemnego mrowienia lub parestezji, trwające do 3 minut.
Produkt leczniczy Dexamethasone hameln jest przeznaczony do krótkotrwałego stosowania. W
przypadku niewłaściwego stosowania produktu przez długi czas, należy zapoznać się z dodatkowymi ostrzeżeniami i środkami ostrożności dotyczącymi długotrwałej terapii produktami leczniczymi
zawierającymi glikokortykosteroidy.
Po podaniu miejscowym należy wziąć pod uwagę możliwość wystąpienia działań niepożądanych i interakcji, jak w przypadku podania ogólnoustrojowego.
Podawanie dostawowe glikokortykosteroidów zwiększa ryzyko zakażeń stawów. Przedłużone i powtarzane stosowanie glikokortykosteroidów w obrębie obciążonych stawów może prowadzić do pogorszenia zmian degeneracyjnych stawów z powodu przeciążenia objętego chorobą stawu po ustąpieniu bólu lub innych objawów.
Dzieci i młodzież
Należy dokładnie ocenić stosunek korzyści do ryzyka wynikającego z leczenia Dexamethasone hameln u dzieci w fazie wzrostu.
Wcześniaki
Dostępne dane wskazują na występowanie długotrwałych zdarzeń niepożądanych wpływających na rozwój neurologiczny wcześniaków z przewlekłą chorobą płuc po rozpoczęciu wczesnego leczenia (<96 godzin) w dawce początkowej 0,25 mg/kg masy ciała dwa razy na dobę.
Kardiomiopatia przerostowa
Występowanie kardiomiopatii przerostowej notowano po ogólnoustrojowym podaniu niemowlętom przedwcześnie urodzonym kortykosteroidów, w tym deksametazonu. W większości zgłoszonych przypadków było to działanie przemijające po odstawieniu leku. U niemowląt przedwcześnie urodzonych leczonych ogólnoustrojowo deksametazonem, należy wykonać ocenę diagnostyczną i monitorować czynność i strukturę serca (patrz punkt 4.8).
Zawartość glikolu propylenowego
Dexamethasone hameln zawiera glikol propylenowy (20 mg na ml), dlatego należy stosować ostrożnie u niemowląt i dzieci w wieku poniżej 5 lat, zwłaszcza jeśli wymagane są duże dawki lub długotrwałe leczenie (patrz punkty 2 i 4.2).
Następujące grupy wiekowe dzieci są szczególnie narażone na ryzyko wystąpienia toksycznego działania glikolu propylenowego:
Noworodki (noworodki poniżej 4 tygodnia życia)
Produktu leczniczego Dexamethasone hameln nie zaleca się stosować u wcześniaków i noworodków urodzonych w terminie. Jednakże, po dokładnej indywidualnej ocenie, można brać pod uwagę
zastosowanie produktu u noworodka, jeżeli w opinii pracownika służby zdrowia / według uznania
lekarza przepisującego produkt leczniczy, korzyści ze stosowania produktu przewyższają potencjalne ryzyko.
Jeśli u noworodków wymagane jest podanie większych dawek produktu leczniczego Dexamethasone hameln niż 0,05 ml/kg/dobę, odpowiadająca im dawka glikolu propylenowego może przekroczyć próg bezpieczeństwa wynoszący 1 mg/kg/dobę. Przekroczenie u noworodków progu bezpieczeństwa może wywołać poważne działania niepożądane w przypadku jednoczesnego podawania z jakimkolwiek substratem dehydrogenazy alkoholowej, takim jak etanol, zwłaszcza jeśli otrzymują one inne leki
zawierające glikol propylenowy lub alkohol. Konieczne jest ścisłe monitorowanie w celu wykrycia jakichkolwiek objawów toksyczności.
Niemowlęta (dzieci w wieku powyżej 4 tygodni) i dzieci w wieku poniżej 5 lat
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Kompatybilny z metoklopramidem i morfiną
Możliwa niezgodność z oktreotydem (analog somatostatyny)
Wytrąca się z następującymi substancjami: cyklizyna, midazolam, haloperidol, lewomepromazyna.
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Dexamethasone hameln, 4 mg/ml, roztwór do wstrzykiwań
1 ml roztworu zawiera 4,00 mg deksametazonu fosforanu (w postaci deksametazonu sodu fosforanu). 2 ml roztworu zawiera 8,00 mg deksametazonu fosforanu (w postaci deksametazonu sodu fosforanu).
Substancje pomocnicze o znanym działaniu
Ten produkt leczniczy zawiera 20 mg glikolu propylenowego na 1 ml – patrz punkty 4.2, 4.4, 4.6 i 4.8. Ten produkt leczniczy zawiera 0,42 mg of sodu na 1 ml – patrz punkt 4.4.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań (płyn do wstrzykiwań).
Przezroczysty, bezbarwny roztwór wolny od cząstek stałych. pH 7,5 – 8,7
Podanie ogólnoustrojowe
Podanie dożylne lub domięśniowe
Dexamethasone hameln jest zalecany do podawania ogólnoustrojowego we wstrzyknięciu dożylnym lub domięśniowym, gdy leczenie doustne jest niemożliwe lub niepożądane w następujących stanach chorobowych:
Dawkowanie
Dawkowanie zależy od rodzaju i nasilenia choroby oraz indywidualnej odpowiedzi pacjenta na leczenie. Zazwyczaj stosuje się stosunkowo duże dawki początkowe. W ciężkich ostrych stanach chorobowych dawka jest znacznie większa niż w przypadku chorób przewlekłych.
Zaleca się następujące schematy dawkowania: Podanie ogólnoustrojowe
Podanie dożylne lub domięśniowe
Dorośli
W pojedynczych przypadkach podczas stosowania produktu leczniczego Dexamethasone hameln obserwowano ciężkie reakcje anafilaktyczne z zapaścią krążeniową, zatrzymaniem pracy serca, zaburzeniem rytmu serca, skurczem oskrzeli i (lub) niedociśnieniem lub nadciśnieniem tętniczym.
W wyniku immunosupresji, leczenie produktem Dexamethasone hameln może prowadzić do wzrostu ryzyka zakażeń bakteryjnych, wirusowych, pasożytniczych, oportunistycznych i grzybiczych. Mogą być maskowane objawy istniejącego lub rozwijającego się zakażenia, co utrudnia diagnozę.
Nieaktywne zakażenia, takie jak gruźlica czy wirusowe zapalenie wątroby typu B, mogą ulec wznowieniu.
Podczas leczenia produktem leczniczym Dexamethasone hameln konieczne może być tymczasowe zwiększenie dawki z powodu szczególnych sytuacji stresu fizycznego (uraz, zabieg, poród itp.).
Nie należy przerywać podawania kortykosteroidów ogólnoustrojowych u pacjentów, którzy są już leczeni ogólnoustrojowymi (doustnymi) kortykosteroidami z innych powodów (np. pacjenci z
przewlekłą obturacyjną chorobą płuc), ale nie wymagają dodatkowego tlenu.
Specjalne środki ostrożności:
Leczenie produktem leczniczym Dexamethasone hameln należy rozważać tylko wtedy, gdy jest to bezwzględnie konieczne, z dodatkowym celowanym leczeniem przeciwinfekcyjnym w następujących przypadkach:
Jeśli wymagane jest podanie większych dawek produktu leczniczego Dexamethasone hameln niż 2,5 ml/kg/dobę, odpowiadająca im dawka glikolu propylenowego może przekroczyć próg bezpieczeństwa wynoszący 50 mg/kg/dobę. Jednoczesne podawanie glikolu propylenowego w dawkach 50 mg/kg/dobę i większych z jakimkolwiek substratem dehydrogenazy alkoholowej (takim jak etanol) może wywołać poważne działania niepożądane u niemowląt i dzieci w wieku poniżej 5 lat,
zwłaszcza jeśli otrzymują one inne leki zawierające glikol propylenowy lub alkohol. Dlatego produkt Dexamethasone hameln należy stosować ostrożnie w tej grupie wiekowej.
W przypadku stosowania u dzieci w fazie wzrostu, należy dokładnie ocenić stosunek korzyści i ryzyka wynikający z leczenia produktem leczniczym Dexamethasone hameln.
Pacjenci w podeszłym wieku
W przypadku stosowania u pacjentów w podeszłym wieku, należy dokładnie ocenić stosunek korzyści do ryzyka wynikającego z leczenia produktem leczniczym Dexamethasone hameln ze względu na
zwiększone ryzyko wystąpienia osteoporozy.
Pacjenci z zaburzeniami czynności wątroby i nerek
Ze względu na zawartość glikolu propylenowego w produkcie pacjenci z zaburzeniami czynności nerek lub zaburzeniami czynności wątroby powinni pozostać pod kontrolą lekarza z powodu różnych działań niepożądanych przypisywanych glikolowi propylenowemu, takich jak zaburzenia czynności nerek (ostra martwica kanalików), ostra niewydolność nerek i zaburzenia czynności wątroby (patrz punkt 2 i 4.2). Dzienna dawka glikolu propylenowego u tych pacjentów nie powinna przekraczać
50 mg/kg, co odpowiada 2,5 ml / kg / dobę produktu Dexamethasone hameln.
Stosowanie Dexamethasone hameln może powodować pozytywne wyniki testów antydopingowych.
Sód
Ten produkt leczniczy zawiera do 1,9 mmol (43 mg) sodu w maksymalnej pojedynczej dawce produktu leczniczego (350 mg dla osoby o masie ciała 70 kg), co odpowiada 2,15% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
Istnieje zwiększone ryzyko owrzodzenia i krwawienia z przewodu pokarmowego podczas stosowania z niesteroidowymi lekami przeciwzapalnymi (NLPZ), salicylanami i indometacyną.
Okres półtrwania glikokortykoidów może być wydłużony podczas stosowania z estrogenami (np. inhibitorami owulacji) i dlatego działanie kortykoidów może być nasilone.
Produkty lecznicze indukujące CYP3A4, takie jak fenytoina, barbiturany, karbamazepina, prymidon, ryfampicyna mogą zwiększać klirens metaboliczny kortykosteroidów, powodując zmniejszenie ich stężenia we krwi i osłabienie aktywności fizjologicznej, może być konieczne dostosowanie dawki.
Inhibitory CYP3A4 (w tym ketokonazol, itrakonazol i kobicystat) mogą zmniejszać klirens deksametazonu, co może spowodować nasilenie działania i zahamowanie czynności nadnerczy (wystąpienie zespołu Cushinga). Należy unikać takiego połączenia, chyba że korzyści z leczenia przewyższają zwiększone ryzyko ogólnoustrojowych działań niepożądanych kortykosteroidów. W takim przypadku należy obserwować, czy u pacjenta nie występują ogólnoustrojowe działania
niepożądane kortykosteroidów.
Efedryna może zwiększać metabolizm glikokortykoidów, a tym samym może zmniejszać ich działanie.
Jednoczesne leczenie enzymem konwertazy angiotensyny (ACE) może zwiększyć ryzyko zmian w morfologii krwi.
Toksyczność digoksyny (glikozydów nasercowych) może być nasilona przez kortykosteroidy poprzez efekt zaburzeń równowagi elektrolitowej (niedobór potasu).
Jeśli kortykosteroidy są podawane jednocześnie z lekami moczopędnymi powodującymi utratę potasu lub lekami przeczyszczającymi, należy uważnie obserwować pacjentów pod kątem rozwoju hipokaliemii spowodowanej zwiększonym wydalaniem potasu.
Skuteczność kumarynowych leków przeciwzakrzepowych może być zmieniona przez równoczesne leczenie kortykosteroidami. Należy często kontrolować czas protrombinowy u pacjentów otrzymujących jednocześnie kortykosteroidy i kumarynowe leki przeciwzakrzepowe, w celu uniknięcia samoistnego krwawienia. W przypadku jednoczesnego stosowania może być konieczne dostosowanie dawki leku przeciwzakrzepowego.
Działanie leków przeciwcukrzycowych (w tym insuliny) jest hamowane przez kortykosteroidy.
W przypadku jednoczesnego stosowania glikokortykoidów z atropiną lub innymi lekami przeciwcholinergicznymi może wystąpić zwiększenie ciśnienia wewnątrzgałkowego.
Podczas jednoczesnego stosowania niedepolaryzujących leków zwiotczających mięśnie z glikokortykoidami zwiotczenie mięśni może utrzymywać się dłużej.
Kortykosteroidy mogą zmniejszać stężenie prazykwantelu we krwi.
Istnieje zwiększone ryzyko wystąpienia miopatii i kardiomiopatii podczas jednoczesnego stosowania deksametazonu z chlorochiną, hydroksychlorochiną i meflochiną.
Po podaniu protireliny wzrost stężenia hormonu tyreotropowego (TSH) może być zmniejszony.
Podczas jednoczesnego podawania z innymi lekami immunosupresyjnymi występuje zwiększona podatność na zakażenia oraz możliwe zaostrzenie lub ujawnienie się nieaktywnych zakażeń.
Dodatkowo w połączeniu z cyklosporyną zwiększa się stężenie cyklosporyny we krwi, a także ryzyko wystąpienia napadów drgawek.
Jednoczesne stosowanie z fluorochinolonami może zwiększać ryzyko wystąpienia objawów związanych ze ścięgnami.
Reakcje skórne na testy alergiczne mogą być hamowane.
Ciąża
Deksametazon przenika przez łożysko.
W okresie ciąży, zwłaszcza w pierwszym trymestrze, produkt wolno stosować jedynie po dokładnej ocenie stosunku korzyści do ryzyka. Kortykosteroidy powinny być przepisywane tylko wtedy, gdy korzyści dla matki i dziecka przewyższają ryzyko.
Kortykosteroidy podawane przez dłuższy czas lub wielokrotnie w czasie ciąży mogą zwiększać ryzyko wewnątrzmacicznego zahamowania wzrostu płodu.
W badaniach wykazano zwiększone ryzyko hipoglikemii u noworodka, występujące po krótkim cyklu leczenia przed porodem kortykosteroidami, w tym deksametazonem, kobiet narażonych na
wystąpienie późnego przedwczesnego porodu.
Podanie kortykosteroidów ciężarnym zwierzętom może być przyczyną nieprawidłowości rozwoju płodu, w tym rozszczepów podniebienia, opóźnienia wzrostu płodu oraz wpływa na rozwój. Brak danych na temat wpływu kortykosteroidów na zwiększenie ilości wad rozwojowych, takich jak rozszczepy podniebienia i (lub) warg u ludzi (patrz punkt 5.3).
Jeśli glikokortykoidy są podawane pod koniec ciąży, płód jest narażony na ryzyko zaniku kory nadnerczy, co może wymagać stopniowego leczenia substytucyjnego u noworodka.
Lek Dexamethasone hameln zawiera glikol propylenowy. Chociaż nie wykazano, aby glikol propylenowy powodował toksyczność reprodukcyjną lub rozwojową u zwierząt lub ludzi, może on
docierać do płodu, dlatego produkt Dexamethasone hameln należy stosować z ostrożnością w okresie ciąży. Staranna ocena potencjalnych korzyści i związanego z nimi ryzyka leczenia steroidami i podawania glikolu propylenowego powinna być dokonywana indywidualnie.
Karmienie piersią
Deksametazon przenika do mleka kobiet karmiących piersią. Dotychczas nie zgłaszano szkodliwego wpływu na niemowlę.
Produkt Dexamethasone hameln należy stosować ostrożnie u kobiet karmiących piersią tylko wtedy, gdy jest to bezwzględnie konieczne. Należy przeprowadzić indywidualną dokładną ocenę potencjalnych korzyści i ryzyka związanego z leczeniem.
Jeśli konieczne jest zastosowanie dużych dawek, należy przerwać karmienie piersią.
Lek Dexamethasone hameln zawiera glikol propylenowy, który został również wykryty w mleku matki. Chociaż nie wykazano, aby glikol propylenowy powodował toksyczność reprodukcyjną lub rozwojową u zwierząt lub ludzi, może on docierać do płodu, dlatego produkt Dexamethasone hameln
należy stosować z ostrożnością u kobiet karmiących piersią. Staranna ocena potencjalnych korzyści i związanego z nimi ryzyka leczenia steroidami i podawania glikolu propylenowego powinna być dokonywana indywidualnie.
Dexamethasone hameln nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn, a także wykonywania prac w niebezpiecznych warunkach.
Podczas krótkotrwałego leczenia deksametazonem ryzyko wystąpienia działań niepożądanych jest małe. Jedyny wyjątek stanowi pozajelitowe leczenie dużymi dawkami, które może prowadzić do wystąpienia zmian dotyczących elektrolitów, powstawania obrzęku, możliwego zwiększenia ciśnienia krwi, zatrzymania akcji serca, zaburzeń rytmu serca lub drgawek; można także obserwować objawy kliniczne zakażeń, nawet podczas krótkotrwałego stosowania.
Należy także zwracać uwagę na możliwość owrzodzeń żołądka i dwunastnicy (często indukowanych stresem), ponieważ leczenie kortykosteroidami może osłabiać ich objawy, a także na zmniejszenie tolerancji glukozy.
Częstość występowania przewidywalnych działań niepożądanych, w tym supresji układu podwzgórzowo-przysadkowo-nadnerczowego, zależy od względnego działania leku, dawki, czasu podawania i czasu trwania leczenia (patrz punkt 4.4).
Częstość występowania działań niepożądanych podano zgodnie z następującą konwencją: Bardzo często (≥1/10)
Często (≥1/100 to <1/10)
Niezbyt często (≥1/1000 to <1/100) Rzadko (≥1/10000 to <1/1000) Bardzo rzadko (<1/10000)
Nieznana (nie może być określona na podstawie dostępnych danych)
Klasyfikacja układów i narządów | Częstość | Działania niepożądane |
Zakażenia i zarażenia pasożytnicze | Nieznana | Maskowanie objawów zakażenia, wystąpienie lub zaostrzenie zakażeń wirusowych, grzybiczych, bakteryjnych, pasożytniczych i oportunistycznych, aktywacja węgorczycy (patrz punkt 4.4). |
Zaburzenia krwi i układu chłonnego | Nieznana | Umiarkowana leukocytoza, limfopenia, eozynopenia, policytemia. |
Zaburzenian układu immunologicznego | Nieznana | Reakcje nadwrażliwości (np. wysypka polekowa), ciężkie reakcje anafilaktyczne, takie jak zaburzenia rytmu serca, skurcz oskrzeli, niedociśnienie lub nadciśnienie tętnicze, zapaść krążeniowa, zatrzymanie akcji serca, osłabienie układu odpornościowego. |
Zaburzenia endokrynologiczne | Nieznana | Zespół Cushinga (typowe objawy: twarz księżycowata, otyłość brzuszna, nadmiar płynów ustrojowych), zahamowanie czynności kory nadnerczy (patrz punkt 4.4). |
Zaburzenia metabolizmu i odżywiania | Nieznana | Zatrzymanie sodu, któremu towarzyszy powstawanie obrzęków, zwiększenie wydalania |
potasu (ryzyko arytmii), zwiększenie masy ciała, obniżenie tolerancji glukozy, cukrzyca, hipercholesterolemia i hipertriglicerydemia, zwiększenie apetytu. | ||
Zaburzenia psychiczne | Nieznana | Depresja, drażliwość, euforia, zwiększenie napędu, psychoza, mania, omamy, zmiany nastroju, lęk, zaburzenia snu, myśli samobójcze. |
Zaburzenia układu nerwowego | Nieznana | Guz rzekomy mózgu, objawy padaczki utajonej, zwiększenie skłonności do drgawek w padaczce z objawami. |
Zaburzenia oka | Nieznana | Zaćma, głównie zaćma tylna podtorebkowa, jaskra, zaostrzenie objawów związanych z owrzodzeniem rogówki, zaostrzenie wirusowych, grzybiczych i bakteryjnych zakażeń oka, zaostrzenie bakteryjnego zapalenia rogówki, opadanie powiek, rozszerzenie źrenic, obrzęk spojówek, jatrogenna perforacja twardówki, chorioretinopatia. Rzadko przemijający wytrzeszcz oczu, niewyraźne widzenie (patrz także punkt 4.4). |
Zaburzenia serca | Nieznana | Kardiomiopatia przerostowa u niemowląt przedwcześnie urodzonych (patrz punkt 4.4). |
Zaburzenia naczyniowe | Nieznana | Nadciśnienie tętnicze, zwiększone ryzyko miażdżycy i zakrzepicy, zapalenie naczyń (może wystąpić również jako efekt odstawienia po długotrwałej terapii), zwiększona kruchość naczyń włosowatych. |
Zaburzenia żołądka i jelit | Nieznana | Wrzody żołądka i jelit, krwawienie z przewodu pokarmowego, zapalenie trzustki, niestrawność. |
Zaburzenia skóry i tkanki podskórnej | Nieznana | Rozstępy, atrofia skóry, teleangiektazja, wybroczyny, hipertrichoza, trądzik steroidowy, zapalenie skóry podobne do trądziku różowatego (okołoustne), zaburzenia barwnikowe. |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Nieznana | Miopatia, zanik i osłabienie mięśni, steroidowa miopatia, osteoporoza (zależna od dawki, możliwa również po krótkotrwałym stosowaniu), aseptyczna martwica kości, choroby ścięgien, zapalenie ścięgna, zerwanie ścięgna, lipomatoza nadtwardówkowa, zahamowanie wzrostu u dzieci. |
Zaburzenia układu rozrodczego i piersi | Nieznana | Zaburzenia wydzielania hormonów płciowych (w wyniku czego mogą wystąpić: nieregularne miesiączki, brak miesiączki, hirsutyzm, impotencja). |
Zaburzenia ogólne i stany w miejscu podania | Nieznana | Wolniejsze gojenie się ran. |
Podanie miejscowe:
Możliwe występowanie reakcji podrażnieniowych i nietolerancji (uczucie pieczenia, długotrwały ból). W przypadku niewłaściwego podania dostawowego (poza jamę stawową) nie można wykluczyć wystąpienia atrofii skóry i tkanki podskórnej w miejscu wstrzyknięcia.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem
Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy:
Nie są znane ostre zatrucia deksametazonem. W przypadku długotrwałego stosowania nadmiernych dawek można oczekiwać nasilenia działań niepożądanych (patrz punkt 4.8), zwłaszcza zaburzeń
endokrynologicznych, metabolizmu i równowagi elektrolitowej.
Nie jest dostępna odtrutka. Leczenie prawdopodobnie nie jest wskazane w przypadku reakcji spowodowanych przewlekłym zatruciem, chyba że u pacjenta występuje stan, który powoduje, że pacjent jest wyjątkowo podatny na wystąpienie działań niepożądanych ze strony kortykosteroidów. W takim przypadku należy wdrożyć leczenie objawowe, jeśli jest to konieczne.
Reakcje anafilaktyczne i nadwrażliwości mogą być leczone adrenaliną, sztucznym oddychaniem pod dodatnim ciśnieniem i aminofiliną.
Grupa farmakoterapeutyczna: Glikokortykosteroidy, kod ATC: H02AB02 Działanie farmakodynamiczne
Deksametazon jest monofluorowanym glikokortykosteroidem o właściwościach przeciwalergicznych, przeciwzapalnych i stabilizujących błony komórkowe. Wpływa również na metabolizm
węglowodanów, białek i tłuszczów.
Deksametazon ma aktywność i działanie innych podstawowych glikokortykoidów i należy do najbardziej aktywnych w swojej klasie.
Deksametazon wykazuje działanie glikokortykosteroidowe 7,5 razy silniejsze niż prednizolon i prednizon. W porównaniu do hydrokortyzonu jest 30 razy silniejszy. Nie wykazuje działania mineralokortykosteroidowego.
Glikokortykosteroidy, takie jak deksametazon wywierają biologiczne działanie przez aktywację
transkrypcji genów zależnych od kortykosteroidów. Działanie przeciwzapalne, immunosupresyjne i antyproliferacyjne jest spowodowane przez różne czynniki, w tym zmniejszone powstawanie,
uwalnianie i aktywność mediatorów zapalnych oraz przez hamowanie czynności i migracji
specyficznych komórek zapalnych. Dodatkowo, kortykosteroidy mogą zapobiegać oddziaływaniu aktywowanych limfocytów T i makrofagów na komórki docelowe.
Jeśli konieczne jest długotrwałe leczenie kortykosteroidami, należy brać pod uwagę możliwość wystąpienia przejściowej niewydolności kory nadnerczy. Zahamowanie osi podwzgórze-przysadka- nadnercza zależy także od czynników indywidualnych.
Skuteczność kliniczna i bezpieczeństwo – COVID-19 Skuteczność kliniczna
Badanie RECOVERY (Randomised Evaluation of COVid-19 thERapY)1 jest zainicjowanym przez badacza, indywidualnie randomizowanym, kontrolowanym, otwartym adaptacyjnym badaniem platformowym prowadzonym w celu oceny skuteczności potencjalnego leczenia u pacjentów hospitalizowanych z powodu COVID-19.
Badanie przeprowadzono w 176 szpitalach państwowych w Wielkiej Brytanii.
6425 pacjentów przydzielono losowo do jednej z dwóch grup badania: grupy otrzymującej deksametazon (2104 pacjentów) lub grupy otrzymującej standardową opiekę medyczną (4321 pacjentów). 89% pacjentów miało potwierdzone laboratoryjnie zakażenie wirusem SARS-CoV-2.
W trakcie randomizacji 16% pacjentów poddawanych było inwazyjnej wentylacji mechanicznej lub pozaustrojowemu utlenowaniu krwi, 60% otrzymywało tylko tlen (z lub bez wentylacji
nieinwazyjnej), a 24% w żaden sposób nie wspomagano oddychania.
Średni wiek pacjentów wynosił 66,1 +/- 15,7 lat. Kobiety stanowiły 36% badanych pacjentów. U 24% pacjentów stwierdzono występowanie cukrzycy, u 27% choroby serca, a u 21% przewlekłej choroby płuc w wywiadzie.
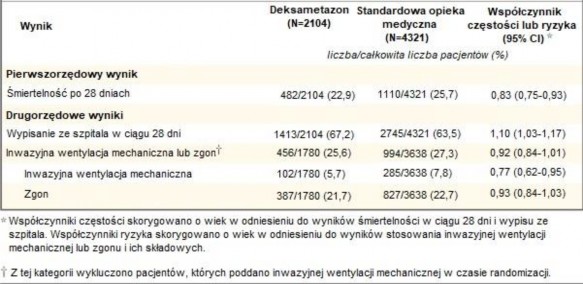
Pierwszorzędowy punkt końcowy
Śmiertelność po 28 dniach była istotnie niższa w grupie leczonej deksametazonem niż w grupie podlegającej standardowej opiece medycznej, odnotowano odpowiednio 482 zgony w grupie 2104 pacjentów (22,9%) i 1110 zgonów w grupie 4321 pacjentów (25,7%) (współczynnik częstości, 0,83;
95% przedział ufności [CI], 0,75 do 0,93; P<0,001).
W grupie otrzymującej deksametazon częstość zgonów była niższa w porównaniu do grupy otrzymującej standardową opiekę medyczną wśród pacjentów poddawanych inwazyjnej wentylacji mechanicznej (29,3% vs. 41,4%; współczynnik częstości, 0,64; 95% CI, 0,51 do 0,81) oraz otrzymujących tlen bez inwazyjnej wentylacji mechanicznej (23,3% vs. 26,2%; współczynnik
częstości, 0,82; 95% CI, 0,72 do 0,94).
Brak wyraźnego wpływu deksametazonu u pacjentów, u których nie stosowano wsparcia oddechowego w czasie randomizacji (17,8% vs. 14,0%; współczynnik częstości, 1,19; 95% CI, 0,91
do 1,55).
Drugorzędowe punkty końcowe
Pacjenci w grupie otrzymującej deksametazon byli hospitalizowani krócej w porównaniu do
pacjentów z grupy otrzymującej standardową opiekę medyczną (mediana, 12 dni vs. 13 dni) i mieli większe prawdopodobieństwo wypisu ze szpitala w ciągu 28 dni przy życiu (współczynnik częstości, 1,10; 95% CI, 1,03 do 1,17).
Zgodnie z pierwszorzędowym punktem końcowym, największy wpływ stosowania deksametazonu na wypisanie ze szpitala w ciągu 28 dni zaobserwowano u pacjentów, których poddawano
inwazyjnej wentylacji mechanicznej w czasie randomizacji (współczynnik częstości, 1,48; 95% CI, 1,16, 1,90), a następnie wśród pacjentów otrzymujących tylko tlen (współczynnik częstości, 1,15; 95% CI, 1,06- 1,24). Nie obserwowano korzyści ze stosowania deksametazonu u pacjentów, których nie poddawano tlenoterapii (współczynnik częstości, 0,96; 95% CI, 0,85-1,08).
Bezpieczeństwo
Wystąpiły cztery ciężkie zdarzenia niepożądane (ang, serious adverse events, SAE) związane z badanym leczeniem: dwa związane z hiperglikemią, jedno związane z psychozą wywołaną steroidami oraz jedno ciężkie zdarzenie niepożądane związane z krwawieniem z górnego odcinka przewodu pokarmowego. Wszystkie zdarzenia ustąpiły.
Analiza podgrup
Wpływ alokacji do grupy otrzymującej DEKSAMETAZON na śmiertelność w ciągu 28 dni, w zależności od wieku i wsparcia oddechowego w czasie randomizacji 2
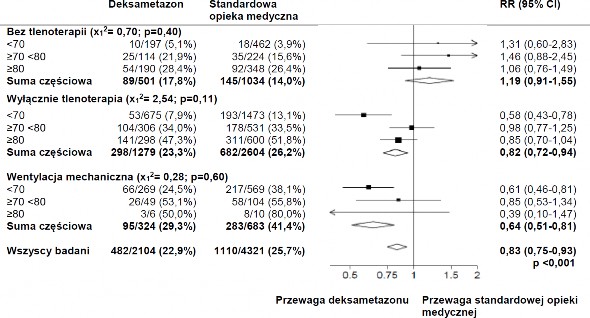
2,3 (source: Horby P. et al., 2020; https://www.medrxiv.org/content/10.1101/2020.06.22.20137273v1 ; doi: https://doi.org/10.1101/2020.06.22.20137273)
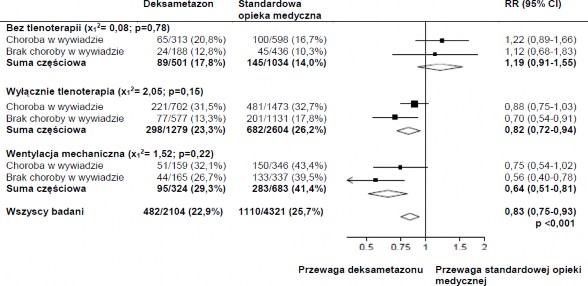
Wpływ alokacji do grupy otrzymującej DEKSAMETAZON na śmiertelność w ciągu 28 dni, w zależności od wsparcia oddechowego w czasie randomizacji i występowania jakiejkolwiek choroby przewlekłej w wywiadzie.3
Dystrybucja
Wiązanie deksametazonu z białkami osocza jest mniejsze niż w przypadku większości innych kortykosteroidów i szacuje się, że wynosi około 77%. Deksametazon wiąże się z białkami osocza w sposób zależny od dawki. W bardzo dużych dawkach większość krąży niezwiązana we krwi. W
przypadku hipoalbuminemii zwiększa się odsetek niezwiązanego (aktywnego) kortykoidu. Po dożylnym podaniu u ludzi deksametazonu radioaktywnie znakowanego maksymalne stężenie deksametazonu w płynie mózgowo-rdzeniowym odpowiada w przybliżeniu 1/6 stężenia w surowicy. Okres półtrwania deksametazonu w osoczu wynosi około 190 minut.
Z powodu długiego biologicznego okresu półtrwania, wynoszącego ponad 36 godzin, deksametazon jest jednym z bardzo długo działających glukokortykoidów. Z tego względu codzienne stosowanie deksametazonu może prowadzić do kumulacji i przedawkowania.
Eliminacja
Średni okres półtrwania deksametazonu w surowicy w fazie eliminacji u osób dorosłych wynosi około 250 minut (+ 80 minut).
Wydalanie odbywa się w dużym stopniu przez nerki w wolnej postaci deksametazonu - alkoholu. Ma miejsce metabolizm, a metabolity, w postaci glukuronianów lub siarczanów, są wydalane głównie
przez nerki. Do 65% dawki jest wydalane z moczem w ciągu 24 godzin. Uszkodzenie czynności nerek nie wpływa znacząco na wydzielanie deksametazonu. Jednakże okres półtrwania w fazie eliminacji jest wydłużony u pacjentów z ciężkimi chorobami wątroby.
Toksyczność po podaniu jednorazowym:
LD50 dla deksametazonu po jednorazowym podaniu doustnym u myszy wynosi 16 g/kg masy ciała w ciągu pierwszych 7 dni, a u szczurów ponad 3 g/kg masy ciała. Po pojedynczym podaniu podskórnym,
LD50 u myszy wynosi ponad 700 mg/kg masy ciała, a u szczurów około 120 mg/kg masy ciała w ciągu pierwszych 7 dni. Wartości te uległy zmniejszeniu w ciągu 21 dniowego okresu obserwacji, co
interpretuje się jako zmiany będące wynikiem ciężkich chorób infekcyjnych spowodowanych immunosupresją hormonalną.
Toksyczność po podaniu wielokrotnym:
Brak danych w odniesieniu do toksyczności po podaniu wielokrotnym u ludzi i zwierząt. Nie są znane objawy zatrucia związanego z glikokortykosteroidami. Podczas długotrwałego leczenia z użyciem dawek powyżej 1,5 mg/dobę należy spodziewać się znaczących działań niepożądanych (patrz punkt 4.8).
Potencjalna genotoksyczność i rakotwórczość:
Dostępne wyniki badań z zastosowaniem glikokortykosteroidów nie wskazują jakichkolwiek klinicznie znaczących właściwości genotoksycznych.
Toksyczny wpływ na reprodukcję:
W badaniach na zwierzętach obserwowano rozszczepienie podniebienia u szczurów, myszy,
chomików, królików, psów i naczelnych, ale nie u koni i owiec. W niektórych przypadkach te wady rozwojowe połączone były z wadami ośrodkowego układu nerwowego i serca. U naczelnych obserwowano po narażeniu wpływ na mózg. Ponadto, opóźniony może być wzrost
wewnątrzmaciczny. Wszystkie te skutki obserwowano po dużych dawkach.
Glikol propylenowy Disodu edetynian
Sodu wodorotlenek (do ustalenia pH) Woda do wstrzykiwań
Deksametazon jest fizycznie niezgodny z daunorubicyną, doksorubicyną, wankomycyną, difenhydraminą (z lorazepamem i metoklopramidem) oraz dwuwinianem metaraminolu i nie należy go mieszać z roztworami zawierającymi te leki. Jest również niezgodny z doksapramem i
glikopirolanem w strzykawce oraz z cyprofloksacyną, idarubicyną i midazolamem we wstrzyknięciach w miejscu Y (mieszanina 1: 1).
Dane dotyczące zgodności deksametazonu podawanego w sposób ciągły przez 24 godziny za pomocą strzykawki automatycznej do ciągłego wlewu leku:
Zamknięta ampułka: 2 lata
Otwarta ampułka: Po pierwszym otwarciu produkt zużyć natychmiast.
Rozcieńczony roztwór:
Sporządzony roztwór wykazuje chemiczną i fizyczną stabilność przez 24 godziny w temperaturze do 25°C.
Z mikrobiologicznego punktu widzenia roztwór do infuzji należy zużyć natychmiast po jego sporządzeniu. W przeciwnym razie za czas i warunki przechowywania odpowiedzialność ponosi
użytkownik i roztworu nie należy przechowywać dłużej niż 24 godziny w temperaturze 2°C do 8°C, o ile został on przygotowany i rozcieńczony w kontrolowanych i zwalidowanych warunkach.
Przechowywać w temperaturze poniżej 25ºC. Nie zamrażać.
Przechowywać ampułkę w opakowaniu zewnętrznym w celu ochrony przed światłem.
Warunki przechowywania produktu leczniczego po pierwszym otwarciu lub rozcieńczeniu produktu leczniczego, patrz punkt 6.3.
Ampułka z bezbarwnego, neutralnego szkła typu I, o pojemności nominalnej 1 ml lub 2 ml, z punktem OPC w tekturowym pudełku.
Opakowanie zawiera 5 lub 10 ampułek.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Jeśli Dexamethasone hameln jest podawany w infuzji dożylnej, jako rozcieńczalniki zaleca się stosowanie 5% glukozy, 0,9% chlorku sodu i roztworu Ringera. Dokładne stężenie deksametazonu w pojemniku do infuzji należy określić na podstawie pożądanej dawki, ilości płynów przyjmowanych przez pacjenta i wymaganej szybkości wlewu przez kroplówkę.
W opiece paliatywnej produkt Dexamethasone hameln może być rozcieńczony chlorkiem sodu i podawany w ciągłej infuzji podskórnej (CSCI).
Przed użyciem roztwór należy poddać kontroli wzrokowej. Należy stosować wyłącznie klarowne roztwory praktycznie wolne od cząstek stałych.
Wyłącznie do jednorazowego użytku.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
hameln pharma gmbh Inselstraße 1
31787 Hameln Niemcy
Pozwolenie nr 27026
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 13 kwietnia 2022
01/2022











