Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Zakażenie górnych dróg oddechowych i opryszczkowe zapalenie jamy ustnej
Zapalenie oskrzeli, zapalenie dolnych dróg oddechowych, zapalenie płuc i zapalenie dróg oddechowych
Ropień, ropień w obrębie kończyny, ropień odbytu, ropień dziąsłowy, ropień wątroby, ropień trzustki, ropień krocza, ropień okolic odbytu i odbytnicy, ropień odbytniczy, ropień podskórny i ropień zęba
Kandydoza przełyku i kandydoza jamy ustnej
Zapalenie tkanki łącznej i zakażenie skóry
Posocznica i wstrząs septyczny
Ropień w jamie brzusznej, posocznica z punktem wyjścia w jamie brzusznej, zapalenie uchyłka i zapalenie kości i szpiku
Mikroangiopatia zakrzepowa, zakrzepowa plamica małopłytkowa oraz zespół hemolityczno-mocznicowy
Zmniejszenie łaknienia i jadłowstręt
Dysgeuzja, ageuzja i zaburzenia smaku
Ostry zespół wieńcowy, dusznica bolesna, dusznica niestabilna, zamknięcie tętnicy wieńcowej oraz niedokrwienie mięśnia sercowego
Zmniejszenie i (lub) nieprawidłowość frakcji wyrzutowej
Ostry zawał mięśnia sercowego, zawał mięśnia sercowego oraz bezobjawowy zawał mięśnia sercowego
Ból jamy ustnej i gardła oraz ból gardła i krtani
Zapalenie jamy ustnej i afty jamy ustnej
Ból brzucha, ból w podbrzuszu i ból w nadbrzuszu
Perforacja przewodu pokarmowego i perforacja jelita
Zapalenie jelita i niedokrwienne zapalenie jelita grubego
Zapalenie pęcherzyka żółciowego i zapalenie pęcherzyka żółciowego niekamiczne
Zażółcenie skóry, przebarwienia skórne i zaburzenia pigmentacji
Łuszczycopodobne zapalenie skóry, wysypka złuszczająca, wysypka, wysypka rumieniowa, wysypka pęcherzykowa, wysypka uogólniona, wysypka plamista, wysypka plamisto-grudkowa, wysypka grudkowa i swędząca wysypka
Reakcje skórne i zaburzenia skórne
Zaburzenia i odbarwienie płytki paznokciowej
Zmęczenie i astenia
Obrzęk twarzy, obrzęk oraz obrzęk obwodowy
Zwiększona aktywność amylazy
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych 12,5 mg kapsułki, twarde
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Asikreba, 12,5 mg kapsułki, twarde Asikreba, 25 mg kapsułki, twarde Asikreba, 37,5 mg kapsułki, twarde Asikreba, 50 mg kapsułki, twarde
Asikreba 12,5 mg kapsułki, twarde
Każda kapsułka zawiera sunitynibu jabłczan, co odpowiada do 12,5 mg sunitynibu.
Asikreba 25 mg kapsułki, twarde
Każda kapsułka zawiera sunitynibu jabłczan, co odpowiada 25 mg sunitynibu.
Asikreba 37,5 mg kapsułki, twarde
Każda kapsułka zawiera sunitynibu jabłczan, co odpowiada 37,5 mg sunitynibu.
Substancje pomocnicze o znanym działaniu
Każda kapsułka zawiera 0,0189 mg żółcieni pomarańczowej FCF (E110) i 0,0057 mg tartrazyny
(E102).
Asikreba 50 mg kapsułki, twarde
Każda kapsułka zawiera sunitynibu jabłczan, co odpowiada 50 mg sunitynibu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Kapsułka, twarda (kapsułka). Asikreba 12,5 mg kapsułki, twarde
Kapsułki, twarde z ciemno-brązowym, nieprzezroczystym wieczkiem i ciemno-brązowym,
nieprzezroczystym korpusem, 13,8-14,8 mm, z wykonanym białym tuszem nadrukiem “LP” na wieczku i „650” na korpusie, zawierające żółty do pomarańczowego proszek granulowany .
Asikreba 25 mg kapsułki, twarde
Kapsułki, twarde z jasno-brązowym, nieprzezroczystym wieczkiem i ciemno-brązowym, nieprzezroczystym korpusem, 15,4 – 16,4 mm, z wykonanym białym tuszem nadrukiem "LP” na wieczku i „651” na korpusie, zawierające żółty do pomarańczowego proszek granulowany.
Asikreba 37,5 mg kapsułki, twarde
Kapsułki, twarde z żółtym, nieprzezroczystym wieczkiem i żółtym, nieprzezroczystym korpusem, 17,5 – 18,5 mm, z wykonanym czarnym tuszem nadrukiem „LP” na wieczku i “652” na korpusie, zawierające żółty do pomarańczowego proszek granulowany.
Asikreba 50 mg kapsułki, twarde
Kapsułki, twarde o rozmiarze z jasno-brązowym, nieprzezroczystym wieczkiem i z jasno-brązowym, nieprzezroczystym korpusem 17,5 – 18,5 mm, z wykonanym białym tuszem nadrukiem „LP” na wieczku i “653” na korpusie, zawierające żółty do pomarańczowego proszek granulowany.
Nowotwory podścieliskowe przewodu pokarmowego (ang. GIST, Gastrointestinal stromal tumour) Produkt leczniczy Asikreba jest wskazany w leczeniu nowotworów podścieliskowych przewodu pokarmowego (GIST) nieoperacyjnych i (lub) z przerzutami u dorosłych po niepowodzeniu leczenia imatynibem ze względu na oporność lub nietolerancję.
Rak nerkowokomórkowy z przerzutami (ang. MRCC, Metastatic renal cell carcinoma) Produkt leczniczy Asikreba jest wskazany w leczeniu zaawansowanego raka nerkowokomórkowego i (lub) raka nerkowokomórkowego z przerzutami (MRCC) u dorosłych.
Nowotwory neuroendokrynne trzustki (ang. pNET, Pancreatic neuroendocrine tumours) Produkt leczniczy Asikreba jest wskazany w leczeniu wysoko zróżnicowanych nowotworów neuroendokrynnych trzustki (pNET) nieoperacyjnych lub z przerzutami u dorosłych, u których doszło do progresji choroby.
Leczenie produktem Asikreba powinien rozpoczynać lekarz doświadczony w podawaniu leków przeciwnowotworowych.
W przypadku GIST i MRCC, zalecana dawka produktu Asikreba wynosi 50 mg raz na dobę, przyjmowana doustnie przez 4 kolejne tygodnie, po czym następuje 2-tygodniowa przerwa (schemat 4/2), co stanowi pełny cykl 6 tygodni.
W przypadku pNET zalecana dawka produktu Asikreba wynosi 37,5 mg raz na dobę, przyjmowana doustnie w sposób ciągły.
Dostosowanie dawki
W przypadku GIST i MRCC można stopniowo dokonywać zmian dawkowania za każdym razem o 12,5 mg, zależnie od indywidualnie ocenianego bezpieczeństwa i tolerancji. Dawka dobowa nie powinna być większa niż 75 mg i nie powinna być mniejsza niż 25 mg.
W przypadku pNET można stopniowo dokonywać zmian dawkowania za każdym razem o 12,5 mg, zależnie od indywidualnie ocenianego bezpieczeństwa i tolerancji. Dawka maksymalna podawana w badaniu III fazy dotyczącym pNET wynosiła 50 mg na dobę.
W zależności od indywidualnej oceny bezpieczeństwa i tolerancji może być konieczne zastosowanie przerw w podawaniu produktu.
Inhibitory i (lub) induktory CYP3A4
Należy unikać równoczesnego podawania sunitynibu z silnymi induktorami CYP3A4, takimi jak ryfampicyna (patrz punkty 4.4 i 4.5). Jeżeli nie jest to możliwe, może być konieczne zwiększanie
dawki sunitynibu, za każdym razem o 12,5 mg (do 87,5 mg na dobę w przypadku GIST i MRCC lub 62,5 mg na dobę w przypadku pNET) z równoczesnym starannym monitorowaniem tolerancji.
Należy unikać równoczesnego podawania sunitynibu z silnymi inhibitorami CYP3A4, takimi jak ketokonazol (patrz punkty 4.4 i 4.5). Jeżeli nie jest to możliwe, może zaistnieć konieczność zmniejszenia dawek sunitynibu do minimum 37,5 mg na dobę w przypadku GIST i MRCC lub 25 mg na dobę w przypadku pNET, z równoczesnym starannym monitorowaniem tolerancji.
Należy rozważyć wybranie do leczenia skojarzonego innego produktu o minimalnym działaniu hamującym CYP3A4, lub bez takiego działania.
Nie określono bezpieczeństwa stosowania ani skuteczności produktu Asikreba u pacjentów poniżej 18 lat.
Aktualnie dostępne dane przedstawiono w punktach 4.8, 5.1 i 5.2, ale brak zaleceń dotyczących dawkowania.
Około jedna trzecia uczestników badań klinicznych, u której zastosowano sunitynib była w wieku 65 lat lub powyżej. Nie obserwowano istotnych różnic pod względem bezpieczeństwa lub skuteczności leczenia pomiędzy młodszymi i starszymi pacjentami.
U pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby (stopnia A i B według klasyfikacji Child-Pugh), którym podaje się sunitynib, nie jest zalecane modyfikowanie początkowego dawkowania. Nie przeprowadzono badań z sunitynibem stosowanym u pacjentów z ciężkimi zaburzeniami czynności wątroby stopnia C według klasyfikacji Child-Pugh i dlatego jego stosowanie u pacjentów z ciężkimi zaburzeniami czynności wątroby nie jest zalecane (patrz punkt 5.2).
Nie ma konieczności modyfikowania dawki początkowej podczas podawania sunitynibu pacjentom z zaburzeniami czynności nerek (lekkimi do ciężkich) ani u pacjentów ze schyłkową niewydolnością nerek (ang. ESRD, End-Stage Renal Disease) poddawanym hemodializie. Późniejsze modyfikacje dawkowania powinny zależeć od bezpieczeństwa i tolerancji leczenia u poszczególnych pacjentów (patrz punkt 5.2).
Produkt Asikreba jest podawany doustnie i może być przyjmowany z posiłkiem lub bez posiłku.
W przypadku pominięcia jednej z dawek nie należy stosować dodatkowej dawki. Pacjent powinien przyjąć zwykłą przepisaną dawkę następnego dnia.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Należy unikać jednoczesnego stosowania z silnymi induktorami CYP3A4, ponieważ może to powodować zmniejszenie stężenia sunitynibu w osoczu (patrz punkty 4.2 i 4.5).
Należy unikać jednoczesnego stosowania z silnymi inhibitorami CYP3A4, ponieważ może to powodować zwiększenie stężenia sunitynibu w osoczu (patrz punkty 4.2 i 4.5).
Zaburzenia skóry i tkanki podskórnej
Pacjentów należy poinformować, że w trakcie stosowania sunitynibu może dojść do odbarwienia włosów lub skóry. Do innych możliwych objawów dermatologicznych należą suchość, zgrubienie lub pękanie skóry, pęcherze lub wysypka na powierzchni dłoni i na podeszwach stóp.
Powyższe reakcje nie występowały łącznie, były na ogół odwracalne i zasadniczo nie wiązały się z koniecznością przerwania leczenia. Zgłaszano przypadki wystąpienia piodermii zgorzelinowej, której objawy zazwyczaj ustępowały po przerwaniu leczenia sunitynibem. Zgłaszano ciężkie reakcje skórne, w tym przypadki rumienia wielopostaciowego (ang. EM, erythema multiforme), przypadki przypominające zespół Stevensa-Johnsona (ang. SJS, Stevens-Johnson syndrome) oraz martwicę toksyczno-rozpływną naskórka (ang. TEN, toxic epidermal necrolysis), niektóre prowadzące do zgonu. Jeżeli wystąpią objawy przedmiotowe lub podmiotowe SJS, TEN lub EM (np. postępująca wysypka skórna często występująca z pęcherzami lub zmiany na błonie śluzowej jamy ustnej), należy przerwać leczenie sunitynibem. Jeżeli potwierdzi się diagnoza SJS lub TEN, nie wolno wznawiać leczenia. W niektórych przypadkach podejrzenia EM, pacjenci tolerowali ponowne wprowadzenie sunitynibu w mniejszej dawce po ustąpieniu reakcji skórnej; niektórzy z tych pacjentów byli również jednocześnie leczeni kortykosteroidami lub lekami przeciwhistaminowymi (patrz punkt 4.8).
Zdarzenia krwotoczne, w niektórych przypadkach prowadzące do zgonu, zgłaszane w badaniach klinicznych z sunitynibem oraz w ramach nadzoru po wprowadzeniu produktu leczniczego zawierającego sunitynib do obrotu obejmowały krwotoki z przewodu pokarmowego, układu oddechowego, dróg moczowych oraz mózgu (patrz punkt
4.8).
Rutynowa ocena zdarzeń krwotocznych powinna obejmować pełną morfologię krwi oraz badanie fizykalne.
Krwotok z nosa był najczęściej występującym krwotocznym działaniem niepożądanym, obserwowanym u około połowy pacjentów z guzami litymi, u których wystąpiły powikłania krwotoczne. Niektóre z tych krwotoków z nosa były ciężkie, ale bardzo rzadko prowadziły do zgonu.
Zgłaszano przypadki krwotoku z guza, czasami związane z martwicą nowotworu; niektóre z nich prowadziły do zgonu.
Krwotoki z guza nowotworowego mogą występować nagle, a w przypadku guzów płuc mogą mieć postać ciężkiego, zagrażającego życiu krwioplucia lub krwotoku płucnego. W badaniach klinicznych oraz po wprowadzeniu produktu leczniczego zawierającego sunitynib do obrotu, u pacjentów z MRCC, GIST i rakiem płuc leczonych sunitynibem, zgłaszano przypadki krwotoku płucnego; niektóre z nich prowadziły do zgonu. Asikreba nie jest zarejestrowany do stosowania u pacjentów z rakiem płuc.
Pacjenci otrzymujący równocześnie produkty przeciwzakrzepowe (np. warfarynę, acenokumarol) mogą być poddawani okresowym kontrolom obejmującym wykonanie morfologii krwi
(z oznaczeniem liczby płytek krwi), badanie czynników krzepnięcia [czas protrombinowy (PT) i (lub) wskaźnik INR] oraz badaniu przedmiotowemu.
Najczęściej obserwowanymi działaniami niepożądanymi ze strony układu pokarmowego były biegunka, nudności i (lub) wymioty, ból brzucha, niestrawność oraz zapalenie jamy ustnej i (lub) ból w jamie ustnej; zgłaszano również przypadki zapalenia przełyku (patrz punkt 4.8).
W razie wystąpienia tego typu działań niepożądanych zastosowane leczenie wspomagające może obejmować stosowanie leków przeciwwymiotnych, przeciwbiegunkowych lub zobojętniających kwas żołądkowy.
U pacjentów z nowotworami złośliwymi w jamie brzusznej, u których zastosowano sunitynib zgłaszano ciężkie, czasem prowadzące do zgonu powikłania ze strony przewodu pokarmowego, w tym perforacje.
Zgłaszano przypadki nadciśnienia tętniczego powiązane ze stosowaniem sunitynibu, w tym ciężkie nadciśnienie (ciśnienie skurczowe > 200 mmHg lub ciśnienie rozkurczowe 110 mmHg). Należy badać pacjentów w celu wykrycia nadciśnienia tętniczego i odpowiednio ich kontrolować. U pacjentów z ciężkim nadciśnieniem tętniczym, którego nie udaje się kontrolować farmakologicznie, zaleca się czasowe przerwanie stosowania produktu. Można je wznowić po uzyskaniu skutecznej kontroli nadciśnienia (patrz punkt 4.8).
Zgłaszano zmniejszenie bezwzględnej liczby neutrofili i płytek krwi powiązane ze stosowaniem sunitynibu (patrz punkt 4.8). Powyższe zdarzenia nie występowały łącznie, były na ogół odwracalne i zasadniczo nie wiązały się z koniecznością przerwania leczenia. Żaden z tych epizodów w badaniach III fazy nie był śmiertelny, ale w ramach nadzoru po wprowadzeniu produktu leczniczego zawierającego sunitynib do obrotu, zgłaszano rzadkie przypadki epizodów hematologicznych o skutkach śmiertelnych, w tym krwotoki związane z małopłytkowością i zakażenia w przebiegu neutropenii.
Obserwowano przypadki niedokrwistości, które występowały zarówno na początku jak i w trakcie leczenia sunitynibem.
U pacjentów, u których stosuje się sunitynib, należy oznaczyć morfologię krwi na początku każdego cyklu leczenia (patrz punkt 4.8).
U pacjentów leczonych sunitynibem zgłaszano zdarzenia sercowo-naczyniowe, w tym niewydolność serca, kardiomiopatię, zmniejszenie frakcji wyrzutowej lewej komory poniżej dolnej granicy normy, zapalenie mięśnia sercowego, niedokrwienie mięśnia sercowego oraz zawał mięśnia sercowego, z czego niektóre przypadki były zakończone zgonem. Dane te wskazują na to, że sunitynib zwiększa ryzyko rozwoju kardiomiopatii. U leczonych pacjentów nie zidentyfikowano żadnych dodatkowych czynników ryzyka rozwoju kardiomiopatii wywołanej przez sunitynib poza wpływem samego produktu. U pacjentów zagrożonych wystąpieniem zdarzeń sercowo-naczyniowych lub, u których takie zdarzenia wystąpiły w przeszłości, sunitynib należy stosować ostrożnie (patrz punkt 4.8).
Ze wszystkich badań klinicznych nad sunitynibem wykluczono pacjentów, u których w ciągu 12 miesięcy przed podaniem produktu miały miejsce incydenty związane z układem krążenia, takie jak zawał mięśnia sercowego (w tym ciężka i (lub) niestabilna dławica piersiowa), przeszczep pomostujący tętnicy wieńcowej i (lub) tętnicy obwodowej, objawowa zastoinowa niewydolność
serca, udar mózgu lub przejściowy napad niedokrwienny, bądź też zator tętnicy płucnej. Nie wiadomo, czy pacjenci z wymienionymi schorzeniami współistniejącymi mogą być narażeni na większe ryzyko rozwoju dysfunkcji lewej komory związanej z sunitynibem.
Lekarz powinien rozważyć stosunek ryzyka do potencjalnych korzyści ze stosowania sunitynibu. Pacjentów, a w szczególności pacjentów z kardiologicznymi czynnikami ryzyka i (lub) chorobą wieńcową w wywiadzie, należy uważnie monitorować pod kątem występowania ewentualnych klinicznych objawów podmiotowych i przedmiotowych zastoinowej niewydolności serca podczas stosowania sunitynibu. Należy również rozważyć wykonywanie oznaczeń LVEF na początku terapii i okresowo w trakcie leczenia sunitynibem. U pacjentów, u których nie występują kardiologiczne czynniki ryzyka należy rozważyć wykonanie wyjściowej oceny frakcji wyrzutowej.
W przypadku wystąpienia objawów klinicznych zastoinowej niewydolności serca zaleca się przerwanie stosowania sunitynibu. U pacjentów bez klinicznych objawów zastoinowej niewydolności serca, ale z frakcją wyrzutową < 50% i >20% poniżej wartości wyjściowej należy przerwać stosowanie sunitynibu i (lub) zmniejszyć dawkę.
Wydłużenie odstępu QT oraz torsade de pointes obserwowano u pacjentów otrzymujących sunitynib. Wydłużenie odstępu QT może prowadzić do zwiększenia ryzyka występowania komorowych zaburzeń rytmu, w tym typu torsade de pointes.
Należy zachować ostrożność podczas stosowania sunitynibu u pacjentów z wydłużonym odstępem QT w wywiadzie, pacjentów przyjmujących leki przeciwarytmiczne lub leki mogące powodować wydłużenie odstępu QT oraz u pacjentów z istotnymi chorobami serca w wywiadzie, bradykardią lub zaburzeniami elektrolitowymi. Należy ograniczyć jednoczesne podawanie sunitynibu z silnymi inhibitorami CYP3A4, które mogą powodować zwiększenie stężenia sunitynibu w osoczu (patrz punkty 4.2, 4.5 i 4.8).
Żylne zaburzenia zakrzepowo-zatorowe
U pacjentów, którzy przyjmowali sunitynib, zgłaszano związane z leczeniem epizody żylnej choroby zakrzepowo-zatorowej, w tym zakrzepicę żył głębokich oraz zator tętnicy płucnej (patrz punkt 4.8). W ramach nadzoru po wprowadzeniu produktu leczniczego zawierającego sunitynib do obrotu obserwowano przypadki zatoru tętnicy płucnej zakończone zgonem.
Tętnicze zdarzenia zakrzepowo-zatorowe
U pacjentów leczonych sunitynibem obserwowano przypadki tętniczych zdarzeń zakrzepowo- zatorowych, czasem prowadzących do zgonu. Najczęstszymi z takich zdarzeń były: udar naczyniowy mózgu, przemijający napad niedokrwienny i zawał mózgu. Do czynników ryzyka związanych z tętniczymi zdarzeniami zakrzepowo-zatorowymi, poza chorobą nowotworową i wiekiem ≥ 65 lat, należały: nadciśnienie tętnicze, cukrzyca i choroba zakrzepowo-zatorowa w wywiadzie.
Tętniak i rozwarstwienie tętnicy
Stosowanie inhibitorów szlaku czynników wzrostu śródbłonka naczyniowego (ang. VEGF, vascular endothelial growth factor) u pacjentów z nadciśnieniem tętniczym lub bez nadciśnienia tętniczego może sprzyjać tworzeniu tętniaka i (lub) rozwarstwieniu tętnicy. Przed rozpoczęciem stosowania sunitynibu należy starannie rozważyć ryzyko wystąpienia tych działań niepożądanych u pacjentów z czynnikami ryzyka, takimi, jak nadciśnienie tętnicze lub tętniak w wywiadzie.
Mikroangiopatia zakrzepowa
W przypadku wystąpienia niedokrwistości hemolitycznej, małopłytkowości, zmęczenia, objawów neurologicznych o charakterze zmiennym, zaburzeń czynności nerek oraz gorączki należy rozważyć możliwość wystąpienia mikroangiopatii zakrzepowej, w tym zakrzepowej plamicy
małopłytkowej i zespołu hemolityczno-mocznicowego, czasami prowadzących do niewydolności nerek lub zgonu. U pacjentów, u których rozwinęła się mikroangiopatia zakrzepowa, należy przerwać terapię sunitynibem i szybko rozpocząć odpowiednie leczenie. Po zaprzestaniu leczenia obserwowano ustąpienie objawów mikroangiopatii zakrzepowej (patrz punkt 4.8).
Zaleca się wstępne badania laboratoryjne czynności tarczycy u wszystkich pacjentów. Pacjenci z niedoczynnością tarczycy lub nadczynnością tarczycy w wywiadzie powinni być leczeni w sposób standardowy przed włączeniem leczenia sunitynibem. W trakcie leczenia sunitynibem należy kontrolować regularnie co 3 miesiące czynność tarczycy. Ponadto, pacjenci w czasie leczenia powinni być starannie obserwowani, czy nie występują u nich przedmiotowe i podmiotowe objawy zaburzeń czynności tarczycy. U pacjentów z objawami wskazującymi na zaburzenia czynności tarczycy konieczne jest wykonywanie badań laboratoryjnych czynności tarczycy zgodnie z klinicznymi wskazaniami. Pacjenci, u których rozwiną się zaburzenia czynności tarczycy powinni być leczeni zgodnie z obowiązującymi standardami.
Zarówno we wczesnym, jak i późniejszym okresie leczenia sunitynibem opisywano przypadki niedoczynności tarczycy (patrz punkt 4.8).
U pacjentów z różnymi guzami litymi otrzymujących sunitynib, obserwowano zwiększenie aktywności lipazy i amylazy w surowicy. Wzrost aktywności lipazy był przemijający i na ogół nie towarzyszyły mu objawy podmiotowe i przedmiotowe zapalenia trzustki (patrz punkt 4.8).
Zgłaszano przypadki ciężkich działań niepożądanych ze strony trzustki, w niektórych przypadkach prowadzące do zgonu. W przypadku wystąpienia u pacjenta objawów zapalenia trzustki, należy przerwać stosowanie sunitynibu i zapewnić właściwe leczenie wspomagające.
U pacjentów leczonych sunitynibem obserwowano przypadki hepatotoksyczności. Przypadki niewydolności wątroby, z których część zakończyła się zgonem, opisywano u < 1% pacjentów z nowotworami litymi leczonych sunitynibem. Należy kontrolować parametry czynnościowe wątroby (aktywność aminotransferazy alaninowej [AlAT] i asparaginianowej [AspAT] oraz stężenie bilirubiny) przed rozpoczęciem leczenia, podczas każdego cyklu leczenia oraz w przypadku wystąpienia wskazań klinicznych. W przypadku wystąpienia objawów niewydolności wątroby należy przerwać stosowanie sunitynibu i zapewnić odpowiednie leczenie podtrzymujące (patrz punkt 4.8).
Obserwowano przypadki zaburzenia czynności nerek, niewydolności nerek i (lub) ostrej niewydolności nerek, które w niektórych przypadkach kończyły się zgonem (patrz punkt 4.8).
Do czynników ryzyka związanych z zaburzeniami czynności nerek i (lub) niewydolnością nerek u pacjentów otrzymujących sunitynib, poza rakiem nerkowokomórkowym, należały: podeszły wiek, cukrzyca, współistniejące zaburzenia czynności nerek, niewydolność serca, nadciśnienie tętnicze, sepsa, odwodnienie i (lub) hipowolemia oraz rabdomioliza.
Bezpieczeństwo stosowania sunitynibu u pacjentów z umiarkowanym lub ciężkim białkomoczem nie zostało odpowiednio zbadane.
Opisywano przypadki białkomoczu oraz rzadkie przypadki zespołu nerczycowego. Zaleca się przeprowadzenie badania moczu na początku leczenia oraz monitorowanie pacjentów w kierunku
wystąpienia lub nasilenia białkomoczu. U pacjentów z zespołem nerczycowym należy przerwać stosowanie sunitynibu.
W przypadku tworzenia się przetok, leczenie sunitynibem powinno zostać przerwane. Dostępna jest ograniczona ilość informacji dotyczących kontynuacji stosowania sunitynibu u pacjentów z przetokami (patrz punkt 4.8).
Nieprawidłowy proces gojenia się ran
Podczas leczenia sunitynibem opisywano przypadki nieprawidłowego procesu gojenia się ran.
Nie przeprowadzano żadnych formalnych badań klinicznych oceniających wpływ stosowania sunitynibu na gojenie się ran. U pacjentów poddawanych dużym zabiegom chirurgicznym zaleca się, jako środek ostrożności, czasowe przerwanie leczenia sunitynibem. Istnieje ograniczone doświadczenie kliniczne dotyczące właściwego momentu ponownego włączenia sunitynibu po dużych interwencjach chirurgicznych. W związku z tym, decyzja o ponownym rozpoczęciu stosowania sunitynibu po dużych interwencjach chirurgicznych powinna być podejmowana w oparciu o kliniczną ocenę przebiegu rekonwalescencji po zabiegu.
Martwica kości szczęki i (lub) żuchwy
Zgłaszano przypadki martwicy kości szczęki/żuchwy (ang. ONJ, Osteonecrosis of the Jaw) u pacjentów leczonych sunitynibem. Większość z nich odnotowano u osób przyjmujących wcześniej lub jednocześnie dożylnie bisfosfoniany, u których ONJ stanowi rozpoznane zagrożenie. Z tego względu należy zachować ostrożność w przypadku jednoczesnego lub sekwencyjnego stosowania sunitynibu i dożylnie bisfosfonianów.
Inwazyjne procedury dentystyczne są także znanym czynnikiem ryzyka rozwoju ONJ. Przed rozpoczęciem stosowania sunitynibu należy rozważyć przeprowadzenie badania stomatologicznego i wdrożyć odpowiednie działania zapobiegawcze. U pacjentów przyjmujących wcześniej lub stosujących obecnie bisfosfoniany dożylnie, w miarę możliwości należy unikać inwazyjnych procedur dentystycznych (patrz punkt 4.8).
Nadwrażliwość i (lub) obrzęk naczynioruchowy
W przypadku wystąpienia obrzęku naczynioruchowego spowodowanego nadwrażliwością, stosowanie sunitynibu powinno zostać przerwane, a pacjenci powinni zostać objęci standardową opieką medyczną (patrz punkt 4.8).
W badaniach klinicznych sunitynibu oraz w ramach nadzoru po wprowadzeniu produktu leczniczego zawierającego sunitynib do obrotu zgłaszano występowanie drgawek. U pacjentów z drgawkami i objawami podmiotowymi i (lub) przedmiotowymi wskazującymi na obecność zespołu odwracalnej tylnej leukoencefalopatii (ang. RPLS, reversible posterior leukoencephalopathy syndrome), takimi jak nadciśnienie, ból głowy, zmniejszona czujność, zmiany psychiczne i utrata wzroku, w tym ślepota korowa, należy kontrolować występujące zaburzenia poprzez zastosowanie właściwego leczenia, w tym farmakologicznej kontroli nadciśnienia. Zaleca się tymczasowe przerwanie stosowania sunitynibu. Po ustąpieniu objawów lekarz prowadzący może podjąć decyzję o kontynuacji leczenia (patrz punkt 4.8).
W badaniach klinicznych oraz w ramach nadzoru po wprowadzeniu do obrotu u pacjentów leczonych sunitynibem rzadko obserwowano przypadki zespołu ostrego rozpadu guza; niektóre z nich prowadziły do zgonu. Czynniki ryzyka zespołu ostrego rozpadu guza obejmują dużą wielkość guza, przewlekłą niewydolność nerek w wywiadzie, skąpomocz, odwodnienie, niedociśnienie
tętnicze i kwaśny odczyn moczu. Pacjentów należy ściśle obserwować i podjąć leczenie w razie wystąpienia wskazań klinicznych, oraz rozważyć zastosowanie nawodnienia pacjenta jako profilaktyki.
Zgłaszano ciężkie zakażenia, z neutropenią lub bez neutropenii, w tym niektóre zakończone zgonem. Zgłaszano nieliczne przypadki martwiczego zapalenia powięzi, w tym krocza, czasami prowadzące do zgonu (patrz punkt 4.8).
U pacjentów, u których wystąpi martwicze zapalenie powięzi, należy przerwać stosowanie sunitynibu i niezwłocznie wdrożyć odpowiednie leczenie.
Podczas leczenia sunitynibem zgłaszano zmniejszenie stężenia glukozy we krwi, w niektórych przypadkach klinicznie objawowe i wymagające hospitalizacji z powodu utraty przytomności. W przypadku objawowej hipoglikemii należy tymczasowo przerwać podawanie sunitynibu. U pacjentów z cukrzycą należy regularnie sprawdzać stężenie glukozy we krwi w celu oceny, czy konieczne jest dostosowanie dawki leku przeciwcukrzycowego, aby zminimalizować ryzyko wystąpienia hipoglikemii (patrz punkt 4.8).
Sód
Ten produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na kapsułkę, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
Produkt Asikreba 37,5 mg kapsułki zawiera żółcień pomarańczową FCF (E110) i tartrazynę (E102) które mogą powodować reakcje alergiczne.
Badania dotyczące interakcji przeprowadzono wyłącznie u dorosłych. Produkty lecznicze, które mogą zwiększać stężenie sunitynibu w osoczu
Równoczesne podanie jednorazowej dawki sunitynibu z silnym inhibitorem CYP3A4, ketokonazolem, powodowało u zdrowych ochotników wzrost wartości maksymalnej sumy stężenia sunitynibu i jego głównego metabolitu (Cmax) o 49% i pola powierzchni pod krzywą zależności sumy stężenia sunitynibu i jego głównego metabolitu we krwi od czasu (AUC0-∞) o 51%.
Podawanie sunitynibu jednocześnie z silnymi inhibitorami CYP3A4 (np. rytonawirem, itrakonazolem, erytromycyną, klarytromycyną, sokiem grejpfrutowym) może wiązać się ze zwiększeniem stężenia sunitynibu.
Z tego względu należy unikać jednoczesnego podawania sunitynibu z inhibitorami CYP3A4 lub należy rozważyć wybranie do leczenia skojarzonego alternatywnego produktu o minimalnym działaniu hamującym CYP3A4, lub bez takiego działania.
Jeżeli nie jest to możliwe, może zaistnieć konieczność zmniejszenia dawki produktu Asikreba do minimum 37,5 mg na dobę w przypadku GIST i MRCC lub 25 mg na dobę w przypadku pNET, na podstawie dokładnie monitorowanej tolerancji (patrz punkt 4.2).
Wpływ inhibitorów białka oporności raka piersi (ang. BCRP, breast cancer resistance protein) Dane kliniczne dotyczące interakcji między sunitynibem a inhibitorami BCRP są ograniczone, więc nie można wykluczyć możliwości występowania interakcji między sunitynibem a innymi inhibitorami BCRP (patrz punkt 5.2).
Produkty lecznicze, które mogą zmniejszyć stężenie sunitynibu w osoczu
Równoczesne podanie jednorazowej dawki sunitynibu z induktorem CYP3A4, ryfampicyną, powodowało u zdrowych ochotników redukcję wartości maksymalnej sumy stężeń sunitynibu i jego głównego metabolitu (Cmax) i AUC0-∞ odpowiednio o 23% i 46%.
Podawanie sunitynibu z silnymi induktorami CYP3A4 (np. deksametazonem, fenytoiną, karbamazepiną, ryfampicyną, fenobarbitalem lub produktami zawierającymi ziele dziurawca (Hypericum perforatum) może prowadzić do zmniejszenia stężenia sunitynibu. Z tego względu należy unikać jednoczesnego stosowania z induktorami CYP3A4, bądź też należy rozważyć wybranie do leczenia skojarzonego innego produktu leczniczego, o minimalnym działaniu indukującym CYP3A4 lub bez takiego działania. Jeżeli nie jest to możliwe, może zaistnieć konieczność stopniowego zwiększania dawek produktu Asikreba, za każdym razem o 12,5 mg (do 87,5 mg na dobę w przypadku GIST i MRCC lub 62,5 mg na dobę w przypadku pNET) na podstawie dokładnie monitorowanej tolerancji (patrz punkt 4.2).
Antykoncepcja u mężczyzn i kobiet
Kobietom w wieku rozrodczym należy doradzić stosowanie skutecznej metody antykoncepcyjnej oraz odradzić zajście w ciążę podczas leczenia produktem Asikreba.
Nie przeprowadzono badań dotyczących stosowania sunitynibu u kobiet w ciąży. W badaniach na zwierzętach stwierdzono toksyczny wpływ leku na zdolność do rozrodu, objawiający się m.in. wadami wrodzonymi płodów (patrz punkt 5.3). Produktu Asikreba nie należy stosować w czasie ciąży lub u kobiet, które nie stosują skutecznej metody antykoncepcyjnej z wyjątkiem przypadku, gdy potencjalne korzyści z leczenia przeważają nad potencjalnym ryzykiem dla płodu. Jeżeli produkt Asikreba zostanie zastosowany w czasie ciąży lub jeżeli pacjentka zajdzie w ciążę w trakcie stosowania produktu Asikreba, należy ją poinformować o potencjalnym zagrożeniu dla płodu.
Sunitynib i (lub) jego metabolity przenikają do mleka szczurów. Nie wiadomo, czy sunitynib lub jego główny czynny metabolit przenikają do mleka ludzkiego. Ze względu na to, że substancje czynne często przenikają do mleka ludzkiego i ze względu na możliwe występowanie ciężkich działań niepożądanych u niemowląt karmionych piersią, kobiety nie powinny karmić piersią podczas stosowania produktu Asikreba.
Dane niekliniczne wskazują, że leczenie sunitynibem może wywierać niekorzystny wpływ na płodność kobiet i mężczyzn (patrz punkt 5.3).
Produktu Asikreba wywiera niewielki wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Pacjenci powinni być poinformowani o możliwości wystąpienia zawrotów głowy w trakcie leczenia sunitynibem.
Podsumowanie profilu bezpieczeństwa
Najcięższe działania niepożądane związane z leczeniem sunitynibem to: niewydolność nerek, niewydolność serca, zator tętnicy płucnej, perforacja przewodu pokarmowego oraz krwotoki (np.
krwotok z układu oddechowego, przewodu pokarmowego, guza, układu moczowego oraz krwotok mózgowy); niektóre z nich prowadziły do zgonu. Do najczęściej zgłaszanych działań niepożądanych o dowolnym stopniu nasilenia (występujących u pacjentów w badaniach rejestracyjnych RCC, GIST i pNET) należały: zmniejszenie apetytu, zaburzenia smaku, nadciśnienie tętnicze, uczucie zmęczenia, zaburzenia ze strony przewodu pokarmowego (takie jak biegunka, nudności, zapalenie jamy ustnej, niestrawność i wymioty), przebarwienia skórne oraz erytrodyzestezja dłoniowo- podeszwowa. Nasilenie tych objawów może się zmniejszać wraz z kontynuacją leczenia. Podczas leczenia może rozwinąć się niedoczynność tarczycy. Do najczęściej występujących działań niepożądanych należą zaburzenia hematologiczne (np. neutropenia, małopłytkowość i niedokrwistość).
Prowadzące do zgonu zdarzenia niepożądane inne niż wymienione w punkcie 4.4 powyżej lub w punkcie 4.8 poniżej, których związek ze stosowaniem sunitynibu uznano za możliwy, obejmowały niewydolność wielonarządową, rozsiane krzepnięcie wewnątrznaczyniowe, krwotok do jamy otrzewnowej, niewydolność nadnerczy, odmę opłucnową, wstrząs lub nagły zgon.
Tabelaryczne zestawienie działań niepożądanych
Poniżej wymieniono działania niepożądane zgłaszane przez pacjentów z GIST, MRCC i pNET w danych zbiorczych obejmujących 7115 pacjentów, częstości występowania i stopnia ciężkości (NCI- CTCAE). Włączono również działania niepożądane stwierdzone w badaniach klinicznych po dopuszczeniu sunitynibu do obrotu. W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
Częstość występowania zdefiniowano następująco: bardzo często (≥1/10), często (od ≥1/100 do
<1/10), niezbyt często (od ≥1/1000 do <1/100), rzadko (od ≥1/10 000 do <1/1000), bardzo rzadko (<1/10 000), częstość nieznana (nie może być określona na podstawie dostępnych danych).
Tabela 1. Działania niepożądane zgłaszane w badaniach klinicznych
Klasyfikacja układów i narządów | Bardzo często | Często | Niezbyt często | Rzadko | Częstość nieznana |
Zakażenia i zarażenia pasożytnicze | Zakażenia wirusowea Zakażenia układu oddechowegob,* Ropieńc,* Zakażenia grzybiczed Zakażenia dróg moczowych Zakażenia skórye Posocznicaf,* | Martwicze zapalenie powięzi* Zakażenia bakteryjneg | |||
Zaburzenia krwi i układu chłonnego | Neutropenia Małopłytkowość Niedokrwistość Leukopenia | Limfopenia | Pancytopenia | Mikroangiopatia zakrzepowah,* | |
Zaburzenia układu immunologicz nego | Nadwrażliwość | Obrzęk naczynioruchowy | |||
Zaburzenia endokrynolog iczne | Niedoczynność tarczycy | Nadczynność tarczycy | Zapalenie tarczycy |
Zaburzenia metabolizmu i odżywiania | Zmniejszenie łaknieniai | Odwodnienie Hipoglikemia | Zespół ostrego rozpadu guza* | ||
Zaburzenia psychiczne | Bezsenność | Depresja | |||
Zaburzenia układu nerwowego | Zawroty głowy Bóle głowy Zaburzenia smakuj | Neuropatia obwodowa Parestezje Niedoczulica Przeczulica | Krwotok mózgowy* Udar mózgu* Przemijający napad niedokrwienny | Zespół odwracalnej tylnej encefalopatii* | |
Zaburzenia oka | Obrzęk tkanek oczodołu Obrzęk powiek Zwiększone łzawienie | ||||
Zaburzenia serca | Niedokrwienie mięśnia sercowegok,* Zmniejszenie frakcji wyrzutowejl | Zastoinowa niewydolność serca Zawał mięśnia sercowegom,* Niewydolność serca* Kardiomio- patia* Wysięk osierdziowy Wydłużenie odstępu QT w EKG | Niewydolność lewokomorowa* Zaburzenia rytmu typu torsade de pointes | ||
Zaburzenia naczyniowe | Nadciśnienie tętnicze | Zakrzepica żył głębokich Uderzenia gorąca Nagłe zaczerwienienie twarzy | Krwotok z guza* | Tętniak i rozwarstwie- nie tętnicy* | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Duszność Krwotok z nosa Kaszel | Zator tętnicy płucnej* Wysięk opłucnowy* Krwioplucie Duszność wysiłkowa Ból jamy ustnej i gardłan Niedrożność nosa Suchość błon śluzowych nosa | Krwotok płucny* Niewydolność oddechowa* |
Zaburzenia żołądka i jelit | Zapalenie błony śluzowej jamy ustnejo Ból brzuchap Wymioty Biegunka Niestrawność Nudności Zaparcia | Choroba refluksowa przełyku Dysfagia Krwotok z przewodu pokarmowego* Zapalenie przełyku* Wzdęcie brzucha Dyskomfort w nadbrzuszu Krwotok z odbytu Krwawienie z dziąseł Owrzodzenie jamy ustnej Ból odbytu Zapalenie warg Guzki krwawnicze Ból języka Ból w jamie ustnej Suchość w jamie ustnej Wzdęcia Dyskomfort w jamie ustnej Odbijanie się ze zwracaniem treści żołądkowej lub gazu | Perforacja przewodu pokarmowegoq,* Zapalenie trzustki Przetoka odbytu Zapalenie jelita grubegor | ||
Zaburzenia wątroby i dróg żółciowych | Niewydolność wątroby* Zapalenie pęcherzyka żółciowegor,* Zaburzenia czynności wątroby | Zapalenie wątroby | |||
Zaburzenia skóry i tkanki podskórnej | Przebarwienia skórys Zespół erytrodyzestezji dłoniowopode- szwowej Wysypkat Zmiany koloru włosów Suchość skóry | Złuszczanie skóry Reakcje skórneu Egzema Pęcherze Rumień Łysienie Trądzik Świąd Hiperpigmentacja skóry Zmiany skórne Rogowacenie skóry Zapalenie skóry Zaburzenia dotyczące płytki paznokciowejv | Rumień wielopostaciowy* Zespół Stevensa- Johnsona* Piodermia zgorzelinowa Martwica toksyczno- rozpływna naskórka* |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Ból w kończynach Bóle stawowe Ból pleców | Bóle mięśniowo- szkieletowe Kurcze mięśni Bóle mięśniowe Osłabienie mięśni | Martwica kości szczęki i (lub) żuchwy Przetoka* | Rabdomioliza* Miopatia | |
Zaburzenia nerek i dróg moczowych | Niewydolność nerek* Ostra niewydolność nerek* Zmiana barwy moczu Białkomocz | Krwotok z dróg moczowych | Zespół nerczycowy | ||
Zaburzenia ogólne i stany w miejscu podania | Zapalenie błon śluzowych Uczucie zmęczeniax Obrzęky Gorączka | Ból w klatce piersiowej Ból Zespół rzekomogrypowy Dreszcze | Nieprawidłowy proces gojenia się ran | ||
Badania diagnostyczne | Zmniejszenie masy ciała Zmniejszenie liczby białych krwinek Zwiększenie aktywności lipazy Zmniejszenie liczby płytek krwi Zmniejszenie stężenia hemoglobiny Zwiększona aktywność amylazyz Zwiększona aktywność aminotransferazy asparaginianowej Zwiększona aktywność aminotransferazy alaninowej Zwiększone stężenie kreatyniny we krwi Zwiększone ciśnienie tętnicze Zwiększone stężenie kwasu moczowego we krwi | Zwiększenie aktywności fosfokinazy kreatynowej we krwi Zwiększone stężenie TSH we krwi |
* W tym przypadki zgonów
Następujące zdarzenia zostały połączone w jedną kategorię:
Opis wybranych działań niepożądanych
Zakażenia i zarażenia pasożytnicze
Zgłaszano przypadki ciężkiego zakażenia (z neutropenią lub bez neutropenii), w tym przypadki prowadzące do zgonu. Zgłaszano przypadki nekrotycznego zapalenia powięzi, w tym krocza, czasami prowadzące do zgonu (patrz również punkt 4.4).
Zaburzenia krwi i układu chłonnego
Zmniejszenie bezwzględnej liczby neutrofili 3. i 4. stopnia ciężkości stwierdzono, odpowiednio u 10% i 1,7% pacjentów z GIST w badaniu III fazy, u 16% i 1,6% pacjentów z MRCC w badaniu III fazy i u 13% i 2,4% pacjentów z pNET w badaniu III fazy. Zmniejszenie liczby płytek krwi 3. i 4. stopnia ciężkości obserwowano odpowiednio u 3,7% i 0,4% pacjentów z GIST w badaniu III fazy, u 8,2% i 1,1% pacjentów z MRCC w badaniu III fazy i u 3,7% i 1,2% pacjentów z pNET w badaniu III fazy (patrz punkt 4.4).
W badaniu klinicznym III fazy dotyczącym GIST krwawienia zgłoszono u 18% pacjentów otrzymujących sunitynib i 17% pacjentów otrzymujących placebo. W grupie pacjentów wcześniej nieleczonych z powodu raka nerkowokomórkowego z przerzutami (MRCC) - krwawienia występowały u 39% pacjentów otrzymujących sunitynib i u 11% pacjentów otrzymujących interferonalfa (IFN-α). Krwawienia stopnia 3. lub wyższego wystąpiły u 17 (4,5%) pacjentów otrzymujących sunitynib i 5 (1,7%) pacjentów otrzymujących IFN-α. W grupie pacjentów otrzymujących sunitynib w leczeniu MRCC opornego na leczenie cytokinami krwawienia wystąpiły u 26%. W badaniu klinicznym III fazy dotyczącym leczenia pNET krwawienia (z wyjątkiem krwawienia z nosa) obserwowano u 21,7% pacjentów otrzymujących sunitynib i u 9,85% pacjentów otrzymujących placebo (patrz punkt 4.4).
W badaniach klinicznych krwotoki z guza nowotworowego występowały u około 2% pacjentów z GIST.
Zaburzenia układu immunologicznego
Zgłaszano przypadki reakcji nadwrażliwości, w tym przypadki obrzęku naczynioruchowego (patrz punkt 4.4).
W 2 badaniach z udziałem pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC) opornym na leczenie cytokinami, u 7 pacjentów (4%) otrzymujących sunitynib wystąpiła niedoczynność tarczycy jako działanie niepożądane leku. W badaniu z udziałem pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC) wcześniej nieleczonych, niedoczynność tarczycy wystąpiła u 61 pacjentów (16%) w grupie otrzymującej sunitynib i u 3 pacjentów (<1%) w grupie otrzymującej IFN-α.
Ponadto u 4 pacjentów (2%) z rakiem nerkowokomórkowym z przerzutami (MRCC) opornym na leczenie cytokinami stwierdzono podwyższenie stężenia tyreotropiny (ang. TSH, thyroid-stimulating hormone). Ogółem u 7% pacjentów z rakiem nerkowokomórkowym z przerzutami (ang. MRCC) stwierdzono kliniczne lub laboratoryjne objawy niedoczynności tarczycy rozwijającej się w trakcie leczenia. Nabytą niedoczynność tarczycy stwierdzono u 6,2% pacjentów z GIST otrzymujących sunitynib i u 1% pacjentów otrzymujących placebo. W badaniu III fazy dotyczącym leczenia pNET niedoczynność tarczycy stwierdzono u 6 pacjentów (7,2%) otrzymujących sunitynib i u 1 pacjenta (1,2%) otrzymującego placebo.
Czynność tarczycy monitorowano w 2 prospektywnych badaniach z udziałem pacjentek z nowotworem piersi. Sunitynib nie jest dopuszczony do stosowania w leczeniu nowotworów piersi. W pierwszym ze wspomnianych badań niedoczynność tarczycy zgłoszono u 15 (13,6%) pacjentek otrzymujących sunitynib oraz u 3 (2,9%) pacjentek poddanych standardowym schematom leczenia. Podwyższone stężenie TSH we krwi wystąpiło u 1 (0,9%) pacjentki otrzymującej sunitynib, a w grupie pacjentek poddanych standardowym schematom leczenia nie wystąpiło u żadnej z nich.
Nadczynność tarczycy nie wystąpiła u żadnej z pacjentek otrzymujących sunitynib, wystąpiła natomiast u 1 (1,0%) pacjentki poddanej standardowemu schematowi leczenia. W drugim ze wspomnianych badań niedoczynność tarczycy wystąpiła łącznie u 31 (13%) pacjentek otrzymujących sunitynib oraz u 2 (0,8%) pacjentek otrzymujących kapecytabinę. Podwyższone stężenie TSH we krwi wystąpiło u 12 (5,0%) pacjentek otrzymujących sunitynib, a w grupie pacjentek otrzymujących kapecytabinę nie wystąpiło u żadnej z nich. Nadczynność tarczycy wystąpiła u 4 (1,7%) pacjentek otrzymujących sunitynib, a w grupie pacjentek otrzymujących kapecytabinę nie wystąpiła u żadnej z nich. Obniżone stężenie TSH we krwi wystąpiło u 3 (1,3%) pacjentek otrzymujących sunitynib, a w grupie pacjentek otrzymujących kapecytabinę nie wystąpiło u żadnej z nich. Podwyższone stężenie T4 we krwi wystąpiło u 2 (0,8%) pacjentek otrzymujących sunitynib oraz u 1 (0,4%) pacjentki otrzymującej kapecytabinę. Podwyższone stężenie T3 we krwi wystąpiło u 1 (0,8%) pacjentki otrzymującej sunitynib, natomiast w grupie pacjentek otrzymujących kapecytabinę nie wystąpiło u żadnej z nich. Wszystkie zgłoszone zdarzenia związane z czynnością tarczycy były 1. lub 2. stopnia ciężkości (patrz punkt 4.4).
Zaburzenia metabolizmu i odżywiania
Częstsze przypadki zdarzeń hipoglikemicznych zgłoszono u pacjentów z pNET w porównaniu z pacjentami z MRCC i GIST. Jednak większość działań niepożądanych obserwowanych w badaniach klinicznych nie została uznana za powiązane z leczeniem zastosowanym w badaniu (patrz punkt 4.4).
W badaniach klinicznych sunitynibu oraz w ramach nadzoru po wprowadzeniu produktu leczniczego zawierającego sunitynib do obrotu zgłoszono kilka przypadków (< 1%) wystąpienia drgawek i objawów radiologicznych zespołu odwracalnej tylnej leukoencefalopatii (RPLS); niektóre z nich zakończyły się zgonem. Drgawki obserwowano zarówno u pacjentów z obecnymi, jak i nieobecnymi objawami radiologicznymi przerzutów do mózgu (patrz punkt 4.4).
W badaniach klinicznych zmniejszenie frakcji wyrzutowej lewej komory (ang. LVEF, left ventricular ejection fraction) o 20% i poniżej dolnej granicy normy wystąpiło u około 2% pacjentów z GIST leczonych sunitynibem, u 4% pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC) opornym na leczenie cytokinami i u 2% pacjentów z GIST otrzymujących placebo. Nie wydaje się, aby spadek LVEF był postępujący, gdyż wartości tego parametru często ulegały poprawie w miarę kontynuowania leczenia. W badaniu klinicznym z udziałem pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC) wcześniej nieleczonym, wartości LVEF poniżej dolnej granicy normy wystąpiły u 27% pacjentów otrzymujących sunitynib i u 15% pacjentów, którzy otrzymywali IFN- α. U dwóch pacjentów (<1%) otrzymujących sunitynib rozpoznano przewlekłą niewydolność serca.
U pacjentów z GIST zdarzenia zakwalifikowane jako „niewydolność serca”, „zastoinowa niewydolność serca” lub „lewokomorowa niewydolność serca” wystąpiły u 1,2% pacjentów leczonych sunitynibem i 1% pacjentów otrzymujących placebo. W badaniu rejestracyjnym III fazy u pacjentów z GIST (N = 312) działania niepożądane ze strony układu krążenia zakończone zgonem wystąpiły u 1% pacjentów w każdej z grup (tj. w grupach otrzymujących sunitynib i placebo). W badaniu II fazy z udziałem pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC) opornym na leczenie cytokinami u 0,9% pacjentów wystąpił związany z leczeniem zawał mięśnia sercowego zakończony zgonem, natomiast wśród pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC) dotychczas nieleczonych w badaniu III fazy, zdarzenia niepożądane ze strony układu krążenia zakończone zgonem wystąpiły u 0,6% pacjentów w grupie otrzymującej IFN- i u 0% pacjentów w grupie otrzymującej sunitynib. W badaniu III fazy dotyczącym pNET u jednego pacjenta (1%) otrzymującego sunitynib wystąpiła niewydolność serca zakończona zgonem związana z zastosowanym leczeniem.
Zaburzenia naczyniowe
Nadciśnienie tętnicze było bardzo częstym działaniem niepożądanym raportowanym w badaniach klinicznych. U około 2,7% pacjentów, u których wystąpiło nadciśnienie tętnicze, zmniejszono dawkę sunitynibu lub tymczasowo wstrzymano jego podawanie. U żadnego z tych pacjentów sunitynibu nie odstawiono jednak całkowicie. Ciężkie nadciśnienie tętnicze (ciśnienie skurczowe > 200 mm Hg lub ciśnienie rozkurczowe > 110 mm Hg) wystąpiło u 4,7% pacjentów z guzami litymi. Nadciśnienie tętnicze obserwowano u około 33,9% pacjentów otrzymujących sunitynib z powodu dotychczas nieleczonego raka nerkowokomórkowego z przerzutami (MRCC) i u 3,6% pacjentów otrzymujących IFN- α. Ciężkie nadciśnienie tętnicze wystąpiło u 12% dotychczas nieleczonych pacjentów otrzymujących sunitynib i u < 1% pacjentów otrzymujących IFN- α. W badaniu III fazy dotyczącym pNET nadciśnienie tętnicze wystąpiło u 26,5% pacjentów otrzymujących sunitynib i u 4,9% pacjentów otrzymujących placebo. Ciężkie nadciśnienie tętnicze stwierdzono u 10% pacjentów z pNET leczonych sunitynibem i u 3% pacjentów otrzymujących placebo.
Incydenty żylnej choroby zakrzepowo-zatorowej (ŻChZZ)
Incydenty ŻChZZ związane z leczeniem wystąpiły u około 1,0% pacjentów z guzami litymi, którzy otrzymywali sunitynib w badaniach klinicznych, w tym u pacjentów z GIST i RCC.
W badaniu klinicznym III fazy z udziałem pacjentów z GIST incydenty ŻChZZ wystąpiły u 7 (3%) pacjentów w grupie otrzymującej sunitynib, natomiast w grupie otrzymującej placebo nie wystąpiły u żadnego z pacjentów. U 5 z 7 pacjentów rozpoznano zakrzepicę żył głębokich 3. stopnia, a u 2 pacjentów – 1. lub 2. stopnia. U 4 z 7 pacjentów przerwano leczenie po wystąpieniu pierwszych objawów zakrzepicy żył głębokich.
Incydenty ŻChZZ wystąpiły u 13 (3%) pacjentów otrzymujących sunitynib w badaniu III fazy dotyczącym wcześniej nieleczonego raka nerkowokomórkowego z przerzutami (MRCC) i u 4 (2%)
pacjentów w 2 badaniach dotyczących raka nerkowokomórkowego z przerzutami (MRCC) opornego na leczenie cytokinami. U 9 z tych pacjentów wystąpiła zatorowość płucna – u 1 pacjenta
2. stopnia, a u 8 pacjentów 4. stopnia. U 8 z tych pacjentów rozpoznano zakrzepicę żył głębokich: 1 przypadek 1. stopnia, 2 przypadki 2. stopnia, 4 przypadki 3. stopnia i 1 przypadek 4. stopnia. U 1 pacjenta z zatorowością płucną w badaniu dotyczącym raka nerkowokomórkowego z przerzutami (MRCC) opornego na leczenie cytokinami podawanie leku przerwano.
W grupie dotychczas nieleczonych pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC), którzy otrzymywali IFN-α, incydenty ŻChZZ wystąpiły u 6 (2%) pacjentów: u 1 (< 1%) pacjenta wystąpiła zakrzepica żył głębokich 3. stopnia, a u 5 (1%) pacjentów — zatorowość płucna
4. stopnia.
W badaniu III fazy dotyczącym pNET incydenty ŻChZZ zgłoszono u 1 (1,2%) pacjenta w grupie otrzymującej sunitynib i u 5 (6,1%) pacjentów w grupie otrzymującej placebo. U dwóch spośród pacjentów otrzymujących placebo wystąpiła zakrzepica żył głębokich, u jednego 2. stopnia, a u drugiego 3. stopnia.
W badaniach rejestracyjnych u pacjentów z GIST, MRCC i pNET nie zgłoszono żadnego przypadku zgonu. Przypadki zakończone zgonem wystąpiły natomiast w ramach nadzoru po wprowadzeniu produktu leczniczego zawierającego sunitynib do obrotu.
Przypadki zatorowości płucnej wystąpiły u około 3,1% pacjentów z GIST i u około 1,2% pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC), którzy otrzymywali sunitynib w badaniach III fazy. W badaniu III fazy z udziałem pacjentów z pNET otrzymujących sunitynib nie stwierdzono żadnego przypadku zatorowości płucnej. Rzadkie przypadki zakończone zgonem wystąpiły natomiast w ramach nadzoru po wprowadzeniu produktu leczniczego zawierającego sunitynib do obrotu.
Pacjenci, u których stwierdzono zatorowość płucną, w okresie poprzedzających 12 miesięcy zostali wykluczeni z badań klinicznych sunitynibu.
W grupie pacjentów, którzy otrzymywali sunitynib w badaniach rejestracyjnych III fazy, zdarzenia płucne (tj. duszność, wysięk opłucnowy, zatorowość płucną lub obrzęk płuc) wystąpiły u około 17,8% pacjentów z GIST, u około 26,7% pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC) i u 12% pacjentów z pNET.
W grupie pacjentów z guzami litymi, w tym z GIST i MRCC, którzy otrzymywali sunitynib w badaniach klinicznych, zdarzenia płucne wystąpiły u około 22,2% pacjentów.
U pacjentów z GITS lub z rakiem nerkowokomórkowym z przerzutami (MRCC) otrzymujących sunitynib zgłaszano niezbyt częste (< 1%) przypadki zapalenia trzustki. U pacjentów z pNET biorących udział w badaniu III fazy nie stwierdzono żadnego przypadku zapalenia trzustki związanego z zastosowanym leczeniem (patrz punkt 4.4).
Przypadki krwawienia z przewodu pokarmowego zakończone zgonem wystąpiły u 0,98% pacjentów otrzymujących placebo w badaniu III fazy dotyczącym leczenia GIST.
Zaburzenia wątroby i dróg żółciowych
Zgłaszano przypadki dysfunkcji wątroby, które mogą obejmować nieprawidłowe wartości parametrów czynnościowych wątroby, zapalenie wątroby lub niewydolność wątroby (patrz punkt 4.4).
Zaburzenia skóry i tkanki podskórnej
Zgłaszano przypadki piodermii zgorzelinowej, która zazwyczaj ustępowała po odstawieniu sunitynibu (patrz również punkt 4.4).
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej
Zgłaszano przypadki miopatii i (lub) rabdomiolizy, niekiedy z towarzyszącą ostrą niewydolnością nerek. Pacjentów z powikłaniami ze strony mięśni należy leczyć zgodnie ze standardowymi zasadami postępowania (patrz punkt 4.4).
Zgłaszano przypadki tworzenia się przetok, czasem związane z martwicą guza nowotworowego lub regresją, w niektórych przypadkach zakończone zgonem (patrz punkt 4.4).
Zgłaszano przypadki martwicy kości szczęki i (lub) żuchwy u pacjentów leczonych sunitynibem, przy czym większość z nich odnotowano u osób, u których stwierdzono znane czynniki ryzyka rozwoju ONJ, zwłaszcza takie jak przyjmowanie bisfosfonianów dożylnie i (lub) choroby stomatologiczne w wywiadzie wymagające przeprowadzenia inwazyjnych procedur dentystycznych (patrz również punkt 4.4).
Dane z badań nieklinicznych (in vitro i in vivo), w których stosowano dawki większe niż zalecane u ludzi, wskazują, że sunitynib może hamować proces repolaryzacji błon komórkowych (skutkując np. wydłużeniem odstępu QT).
Wydłużenie odstępu QTc do ponad 500 ms wystąpiło u 0,5%, natomiast zmiany od wartości wyjściowej o więcej niż 60 ms wystąpiły u 1,1% spośród 450 pacjentów z guzami litymi; zmiany obu powyższych parametrów są uznawane za potencjalnie istotne. Wykazano, że sunitynib w stężeniach w przybliżeniu dwukrotnie większych niż terapeutyczne wydłuża odstęp QTcF (odstęp QT skorygowany wg wzoru Fridericia).
Wydłużenie odstępu QTc oceniano w badaniu z udziałem 24 pacjentów w wieku od 20 do 87 lat z zaawansowanymi nowotworami złośliwymi. Wyniki tego badania wykazały, że sunitynib miał wpływ na odstęp QTc [określany jako średnia zmiana skorygowana o placebo > 10 ms z górną granicą 90% przedziału ufności (CI) wynoszącą > 15 ms] przy stężeniu terapeutycznym (dzień 3.) z zastosowaniem metody korygowania codziennym stanem początkowym oraz przy stężeniu większym od terapeutycznego (dzień 9.) z zastosowaniem obu metod korygowania według stanu początkowego. U żadnego pacjenta wartość QTc nie była > 500 ms. Pomimo zaobserwowanego wpływu na odstęp QTcF w dniu 3. w okresie 24 godzin po podaniu dawki (tj. przy oczekiwanym terapeutycznym stężeniu w osoczu po podaniu zalecanej dawki początkowej 50 mg) z zastosowaniem metody korygowania codziennym stanem początkowym, znaczenie kliniczne tej obserwacji jest nieznane.
U żadnego z pacjentów populacji kwalifikującej się do oceny lub populacji zgodnej z zaplanowanym leczeniem (ang. ITT, intent-to-treat) nie odnotowano wydłużenia odstępu QTc, który zostałby uznany za „ciężki” [tj. równy lub większy od stopnia 3. wg „Wspólnych kryteriów terminologicznych dla zdarzeń niepożądanych” (ang. CTCAE, Common Terminology Criteria for Adverse Events wersja 3.0)] na podstawie serii kompleksowych badań EKG przeprowadzonych w punktach czasowych odpowiadających ekspozycji terapeutycznej lub większej niż terapeutyczna.
Przy stężeniach terapeutycznych w osoczu maksymalna średnia zmiana odstępu QTcF (odstęp QT skorygowany wg wzoru Fridericia) od stanu wyjściowego wynosiła 9 ms (90% CI: 15,1 ms). Przy około dwukrotnie większych stężeniach terapeutycznych maksymalna zmiana odstępu QTcF w porównaniu ze stanem wyjściowym wyniosła 15,4 ms (90% CI: 22,4 ms). Po podaniu moksyfloksacyny (400 mg) jako kontroli dodatniej wykazano, że maksymalna średnia zmiana
odstępu QTcF wynosi 5,6 ms w porównaniu ze stanem wyjściowym. U żadnego z pacjentów nie stwierdzono wydłużenia odstępu QTc w stopniu ciężkości większym niż 2. (CTCAE, wersja 3.0) (patrz punkt 4.4).
Ocena długookresowego bezpieczeństwa u pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC)
Długookresowe bezpieczeństwo stosowania sunitynibu u pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC) analizowano w 9 zakończonych badaniach klinicznych w schematach leczenia pierwszego rzutu, oporności na bewacyzumab oraz oporności na cytokiny u 5739 pacjentów, z których 807 (14%) było leczonych przez okres od ≥ 2 lat do 6 lat. U 807 pacjentów, którzy otrzymywali sunitynib przez długi czas, większość działań niepożądanych związanych ze stosowanym leczeniem wystąpiła po raz pierwszy w okresie pierwszych 6–12 miesięcy, a następnie ich częstość występowania utrzymywała się na stałym poziomie lub zmniejszała się w miarę upływu czasu, z wyjątkiem niedoczynności tarczycy, której częstość występowania stopniowo zwiększała się, a nowe przypadki pojawiały się w ciągu kolejnych 6 lat. Długotrwałe leczenie sunitynibem nie było powiązane z nowymi rodzajami działań niepożądanych związanych z leczeniem.
Profil bezpieczeństwa sunitynibu ustalono na podstawie badania fazy I ze zwiększeniem dawki, otwartego badania II fazy, fazy I/II badania na jednej grupie oraz na podstawie publikacji jak opisano poniżej.
Badanie I fazy ze zwiększeniem dawki sunitynibu podawanego doustnie przeprowadzono z udziałem grupy 35 pacjentów, w tym 30 pacjentów z populacji dzieci i młodzieży (w wieku 3 do 17 lat) oraz 5 pacjentów z grupy młodych osób dorosłych (w wieku od 18 do 21 lat) z guzami litymi opornymi na leczenie. U większości pacjentów pierwotnie rozpoznano guza mózgu. U wszystkich uczestników badania wystąpiły działania niepożądane, większość działań niepożądanych miała przebieg ciężki (stopień toksyczności ≥3) i obejmowała kardiotoksyczność. Najczęściej spotykanymi działaniami niepożądanymi były działania dotyczące toksyczności żołądkowo-jelitowej, neutropenia, zmęczenie oraz zwiększenie aktywności ALAT.
Ryzyko występowania kardiologicznych działań niepożądanych wydawało się być większe w grupie dzieci i młodzieży wcześniej leczonych antracyklinami lub radioterapią, której zasięg obejmował serce w porównaniu do grupy pacjentów, u których nie stosowano tego typu terapii. U pacjentów z populacji dzieci i młodzieży, u których nie było wcześniejszej ekspozycji na antracykliny lub radioterapię (której zasięg obejmował serce) została ustalona maksymalna dawka tolerowana (patrz punkt 5.1).
Przeprowadzono badanie otwarte fazy II przeprowadzone na grupie 29 pacjentów, w tym 27 pacjentów z populacji dzieci i młodzieży (w wieku od 3 do 16 lat) oraz 2 młodych dorosłych (w wieku 18 do 19 lat) z nawracającym, postępującym, opornym na leczenie glejakiem o wysokim stopniu złośliwości lub wyściółczakiem. Nie obserwowano działań niepożądanych stopnia 5. ciężkości w żadnej z grup. Najczęściej spotykanym (≥10%) działaniem niepożądanym związanym z leczeniem było zmniejszenie liczby neutrofili [u 6 (20,7%) pacjentów] oraz krwotok wewnątrzczaszkowy [u 3 (10,3%) pacjentów].
Badanie fazy I/II na pojedynczej grupie było prowadzone u 6 pacjentów z populacji dzieci i młodzieży (w wieku od 3 do 16 lat) z zaawansowanym, nieoperacyjnym GIST. Najczęściej spotykanym działaniem niepożądanym była biegunka, nudności, zmniejszenie ilości białych krwinek, neutropenia i ból głowy, przeważnie ciężkości 1. lub 2. stopnia u 3 (50%) pacjentów. U 4 z 6 pacjentów (66,7%) wystąpiły działania niepożądane związane z leczeniem o stopniu ciężkości 3.- 4., (stopień 3.: hipofosfatemia, neutropenia i trombocytopenia u 1 pacjenta i u 1 pacjenta neutropenia
Nie istnieje swoista odtrutka, a leczenie przedawkowania produktem Asikreba powinno polegać na zastosowaniu standardowych środków wspomagających. O ile istnieją wskazania, można uzyskać eliminację niewchłoniętej substancji czynnej poprzez wywołanie wymiotów lub płukanie żołądka. Zgłaszano przypadki przedawkowania; niektóre z nich wiązały się z występowaniem działań niepożądanych pokrywających się ze znanym profilem bezpieczeństwa stosowania sunitynibu.
Grupa farmakoterapeutyczna: Leki przeciwnowotworowe, inhibitory kinazy białkowej; kod ATC:
L01EX01.
Sunitynib hamuje liczne receptory kinazy tyrozynowej (ang. RTK, receptor tyrosine kinase), które biorą udział we wzroście nowotworów, w neoangiogenezie i w rozsiewie choroby nowotworowej z przerzutami. Sunitynib został zidentyfikowany jako inhibitor receptorów płytkowego czynnika wzrostu (PDGFRα i PDGFRβ), receptorów czynników wzrostu śródbłonka naczyniowego (VEGFR1, VEGFR2 i VEGFR3), receptorów czynnika komórek pnia (KIT), kinazy tyrozynowej podobnej do Fms-3 (FLT3), receptorów czynnika stymulującego powstawanie kolonii (CSF-1R) i receptorów glejopochodnego czynnika neurotroficznego (RET). W testach biochemicznych i komórkowych podstawowy metabolit sunitynibu wykazuje działanie podobne do sunitynibu.
Skuteczność kliniczna i bezpieczeństwo stosowania
Skuteczność kliniczną i bezpieczeństwo stosowania sunitynibu badano podczas leczenia pacjentów z GIST opornymi na imatynib (tj. pacjentów, u których doszło do progresji choroby w trakcie leczenia imatynibem lub po nim) lub nietolerujących imatynibu (tj. pacjentów, u których wystąpiły istotne objawy toksyczności w trakcie leczenia imatynibem, które uniemożliwiły dalsze leczenie), leczenia pacjentów z MRCCi leczenia pacjentów z nieoperacyjnymi pNET.
Skuteczność leczenia ustalano na podstawie czasu do wystąpienia progresji nowotworu (ang. TTP, time to tumour progression) oraz wydłużenia czasu przeżycia u pacjentów z nowotworami podścieliskowymi przewodu pokarmowego, na podstawie czasu przeżycia bez progresji choroby (ang. PFS, progression free survival) i wskaźników obiektywnych odpowiedzi (ang. ORR, objective response rates) u pacjentów z rakiem nerkowokomórkowym z przerzutami, którzy dotychczas nie byli leczeni i po niepowodzeniu leczenia cytokinami oraz na podstawie wskaźnika przeżycia wolnego od progresji choroby u pacjentów z pNET.
Nowotwory podścieliskowe przewodu pokarmowego
Wstępne otwarte, zakładające zwiększanie dawkowania badanie zostało przeprowadzone u pacjentów z nowotworami podścieliskowymi przewodu pokarmowego po niepowodzeniu
stosowania imatynibu (mediana maksymalnej dawki dobowej: 800 mg) ze względu na oporność lub nietolerancję leczenia. Do badania zakwalifikowano dziewięćdziesięciu siedmiu pacjentów, otrzymujących dawki według różnych schematów; 55 pacjentów otrzymywało dawkę 50 mg według zalecanego schematu leczenia: 4 tygodnie przyjmowania leku/2 tygodnie przerwy (schemat 4/2).
W niniejszym badaniu mediana TTP wynosiła 34,0 tygodnie (95% CI: 22,0–46,0).
Przeprowadzono randomizowane, podwójnie zaślepione, kontrolowane placebo badanie fazy III sunitynibu, u pacjentów z nowotworami podścieliskowymi przewodu pokarmowego, którzy nie tolerowali leczenia imatynibem, lub u których doszło do progresji choroby w trakcie leczenia imatynibem (mediana maksymalnej dawki dobowej 800 mg). W badaniu tym 312 pacjentów w sposób randomizowany (w stosunku 2:1) przydzielono do grup otrzymujących odpowiednio sunitynib w dawce 50 mg lub placebo doustnie, raz na dobę, według schematu 4/2, do momentu wystąpienia progresji choroby lub wycofania z badania z innego powodu (207 pacjentów otrzymywało sunitynib, a 105 pacjentów otrzymywało placebo). Pierwszorzędowym punktem końcowym oceny skuteczności w badaniu był TTP definiowany jako czas od randomizacji do pierwszego potwierdzenia obiektywnej progresji guza. W chwili przeprowadzenia ustalonej z góry analizy okresowej, mediana TTP podczas stosowania sunitynibu wynosiła 28,9 tygodnia (95% CI: 21,3; 34,1) w ocenie badacza i 27,3 tygodnia (95% CI: 16,0; 32,1) w ocenie niezależnej komisji weryfikującej i była istotnie statystycznie dłuższa niż TTP w przypadku stosowania placebo, w którym to wypadku wynosiła 5,1 tygodnia
(95% CI: 4,4; 10,1) w ocenie badacza i 6,4 tygodnia (95% CI: 4,4; 10,0) w ocenie niezależnej komisji weryfikującej. Różnica wskaźnika przeżycia całkowitego (ang. OS, overall survival) była statystycznie większa na korzyść sunitynibu [współczynnik ryzyka (HR): 0,491 (95% CI: 0,290; 0,831)]; ryzyko zgonu było 2 razy większe u pacjentów w grupie otrzymującej placebo w porównaniu do grupy leczonej sunitynibem.
Zgodnie z zaleceniem Niezależnej Komisji Monitorującej Badanie (ang. DSMB, Data and Safety Monitoring Board), po uzyskaniu pozytywnych wyników w zakresie skuteczności i bezpieczeństwa stosowania w analizie okresowej badanie zostało odślepione, i pacjentom z grupy placebo zaproponowano leczenie sunitynibem w otwartej fazie badania.
Ogółem, w fazie otwartej badania sunitynib otrzymało 255 pacjentów, w tym 99 pacjentów, którzy pierwotnie otrzymywali placebo.
Analizy pierwszo- i drugorzędowych punktów końcowych w fazie otwartej badania potwierdziły wyniki uzyskane w trakcie ustalonej z góry analizy okresowej, jak przedstawiono w Tabeli 2.
Tabela 2. Podsumowanie punktów końcowych dotyczących skuteczności w leczeniu pacjentów z GIST [populacja zgodna z zaplanowanym leczeniem (ang. ITT, intent-to-treat)]
Leczenie w warunkach podwójnie ślepej próbya | |||||
Mediana (95% CI) | Współczynnik ryzyka | Leczenie w grupach skrzyżowanych z placebob | |||
Punkt końcowy | Sunitynib | Placebo | (95% CI) | p | |
Pierwszorzędowy | |||||
TTP (tygodnie) | |||||
Analiza okresowa | 27,3 (16,0; 32,1) | 6,4 (4,4; 10,0) | 0,329 (0,233; 0,466) | < 0,001 | - |
Analiza ostateczna | 26,6 (16,0; 32,1) | 6,4 (4,4; 10,0) | 0,339 (0,244; 0,472) | < 0,001 | 10,4 (4,3; 22,0) |
Drugorzędowy | |||||
PFS (tygodnie)c | |||||
Analiza okresowa | 24,1 (11,1; 28,3) | 6,0 (4,4; 9,9) | 0,333 (0,238; 0,467) | < 0,001 | - |
Analiza ostateczna | 22,9 (10,9; 28,0) | 6,0 (4,4; 9,7) | 0,347 (0,253; 0,475) | < 0,001 | - |
ORR (%)d | |||||
Analiza okresowa | 6,8 (3,7; 11,1) | 0 (-) | NA | 0,006 | - |
Analiza ostateczna | 6,6 (3,8; 10,5) | 0 (-) | NA | 0,004 | 10,1 (5,0; 17,8) |
OS (tygodnie)e | |||||
Analiza okresowa | - | - | 0,491 (0,290; 0,831) | 0,007 | - |
Analiza ostateczna | 72,7 (61,3; 83,0) | 64,9 (45,7; 96,0) | 0,876 (0,679; 1,129) | 0,306 | - |
Skróty: CI = przedział ufności (ang. confidence interval); ITT = populacja ITT (ang. intent-to-treat); NA = nie dotyczy; ORR = odsetek obiektywnych odpowiedzi (ang. objective response rate); OS = czas przeżycia całkowitego (ang. overall survival); PFS = czas przeżycia wolny od progresji choroby (ang. progression-free survival); TTP = czas do pierwszego potwierdzenia obiektywnej progresji guza (ang. time-to-tumour progression)
a Wyniki dotyczące leczenia w warunkach podwójnie ślepej próby dotyczą populacji ITT i oparte są na wynikach centralnej oceny radiologicznej.
b Wyniki dotyczące skuteczności dla 99 pacjentów z grupy placebo, u których rozpoczęto leczenie sunitynibem po odślepieniu badania. W momencie zmiany z placebo na sunitynib ponownie wyznaczano wartości wyjściowe, a analizy skuteczności oparto na ocenie badaczy.
c Wartości PFS dla analizy okresowej uaktualniono po ponownym przeliczeniu danych oryginalnych.
d Wyniki dotyczące ORR podano jako odsetek pacjentów z potwierdzoną odpowiedzią na leczenie z 95% CI.
e Mediana nieustalona z powodu braku wystarczającej ilości danych.
Mediana OS w populacji ITT wyniosła 72,7 tygodni u pacjentów otrzymujących sunitynib i 64,9 tygodni u pacjentów otrzymujących placebo (HR: 0,876; 95% CI: 0,679; 1,129, p = 0,306). W tej analizie grupa placebo obejmowała pacjentów zrandomizowanych do grupy placebo, którzy w późniejszym czasie otrzymywali sunitynib w ramach otwartej fazy badania.
Rak nerkowokomórkowy z przerzutami u pacjentów, którzy dotychczas nie byli leczeni
Przeprowadzono randomizowane, wieloośrodkowe, międzynarodowe badanie III fazy oceniające skuteczność i bezpieczeństwo stosowania sunitynibu w porównaniu z IFN-α u pacjentów z rakiem nerkowokomórkowym z przerzutami, którzy dotychczas nie byli leczeni. 750 pacjentów w sposób randomizowany w stosunku 1:1 przydzielono do dwóch grup terapeutycznych otrzymujących odpowiednio sunitynib w cyklach sześciotygodniowych obejmujących codzienne podawanie leku doustnie przez 4 tygodnie w dawce 50 mg, po czym następowały 2 tygodnie przerwy (schemat 4/2), albo IFN-α podawany w postaci wstrzyknięć podskórnych w dawce 3 miliony jednostek (MU) w pierwszym tygodniu, 6 MU w drugim tygodniu i 9 MU w trzecim tygodniu oraz w następnych tygodniach, w 3 dawkach podawanych co drugi dzień.
Mediana okresu leczenia wynosiła 11,1 miesiąca (zakres: 0,4–46,1) w przypadku leczenia sunitynibem i 4,1 miesiąca (zakres: 0,1–45,6) w przypadku leczenia IFN-α. Ciężkie zdarzenia niepożądane związane z leczeniem odnotowano u 23,7% pacjentów otrzymujących sunitynib i 6,9% pacjentów otrzymujących IFN- α. Odsetek pacjentów, którzy zakończyli leczenie z powodu zdarzeń niepożądanych wyniósł 20% w przypadku sunitynibu i 23% w przypadku IFN- α. Przerwy w leczeniu nastąpiły u 202 pacjentów (54%) przyjmujących sunitynib i 141 pacjentów (39%) przyjmujących IFN- α. Dawkowanie zmniejszono u 194 pacjentów (52%) leczonych sunitynibem i u 98 pacjentów (27%) leczonych IFN- α. Pacjenci byli leczeni do momentu stwierdzenia progresji choroby lub wycofania z badania. Pierwszorzędowym punktem końcowym oceny skuteczności był PFS. W planowanej analizie okresowej z przebiegu badania stwierdzono istotną statystycznie przewagę sunitynibu nad IFN-α, w omawianym badaniu mediana PFS w grupie leczonej sunitynibem wyniosła 47,3 tygodnia w porównaniu do 22,0 tygodnia w grupie leczonej IFN-α. HR wyniósł natomiast 0,415 (95% CI: 0,320; 0,539, p < 0,001). Inne punkty końcowe obejmowały ORR, OS i bezpieczeństwo. Podstawową ocenę radiologiczną przerwano po osiągnięciu podstawowego punktu końcowego. W ostatecznej analizie ORR w ocenie badaczy wynosił 46% (95% CI: 41%; 51%) w grupie pacjentów stosujących sunitynib i 12,0% (95% CI: 9%; 16%) w grupie pacjentów stosujących IFN-α (p < 0,001).
Leczenie sunitynibem wiązało się z dłuższym przeżyciem całkowitym w porównaniu do leczenia IFN-α. Mediana OS wynosiła 114,6 tygodnia w grupie pacjentów stosujących sunitynib (95% CI: 100,1; 142,9) i 94,9 tygodnia w grupie pacjentów stosujących IFN-α (95% CI: 77,7; 117,0) z HR
wynoszącym 0,821 (95% CI: 0,673; 1,001; p = 0,0510) według niestratyfikowanego testu logarytmicznego rang.
Ogólne wartości PFS i OS, stwierdzone w populacji ITT na podstawie oceny dokonanej przez centralną pracownię radiologiczną, podano w Tabeli 3.
Tabela 3. Podsumowanie punktów końcowych dotyczących skuteczności leczenia dotychczas nieleczonych pacjentów z rakiem nerkowokomórkowym z przerzutami (MRCC) (populacja zgodna z zaplanowanym leczeniem - ITT)
Podsumowanie danych dotyczących przeżycia wolnego od progresji choroby | Sunitynib (N = 375) | IFN-α (N = 375) |
Liczba pacjentów, u których nie doszło do progresji choroby ani zgonu [n (%)] | 161 (42,9) | 176 (46,9) |
Liczba pacjentów, u których stwierdzono progresję choroby lub zgon [n (%)] | 214 (57,1) | 199 (53,1) |
PFS (tygodnie) | ||
Kwartyl (95% CI) | ||
25% | 22,7 (18,0; 34,0) | 10,0 (7,3; 10,3) |
50% | 48,3 (46,4; 58,3) | 22,1 (17,1; 24,0) |
75% | 84,3 (72,9; 95,1) | 58,1 (45,6; 82,1) |
Analiza bez stratyfikacji | ||
Współczynnik ryzyka (sunitynib w porównaniu z IFN-α) | 0,5268 | |
95% CI dla współczynnika ryzyka | (0,4316; 0,6430) | |
Wartość pa | < 0,0001 | |
Podsumowanie danych dotyczących przeżycia całkowitego | ||
Liczba pacjentów, o których brak informacji o wystąpieniu zgonu [n (%)] | 185 (49,3) | 175 (46,7) |
Liczba pacjentów, u których nastąpił zgon [n (%)] | 190 (50,7) | 200 (53,3) |
OS (tygodnie) | ||
Kwartyl (95% CI) | ||
25% | 56,6 (48,7; 68,4) | 41,7 (32,6; 51,6) |
50% | 114,6 (100,1; 142,9) | 94,9 (77,7; 117,0) |
75% | NA (NA, NA) | NA (NA, NA) |
Analiza bez stratyfikacji | ||
Współczynnik ryzyka (sunitynib w porównaniu z IFN-α) | 0,8209 | |
95% CI dla współczynnika ryzyka | (0,6730; 1,0013) | |
Wartość pa | 0,0510 | |
Skróty: CI = przedział ufności (ang. confidence interval); INF-α = interferon alfa; ITT = populacja ITT (ang. intent-to-treat); N = liczba pacjentów; NA = nie dotyczy; OS = czas przeżycia całkowitego (ang. overall survival); PFS = czas przeżycia wolny od progresji choroby (ang. progression-free survival);
a Dla dwustronnego testu log- rank
Rak nerkowokomórkowy z przerzutami po niepowodzeniu leczenia cytokinami
Badanie II fazy sunitynibu przeprowadzono u pacjentów opornych na wcześniejsze leczenie cytokinami, tzn. interleukiną-2 lub IFN- α. Sześćdziesięciu trzech pacjentów otrzymało dawkę początkową 50 mg sunitynibu doustnie, raz na dobę przez 4 kolejne tygodnie, po czym następował dwutygodniowy okres przerwy, który kończył pełny cykl 6 tygodni (schemat 4/2). Podstawowym punktem końcowym oceny skuteczności był ORR ustalany na podstawie kryteriów oceny odpowiedzi u pacjentów z guzami litymi (ang. RECIST, Response Evaluation Criteria in Solid Tumours).
W omawianym badaniu wskaźnik obiektywnych odpowiedzi wynosił 36,5% (95% CI: 24,7–49,6%), a mediana TTP wynosiła 37,7 tygodnia (95% CI: 24,0; 46,4).
Przeprowadzono potwierdzające, otwarte, obejmujące jedną grupę pacjentów, wieloośrodkowe badanie oceniające skuteczność i bezpieczeństwo stosowania sunitynibu u pacjentów z rakiem nerkowokomórkowym z przerzutami, którzy byli oporni na uprzednio stosowane leczenie cytokinami.Stu sześciu (106) pacjentów otrzymało co najmniej jedną dawkę 50 mg sunitynibu według schematu 4/2.
Pierwszorzędowym punktem końcowym oceny skuteczności tego badania był ORR. Drugorzędowe punkty końcowe obejmowały TTP, okres utrzymywania się odpowiedzi (DR) i OS.
W niniejszym badaniu wskaźnik ORR wynosił 35,8% (95% CI: 26,8; 47,5%). Mediany DR i OS nie zostały jeszcze osiągnięte.
Nowotwory neuroendokrynne trzustki
W dodatkowym wieloośrodkowym badaniu otwartym II fazy oceniano skuteczność i bezpieczeństwo stosowania sunitynibu w dawce 50 mg na dobę w monoterapii w schemacie 4/2 u pacjentów z nieoperacyjnymi pNET. W kohorcie 66 pacjentów z wyspiakiem trzustki, odsetek odpowiedzi na leczenie (pierwszorzędowy punkt końcowy badania) wyniósł 17%.
U pacjentów z nieoperacyjnymi pNET przeprowadzono główne, wieloośrodkowe, międzynarodowe, randomizowane, kontrolowane placebo badanie III fazy z zastosowaniem podwójnie ślepej próby, w którym oceniano stosowanie sunitynibu w monoterapii.
Pacjentów z udokumentowaną w ostatnich 12 miesiącach progresją choroby ocenianą wg kryteriów RECIST zrandomizowano (w stosunku 1:1) do grupy otrzymującej sunitynib w dawce 37,5 mg raz na dobę w schemacie ciągłym (N = 86) lub do grupy placebo (N = 85).
Głównym celem badania było porównanie PFS u pacjentów otrzymujących sunitynib i pacjentów otrzymujących placebo. Inne punkty końcowe obejmowały OS, ORR, PRO oraz parametry bezpieczeństwa.
Grupa otrzymująca sunitynib i grupa placebo były porównywalne pod względem charakterystyki demograficznej. Ponadto u 49% pacjentów otrzymujących sunitynib (wobec 52% pacjentów z grupy placebo) występowały nowotwory nieczynne hormonalnie, a u 92% pacjentów w obu badanych grupach stwierdzano przerzuty do wątroby.
W badaniu dozwolone było stosowanie analogów somatostatyny.
Uprzedniemu leczeniu układowemu poddawanych było łącznie 66% pacjentów otrzymujących sunitynib i 72% pacjentów otrzymujących placebo. Ponadto 24% pacjentów otrzymujących sunitynib i 22% pacjentów z grupy placebo otrzymywało w przeszłości analogi somatostatyny.
Stwierdzono klinicznie istotne wydłużenie ocenianego przez badacza PFS w przypadku sunitynibu w porównaniu z placebo. Mediana PFS wyniosła 11,4 miesiąca w grupie otrzymującej sunitynib i 5,5 miesiąca w grupie placebo [HR: 0,418 (95% CI: 0,263–0,662), p = 0,0001]; podobne wyniki uzyskano, kiedy w celu ustalenia progresji choroby zastosowano pochodne oceny odpowiedzi na leczenie oparte na zastosowaniu kryteriów RECIST w pomiarach wielkości nowotworów wykonywanych przez badaczy, co ilustruje Tabela 5. We wszystkich podgrupach wyróżnionych ze względu na oceniane parametry wyjściowe, w tym liczbę rzutów uprzedniego leczenia układowego, stwierdzono HR na korzyść sunitynibu. Łącznie 29 pacjentów z grupy otrzymującej sunitynib i 24 z grupy placebo niepoddawanych było uprzednio żadnemu leczeniu układowemu; wśród tych pacjentów HR dla PFS wyniósł 0,365 (95% CI: 0,156–0,857), p = 0,0156. Podobnie wśród 57 pacjentów z grupy otrzymującej sunitynib (w tym 28 pacjentów z jednym rzutem leczenia układowego w przeszłości i 29 z dwoma lub większą liczbą rzutów leczenia układowego w przeszłości) oraz wśród 61 pacjentów z grupy placebo (w tym 25 pacjentów z jednym rzutem leczenia układowego w przeszłości i 36 z dwoma lub większą liczbą rzutów leczenia układowego w przeszłości) HR dla PFS wyniósł 0,456 (95% CI: 0,264–0,787), p = 0,0036.
Przeprowadzono analizę wrażliwości PFS w przypadkach, w których progresja choroby stwierdzana była na podstawie zgłaszanych przez badacza wyników pomiaru wielkości nowotworu, i w których dane wszystkich pacjentów ucinane z powodów innych niż przerwanie udziału w badaniu były traktowane jako zdarzenia PFS. Analiza umożliwiła konserwatywną ocenę działania leczniczego sunitynibu i dodatkowo wzmocniła analizę pierwotną, wykazując HR wynoszący 0,507 (95% CI: 0,350–0,733), p = 0,000193. Główne badanie dotyczące pNET przerwano zgodnie z zaleceniem niezależnej komisji ds. monitorowania leków, a ocenę pierwszorzędowego punktu końcowego oparto na ocenie badaczy - oba czynniki mogły wpłynąć na ocenę działania leczniczego.
W celu wykluczenia błędu systematycznego w dokonywanej przez badaczy ocenie PFS, przeprowadzono ocenę BICR wyników badań obrazowych, która potwierdziła oceny przeprowadzone przez badaczy, co ilustruje Tabela 4.
Tabela 4. Wyniki dotyczące skuteczności leczenia pNET w badaniu III fazy
Parametr skuteczności | Sunitynib (N = 86) | Placebo (N = 85) | Współczynnik ryzyka (95% CI) | Wartość p |
Przeżycie wolne od progresji choroby [mediana, miesiące (95% CI)] na podstawie oceny badacza | 11,4 (7,4, 19,8) | 5,5 (3,6, 7,4) | 0,418 (0,263, 0,662) | 0,0001a |
Przeżycie wolne od progresji choroby [mediana, miesiące (95% CI)] na podstawie pochodnej oceny odpowiedzi na leczenie opartej na zastosowaniu kryteriów RECIST w pomiarach wielkości nowotworów wykonywanych przez badaczy | 12,6 (7,4, 16,9) | 5,4 (3,5, 6,0) | 0,401 (0,252, 0,640) | 0,000066a |
Przeżycie wolne od progresji choroby [mediana, miesiące (95% CI)] na podstawie zaślepionej niezależnej centralnej oceny nowotworu | 12,6 (11,1, 20,6) | 5,8 (3,8, 7,2) | 0,315 (0,181, 0,546) | 0,000015a |
Przeżycie całkowite [5 lat kontroli] [mediana, miesiące (95% CI)] | 38,6 (25,6, 56,4) | 29,1 (16,4, 36,8) | 0,730 (0,504, 1,057) | 0,0940a |
Odsetek obiektywnych odpowiedzi [%, (95% CI)] | 9,3 (3,2, 15,4) | 0 | NA | 0,0066b |
Skróty: CI = przedział ufności (ang. confidence interval); N = liczba pacjentów; NA = nie dotyczy; pNET = nowotwory neuroendokrynne trzustki (ang. pancreatic neuroendocrine tumours); RECIST = kryteria oceny odpowiedzi u pacjentów z guzami litymi (ang. response evaluation criteria in solid tumours)
a Dwustronny test log- rank bez stratyfikacji
b Dokładny test Fishera
sunitynib (N=86) mediana 11,4 miesiąca
placebo (N=85)
mediana 5,5 miesiąca
liczba pacjentów
Sunitynib placebo
Czas (miesiące)
Współczynnik ryzyka = 0,42 95% CI (0,26-0,66)
p = 0,0001
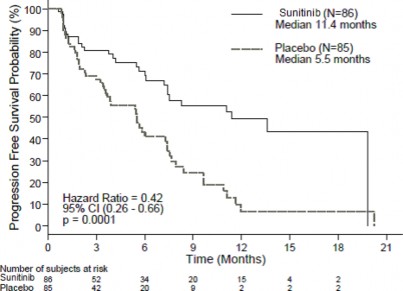
Prawdopodobieństwo przeżycia bez progresji (%)
Rycina 1. Wykres Kaplana-Meiera dla PFS w badaniu III fazy dotyczącym pNET
Liczba pacjentów z ryzykiem | |||||||
Sunitynib | 86 | 52 | 34 | 20 | 15 | 4 | 2 |
Placebo | 85 | 42 | 20 | 9 | 2 | 2 | 2 |
Skróty: CI = przedział ufności; N = liczba pacjentów; PFS = czas przeżycia wolny od progresji choroby; pNET
= nowotwory neuroendokrynne trzustki
Dane na temat OS nie były wystarczająco dojrzałe w momencie zamknięcia badania {20,6 miesiąca (95% CI: 20,6, NR [nie osiągnięto wartości]) w przypadku grupy sunitynibu, w porównaniu do NR (95% CI: 15,5, NR) dla grupy placebo,HR: 0,409 (95% CI: 0,187, 0,894), wartość p = 0,0204}.
Odnotowano 9 zgonów w grupie leczonej sunitynibem i 21 w grupie placebo.
W momencie stwierdzenia progresji choroby dane pacjentów odkodowano i pacjentom, którzy otrzymywali placebo zaproponowano dostęp do sunitynibu w odrębnym, otwartym badaniu będącym przedłużeniem poprzedniego badania. W wyniku przedwczesnego przerwania badania dane pozostałych pacjentów odkodowano, a pacjentom tym zaproponowano dostęp do sunitynibu w odrębnym, otwartym badaniu będącym przedłużeniem poprzedniego badania. Łącznie 59 spośród 85 pacjentów (69,4%) z grupy placebo przeszło do otwartego badania sunitynibu po wystąpieniu progresji choroby lub odkodowaniu podczas zamknięcia badania. OS obserwowane po 5 latach w przedłużonym badaniu wykazało HR wynoszący 0,730 (95% CI: 0,504, 1,057).
Ocena za pomocą kwestionariusza EORTC QLQ-C30 (European Organization for Research and Treatment of Cancer Quality of Life Questionnaire) wykazała, że ogólna globalna jakość życia związana ze stanem zdrowia oraz 5 domen funkcjonowania (fizyczna, ról społecznych, poznawcza, emocjonalna i społeczna) były utrzymane u pacjentów leczonych sunitynibem w porównaniu z grupą pacjentów otrzymujących placebo przy ograniczonych, objawowych działaniach niepożądanych.
Przeprowadzono międzynarodowe, wieloośrodkowe, jednoramienne badanie otwarte IV fazy, w którym oceniano skuteczność i bezpieczeństwo stosowania sunitynibu u pacjentów z postępującą, zaawansowaną i (lub) przerzutową, wysoko zróżnicowaną i nieoperacyjną postacią pNET.
Sunitynib podawano doustnie w dawce 37,5 mg raz na dobę w sposób ciągły 106 pacjentom (61 pacjentom w kohorcie wcześniej nieleczonej i 45 pacjentom w kohorcie otrzymującej sunitynib jako leczenie kolejnego rzutu).
Mediana PFS oceniana przez badacza wynosiła 13,2 miesiąca zarówno w populacji ogólnej (95% CI: 10,9; 16,7) jak i w kohorcie wcześniej nieleczonej (95% CI: 7,4; 16,8).
Doświadczenie dotyczące stosowania sunitynibu u dzieci i młodzieży są ograniczone (patrz punkt
4.2).
Przeprowadzono badanie I fazy ze zwiększeniem dawki sunitynibu podawanego doustnie z udziałem 35 pacjentów w tym u 30 pacjentów z populacji dzieci i młodzieży (w wieku od 3 do 17 lat) oraz 5 młodych osób dorosłych (w wieku od 18 do 21 lat) z guzami litymi opornymi na leczenie. U większości pacjentów pierwotnie rozpoznano guza mózgu. Kardiotoksyczność ograniczającą wielkość dawki zaobserwowano na pierwszym etapie badania, co wpłynęło na zmianę schematu badania w celu wykluczenia pacjentów z wcześniejszą ekspozycją na terapie potencjalnie kardiotoksyczne (w tym stosowanie antracyklin) lub radioterapię, której zasięg obejmował serce. Na drugim etapie badania, w którym uwzględniono pacjentów wcześniej poddawanych leczeniu przeciwnowotworowemu, jednakże bez czynników ryzyka wystąpienia kardiotoksyczności, sunitynib był ogólnie tolerowany przez pacjentów i możliwy do kontrolowania klinicznie w dawce 15 mg/m2 pc. dobowo (MTD) według schematu 4/2. U żadnego z pacjentów nie osiągnięto
całkowitej ani częściowej odpowiedzi. Stabilizację choroby zaobserwowano u 6 pacjentów (17%). W przypadku jednego pacjenta z nowotworem podścieliskowym przewodu pokarmowego przyjmującego dawkę 15 mg/m2 pc. nie odnotowano korzyści z leczenia. Zaobserwowane działania niepożądane były na ogół podobne do działań niepożądanych występujących u dorosłych pacjentów (patrz punkt 4.8).
Otwarte badanie II fazy przeprowadzono z udziałem 29 pacjentów, w tym 27 pacjentów z populacji dzieci i młodzieży (w wieku od 3 do 16 lat) i 2 pacjentów z grupy młodych osób dorosłych (w wieku 18 do 19 lat) z glejakiem wysokiej złośliwości (ang. HGG, high-grade glioma) lub wyściółczakiem. Badanie zostało przerwane, gdy wyniki zaplanowanej pośredniej analizy wykazały brak kontroli przebiegu choroby. Średni czas przeżycia wolny od progresji choroby (ang. PFS, progression free survival) wynosił 2,3 miesiąca w grupie z glejakiem i 2,7 miesiąca z wyściółczakiem. Mediana całkowitego przeżycia wynosiła 5,1 miesiąca w ramieniu chorych z glejakiem i 12,3 miesiąca z wyściółczakiem. Do najczęściej raportowanych zdarzeń niepożądanych związanych z leczeniem (>10%) u pacjentów z obydwu grup było zmniejszenie liczby neutrofili [6 pacjentów (20,7%)] i krwotok śródczaszkowy [3 pacjentów (10,3%)], (patrz punkt 4.8).
Dane pochodzące z badania I/II fazy dotyczącego doustnego stosowania sunitynibu u 6 pacjentów z populacji dzieci i młodzieży z GIST w wieku od 13 do 16 lat, którzy otrzymywali sunitynib w schemacie 4/2 w dawkach od 15 mg/m2 pc. na dobę do 30 mg/m2 pc. na dobę oraz dostępne opublikowane dane (pochodzące od 20 pacjentów z populacji dzieci i młodzieży lub młodych osób dorosłych z GIST) wykazały, że leczenie sunitynibem spowodowało stabilizację choroby u 18 z 26 (69,2%) pacjentów, u których stwierdzono niepowodzenie leczenia imatynibem lub jego nietolerancję (16 pacjentów z chorobą stabilną z 21) albo pacjentów de novo lub po zabiegu operacyjnym (2 pacjentów z chorobą stabilną z 5). W badaniu fazy 1/2 obserwowano stabilizację choroby oraz progresję choroby również u 3 z 6 pacjentów (1 pacjent otrzymał leczenie neoadiuwantowe oraz 1 pacjent otrzymał leczenie uzupełniające [adiuwantowe] imatinibem). W omawianym badaniu I/II fazy u 4 z 6 pacjentów (66,7%) wystąpiły zdarzenia niepożądane 3. lub 4. stopnia nasilenia (zdarzenia o 3. stopniu nasilenia: hipofosfatemia, neutropenia i małopłytkowość,
przy czym każde z nich wystąpiło u 1 pacjenta oraz neutropenia o 4. stopniu nasilenia – u 1 pacjenta. Ponadto w publikacjach raportowano następujące działania niepożądane 3. stopnia nasilenia związane z lekiem, które wystąpiły u 5 pacjentów: zmęczenie (2), zaburzenia żołądkowo-jelitowe łącznie z biegunką (2), zaburzenia hematologiczne łącznie z anemią (2), zapalenie pęcherzyka żółciowego (1), nadczynność tarczycy (1), zapalenie błony śluzowej (1).
Przeprowadzono analizę farmakokinetyczną populacji (PK) oraz analizę farmakokinetyczno- farmakodynamiczną (PK/PD) w zakresie ekstrapolacji farmakokinetyki oraz głównych punktów końcowych wymaganych do oceny bezpieczeństwa i skuteczności stosowania sunitynibu u dzieci i młodzieży z GIST (w wieku od 6 do 17 lat). Analiza została oparta na danych zebranych od dorosłych pacjentów z GIST lub guzami litymi oraz od dzieci i młodzieży z guzami litymi. Na podstawie analiz modelowania nie wydaje się, aby młody wiek pacjentów oraz drobniejsza budowa ciała wpływały negatywnie na reakcje organizmu w zakresie skuteczności i bezpieczeństwa ekspozycji na sunitynib w osoczu. Nie stwierdzono, aby na stosunek korzyści do ryzyka sunitynibu negatywnie wpływały młody wiek lub drobniejsza budowa ciała pacjentów. Na ten stosunek głównie wpływa ekspozycja na ten lek w osoczu.
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań produktu leczniczego zawierającego sunitynib we wszystkich podgrupach populacji dzieci i młodzieży w leczeniu raka nerkowokomórkowego lub raka miedniczki nerkowej (z wyłączeniem nerczaka płodowego, nefroblastomatozy, mięsaka jasnokomórkowego, nerczaka mezoblastycznego, raka rdzeniastego nerki i nowotworu rabdoidalnego nerki) (patrz punkt 4.2).
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań produktu leczniczego zawierającego sunitynib we wszystkich podgrupach populacji dzieci i młodzieży w leczeniu nowotworów neuroendokrynnych żołądka, jelit i trzustki (z wyłączeniem nerwiaka płodowego, nerwiaka zwojowego płodowego i guza chromochłonnego nadnerczy) (patrz punkt 4.2).
Właściwości farmakokinetyczne sunitynibu oceniono w badaniach obejmujących 135 zdrowych ochotników i 266 pacjentów z guzami litymi. Właściwości farmakokinetyczne były podobne we wszystkich badanych populacjach pacjentów z guzami litymi i u zdrowych ochotników.
W zakresie dawkowania od 25 do 100 mg pole pod krzywą zależności stężenia leku w osoczu od czasu (AUC) i Cmax zwiększa się proporcjonalnie do dawki. Podczas podania wielokrotnego w ciągu doby sunitynib ulega kumulacji, przy czym jego stężenie zwiększa się 3–4-krotnie, a stężenie jego podstawowego czynnego metabolitu zwiększa się 7–10-krotnie. Stężenie sunitynibu i jego podstawowego czynnego metabolitu w stanie równowagi zostaje osiągnięte w ciągu od 10 do 14 dni. Do 14. dnia łączne stężenie osoczowe sunitynibu i jego podstawowego czynnego metabolitu wynosi 62,9–101 ng/ml, co jest docelowym stężeniem przewidywanym na podstawie danych z badań przedklinicznych jako stężenie hamujące fosforylację receptorów in vitro, prowadzącym do zatrzymania i (lub) zmniejszenia wzrostu guzów in vivo. Podstawowy czynny metabolit odpowiada za 23% do 37% całkowitej ekspozycji na lek. Nie obserwuje się istotnych zmian farmakokinetyki sunitynibu lub jego podstawowego czynnego metabolitu podczas kilkakrotnego podawania leku w ciągu doby, lub w trakcie powtarzanych cyklów badanych schematów dawkowania.
Po podaniu doustnym sunitynibu Cmax stwierdza się na ogół po upływie 6–12 godzin (tmax - czas od podania do osiągnięcia stężenia maksymalnego).
Pokarm nie wpływa na dostępność biologiczną sunitynibu. Dystrybucja
W badaniach in vitro stopień wiązania się sunitynibu i jego podstawowego czynnego metabolitu z
ludzkimi białkami osocza wynosił odpowiednio 95% i 90% niezależnie od stężenia. Pozorna objętość dystrybucji (Vd) w przypadku sunitynibu była znaczna – 2230 l, co wskazuje na penetrację leku do tkanek.
Obliczone in vitro wartości stałej Ki dla wszystkich badanych izoenzymów cytochromu P450 (CYP) (CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5 i
CYP4A9/11) wskazują na to, że sunitynib i jego podstawowy czynny metabolit prawdopodobnie nie przyspieszają w stopniu istotnym klinicznie metabolizmu substancji czynnych metabolizowanych przez te enzymy.
Sunitynib jest metabolizowany głównie przez izoenzym CYP3A4, izoformę CYP, która katalizuje reakcję powstawania głównego czynnego metabolitu dezetylosunitynibu podlegającego dalszemu metabolizmowi katalizowanemu przez ten sam izoenzym.
Należy unikać równoczesnego podawania sunitynibu z silnymi induktorami lub inhibitorami CYP3A4, ponieważ stężenie sunitynibu w osoczu może ulec zmianie (patrz punkty 4.4 i 4.5).
Substancja czynna jest wydalana głównie z kałem (61%), natomiast przez nerki ulega wydaleniu 16% podanej dawki w postaci niezmienionej i metabolitów. Sunitynib i jego podstawowy czynny metabolit były głównymi związkami wykrywanymi w osoczu, moczu i kale, odpowiadając
odpowiednio za 91,5%, 86,4% i 73,8% radioaktywności w zebranych próbkach. Pozostałe metabolity zostały zidentyfikowane w moczu i w kale, jednak na ogół nie były wykrywane w osoczu. Całkowity klirens leku po podaniu doustnym (CL/F) wynosił 34–62 l/h. Po podaniu doustnym zdrowym ochotnikom okres półtrwania sunitynibu i jego podstawowego czynnego metabolitu dietylowego wynosił odpowiednio około 40–60 godzin i 80–110 godzin.
Równoczesne podawanie z produktami leczniczymi będącymi inhibitorami BCRP
W warunkach in vitro sunitynib jest substratem BCRP (białka oporności raka piersi), zaliczanego do transporterów czynnie usuwających substraty poza komórkę. W badaniu A6181038 równoczesne podawanie z gefitynibem, który jest inhibitorem BCRP, nie wpływało w sposób klinicznie istotny na wartości Cmax i AUC sunitynibu ani łącznie sunitynibu i jego metabolitu (patrz punkt 4.5). Było to badanie wieloośrodkowe, otwarte, I/II fazy, mające na celu ocenę bezpieczeństwa i tolerancji, ustalenie maksymalnej tolerowanej dawki oraz aktywności przeciwnowotworowej sunitynibu w skojarzeniu z gefitynibem u pacjentów z MRCC. Jako drugorzędowy punkt końcowy badania oceniano parametry farmakokinetyczne gefitynibu (podawanego w dawce dobowej 250 mg) i sunitynibu [podawanego w dawce dobowej 37,5 mg w kohorcie nr 1 (n = 4) i 50 mg w kohorcie nr 2 (n = 7) w schemacie 4 tygodnie leczenia i 2 tygodnie przerwy] w okresach jednoczesnego podawania. Zmiany wartości parametrów farmakokinetycznych sunitynibu nie były klinicznie istotne ani nie wskazywały na występowanie jakichkolwiek interakcji międzylekowych, jednak ze względu na stosunkowo małą liczbę uczestników badania (N = 7 + 4) i umiarkowaną do dużej zmienność osobniczą w zakresie parametrów farmakokinetycznych uzyskane w tym badaniu wyniki dotyczące farmakokinetycznych interakcji międzylekowych należy interpretować z ostrożnością.
Sunitynib i jego główny metabolit są metabolizowane przede wszystkim przez wątrobę. Całkowity wpływ na organizm sunitynibu podanego w pojedynczej dawce był podobny u pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby (stopnia A i B według klasyfikacji Childa-Pugh) w porównaniu z pacjentami z prawidłową czynnością wątroby. Nie przeprowadzono badań z produktem Asikreba stosowanym u pacjentów z ciężkimi zaburzeniami czynności wątroby (stopnia C według klasyfikacji Childa-Pugh).
Z badań u pacjentów z nowotworami wykluczono pacjentów z aktywnością AlAT lub AspAT przekraczającą o ponad 2,5 x górną granicę normy, lub o ponad 5,0 x górną granicę normy, gdy zwiększenie to wiązało się z przerzutami do wątroby.
Populacyjne analizy farmakokinetyki wykazały, że klirens pozorny sunitynibu (CL/F) nie jest uzależniony od klirensu kreatyniny (Clcr) w ocenianym zakresie stężeń (42–347 ml/min).
Ekspozycja ogólnoustrojowa po pojedynczej dawce sunitynibu była podobna u pacjentów z ciężkimi zaburzeniami czynności nerek (CLcr < 30 ml/min) i u pacjentów z prawidłową czynnością nerek (CLcr > 80 ml/min). Mimo, iż sunitynib i jego główny metabolit nie były eliminowane przez hemodializę u pacjentów z ESRD, całkowita ekspozycja ogólnoustrojowa była mniejsza o 47% dla sunitynibu i 31% dla głównego metabolitu w porównaniu z pacjentami z prawidłową czynnością nerek.
Masa ciała, sprawność fizyczna
Analiza danych demograficznych pod kątem farmakokinetyki populacyjnej wskazuje, że nie ma konieczności dostosowania dawki początkowej w zależności od masy ciała i sprawności fizycznej ocenianej za pomocą kwestionariusza Eastern Cooperative Oncology Group (ECOG).
Dostępne dane wskazują, że kobiety mogą mieć o około 30% mniejszy pozorny klirens (CL/F) sunitynibu w porównaniu do mężczyzn: różnica ta nie wymaga jednak dostosowywania dawki początkowej.
Dane dotyczące stosowania sunitynibu u dzieci i młodzieży są ograniczone (patrz punkt 4.2). Analizy farmakokinetyki populacji zbiorczych danych zebranych od dorosłych pacjentów z GIST i guzami litymi oraz od dzieci i młodzieży z guzami litymi zostały zakończone. Przeprowadzono analizy krokowego modelowania zmiennych kowariancji (ang. stepwise covariate modelling analyses) w celu oceny wpływu wieku oraz rozmiaru ciała (całkowitej masy ciała lub powierzchni ciała), jak również innych zmiennych kowariancji na istotne parametry farmakokinetyczne dla sunitynibu oraz jego czynnego metabolitu. Spośród analizowanych zmiennych związanych z wiekiem i rozmiarem ciała, wiek znacząco wpływał na pozorny klirens sunitynibu (zależność: im młodszy wiek pacjenta należącego do populacji dzieci i młodzieży, tym mniejszy pozorny klirens). W podobny sposób powierzchnia ciała znacząco wpływała na pozorny klirens czynnego metabolitu (zależność: im mniejsza powierzchnia ciała, tym mniejszy pozorny klirens).
Ponadto na podstawie zintegrowanej populacyjnej analizy farmakokinetycznej danych zbiorczych uzyskanych z 3 badań klinicznych przeprowadzonych z udziałem dzieci i młodzieży w wieku od 6 do 11 lat i od 12 do 17 lat (2 badania kliniczne przeprowadzone z udziałem dzieci i młodzieży z guzami litymi i 1 badanie kliniczne z udziałem dzieci i młodzieży z GIST) wyjściowe pole powierzchni ciała (ang. BSA, body surface area) stanowiło istotną współzmienną, która wpływała na pozorny klirens sunitynibu i jego czynnego metabolitu. Opierając się na niniejszej analizie, przewiduje się, że po podaniu dawki około 20 mg/m2 pc. na dobę (zakres BSA: 1,10–1,87 m2 ) u dzieci i młodzieży uzyska się porównywalną ekspozycję na sunitynib i jego czynny metabolit w osoczu, jak u dorosłych pacjentów z GIST leczonych dawką 50 mg na dobę według schematu 4/2 (AUC 1233 ng*h/ml) W badaniach pediatrycznych, dawka początkowa sunitynibu wynosiła
15 mg/m2 pc. (bazując na MTD ustalonej w badaniu fazy I z eskalacją dawki, patrz punkt 5.1), która u pacjentów z populacji dzieci i młodzieży z GIST została zwiększona do 22 mg/m2 pc., a następnie do 30 mg/m2 pc. (tak aby nie przekroczyć dawki całkowitej wynoszącej 50 mg na dobę) bazując na indywidualnym bezpieczeństwie/tolerancji pacjenta. Co więcej, zgodnie z opublikowanymi danymi literaturowymi u pacjentów z populacji dzieci i młodzieży z GIST, obliczona dawka początkowa, która mieściła się w zakresie od 16,6 mg/m2 pc. do 36 mg/m2 pc., uległa zwiększeniu do 40,4 mg/m2 pc. (nie przekraczając dawki całkowitej wynoszącej 50 mg na dobę).
W trwających do 9 miesięcy badaniach toksyczności po podaniu wielokrotnym u szczurów i małp stwierdzono, że podstawowymi narządami, na które wpływa lek, są: przewód pokarmowy (nudności i biegunki u małp), nadnercza (przekrwienie kory i (lub) krwotoki u szczurów i małp, z martwicą i następującym po niej włóknieniem u szczurów), układ limfatyczny i krwiotwórczy (zmniejszenie liczby komórek szpiku kostnego i zanik tkanki limfoidalnej grasicy, śledziony i węzłów chłonnych), zewnątrzwydzielnicza część trzustki (degranulacja komórek pęcherzykowych z martwicą pojedynczych komórek), ślinianki (przerost gronek), stawy (zgrubienie płytki wzrostu), macica (zanik) i jajniki (zmniejszony wzrost pęcherzyków). Wszystkie wyniki uzyskano przy istotnych klinicznie poziomach stężenia osoczowego sunitynibu. Dodatkowe działania produktu obserwowane w innych badaniach obejmowały: wydłużenie odstępu QTc, zmniejszenie LVEF, zanik kanalików jądrowych, rozrost komórek mezangium w nerkach, krwotok z przewodu pokarmowego i do jamy ustnej, i przerost komórek płata przedniego przysadki. Uważa się, że zmiany w obrębie macicy (zanik błony śluzowej) i płytki wzrostowej kości (zgrubienie nasad kostnych lub dysplazja chrząstki) są związane z działaniem farmakologicznym sunitynibu. Większość z tych zmian była odwracalna po upływie od 2 do 6 tygodni od zakończenia leczenia.
Potencjalne działanie genotoksyczne sunitynibu oceniano zarówno in vitro, jak i in vivo. Sunitynib nie wykazywał właściwości mutagennych w badaniach na bakteriach z zastosowaniem aktywacji metabolicznej przez wątrobę szczura. Sunitynib nie indukował strukturalnych aberracji chromosomalnych w ludzkich limfocytach krwi obwodowej in vitro. Obserwowano poliploidię (liczbowe aberracje chromosomalne) w ludzkich limfocytach krwi obwodowej in vitro, zarówno w przypadku zastosowania aktywacji metabolicznej, jak i bez niej. Sunitynib nie wykazywał działania klastogennego w szczurzym szpiku kostnym in vivo. Nie oceniano jego podstawowego czynnego metabolitu pod kątem potencjalnej genotoksyczności.
W trwającym 1 miesiąc badaniu określającym zakres wielkości dawek podawanych doustnie (0, 10, 25, 75 lub 200 mg/kg mc. na dobę) w sposób ciągły u myszy transgenicznych rasH2, rak i rozrost gruczołów Brunner’a w dwunastnicy obserwowano przy największej badanej dawce (200 mg/kg mc. na dobę).
Trwające 6 miesięcy badanie rakotwórczości, po codziennym podaniu doustnym (0, 8, 25, 75 [zmniejszone do 50] mg/kg mc. na dobę), przeprowadzono na myszach transgenicznych rasH2. Podczas stosowania dawek ≥ 25 mg/kg mc. na dobę po 1 miesiącu lub 6 miesiącach leczenia (ekspozycja ≥ 7,3 razy większa niż AUC u pacjentów otrzymujących zalecaną dawkę dobową) obserwowano przypadki raka żołądka i dwunastnicy, zwiększoną częstość występowania złośliwego śródbłoniaka krwionośnego w tle i (lub) hiperplazji błony śluzowej żołądka.
W trwającym 2 lata badaniu rakotwórczości u szczurów (0, 0,33, 1 lub 3 mg/kg mc. na dobę), podawanie sunitynibu w 28-dniowych cyklach, po których następowała 7-dniowa przerwa, powodowało zwiększenie odsetka guzów chromochłonnych i rozrostu rdzenia nadnerczy u samców szczurów po podaniu 3 mg/kg mc. na dobę przez > 1 rok (ekspozycja ≥ 7,8 razy większa niż AUC u pacjentów otrzymujących zalecaną dawkę dobową). Rak gruczołów Brunner’a w dwunastnicy wystąpił po dawce ≥ 1 mg/kg mc. na dobę u samic szczurów i po dawce 3 mg/kg mc. na dobę
u samców szczurów, a rozrost komórek błony śluzowej był jednoznaczny w gruczołach żołądka po dawce 3 mg/kg mc. na dobę u samców szczurów, co stanowiło odpowiednio ≥ 0,9, 7, 8 i 7,8 razy większą ekspozycję niż AUC u pacjentów otrzymujących zalecaną dawkę dobową. Nie ustalono znaczenia dla ludzi obserwowanych u mysz transgenicznych rasH2 i szczurów nowotworów w badaniach nad rakotwórczością sunitynibu.
Toksyczny wpływ na rozród i rozwój potomstwa
W badaniach toksycznego wpływu na rozród nie stwierdzono wpływu produktu na płodność samców lub samic. Jednak w badaniach toksyczności po podaniu wielokrotnym przeprowadzonych na szczurach i małpach obserwowano oddziaływanie leku na płodność samic w postaci atrezji pęcherzyków, zwyrodnienia ciałek żółtych, zmian błony śluzowej macicy oraz zmniejszenia masy macicy i jajników przy klinicznie istotnych poziomach ekspozycji układowej. U szczurów obserwowano wpływ leku na płodność samców w postaci zaniku kanalików jąder, zmniejszenia liczby plemników w najądrzach i zmniejszenia ilości koloidu w obrębie gruczołu krokowego i pęcherzyków nasiennych przy poziomach ekspozycji osoczowej 25 razy większych niż narażenie ogólnoustrojowe u ludzi.
U szczurów śmiertelność zarodków i płodów przejawiała się istotnym zmniejszeniem liczby żywych płodów, zwiększoną liczbą resorpcji, wzrostem utrat ciąży po zagnieżdżeniu zarodka i całkowitą utratą miotów u 8 z 28 samic ciężarnych przy poziomach stężenia leku w osoczu 5,5 razy większych niż narażenie ogólnoustrojowe u ludzi. U królików redukcja masy macicy samic ciężarnych i liczby żywych płodów była związana ze zwiększeniem liczby resorpcji, wzrostem liczby utrat ciąży po zagnieżdżeniu zarodka i całkowitą utratą miotów u 4 z 6 samic ciężarnych przy poziomach stężenia leku w osoczu 3 razy większych niż narażenie ogólnoustrojowe u ludzi. Stosowanie sunitynibu u
szczurów w okresie organogenezy w dawce ≥ 5 mg/kg mc./dobę prowadziło do zmian rozwojowych, polegających na zwiększonej częstości występowania wad rozwojowych szkieletu płodu, charakteryzujących się przede wszystkim opóźnieniem kostnienia kręgów piersiowych i (lub) lędźwiowych i obserwowanych przy poziomach stężenia leku w osoczu 5,5 razy większych niż narażenie ogólnoustrojowe u ludzi. U królików wpływ leku na rozwój polegał na zwiększeniu częstości występowania rozszczepu wargi przy poziomach stężenia leku w osoczu w przybliżeniu odpowiadających poziomom obserwowanym w warunkach klinicznych u ludzi oraz rozszczepu wargi i rozszczepu podniebienia przy poziomach stężenia leku w osoczu 2,7 razy większych niż narażenie ogólnoustrojowe u ludzi.
Sunitynib (0,3, 1,0 lub 3,0 mg/kg mc. na dobę) był oceniany w prenatalnym i postnatalnym badaniu rozwoju potomstwa u ciężarnych szczurów. Przyrost masy ciała matki był zmniejszony podczas ciąży i laktacji po dawce > 1 mg/kg mc. na dobę, ale nie obserwowano toksycznego wpływu na rozród do dawki 3 mg/kg mc. na dobę (szacowana ekspozycja ≥ 2,3 razy większa niż AUC u pacjentów otrzymujących zalecaną dawkę dobową). Zmniejszenie masy ciała potomstwa obserwowano w okresie przed odstawieniem od piersi i po odstawieniu od piersi po dawce
3 mg/kg mc. na dobę. Nie obserwowano toksycznego wpływu na rozród po dawce
1 mg/kg mc./dobę (przybliżona ekspozycja ≥ 0,9 razy większa niż AUC u pacjentów otrzymujących zalecaną dawkę dobową).
Zawartość kapsułki Powidon K25 Mannitol Kroskarmeloza sodowa Magnezu stearynian
Otoczka kapsułki
Żelatyna
Żelaza tlenek czerwony (E172) Tytanu dwutlenek (E171) Żelaza tlenek czarny (E172)
Tusz do nadruku
Szelak
Glikol propylenowy Sodu wodorotlenek Powidon
Tytanu dwutlenek (E171)
25 mg kapsułki, twarde Zawartość kapsułki Powidon K25
Mannitol Kroskarmeloza sodowa Magnezu stearynian
Otoczka kapsułki
Żelatyna
Tytanu dwutlenek (E171) Żelaza tlenek czerwony (E172) Żelaza tlenek czarny (E172) Żelaza tlenek żółty (E172)
Tusz do nadruku
Szelak
Glikol propylenowy Sodu wodorotlenek Powidon
Tytanu dwutlenek (E171)
37,5 mg kapsułki, twarde Zawartość kapsułki Powidon K25
Mannitol Kroskarmeloza sodowa Magnezu stearynian
Otoczka kapsułki
Żelatyna
Żółcień pomarańczowa FCF (E110)
Tartrazyna (E102
Tytanu dwutlenek (E171)
Tusz do nadruku
Szelak
Glikol propylenowy
Amonowy wodorotlenek stężony Żelaza tlenek czarny (E172) Potasu wodorotlenek
Woda oczyszczona
50 mg kapsułki, twarde Zawartość kapsułki Powidon K25
Mannitol Kroskarmeloza sodowa Magnezu stearynian
Otoczka kapsułki
Żelatyna
Tytanu dwutlenek (E171) Żelaza tlenek żółty (E172) Żelaza tlenek czerwony (E172) Żelaza tlenek czarny (E172)
Tusz do nadruku
Szelak
Glikol propylenowy Sodu wodorotlenek Powidon
Tytanu dwutlenek (E171)
Nie dotyczy.
30 miesięcy
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Kapsułki pakowane są w: białe blistry poliwinylowo (PVC) polichlorotrifluoroatylenowo (PCTFE)/Aluminiowe zawierające 28 lub 30 kapsułek, twardych.
Butelki HDPE z zakrętką PP zawierające 30 kapsułek, twardych.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Brak szczególnych zaleceń dotyczących usuwania.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
DOPUSZCZENIE DO OBROTU
Zentiva k.s.
U Kabelovny 130 Dolni Měcholupy 102 37 Praga 10 Republika Czeska
Asikreba 12,5 mg kapsułki twarde Pozwolenie nr Asikreba 25 mg kapsułki twarde Pozwolenie nr Asikreba 37,5 mg kapsułki twarde Pozwolenie nr Asikreba 50 mg kapsułki twarde Pozwolenie nr
OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











