Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Dzieci poniżej 12 lat
Nie określono bezpieczeństwa stosowania i skuteczności efedryny u dzieci w wieku poniżej 12 lat. Dane nie są dostępne.
Dzieci od 12 lat
Przeciwwskazania
nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1;
w skojarzeniu z innymi pośrednimi środkami sympatykomimetycznymi, takimi jak felolopropanoloamina, fenylefryna, pseudoefedryna i metylofenidat;
w skojarzeniu ze środkami alfa sympatykomimetycznymi;
w skojarzeniu z nieselektywnymi inhibitorami MAO lub w ciągu 14 dni od ich odstawienia.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania Ostrzeżenia
Interakcje z innymi produktami leczniczymi oraz inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Wyciągnąć ampułkostrzykawkę z jałowego blistra.
Wcisnąć tłoczek, aby uwolnić korek.
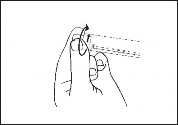
Obrócić zatyczkę w celu zerwania zabezpieczenia.
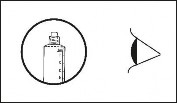
Upewnić się, że całkowicie usunięto zabezpieczenie strzykawki. Jeśli nie, założyć zatyczkę i obrócić ponownie.
Wycisnąć powietrze przez łagodne naciśnięcie tłoczka.
Podłączyć strzykawkę do urządzenia z dostępem do żyły. Powoli wciskać tłoczek w celu wstrzyknięcia wymaganej objętości.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Ephedrinum hydrochloricum Aguettant, 3 mg/ml, roztwór do wstrzykiwań w ampułko-strzykawce
Każdy mililitr roztworu do wstrzykiwań zawiera 3 mg efedryny chlorowodorku, co odpowiada 2,46 mg efedryny.
Każda ampułkostrzykawka o pojemności 10 ml zawiera 30 mg efedryny chlorowodorku, co odpowiada 24,6 mg efedryny.
Substancja pomocnicza o znanym działaniu Ten produkt leczniczy zawiera sód.
Każdy mililitr roztworu do wstrzykiwań zawiera 3,39 mg sodu, co odpowiada 0,15 mmol. Każda ampułkostrzykawka o pojemności 10 ml zawiera 33,9 mg sodu, co odpowiada 1,5 mmol.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań (wstrzyknięcie)
Przejrzysty, bezbarwny płyn pH = 4,5 do 5,5
Osmolalność: w granicach 270–300 mOsm/kg
Leczenie niedociśnienia w wyniku znieczulenia zewnątrzoponowego lub nadtwardówkowego.
Dawkowanie
Dorośli
Powolne wstrzyknięcie dożylne od 3 do 6 mg (maksymalnie 9 mg), w razie potrzeby powtarzane co 3–4 min do maksymalnej dawki 30 mg. Brak skuteczności po podaniu 30 mg powinien prowadzić do ponownego rozważenia wyboru środka terapeutycznego.
Dawka podana w ciągu 24 godzin nie może przekroczyć 150 mg.
Dzieci i młodzież
Produkt leczniczy Ephedrinum hydrochloricum Aguettant zasadniczo nie jest zalecany do stosowania u dzieci, ze względu na brak wystarczających danych dotyczących skuteczności, bezpieczeństwa stosowania i zalecanej dawki.
Dawkowanie i sposób podawania są takie same jak dla dorosłych.
Pacjenci z zaburzeniami czynności nerek lub wątroby
Brak konieczności dostosowania dawki u pacjentów z zaburzeniami czynności nerek lub wątroby.
Pacjenci w podeszłym wieku
Tak jak dorośli.
Sposób podawania
Efedrynę należy stosować wyłącznie pod nadzorem anestezjologa jako wstrzyknięcie drogą dożylną. Podanie dożylne
Efedryny nie należy stosować w następujących przypadkach:
Efedrynę należy stosować z zachowaniem ostrożności u pacjentów, którzy mogą być szczególnie podatni na jej działanie, w szczególności u osób z nadczynnością tarczycy. Szczególna ostrożność wymagana jest też u pacjentów z chorobami układu sercowo-naczyniowego, takimi jak choroba niedokrwienna serca, arytmia lub częstoskurcz oraz z zarostowymi chorobami naczyń krwionośnych takimi jak stwardnienie tętnic, nadciśnienie tętnicze lub tętniaki. U pacjentów z dusznicą bolesną możliwe jest wywołanie bólu dusznicowego.
Ostrożność wymagana jest również w przypadku podawania efedryny pacjentom z cukrzycą, jaskrą z zamkniętym kątem przesączania lub przerostem gruczołu krokowego.
Efedryny należy unikać lub stosować ją z zachowaniem ostrożności u pacjentów poddawanych znieczuleniu cyklopropanem, halotanem lub innymi halogenowanymi środkami znieczulającymi, ponieważ mogą indukować migotanie komór. Możliwe jest także wystąpienie podwyższonego ryzyka arytmii, jeśli efedryna będzie podawana pacjentom przyjmującym glikozydy nasercowe, chinidynę lub antydepresanty trójcykliczne.
Wiele sympatykomimetyków wchodzi w interakcje z inhibitorami monoaminooksydazy i nie należy ich podawać pacjentom przyjmującym takie leczenie lub w ciągu 14 dni od jego zakończenia. Zaleca się unikanie sympatykomimetyków podczas przyjmowania selektywnych inhibitorów MAO.
Efedryna zwiększa ciśnienie krwi, a w związku z tym zaleca się szczególną ostrożność u pacjentów otrzymujących terapię przeciw nadciśnieniu. Interakcje efedryny z blokerami alfa i beta mogą być złożone. Propranolol i inne środki blokujące receptor beta adrenergiczny mają działanie antagonistyczne względem stymulantów receptora beta-2 adrenergicznego (agoniści beta2), takich jak salbutamol.
Niepożądane działania metaboliczne wysokich dawek agonistów beta2 mogą zostać zaostrzone przez jednoczesne podawanie wysokich dawek kortykosteroidów, w związku z czym należy starannie monitorować pacjentów, gdy te dwie postacie leczenia stosowane są równocześnie, choć ten środek ostrożności nie dotyczy wziewnego leczenia kortykosteroidami. Hipokalemia powiązana z wysokimi
dawkami agonistów beta2 może prowadzić do zwiększonej podatności na arytmię serca indukowaną przez naparstnicę. Hipokalemia może zostać nasilona przez równoczesne podawanie aminofiliny lub innych ksantyn, kortykosteroidów lub leczenie środkami moczopędnymi.
Środki ostrożności dotyczące stosowania
Efedrynę należy stosować z zachowaniem ostrożności u pacjentów ze stwierdzoną w wywiadzie chorobą serca.
Sportowców należy poinformować, że ten produkt leczniczy zawiera substancję czynną, która może dawać dodatni wynik w testach antydopingowych.
Przed infuzją należy sprawdzić, czy roztwór jest klarowny i nie zawiera widocznych cząstek stałych. Ten produkt leczniczy zawiera sód:
Ten produkt leczniczy zawiera 33,9 mg sodu na ampułkostrzykawkę 10 ml, co stanowi odpowiednik 1,7% maksymalnej zalecanej przez WHO dziennej dawki pokarmowej sodu dla osoby dorosłej wynoszącej 2 g sodu.
Przeciwwskazane połączenia:
Pośrednie środki sympatykomimetyczne (fenylopropanoloamina, pseudoefedryna, fenylefryna, metylofenidat)
Ryzyko zwężenia naczyń i (lub) ostrych epizodów nadciśnienia.
Alfa sympatykomimetyki (podawane doustnie i donosowo)
Ryzyko zwężenia naczyń i (lub) epizodów nadciśnienia.
Nieselektywne inhibitory MAO
Napadowe nadciśnienie tętnicze, hipertermia mogąca prowadzić do zgonu.
Niezalecane połączenia:
Alkaloidy sporyszu (działanie dopaminergiczne)
Ryzyko zwężenia naczyń i (lub) epizodów nadciśnienia.
Alkaloidy sporyszu (zwężające naczynia krwionośne)
Ryzyko zwężenia naczyń i (lub) epizodów nadciśnienia.
Selektywne inhibitory MAO-A (podawane równocześnie lub w ciągu ostatnich 2 tygodni): Ryzyko zwężenia naczyń i (lub) epizodów nadciśnienia.
Linezolid
Ryzyko zwężenia naczyń i (lub) epizodów nadciśnienia.
Antydepresanty trójcykliczne (np. imipramina)
Napadowe nadciśnienie tętnicze z możliwością arytmii (hamowanie przenikania adrenaliny lub noradrenaliny we włóknach współczulnych).
Antydepresanty noradrenergiczne-serotoninergiczne (minalcipran, wenlafaksyna) Napadowe nadciśnienie tętnicze z możliwością arytmii (hamowanie przenikania adrenaliny lub noradrenaliny we włóknach współczulnych).
Guanetydyna i produkty pokrewne
Znaczące zwiększenie ciśnienia krwi (hiperreaktywność powiązana ze zmniejszeniem napięcia współczulnego i (lub) hamowaniem przenikania adrenaliny lub noradrenaliny we włóknach współczulnych).
Jeśli połączenia nie można uniknąć, stosować z zachowaniem ostrożności niższe dawki środków sympatykomimetycznych.
Sibutramina
Napadowe nadciśnienie tętnicze z możliwością arytmii (hamowanie przenikania adrenaliny lub noradrenaliny we włóknach współczulnych).
Halogenowe anestetyki wziewne
Ryzyko okołooperacyjnego przełomu nadciśnieniowego i poważnych arytmii komorowych.
Połączenia wymagające środków ostrożności dotyczących stosowania:
Teofilina
Równoczesne podawanie efedryny i teofiliny może prowadzić do bezsenności, nerwowości i zaburzeń żołądka i jelit.
Kortykosteroidy
Wykazano, że efedryna zwiększa klirens deksametazonu.
Leki przeciwpadaczkowe: zwiększone stężenie fenytoiny oraz potencjalnie fenobarbitalu i prymidonu.
Doksapram: ryzyko nadciśnienia.
Oksytocyna: nadciśnienie z sympatykomimetykami zwężającymi naczynia krwionośne.
Leki hipotensyjne: rezerpina i metylodopa mogą ograniczać działanie wazopresyjne efedryny.
Ciąża
Badania na zwierzętach wykazały działanie teratogenne.
Dane kliniczne z badań epidemiologicznych na ograniczonej liczbie kobiet wydają się wskazywać brak określonego efektu efedryny w zakresie wad rozwojowych.
Opisano pojedyncze przypadki nadciśnienia tętniczego matek po nadużywaniu lub przedłużonym stosowaniu amin zwężających naczynia krwionośne.
Efedryna przenika przez łożysko i została powiązana z przyspieszonym biciem serca płodu oraz zmiennością pomiędzy uderzeniami.
W związku z tym podczas ciąży efedryny należy unikać lub stosować z zachowaniem ostrożności i wyłącznie, gdy jest to konieczne.
Karmienie piersią
Efedryna przenika do mleka kobiecego. U niemowląt karmionych piersią zgłaszano rozdrażnienie i zaburzenia cyklu snu. Istnieją dowody wskazujące, że efedryna ulega eliminacji w ciągu od 21 do 42 godzin po podaniu, a w związku z tym konieczne jest podjęcie decyzji, czy unikać leczenia efedryną, czy wstrzymać karmienie piersią na 2 dni po podaniu leku, uwzględniając korzyści z karmienia piersią dla dziecka i korzyści z leczenia dla kobiety.
Płodność
Dane nie są dostępne.
Nie dotyczy.
Bardzo często: ≥1/10; często: ≥1/100 do <1/10; niezbyt często: ≥1/1000 do <1/100; rzadko:
≥1/10000 do <1/1000; bardzo rzadko <1/10000; częstość nieznana: nie może być określona na podstawie dostępnych danych.
Zaburzenia krwi i układu chłonnego:
Częstość nieznana: modyfikacje hemostazy pierwotnej
Zaburzenia układu immunologicznego:
Częstość nieznana: nadwrażliwość
Zaburzenia psychiczne:
Często: splątanie, niepokój, depresja
Częstość nieznana: stany psychotyczne, lęk
Zaburzenia układu nerwowego:
Często: nerwowość, rozdrażnienie, niepokój, osłabienie, bezsenność, ból głowy, pocenie się
Częstość nieznana: drżenie, nadmierne ślinienie się
Zaburzenia oka:
Częstość nieznana: epizody jaskry z zamkniętym kątem przesączania
Zaburzenia serca:
Często: kołatania, nadciśnienie, częstoskurcz
Rzadko: arytmia serca
Częstość nieznana: ból dusznicowy, bradykardia odruchowa, zatrzymanie serca, obniżone ciśnienie krwi
Zaburzenia naczyniowe:
Częstość nieznana: krwotok mózgowy
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia:
Często: duszność
Częstość nieznana: obrzęk płuc
Zaburzenia żołądka i jelit:
Często: mdłości, wymioty
Częstość nieznana: zmniejszone łaknienie
Zaburzenia nerek i dróg moczowych:
Rzadko: ostre zatrzymanie moczu
Badania diagnostyczne:
Częstość nieznana: hipokalemia, zmiany poziomu glukozy we krwi
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem:
Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181 C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
W przypadku przedawkowania obserwuje się mdłości, wymioty, gorączkę, psychozę paranoidalną, arytmię komorową i nadkomorową, nadciśnienie, zahamowanie czynności oddechowej, drgawki i śpiączkę.
Dawka śmiertelna dla ludzi wynosi około 2 g, co odpowiada stężeniu we krwi wynoszącemu od około 3,5 do 20 mg/l.
Leczenie
Leczenie przedawkowania efedryny po tym produkcie leczniczym może wymagać intensywnego leczenia wspomagającego. Można podać powolne wstrzyknięcie dożylne labetalolu 50 do 200 mg z monitorowaniem elektrokardiograficznym w celu leczenia częstoskurczu nadkomorowego. Znacząca hipokalemia (<2,8 mmol.l–1) w wyniku przesunięcia przedziałowego potasu jest czynnikiem predysponującym do arytmii serca i można ją skorygować przez infuzję chlorku potasu wraz z propranololem i korektą zasadowicy oddechowej, jeśli występuje.
Do opanowania skutków pobudzenia OUN może być konieczna benzodiazepina i (lub) środek neuroleptyczny.
W przypadku ciężkiego nadciśnienia, możliwości przeciwdziałania nadciśnieniu drogą pozajelitową obejmują azotany dożylne, blokery kanałów wapniowych, nitroprusydek sodu, labetalol lub fentolaminę. Wybór leku przeciwnadciśnieniowego zależny jest od dostępności, stanów współistniejących oraz stanu klinicznego pacjenta.
Grupa farmakoterapeutyczna: leki pobudzające układ sercowo-naczyniowy, wpływające na receptory adrenergiczne i dopaminergiczne.
Kod ATC: C01CA26
Efedryna jest aminą sympatykomimetyczną działającą bezpośrednio na receptory alfa i beta oraz pośrednio przez zwiększenie uwalniania noradrenaliny przez zakończenia nerwów współczulnych. Jako środek sympatykomimetyczny efedryna stymuluje ośrodkowy układ nerwowy, układ sercowo- naczyniowy, układ oddechowy oraz zwieracze układu pokarmowego i moczowego. Efedryna jest także inhibitorem monoaminooksydazy (MAO).
Po podaniu dożylnym efedryna jest całkowicie biodostępna a biodostępność efedryny po podaniu doustnym wynosi powyżej 90%.
Wydalanie zależy od pH moczu:
Od 73 do 99% (średnia: 88%) w moczu kwaśnym,
Od 22 do 35% (średnia: 27%) w moczu zasadowym.
Po podaniu doustnym lub pozajelitowym 77% efedryny jest wydalana w postaci niezmienionej w moczu.
Okres półtrwania zależy od pH moczu. Przy moczu zakwaszonym na poziomie pH = 5, okres półtrwania wynosi 3 godziny, przy moczu zasadowym o pH = 6,3, okres półtrwania wynosi około 6 godzin.
Brak danych przedklinicznych istotnych dla lekarza przepisującego lek, które nie byłyby wymienione w innych punktach Charakterystyki Produktu Leczniczego.
Sodu chlorek
Kwas cytrynowy jednowodny Sodu cytrynian
Kwas solny stężony (do ustalenia pH) Sodu wodorotlenek (do ustalenia pH) Woda do wstrzykiwań
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonywano badań dotyczących zgodności.
3 lata
Po otwarciu: produkt musi zostać wykorzystany natychmiast.
Przechowywać blister z ampułko-strzykawką w tekturowym pudełku w celu ochrony przed światłem.
Polipropylenowa ampułko-strzykawka o pojemności 10 ml z polipropylenową zatyczką oraz zabezpieczeniem gwarancyjnym, pakowana osobno w przezroczysty blister. Ampułko-strzykawki dostępne są w tekturowych pudełkach po 1, 5, 10, 12 i 20 sztuk.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Instrukcja stosowania:
Należy starannie przygotować strzykawkę w opisany sposób
Ampułko-strzykawka przeznaczona jest wyłącznie dla jednego pacjenta. Wyrzucić strzykawkę po użyciu. NIE UŻYWAĆ PONOWNIE.
Zawartość nieotwartego i nieuszkodzonego blistra jest jałowa i nie wolno go otwierać przed użyciem. Produkt należy przed podaniem skontrolować wizualnie w celu wykrycia cząstek stałych i przebarwienia. Należy stosować wyłącznie przejrzysty bezbarwny roztwór bez cząstek stałych lub osadów.
Nie należy stosować produktu w razie zerwania zabezpieczenia gwarancyjnego na strzykawce.
Zewnętrzna powierzchnia strzykawki jest jałowa do otwarcia blistra.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Laboratoire AGUETTANT 1, rue Alexander Fleming 69007 Lyon
Francja
Pozwolenie nr
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











