Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Jeśli początkowa tabletka 100 µg okaże się nieskuteczna, do leczenia kolejnego epizodu bólu przebijającego (BTP) pacjent może zażyć dwie tabletki o mocy 100 µg. Zaleca się, by po każdej stronie jamy ustnej umieszczona została jedna tabletka. Jeśli dawka ta uznana zostanie za skuteczną, terapia kolejnych epizodów bólu przebijającego (BTP) może być kontynuowana za pomocą jednej tabletki podpoliczkowej fentanylu o mocy 200 µg.
Jeśli jedna tabletka podpoliczkowa fentanylu o mocy 200 µg (lub dwie o mocy 100 µg) nie
zostanie uznana za skuteczną, pacjent może zastosować dwie tabletki o mocy 200 µg (lub cztery o
mocy 100 µg) do leczenia kolejnego epizodu bólu przebijającego (BTP). Zaleca się umieszczenie dwóch tabletek po każdej stronie jamy ustnej. Jeśli dawka ta zostanie uznana za skuteczną, terapia kolejnych epizodów bólu przebijającego (BTP) może być kontynuowana za pomocą jednej
tabletki podpoliczkowej fentanylu o mocy 400 µg.
W procesie doboru dawki do 600 µg i 800 µg, należy stosować tabletki o mocy 200 µg.
W badaniach klinicznych nie dokonano oceny dawek przewyższających 800 µg.
Do leczenia jednego epizodu bólu przebijającego (BTP) nie należy stosować więcej niż dwie tabletki, za wyjątkiem procesu doboru dawki przy zastosowaniu do czterech tabletek, zgodnie z podanym powyżej opisem.
W czasie dostosowywania dawki fentanylu w postaci tabletek podpoliczkowych, przed rozpoczęciem leczenia kolejnego epizodu bólu przebijającego (BTP) pacjenci powinni odczekać co najmniej 4 godziny.
Leczenie podtrzymujące
Po ustaleniu w procesie doboru dawki skutecznej, pacjenci powinni kontynuować stosowanie tej dawki w postaci jednej tabletki o danej mocy. Nasilenie bólu przebijającego w epizodach może
zmieniać się i może być potrzebne zwiększenie dawki fentanylu w postaci tabletek podjęzykowych w czasie wynikające z postępu choroby nowotworowej. W tych przypadkach można zastosować drugą tabletkę podpoliczkową fentanylu o tej samej mocy. Jeżeli przez kilka kolejnych epizodów druga
tabletka podpoliczkowa fentanylu była potrzebna, należy ponownie dostosować dawkę produktu w leczeniu podtrzymującym (patrz poniżej).
W leczeniu podtrzymującym, pacjenci powinni odczekać co najmniej 4 godziny przed rozpoczęciem leczenia kolejnego epizodu bólu przebijającego (BTP) fentanylem w postaci tabletek podpoliczkowych.
Dostosowywanie dawki
Dawkę podtrzymującą fentanylu w postaci tabletek podpoliczkowych należy zwiększyć jeśli u
pacjenta podczas kilku kolejnych epizodów bólu przebijającego (BTP) konieczne było użycie więcej niż jednej tabletki. Ponowne dostosowywanie dawki oparte jest na tych samych zasadach co sposób doboru dawki (patrz powyżej). Niezbędne może być ponowne dostosowanie dawki w terapii uzupełniającej lekami opioidowymi, jeśli pacjenci zgłaszają wystąpienie ponad czterech epizodów bólu przebijającego (BTP) w ciągu 24 godzin.
W przypadku braku odpowiedniej kontroli bólu należy rozważyć możliwość wystąpienia hiperalgezji, tolerancji i postępu choroby podstawowej (patrz punkt 4.4).
Przerwanie terapii
Stosowanie tabletek podpoliczkowych fentanylu należy natychmiast przerwać, jeśli pacjent już nie ma epizodów bólu przebijającego. Leczenie utrzymującego się bólu podstawowego powinno odbywać się zgodnie z zaleceniami. Jeśli niezbędne jest odstawienie wszystkich leków opioidowych, lekarz musi dokładnie kontrolować pacjenta w celu zarządzania ryzykiem wystąpienia ostrych objawów odstawiennych.
Pacjenci z niewydolnością wątroby lub nerek
U pacjentów z umiarkowaną lub ostrą niewydolnością wątroby lub nerek należy zachować ostrożność stosując tabletki podpoliczkowe fentanylu (patrz punkt 4.4).
Pacjenci z suchością jamy ustnej
Pacjentom z suchością jamy ustnej zaleca się wypicie wody przed podaniem tabletek powlekanych fentanylu, aby zwilżyć jamę ustną. Jeśli nie spowoduje to prawidłowego rozkładu tabletki w jamie ustnej, może być zalecana zmiana leczenia.
Stosowanie u pacjentów w podeszłym wieku (w wieku powyżej 65 lat)
Badania kliniczne wykazały, że u pacjentów w wieku powyżej 65 lat występuje tendencja doboru dawki skutecznej niższej niż dawka stosowana u pacjentów młodszych. Zaleca się zachowanie szczególnej ostrożności podczas doboru dawki fentanylu w postaci tabletek podpoliczkowych u pacjentów w podeszłym wieku.
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności tabletek podpoliczkowych fentanylu u dzieci w wieku od 0 do 18 lat. Brak dostępnych danych.
Sposób podawania
Należy pouczyć pacjentów, by nie otwierali blistra aż do momentu, w którym są gotowi do umieszczenia tabletki w jamie ustnej.
Otwieranie blistra
Należy pouczyć pacjentów, by NIE próbowali wyciskać tabletki przez blister, ponieważ mogłoby to uszkodzić tabletkę podpoliczkową.
Prawidłowa metoda wyjmowania tabletki z blistra jest następująca:
Pojedynczą część blistra należy oddzielić od pozostałego listka blistra poprzez oddarcie jej na linii perforacji. Oddzieloną część blistra należy zgiąć zgodnie z oznaczeniem wzdłuż linii wydrukowanej na tylnej stronie folii. Folię należy usunąć w celu udostępnienia tabletki. Należy pouczyć pacjentów, by nie próbowali kruszyć lub dzielić tabletki.
Po wyjęciu tabletki z blistra nie należy jej przechowywać, ponieważ w tym przypadku nie można
zagwarantować, że tabletka pozostanie w stanie niezmienionym i zajść może ryzyko narażenia tabletki na przypadkowe działanie czynników zewnętrznych.
Podawanie tabletki
Pacjenci powinni wyjąć tabletkę podpoliczkową fentanylu z blistra i natychmiast umieścić ją w całości w jamie ustnej pod policzkiem (obok zęba trzonowego, pomiędzy policzkiem i dziąsłem).
Tabletki podpoliczkowe fentanylu nie powinny być ssane, żute czy połykane, ponieważ skutkowałoby to uzyskaniem niższego stężenia w osoczu, niż w przypadku przyjmowania preparatu w zalecany sposób.
Tabletka podpoliczkowa fentanylu powinna być umieszczona i trzymana w jamie ustnej przez czas wystarczający do jej rozpuszczenia, co może potrwać do 30 minut.
Tabletkę można alternatywnie umieścić podjęzykowo (patrz punkt 5.2).
Po 30 minutach, jeśli pozostałości tabletki podpoliczkowej fentanylu wciąż są obecne w jamie ustnej, mogą one zostać połknięte i popite szklanką wody.
Czas potrzebny do całkowitego rozpuszczenia tabletki po podaniu na śluzówkę jamy ustnej nie wydaje się mieć wpływu na wczesną odpowiedź ogólnoustrojową po ekspozycji na fentanyl.
W czasie gdy tabletka znajduje się w jamie ustnej pacjenci nie powinni spożywać jakichkolwiek posiłków czy napojów.
W przypadku podrażnienia śluzówki jamy ustnej, zaleca się zmianę umiejscowienia tabletki w obrębie jamy ustnej pod policzkiem.
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Stosowanie u pacjentów, którzy nie otrzymują leczenia podtrzymującego opioidami, ze względu na podwyższone ryzyko depresji oddechowej.
Ostra depresja oddechowa lub ostra choroba obturacyjna płuc.
Leczenie ostrego bólu innego niż ból przebijający.
Pacjenci leczeni produktami leczniczymi zawierającymi hydroksymaślan sodu.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
AuroFena, 100 mikrogramów, tabletki podpoliczkowe AuroFena, 200 mikrogramów, tabletki podpoliczkowe AuroFena, 400 mikrogramów, tabletki podpoliczkowe
AuroFena, 100 mikrogramów, tabletki podpoliczkowe
Każda tabletka podpoliczkowa zawiera 100 mikrogramów fentanylu (w postaci cytrynianu). Substancja pomocnicza o znanym działaniu: Każda tabletka zawiera 67,1 mg sorbitolu.
AuroFena, 200 mikrogramów, tabletki podpoliczkowe
Każda tabletka podpoliczkowa zawiera 200 mikrogramów fentanylu (w postaci cytrynianu). Substancja pomocnicza o znanym działaniu: Każda tabletka zawiera 67,1 mg sorbitolu.
AuroFena, 400 mikrogramów, tabletki podpoliczkowe
Każda tabletka podpoliczkowa zawiera 400 mikrogramów fentanylu (w postaci cytrynianu). Substancja pomocnicza o znanym działaniu: Każda tabletka zawiera 67,1 mg sorbitolu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka podpoliczkowa.
AuroFena, 100 mikrogramów, tabletki podpoliczkowe
Białe, okrągłe tabletki o skośnych krawędziach, z liczbą „1” wytłoczoną na jednej stronie.
AuroFena, 200 mikrogramów, tabletki podpoliczkowe
Białe, okrągłe tabletki o skośnych krawędziach, z liczbą „2” wytłoczoną na jednej stronie.
AuroFena, 400 mikrogramów, tabletki podpoliczkowe
Białe, okrągłe tabletki o skośnych krawędziach, z liczbą „4” wytłoczoną na jednej stronie. Każda tabletka ma średnicę około 10 mm.
Produkt leczniczy AuroFena wskazany jest do leczenia bólu przebijającego (ang. BTP –
breakthroughpain) u dorosłych pacjentów z chorobą nowotworową, którzy w ramach leczenia przewlekłego bólu nowotworowego otrzymują opioidową terapię podtrzymującą.
Ból przebijający to przemijające ostre nasilenie dolegliwości bólowych, nakładające się na opanowany ból przewlekły.
Pacjenci poddani opioidowej terapii podtrzymującej, to pacjenci otrzymujący co najmniej 60 mg morfiny w postaci doustnej na dobę, co najmniej 25 mikrogramów przezskórnego fentanylu na
godzinę, co najmniej 30 mg oksykodonu na dobę, co najmniej 8 mg doustnego hydromorfonu na dobę, lub równoważną dawkę innego leku opioidowego przez tydzień lub dłużej.
Leczenie powinno zostać rozpoczęte i prowadzone przez lekarza doświadczonego w stosowaniu leków opioidowych u pacjentów z chorobą nowotworową. Lekarze powinni być świadomi
niebezpieczeństwa nadużywania fentanylu. Nie należy przepisywać pacjentom jednocześnie dwóch produktów fentanylu do leczenia bólu przebijającego o różnym składzie. Pacjenci powinni usunąć wszelkie inne produkty zawierające fentanyl przepisane im do leczenia BTP przed zmianą na produkt leczniczy AuroFena. Ilość tabletek dostępna dla pacjenta w każdym czasie powinna być jak najmniejsza, aby zapobiec wystąpieniu reakcji splątania lub ewentualnemu przedawkowaniu.
Dawkowanie
Dobór dawki
Dawka fentanylu w postaci tabletek podpoliczkowych powinna być dostosowana indywidualnie, aż do uzyskania dawki „skutecznej”, która zapewnia odpowiednią analgezję i minimalizuje reakcje
niepożądane.
W badaniach klinicznych nie można było ustalić skutecznej dawki fentanylu w leczeniu bólu
przebijającego na podstawie dziennej dawki podtrzymującej leku opioidowego. Pacjenci powinni być ściśle monitorowani aż do momentu osiągnięcia dawki skutecznej.
Dostosowanie dawki u pacjentów, u których nie dokonano zmiany terapii z innych produktów zawierających fentanyl
Początkowa dawka fentanylu w postaci tabletek podpoliczkowych powinna wynosić 100 µg,
zwiększana w zależności od potrzeby, w zakresie dostępnych mocy tabletek (100 µg, 200 µg, 400 µg, 600 µg, 800 µg).
Dostosowanie dawki u pacjentów, u których dokonano zmiany terapii z innych produktów zawierających fentanyl
Ze względu na różne profile wchłaniania, zmiana terapii nie może być dokonana w stosunku 1:1. Przy zmianie leczenia z innego doustnego produktu zawierającego cytrynian fentanylu, dawkowanie
fentanylu w postaci tabletek podpoliczkowych powinno być niezależnie dobierane z powodu
znacznych różnic w biodostępności różnych produktów. Jednakże u tych pacjentów uwzględniona może być dawka początkowa wyższa niż 100 µg.
Sposób doboru dawki
Jeśli w trakcie procesu doboru dawki w przeciągu 30 minut od podania jednej tabletki nie zostanie uzyskana odpowiednia analgezja, podana może być druga tabletka podpoliczkowa fentanylu o tej samej mocy.
Jeśli leczenie epizodu bólu przebijającego (BTP) wymaga podania więcej niż jednej tabletki, do leczenia kolejnego epizodu BTP rozważyć należy zwiększenie dawki do kolejnej wyższej dostępnej mocy preparatu.
W trakcie doboru dawki stosowane mogą być różne tabletki: do leczenia jednego epizodu bólu
przebijającego (BTP) użytych może być do czterech tabletek o mocy 100 µg lub do czterech tabletek o mocy 200 µg, według następującego schematu:
Przypadkowe zastosowanie u dzieci
Należy poinformować pacjentów i ich opiekunów, że tabletki podpoliczkowe fentanylu zawierają substancję aktywną w ilości, która może być śmiertelna, szczególnie dla dziecka. Dlatego wszystkie tabletki muszą być przechowywane w miejscu niewidocznym i niedostępnym dla dzieci.
Monitorowanie
Aby ograniczyć do minimum ryzyko wystąpienia działań niepożądanych związanych ze stosowaniem opioidów i dostosować dawkę skuteczną, niezbędne jest, by w trakcie procesu doboru dawki pacjenci byli ściśle monitorowani przez lekarza.
Podtrzymująca terapia opioidowa
Ważne jest, by przed rozpoczęciem leczenia tabletkami podpoliczkowymi fentanylu ustabilizowana została podtrzymująca terapia opioidowa stosowana do leczenia utrzymującego się bólu oraz, aby kontynuować leczenie pacjenta podtrzymującą terapią opioidową w czasie stosowania tabletek podpoliczkowych fentanylu. Produktu nie można podawać pacjentom, którzy nie otrzymują
podtrzymującej terapii opioidowej, ponieważ istnieje zwiększone ryzyko wystąpienia depresji oddechowej i zgonu.
Depresja oddechowa
Tak jak w przypadku wszystkich opioidów, istnieje ryzyko wystąpienia depresji oddechowej o znaczeniu klinicznym, związanej ze stosowaniem fentanylu. Wybór niewłaściwego pacjenta do leczenia zarówno tabletkami podpoliczkowymi fentanylu jak i innymi produktami fentanylu (np.
pacjenci nieleczeni podtrzymującą terapią opioidową) i (lub) nieodpowiednie dawkowanie prowadziło do zgonu pacjenta. Tabletki podpoliczkowe fentanylu należy stosować tylko w przypadkach opisanych w punkcie 4.1.
Przewlekła choroba obturacyjna płuc
Należy zachować szczególną ostrożność podczas doboru dawki fentanylu w postaci tabletek podpoliczkowych u pacjentów z niezbyt ciężką przewlekłą chorobą obturacyjną płuc lub innym schorzeniem predysponującym ich do depresji oddechowej, ze względu na fakt, że nawet normalne dawki lecznicze fentanylu w postaci tabletek podpoliczkowych mogą osłabiać odruch oddechowy, aż do momentu powstania niewydolności oddechowej.
Zaburzenia oddychania podczas snu
Opioidy mogą powodować zaburzenia oddychania związane ze snem, w tym centralny bezdech senny (ang. central sleep apnoea, CSA) i hipoksemię związaną ze snem. Stosowanie opioidów zwiększa ryzyko wystąpienia CSA w sposób zależny od dawki. U pacjentów z CSA należy rozważyć
zmniejszenie całkowitej dawki opioidów.
Alkohol
Jednoczesne spożywanie alkoholu i stosowanie fentanylu może powodować nasilone działanie depresyjne, które może prowadzić do zgonu pacjenta (patrz punkt 4.5).
Ryzyko związane z jednoczesnym podawaniem z benzodiazepinami lub podobnymi lekami Jednoczesne stosowanie opioidów, w tym produktu leczniczego AuroFena, z benzodiazepinami lub podobnymi lekami może prowadzić do głębokiego uspokojenia polekowego, depresji oddechowej, śpiączki i zgonu. Z powodu tego ryzyka opioidy jednocześnie z benzodiazepinami lub podobnymi lekami powinno się przepisywać wyłącznie u pacjentów, u których alternatywne opcje leczenia są nieodpowiednie.
W przypadku podjęcia decyzji o przepisaniu fentanylu jednocześnie z benzodiazepinami lub podobnymi lekami należy wybrać najmniejszą skuteczną dawkę i minimalny czas trwania jednoczesnego stosowania. Pacjentów należy ściśle monitorować w kierunku objawów przedmiotowych i podmiotowych depresji oddechowej i uspokojenia polekowego (patrz punkt 4.5).
Podwyższone ciśnienie wewnątrzczaszkowe, zaburzenia świadomości
Tabletki podpoliczkowe fentanylu powinny być stosowane z zachowaniem dużej ostrożności u pacjentów, którzy mogą być szczególnie podatni na wewnątrzczaszkowe efekty zatrzymania CO2,
takie jak te, które powodują podwyższone ciśnienie wewnątrzczaszkowe lub zaburzenia świadomości. Opioidy mogą przeszkadzać w klinicznym leczeniu pacjenta z urazem głowy i powinny być stosowane jedynie w przypadku, gdy istnieją ku temu podstawy kliniczne.
Bradyarytmie
Fentanyl może powodować bradykardię. U pacjentów z uprzednimi lub zdiagnozowanymi wcześniej bradyarytmiami fentanyl powinien być stosowany z zachowaniem szczególnej ostrożności.
Zaburzenia czynności wątroby lub nerek
Tabletki podpoliczkowe fentanylu powinny być również ostrożnie stosowane u pacjentów z niewydolnością wątroby lub nerek. Nie zbadano wpływu niewydolności wątroby lub nerek na
właściwości farmakokinetyczne produktu leczniczego, wykazano jednak, że po podaniu dożylnym u pacjentów z niewydolnością wątroby lub nerek klirens fentanylu uległ zmianie z powodu zmian w klirensie metabolicznym i białkach osocza. Po podaniu tabletek podpoliczkowych fentanylu,
zaburzenia czynności wątroby i nerek mogą zarówno zwiększyć biodostępność połkniętego fentanylu oraz zmniejszyć jego klirens ogólnoustrojowy, co z kolei może prowadzić do bardziej intensywnych i dłuższych efektów działania opioidów. Należy zatem zachować szczególną ostrożność w trakcie procesu doboru dawki u pacjentów z umiarkowaną lub poważną niewydolnością wątroby lub nerek.
Należy zachować ostrożność w przypadku pacjentów z hipowolemią i niedociśnieniem. Zespół serotoninowy
Należy zachować ostrożność podczas jednoczesnego podawania tabletek podpoliczkowych fentanylu z
lekami wpływającymi na serotoninergiczne układy neuroprzekaźnikowe.
Potencjalnie zagrażający życiu zespół serotoninowy może wystąpić podczas jednoczesnego stosowania z lekami serotoninergicznymi, takimi jak selektywne inhibitory wychwytu zwrotnegoserotoniny (SSRI) i inhibitory zwrotnego wychwytu serotoniny i noradrenaliny (SNRI), i z lekami, które zaburzają metabolizm serotoniny (w tym inhibitorami monoaminooksydazy [IMAO]). Może to wystąpić przy zalecanych dawkach.
Zespół serotoninowy może obejmować zmiany stanu psychicznego (np. pobudzenie, omamy, śpiączkę), niestabilność układu autonomicznego (np. tachykardię, wahania ciśnienia tętniczego,
hipertermię), zaburzenia nerwowo-mięśniowe (np. hiperrefleksję, zaburzenia koordynacji, sztywność), i (lub) objawy żołądkowo-jelitowe (np. nudności, wymioty, biegunkę).
W razie podejrzenia zespołu serotoninowego należy przerwać leczenie tabletkami podpoliczkowymi fentanylu.
Uzależnienie od produktu leczniczego i zagrożenie nadużywania produktu leczniczego
Po wielokrotnym podawaniu opioidów, wystąpić może tolerancja, uzależnienie fizyczne i psychiczne. Po podaniu opioidów może wystąpić uzależnienie jatrogenne. Fentanyl może być nadużywany w podobny sposób jak inne opioidy i konieczne jest monitorowanie wszystkich pacjentów leczonych opioidami pod kątem oznak nadużywania i uzależnienia. U pacjentów ze zwiększonym ryzykiem nadużywania opioidów można jednak stosować odpowiednie leczenie opioidami, ale konieczne jest
dodatkowe monitorowanie pod kątem oznak nieprawidłowego stosowania, nadużywania lub uzależnienia.
Wielokrotne stosowanie produktu AuroFena może doprowadzić do zaburzeń związanych z używaniem opioidów (ang. Opioid Use Disorder, OUD). Nadużywanie lub celowe nieprawidłowe stosowanie produktu AuroFena może prowadzić do przedawkowania i (lub) zgonu. Ryzyko
wystąpienia OUD jest podwyższone u pacjentów z zaburzeniami związanymi z używaniem substancji (w tym zaburzenia związane z używaniem alkoholu), w wywiadzie osobistym lub rodzinnym (u rodziców lub rodzeństwa), u osób aktualnie używających tytoniu lub u pacjentów z innymi zaburzeniami psychicznymi w wywiadzie osobistym (np. duża depresja, zaburzenia lękowe i
zaburzenia osobowości).
U pacjentów będzie konieczne monitorowanie pod kątem objawów przedmiotowych zachowania
związanego z poszukiwaniem produktu leczniczego (np. zbyt wczesne zgłaszanie się po nowy zapas leku). Obejmuje to weryfikację równoczesnego stosowania innych opioidów i leków psychoaktywnych (takich jak benzodiazepiny). U pacjentów z przedmiotowymi i podmiotowymi objawami OUD należy rozważyć konsultację ze specjalistą ds. uzależnień.
Wpływ na układ hormonalny
Opioidy mogą wywierać wpływ na oś podwzgórze-przysadka-nadnercza lub oś podwzgórze- przysadka-gonady. Niektóre obserwowane zmiany obejmują zwiększenie stężenia prolaktyny w surowicy krwi oraz zmniejszenie stężenia kortyzolu i testosteronu w osoczu. Rezultatem tych zmian hormonalnych mogą być kliniczne objawy przedmiotowe i podmiotowe.
Hiperalgezja
Podobnie jak w przypadku innych opioidów, w razie niewystarczającej kontroli bólu w odpowiedzi na zwiększoną dawkę fentanylu, należy rozważyć możliwość wystąpienia hiperalgezji wywołanej opioidem. Wskazane może być zmniejszenie dawki fentanylu, przerwanie leczenia fentanylem lub weryfikacja metody leczenia.
Reakcje anafilaktyczne i nadwrażliwość
W związku ze stosowaniem produktów zawierających fentanyl podawany doustnie przez błonę śluzową zgłaszano reakcje anafilaktyczne i nadwrażliwość (patrz punkt 4.8).
Substancja pomocnicza
Ten produkt leczniczy zawiera 67,1 mg sorbitolu w każdej tabletce podpoliczkowej.
Leki wpływające na aktywność CYP3A4
Fentanyl jest metabolizowany głównie poprzez układ enzymatyczny cytochromu P450 3A4 (CYP3A4), zatem podczas podawania produktu leczniczego AuroFena równocześnie z lekami wpływającymi na aktywność CYP3A4 wystąpić mogą potencjalne interakcje.
Induktory CYP3A4
Jednoczesne podawanie z lekami które indukują aktywność 3A4 może obniżać skuteczność tabletek podpoliczkowych fentanylu.
Inhibitory CYP3A4
Jednoczesne stosowanie tabletek podpoliczkowych fentanylu z silnymi inhibitorami CYP3A4 (np. rytonawirem, ketokonazolem, itrakonazolem, troleandomycyną, klarytromycyną i nelfinawirem) lub umiarkowanymi inhibitorami CYP3A4 (np. amprenawirem, aprepitantem, diltiazemem, erytromycyną, flukonazolem, fosamprenawirem, sokiem grejpfrutowym i werapamilem) może skutkować podwyższonymi stężeniami fentanylu w osoczu, potencjalnie powodując poważne działania
niepożądane leku, łącznie z depresją oddechową, która może prowadzić do zgonu. Pacjenci otrzymujący tabletki podpoliczkowe fentanylu jednocześnie z umiarkowanymi lub silnymi
inhibitorami CYP3A4 powinni być długotrwale i dokładnie monitorowani przez lekarza. Zwiększanie dawki powinno być dokonywane z ostrożnością.
Leki, które mogą nasilać działanie depresyjne na ośrodkowy układ nerwowy
Jednoczesne podawanie fentanylu z innymi lekami działającymi depresyjnie na ośrodkowy układ nerwowy, takich jak inne opioidy, środki sedatywne lub nasenne (w tym benzodiazepiny), leki do znieczulenia ogólnego, fenotiazyny, leki uspokajające, leki rozluźniające mięśnie szkieletowe, leki
antyhistaminowe o działaniu uspokajającym, alkohol i gabapentynoidy (gabapentyną i pregabaliną) mogą powodować addytywne efekty depresyjne, które mogą prowadzić do depresji oddechowej, niedociśnienia, głębokiego uspokojenia, śpiączki lub zgonu pacjenta (patrz punkt 4.4).
Leki sedatywne, takie jak benzodiazepiny lub leki podobne
Jednoczesne stosowanie opioidów z lekami sedatywnymi, takimi jak benzodiazepiny lub podobne
leki, zwiększa ryzyko wystąpienia uspokojenia polekowego, depresji oddechowej, śpiączki i zgonu z powodu addytywnego działania depresyjnego na ośrodkowy układ nerwowy. Dawka i czas trwania jednoczesnego stosowania powinny być ograniczone (patrz punkt 4.4).
Częściowi opioidowi agonisto/antagoniści
Nie zaleca się jednoczesnego stosowania częściowych opioidowych agonisto/antagonistów (np.
buprenorfiny, nalbufiny, pentazocyny). Mają one wysokie powinowactwo do receptorów opioidowych z względnie niską aktywnością wewnętrzną i dlatego częściowo znoszą przeciwbólowy efekt fentanylu i mogą wywoływać zespół odstawienia u pacjentów uzależnionych od opioidów.
Leki serotoninergiczne
Jednoczesne podawanie fentanylu z lekiem serotoninergicznym, takim jak selektywny inhibitor wychwytu zwrotnego serotoniny (SSRI) lub inhibitor zwrotnego wychwytu serotoniny i noradrenaliny (SNRI) lub inhibitor monoaminooksydazy (IMAO), może zwiększać ryzyko wystąpienia zespołu serotoninowego, który potencjalnie zagraża życiu. Tabletki podpoliczkowe fentanylu nie są zalecane do stosowania u pacjentów, którzy w ciągu 14 dni przyjmowali IMAO, ponieważ odnotowano
poważne i nieprzewidywalne nasilenie działania opioidowych leków przeciwbólowych podczas stosowania z IMAO.
Hydroksymaślan sodu
Jednoczesne stosowanie produktów leczniczych zawierających hydroksymaślan sodu i fentanyl jest przeciwwskazane (patrz punkt 4.3). Leczenie hydroksymaślanem sodu należy przerwać przed rozpoczęciem leczenia produktem AuroFena.
Ciąża
Brak jest wystarczających danych dotyczących stosowania fentanylu u kobiet w ciąży. Badania na
zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3). Potencjalne zagrożenie dla człowieka nie jest znane. Tabletki podpoliczkowe fentanylu nie powinny być stosowane w okresie
ciąży, jeśli nie jest to bezwzględnie konieczne.
W przypadku długotrwałego stosowania fentanylu w okresie ciąży istnieje ryzyko wystąpienia u noworodka opioidowego zespołu odstawiennego, który nierozpoznany i nieleczony może zagrażać życiu oraz który wymaga zastosowania leczenia zgodnie z protokołami opracowanymi przez
ekspertów w dziedzinie neonatologii. Jeśli wymagane jest stosowanie opioidów przez dłuższy czas u kobiety w ciąży, należy poinformować pacjentkę o ryzyku wystąpienia opioidowego zespołu
odstawiennego u noworodka oraz zapewnić dostępność odpowiedniego leczenia (patrz punkt 4.8).
Zaleca się, by nie stosować fentanylu w trakcie porodu (również cesarskiego cięcia), ponieważ przenika on przez łożysko matki i może powodować depresję oddechową u płodu. W przypadku
podania tabletek podpoliczkowych fentanylu, antidotum dla dziecka powinno być przygotowane do użycia.
Karmienie piersią
Fentanyl przenika do mleka matki i może powodować uspokojenie polekowe i depresję oddechową u dziecka karmionego piersią. Fentanyl nie powinien być stosowany u kobiet karmiących i nie należy zaczynać ponownego karmienia piersią przynajmniej przez 5 dni po ostatnim podaniu fentanylu.
Płodność
Brak jest dostępnych danych dotyczących wpływu na płodność. W badaniach na zwierzętach występowało upośledzenie płodności samców (patrz punkt 5.3).
Nie przeprowadzono badań nad wpływem produktu na zdolność prowadzenia pojazdów mechanicznych i obsługiwania urządzeń mechanicznych w ruchu, jednakże opioidowe leki
przeciwbólowe upośledzają sprawność psychiczną i (lub) fizyczną wymaganą do wykonywania zadań potencjalnie niebezpiecznych (np. prowadzenie pojazdów czy obsługiwanie maszyn). Pacjenci powinni być pouczeni, by nie prowadzić pojazdów czy obsługiwać maszyn, jeśli podczas stosowania tabletek podpoliczkowych fentanylu, odczuwać będą senność, zawroty głowy lub zaburzenia widzenia, a także by nie prowadzić pojazdów czy obsługiwać maszyn dopóki nie będą znać swojej reakcji na lek.
Podsumowanie profilu bezpieczeństwa
Podczas stosowania tabletek podpoliczkowych fentanylu można spodziewać się reakcji niepożądanych typowych dla leków opioidowych. Często w trakcie stosowania preparatu działania te znikną lub
zmniejszy się ich intensywność, ponieważ dla każdego pacjenta dobrana zostanie najbardziej odpowiednia dawka. Najpoważniejsze działania niepożądane to depresja oddechowa (potencjalnie prowadząca do duszności lub zatrzymania oddechu), depresja krążeniowa, niedociśnienie i wstrząs. Należy ściśle monitorować pacjentów pod kątem ich wystąpienia.
Badania kliniczne tabletek podpoliczkowych fentanylu miały na celu dokonanie oceny bezpieczeństwa i skuteczności w leczeniu bólu przebijającego (BTP) . Do leczenia utrzymującego się bólu wszyscy pacjenci stosowali równocześnie leki opioidowe, takie jak morfina o przedłużonym uwalnianiu lub
przezskórny fentanyl. Dlatego niemożliwe jest definitywne oddzielenie efektów działania samych tabletek podpoliczkowych fentanylu.
Tabela reakcji niepożądanych
Zaobserwowano następujące działania niepożądane w czasie stosowania tabletek podpoliczkowych fentanylu i (lub) innych związków zawierających fentanyl w badaniach klinicznych i po
wprowadzeniu leku do obrotu. Działania niepożądane podane są według częstości występowania w poszczególnych grupach narządów (częstość określona jako: bardzo często ≥ 1/10, często ≥ 1/100 do
< 1/10, niezbyt często ≥ 1/1 000 do < 1/100, rzadko (≥ 1/10 000 do < 1/1 000), nieznana (częstość nie może być określona na podstawie dostępnych danych)); w obrębie każdej grupy o określonej częstości występowania objawy niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem:
Bardzo często ( 1/10) | Często ( 1/100, < 1/10) | Niezbyt często ( 1/1 000, < 1/100) | Rzadko ( 1/10 000, < 1/1 000) | Częstość nieznana (nie może być określona na podstawie dostępnych danych) | |
Zakażenia i zarażenia pasożytnicze | Kandydoza jamy ustnej | Zapalenie gardła | Krosty w jamie ustnej | ||
Zaburzenia krwi i układu chłonnego | Niedokrwistość Neutropenia | Trombocytopenia | |||
Zaburzenia układu immunologicznego | Nadwrażliwość* | ||||
Zaburzenia endokrynologiczne | Hipogonadyzm | Niedoczynność kory nadnerczy, niedobór androgenów | |||
Zaburzenia metabolizmu i odżywiania | Jadłowstręt | ||||
Zaburzenia psychiczne | Depresja Niepokój Stan splątania Bezsenność | Stan euforyczny Nerwowość Halucynacje Omamy wzrokowe Zmiany psychiczne Dezorientacja | Uzależnienie od leków* Nadużywanie leków (patrz punkt 4.4) Majaczenie | ||
Zaburzenia układu nerwowego | Zawroty głowy Ból głowy | Zaburzenia smaku Senność Letarg Drżenie Uspokojenie Niedoczulica Migrena | Obniżony poziom świadomości Zaburzenia uwagi Zaburzenia równowagi Dyzartria | Zaburzenia zdolności poznawczych Zaburzenia motoryczne | Utrata świadomości* Drgawki |
Zaburzenia oka | Zaburzenia wzroku Przekrwienie spojówek Zamglone widzenie Ograniczona ostrość widzenia | Zaburzenia odczuć w obrębie gałki ocznej Fotopsja |
Zaburzenia ucha i błędnika | Zawroty głowy Szumy uszne Dolegliwości uszne | ||||
Zaburzenia serca | Tachykardia | Bradykardia | |||
Zaburzenia naczyniowe | Niedociśnienie Nadciśnienie | Rumieńce Uderzenia gorąca | |||
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Duszność Ból gardła i krtani | Depresja oddechowa Zespół bezdechu sennego | Zatrzymanie oddychania* | ||
Zaburzenia żołądka i jelit | Nudności Wymioty | Zaparcia Zapalenie błony śluzowej jamy ustnej Suchość w ustach Biegunka Ból brzucha Refluks żołądkowo- przełykowy Dolegliwości żołądkowe Dyspepsja Bóle zębów | Niedrożność jelit Owrzodzenia ust Niedoczulica jamy ustnej Dolegliwości jamy ustnej Odbarwienie błony śluzowej jamy ustnej Dolegliwości tkanek miękkich jamy ustnej Obrzęk języka Pęcherze na języku Ból dziąseł Owrzodzenia języka Dolegliwości języka Zapalenie przełyku Spękane usta Choroby zębów | Zmiany pęcherzowe błony śluzowej jamy ustnej Suche wargi | |
Zaburzenia wątroby i dróg żółciowych | Poszerzenie dróg żółciowych | ||||
Zaburzenia skóry i tkanki podskórnej | Świąd Nadmierna potliwość Wysypka | Zimne poty Obrzęk twarzy Ogólny świąd Łysienie | Łamliwość paznokci | ||
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Bóle mięśni Ból pleców | Drżenie mięśni Osłabienie mięśni |
Zaburzenia nerek i dróg moczowych | Zatrzymanie moczu | ||||
Zaburzenia ogólne i stany w miejscu podania | Reakcje w miejscu podania leku, takie jak krwawienie, ból, owrzodzenie, podrażnienie, parestezja, brak czucia, rumień, obrzęk, opuchlizna i pęcherze | Obrzęk obwodowy Zmęczenie Osłabienie Zespół odstawienia leku* Dreszcze | Apatia Spowolnienie Dolegliwości w klatce piersiowej Złe samopoczucie Zdenerwowanie Uczucie pragnienia Uczucie zimna Uczucie gorąca | Gorączka Zespół odstawienny u noworodka (patrz punkt 4.6) | |
Badania diagnostyczne | Zmniejszenie masy ciała | Obniżona liczba płytek krwi Zwiększona częstość akcji serca Obniżony hematokryt Obniżony poziom hemoglobiny | |||
Urazy, zatrucia i powikłania po zabiegach | Upadki |
* Patrz punkt „Opis wybranych reakcji niepożądanych”
Opis wybranych reakcji niepożądanych
Tolerancja, fizyczne i (lub) psychiczne uzależnienie mogą rozwinąć się po podawaniu opioidów takich jak fentanyl (patrz punkt 4.4).
W związku z fentanylem podawanym przez błony śluzowe obserwowano objawy zespołu odstawienia opioidów, jak nudności, wymioty, biegunka, niepokój, dreszcze, drżenie i potliwość.
Utrata świadomości oraz zatrzymanie oddychania obserwowano w kontekście przedawkowania (patrz punkt 4.9).
Reakcje nadwrażliwości zgłaszano po wprowadzeniu leku do obrotu i obejmowały one wysypkę, rumień, obrzęk warg i twarzy oraz pokrzywkę (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane do Departamentu Monitorowania Niepożądanych
Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301, faks:
+ 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Objawy
Należy spodziewać się, że objawy przedawkowania fentanylu są podobne do objawów
przedawkowania fentanylu podawanego dożylnie i innych opioidów. Stanowią one rozszerzenie działania farmakologicznego leku, a najpoważniejszymi i najbardziej znaczącymi z nich są zmiany
psychiczne, utrata świadomości, śpiączka, niedociśnienie, depresja oddechowa, zaburzenia oddechowe i niewydolność oddechowa, które prowadziły do śmierci. W przypadku przedawkowania fentanylu obserwowano przypadki oddechu Cheyne-Stoke’sa, szczególnie u pacjentów z niewydolnością serca w wywiadzie.
Leczenie
Doraźne leczenie przedawkowania opioidów obejmuje usunięcie tabletki podpoliczkowej fentanylu, jeśli wciąż znajduje się ona w jamie ustnej, zapewniając swobodny przepływ powietrza, stymulację fizyczną i werbalną pacjenta, ocenę stanu świadomości, stanu wentylacji i krążenia, oraz wspomaganą wentylację, jeśli zajdzie taka konieczność.
Przedawkowanie (połknięcie przypadkowe) u osoby, która nie przyjmowała dotąd opioidów
Do leczenia przedawkowania (połknięcie przypadkowe) u osoby, która nie przyjmowała dotąd opioidów, należy uzyskać dostęp do żyły oraz zastosować nalokson lub inny lek będący antagonistą opioidów zgodnie ze wskazaniami klinicznymi. Czas trwania depresji oddechowej po przedawkowaniu może być dłuższy niż efekt działania antagonisty opioidów (np. okres półtrwania naloksonu wynosi od 30 do 81 minut) i konieczne może być powtórne podanie leku. Charakterystyka Produktu Leczniczego konkretnych antagonistów opioidów zawiera szczegółowe informacje na temat stosowania tych leków.
Przedawkowanie u pacjentów leczonych opioidami
W celu leczenia przedawkowania u pacjentów leczonych opioidami, należy uzyskać dostęp żylny. W niektórych przypadkach uzasadnione może być rozsądne zastosowanie naloksonu lub innego
antagonisty opioidów, lecz związane jest ono z ryzykiem przyspieszenia wystąpienia ostrego zespołu odstawienia leku.
Mimo, że w trakcie stosowania tabletek podpoliczkowych fentanylu nie zaobserwowano wystąpienia sztywności mięśni zakłócającej oddychanie, możliwe jest jej wystąpienie w przypadku stosowania
fentanylu i innych opioidów. Jeśli wystąpi sztywność mięśni, należy zastosować wspomaganą
wentylację lub antagonistę opioidów, a w przypadku braku skuteczności takiego postępowania – leki zwiotczające.
Grupa farmakoterapeutyczna: leki przeciwbólowe; opioidy; kod ATC: N02AB03. Mechanizm działania i działanie farmakodynamiczne
Fentanyl jest opioidowym lekiem przeciwbólowym, wchodzącym w interakcje głównie z opioidowym receptorem µ. Jego podstawowe działanie lecznicze polega na znieczuleniu i uspokojeniu.
Drugorzędne efekty farmakologiczne to: depresja oddechowa, bradykardia, hipotermia, zaparcia, zwężenie źrenicy, uzależnienie fizyczne i euforia.
Przeciwbólowe działanie fentanylu związane jest z jego poziomem w osoczu. Na ogół, stężenie skuteczne i stężenie, przy którym występuje toksyczność ulegają zwiększeniu wraz z rosnącą
tolerancją na opioidy. Szybkość rozwoju tolerancji różni się znacznie u poszczególnych pacjentów, w związku z czym, aby uzyskać oczekiwane działanie dawka fentanylu w postaci tabletek podpoliczkowych powinna być dobierana indywidualnie (patrz punkt 4.2).
Wszyscy agoniści opioidowego receptora µ, łącznie z fentanylem, powodują dawkozależną depresję oddechową. Ryzyko wystąpienia depresji oddechowej jest niższe u pacjentów poddanych przewlekłej terapii opioidowej, ponieważ u pacjentów tych rozwinie się tolerancja na depresję oddechową powodowaną przez opioidy.
Opioidy mogą wpływać na oś podwzgórze-przysadka-nadnercza lub oś podwzgórze-przysadka - gonady. Niektóre obserwowane zmiany obejmują zwiększenie stężenia prolaktyny w surowicy krwi oraz zmniejszenie stężenia kortyzolu i testosteronu w osoczu. Rezultatem tych zmian hormonalnych mogą być objawy przedmiotowe i podmiotowe (patrz również punkt 4.8).
Skuteczność kliniczna i bezpieczeństwo stosowania
Bezpieczeństwo i skuteczność tabletek powlekanych fentanylu zostały ocenione u pacjentów
stosujących preparat w czasie napadu epizodu bólu przebijającego. Nie prowadzono badań klinicznych zastosowania z wyprzedzeniem tabletek podpoliczkowych fentanylu do leczenia przewidywanego
epizodu bólu. Przeprowadzono dwa badania krzyżowe randomizowane, z podwójnie ślepą próbą, kontrolowane placebo, z udziałem 248 pacjentów cierpiących na nowotwór i ból przebijający (BTP), u których podczas stosowania podtrzymującej terapii opioidowej wystąpiło przeciętnie od 1 do 4
epizodów BTP dziennie. W trakcie początkowej otwartej fazy badania dobierano skuteczną dawkę fentanylu, tabletek podpoliczkowych. Pacjenci, dla których zidentyfikowano dawkę skuteczną wchodzili w fazę badania z podwójnie ślepą próbą.
Podstawową zmienną skuteczności była ocena intensywności bólu przez pacjenta. Pacjenci dokonywali oceny intensywności bólu w skali 11-punktowej. Dla każdego epizodu bólu
przebijającego (BTP), intensywność bólu oceniano przed leczeniem i w kilku odstępach czasowych po leczeniu.
Dla 67% pacjentów dostosowano dawkę skuteczną.
W podstawowym badaniu klinicznym (badanie 1), pierwszorzędowym punktem końcowym była
średnia suma różnic w wynikach badania intensywności bólu od podania dawki do 60 minut, włącznie (ang. SPID60 - sum of pain intensity differences 60), która była statystycznie znacząca w porównaniu z placebo (p<0,0001).
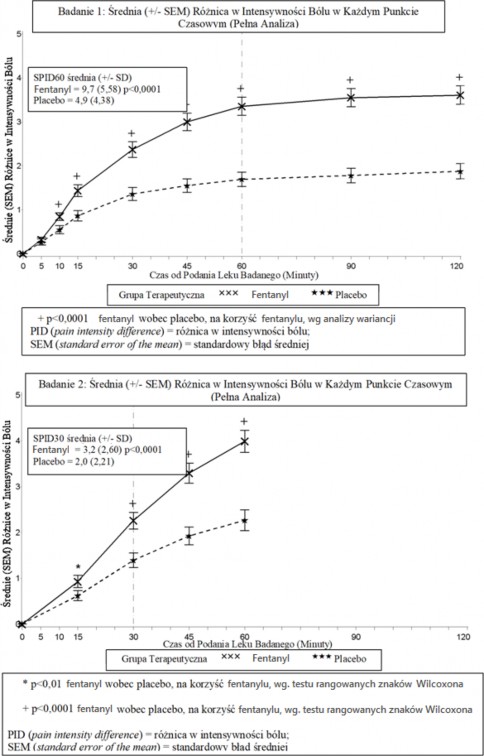
W drugim podstawowym badaniu klinicznym (badanie 2), pierwszorzędowym punktem końcowym było SPID30, które również było statystycznie znaczące w porównaniu z placebo (p<0,0001).
Statystycznie znacząca poprawa w różnicy intensywności bólu została zaobserwowana w trakcie
zastosowania tabletek podpoliczkowych fentanylu w porównaniu do placebo już po 10 minutach w Badaniu 1 i po 15 minutach (najwcześniejszy zmierzony punkt czasowy) w Badaniu 2. Różnice pozostały znaczące w każdym kolejnym punkcie czasowym w każdym badaniu.
Wprowadzenie
Fentanyl charakteryzuje się wysoką lipofilnością i jest bardzo szybko wchłaniany przez śluzówkę jamy ustnej i wolniej drogą konwencjonalną z przewodu pokarmowego. Jest on metabolizowany podczas pierwszego przejścia w wątrobie i jelitach, a jego metabolity nie mają wpływu na działanie terapeutyczne fentanylu.
Czas rozpadu (czas niezbędny, by tabletka uległa pełnemu rozpuszczeniu po podaniu
podpoliczkowym) nie ma wpływu na wczesną odpowiedź ogólnoustrojową po ekspozycji na fentanyl. Badanie porównawcze między podaniem jednej tabletki 400 µg fentanylu podpoliczkowo (tzn.
pomiędzy policzkiem a dziąsłem) lub podjęzykowo spełniało kryteria biorównoważności.
Wpływ upośledzonej czynności nerek lub wątroby na farmakokinetykę tabletek podpoliczkowych fentanylu nie został zbadany.
Wchłanianie:
Po podaniu tabletek podpoliczkowych fentanylu na śluzówkę jamy ustnej fentanyl jest szybko wchłaniany, a jego biodostępność bezwzględna wynosi 65%. Profil wchłaniania tabletek
podpoliczkowych fentanylu jest w dużej mierze wynikiem początkowego szybkiego wchłaniania ze śluzówki policzka, a szczytowe stężenia w osoczu po podaniu doustnym i po pobraniu próby z żyły
zazwyczaj osiągane są w ciągu godziny. Około 50% całkowitej podanej dawki jest szybko wchłaniane przez błony śluzowe i staje się dostępne ogólnoustrojowo. Druga połowa całkowitej dawki jest połykana i powoli wchłaniana z przewodu pokarmowego. Około 30% ilości połkniętej (50%
całkowitej dawki) unika eliminacji w wyniku pierwszego przejścia przez wątrobę i jelita i staje się dostępna ogólnoustrojowo.
Główne parametry farmakokinetyczne przedstawione są w poniższej tabeli.
Parametry farmakokinetyczne* u dorosłych pacjentów przyjmujących tabletki podpoliczkowe fentanylu
Parametr farmakokinetyczny (średnia) | Tabletki podpoliczkowe fentanylu 400 mikrogramów |
Biodostępność bezwzględna | 65% (±20%) |
Frakcja wchłonięta przez błonę śluzową | 48% (±31,8%) |
tmax (minuty) ** | 46,8 (20-240) |
Cmax (ng/ml) | 1,02 (± 0,42) |
AUC0-tmax (ng.h/ml) | 0,40 (± 0,18) |
AUC0-inf (ng.h/ml) | 6,48 (± 2,98) |
* W oparciu o próbki krwi z żyły (osocza). Stężenia fentanylu uzyskane w surowicy krwi były
większe niż w osoczu. AUC dla surowicy krwi i Cmax były około 20% i 30% większe niż AUC i Cmax dla osocza. Przyczyna tej różnicy nie jest znana.
** Dane dla tmax przedstawione jako mediana (zakres).
W badaniach farmakokinetycznych, które porównywały biodostępność bezwzględną i względną tabletek podpoliczkowych fentanylu i cytrynianu fentanylu (ang. OTFC – oral transmucosal fentanyl
citrate) podawanego doustnie przez błonę śluzową, szybkość i zakres wchłaniania fentanylu w
przypadku tabletek podpoliczkowych fentanylu wykazało ekspozycję pomiędzy 30% do 50% wyższą niż dla cytrynianu fentanylu podawanego doustnie, przez błonę śluzową. Jeżeli następuje zmiana z innego doustnego produktu cytrynianu fentanylu, konieczne jest osobne dostosowanie dawki tabletek podpoliczkowych fentanylu ze względu na dużą różnicę biodostępności między produktami. Jednak można rozważyć zastosowanie u tych pacjentów dawki początkowej większej niż 100 µg.
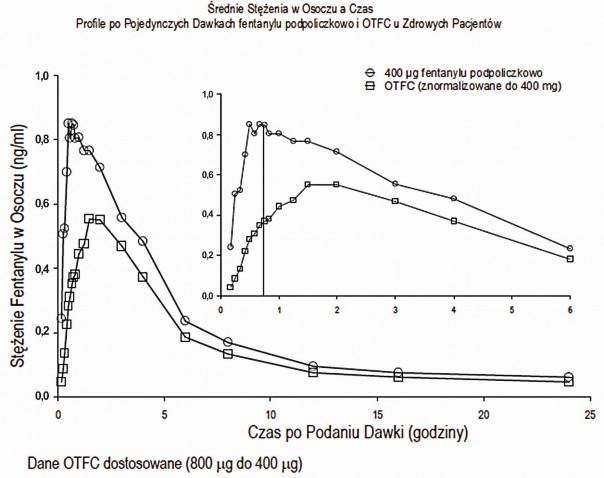
Różnice w ekspozycji dla tabletek podpoliczkowych fentanylu zaobserwowano w badaniu klinicznym z udziałem pacjentów z zapaleniem błony śluzowej stopnia 1. Cmax i AUC0-8 były odpowiednio o 1% i 25% wyższe u pacjentów z zapaleniem błony śluzowej w porównaniu do pacjentów bez tego schorzenia. Zaobserwowane różnice nie były klinicznie znaczące.
Dystrybucja
Fentanyl charakteryzuje się wysoką lipofilnością i wysoką objętością dystrybucji poza układ naczyniowy. Po podaniu pod policzek tabletek podpoliczkowych fentanylu, fentanyl ulega początkowej szybkiej dystrybucji, charakteryzującej się równowagą pomiędzy osoczem a tkankami o wysokim przepływie naczyniowym (mózg, serce i płuca). Następnie fentanyl ulega redystrybucji do przestrzeni między tkankami głębokimi (mięśnie i tkanka tłuszczowa) a osoczem.
Wiązanie fentanylu z białkami osocza wynosi 80% do 85%. Głównym białkiem wiążącym jest alfa-1- kwaśna glikoproteina, lecz zarówno albumina jak i lipoproteiny w pewnym stopniu biorą udział.
Wolna frakcja fentanylu zwiększa się w miarę kwasicy.
Metabolizm
W badaniach klinicznych nie opisano szlaków metabolicznych po podpoliczkowym podaniu tabletek podpoliczkowych fentanylu. Fentanyl jest metabolizowany w wątrobie i błonie śluzowej jelit do norfentanylu przez izoformę CYP3A4. W badaniach na zwierzętach norfentanyl nie jest farmakologicznie aktywny. Ponad 90% podanej dawki fentanylu eliminowane jest poprzez
biotransformację do N-dealkilowanych i hydroksylowanych nieaktywnych metabolitów.
Eliminacja
Po podaniu dożylnym fentanylu, mniej niż 7% podanej dawki wydalane jest w postaci niezmienionej z moczem, a jedynie około 1% wydalane jest w postaci niezmienionej w kale. Metabolity są wydalane głównie w moczu, natomiast wydalanie z kałem jest mniejsze.
Po podaniu tabletek podpoliczkowych fentanylu, ostatnia faza eliminacji fentanylu jest wynikiem
redystrybucji pomiędzy osoczem a tkankami głębokimi. Ta faza eliminacji jest powolna, co wynika ze średniego okresu półtrwania t1/2 fazy końcowej wydalania wynoszącego około 22 godziny po podaniu podpoliczkowym w formie musującej tabletki i około 18 godzin po podaniu dożylnym. Całkowity klirens fentanylu z osocza po podaniu dożylnym wynosi około 42 l/h.
Liniowość lub nieliniowość
Wykazano proporcjonalność dawki od 100 µg do 1000 µg.
Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących
bezpieczeństwa, badań toksyczności po podaniu wielokrotnym, genotoksyczności i rakotwórczości, nie ujawniają szczególnego zagrożenia dla człowieka.
Badania toksyczności rozwojowej zarodka i płodu prowadzone u szczurów i królików nie wykazały żadnych wad rozwojowych wywołanych przez substancję lub zmian rozwojowych po podaniu w okresie organogenezy.
W badaniach płodności i rozwoju zarodków u szczurów obserwowano działanie przenoszone przez męski układ rozrodczy po dużych dawkach (300 µg/kg/dobę, sc.) co uznano za wynik wpływu uspokajającego fentanylu w badaniach na zwierzętach.
W badaniach rozwoju szczurów przed i po narodzinach, wskaźnik przeżycia potomstwa był znacznie obniżony po dawkach wywołujących ciężką toksyczność u matki. Dalsze wyniki wpływu toksycznych dawek u rodziców na potomstwo (F1) dotyczyły opóźnionego rozwoju fizycznego, funkcji czucia, odruchów i zachowań. Te efekty mogły być pośrednio spowodowane albo pogorszeniem opieki ze strony matki i (lub) zmniejszonym wydzielaniem mleka, lub bezpośrednim wpływem fentanylu na potomstwo.
Badania dotyczące rakotwórczości (26-tygodniowy alternatywny skórny test biologiczny na transgenicznych myszach Tg.AC; dwuletnie badanie podskórnej rakotwórczości u szczurów)
fentanylu nie ujawniły żadnych wyników wskazujących na onkogenny potencjał. Ocena preparatów histologicznych mózgu z badania rakotwórczości u szczurów wykazała zmiany w mózgu u zwierząt, którym podawano duże dawki cytrynianu fentanylu. Znaczenie tych obserwacji dla ludzi jest nieznane.
Mannitol Sorbitol
Kwas cytrynowy
Makrogol 6000 L-arginina
Magnezu stearynian
Nie dotyczy.
100, 200 i 400 mikrogramów: 2 lata
Nie przechowywać w temperaturze powyżej 30ºC.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią.
Blister z folii PVC/Aluminium/PA/PVC-papier/PE w tekturowym pudełku. Blistry pakowane są w pudełka tekturowe po 4 lub 28 sztuk tabletek.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie wykorzystane lub niewykorzystane resztki produktu leczniczego, których się już nie potrzebuje, lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Aurovitas Pharma Polska Sp. z o.o. ul. Sokratesa 13D lokal 27
01-909 Warszawa
AuroFena, 100 mikrogramów, tabletki podpoliczkowe – pozwolenie nr: 26454 AuroFena, 200 mikrogramów, tabletki podpoliczkowe – pozwolenie nr: 26455 AuroFena, 400 mikrogramów, tabletki podpoliczkowe – pozwolenie nr: 26456
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 2021-06-15
19.08.2022











