Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
Sunitinib Glenmark, 12,5 mg, kapsułki twarde Sunitinib Glenmark, 25 mg, kapsułki twarde Sunitinib Glenmark, 50 mg, kapsułki twarde
Sunitinib Glenmark, 12,5 mg, kapsułki twarde Każda kapsułka zawiera 12,5 mg sunitynibu.
Sunitinib Glenmark, 25 mg, kapsułki twarde Każda kapsułka zawiera 25 mg sunitynibu.
Sunitinib Glenmark, 50 mg, kapsułki twarde Każda kapsułka zawiera 50 mg sunitynibu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Kapsułka twarda (kapsułka).
Sunitinib Glenmark, 12,5 mg, kapsułki twarde (kapsułki)
Kapsułki żelatynowe o rozmiarze 4 (o długości około 14,3 mm) z pomarańczowym wieczkiem i pomarańczowym korpusem, z wykonanym białym tuszem napisem „12.5 mg” na korpusie, zawierające granulki o barwie od żółtej do pomarańczowej.
Sunitinib Glenmark, 25 mg, kapsułki twarde (kapsułki)
Kapsułki żelatynowe o rozmiarze 3 (o długości około 15,9 mm) z karmelowym wieczkiem
i pomarańczowym korpusem, z wykonanym białym tuszem napisem „25 mg” na korpusie, zawierające granulki o barwie od żółtej do pomarańczowej.
Sunitinib Glenmark, 50 mg, kapsułki twarde (kapsułki)
Kapsułki żelatynowe o rozmiarze 1 (o długości około 19,4 mm) z karmelowym wieczkiem
i karmelowym korpusem, z wykonanym białym tuszem napisem „50 mg” na korpusie, zawierające granulki o barwie od żółtej do pomarańczowej.
Nowotwory podścieliskowe przewodu pokarmowego (ang. GIST, Gastrointestinal stromal tumour) Produkt leczniczy Sunitinib Glenmark jest wskazany w leczeniu nowotworów podścieliskowych przewodu pokarmowego (GIST) nieoperacyjnych i (lub) z przerzutami u dorosłych po niepowodzeniu leczenia imatynibem ze względu na oporność lub nietolerancję.
Rak nerkowokomórkowy z przerzutami (ang. MRCC, Metastatic renal cell carcinoma) Produkt leczniczy Sunitinib Glenmark jest wskazany w leczeniu zaawansowanego raka nerkowokomórkowego i (lub) raka nerkowokomórkowego z przerzutami (MRCC) u dorosłych.
Nowotwory neuroendokrynne trzustki (ang. pNET, Pancreatic neuroendocrine tumours)
Produkt leczniczy Sunitinib Glenmark jest wskazany w leczeniu wysoko zróżnicowanych nowotworów neuroendokrynnych trzustki (pNET) nieoperacyjnych lub z przerzutami u dorosłych, u których doszło do progresji choroby.
Leczenie produktem Sunitinib Glenmark powinien rozpoczynać lekarz doświadczony w podawaniu leków przeciwnowotworowych.
Dawkowanie
W przypadku GIST i MRCC, zalecana dawka produktu Sunitinib Glenmark wynosi 50 mg doustnie raz na dobę, przyjmowana doustnie przez 4 kolejne tygodnie, po czym następuje 2-tygodniowa przerwa (schemat 4/2), co stanowi pełny cykl 6 tygodni.
W przypadku pNET, zalecana dawka produktu Sunitinib Glenmark wynosi 37,5 mg raz na dobę, przyjmowana doustnie w sposób ciągły.
Dostosowanie dawki
Bezpieczeństwo stosowania i tolerancja
W przypadku GIST i MRCC można stopniowo zmieniać dawkowanie za każdym razem o 12,5 mg, zależnie od indywidualnie ocenianego bezpieczeństwa stosowania i tolerancji. Dawka dobowa nie powinna być większa niż 75 mg i nie powinna być mniejsza niż 25 mg.
W przypadku pNET można stopniowo zmieniać dawkowanie za każdym razem o 12,5 mg, zależnie od indywidualnie ocenianego bezpieczeństwa stosowania i tolerancji. Dawka maksymalna podawana
w badaniu III fazy dotyczącym pNET wynosiła 50 mg na dobę.
W zależności od indywidualnej oceny bezpieczeństwa stosowania i tolerancji leczenia może być konieczne zastosowanie przerw w podawaniu produktu.
Inhibitory i (lub) induktory CYP3A4
Należy unikać jednoczesnego podawania sunitynibu z silnymi induktorami CYP3A4, takimi jak ryfampicyna (patrz punkty 4.4 i 4.5). Jeżeli nie jest to możliwe, może być konieczne zwiększanie dawki sunitynibu, za każdym razem o 12,5 mg (do 87,5 mg na dobę w przypadku GIST i MRCC lub 62,5 mg na dobę w przypadku pNET) z jednoczesnym starannym monitorowaniem tolerancji.
Należy unikać jednoczesnego podawania sunitynibu z silnymi inhibitorami CYP3A4, takimi jak ketokonazol (patrz punkty 4.4 i 4.5). Jeżeli nie jest to możliwe, może być konieczne zmniejszenie dawek sunitynibu do minimum 37,5 mg na dobę w przypadku GIST i MRCC lub 25 mg na dobę w przypadku pNET, z jednoczesnym starannym monitorowaniem tolerancji.
Do leczenia skojarzonego należy rozważyć zastosowanie innego produktu wykazującego minimalne działanie indukujące lub hamujące CYP3A4, lub niewykazującego takiego działania.
Szczególne grupy populacji
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności sunitynibu u pacjentów w wieku poniżej 18 lat.
Aktualne dane przedstawiono w punktach 4.8, 5.1 i 5.2, ale brak jest zaleceń dotyczących dawkowania.
Pacjenci w podeszłym wieku
Około jedna trzecia pacjentów otrzymujących sunitynib w ramach badań klinicznych była w wieku 65 lat lub starsza. Nie obserwowano istotnych różnic pod względem bezpieczeństwa stosowania lub skuteczności leczenia pomiędzy młodszymi i starszymi pacjentami.
Zaburzenia czynności wątroby
U pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby (stopnia A i B według klasyfikacji Childa-Pugha), którym podaje się sunitynib, nie zaleca się modyfikowania dawki początkowej. Nie badano sunitynibu u pacjentów z ciężkimi zaburzeniami czynności wątroby (stopnia C według klasyfikacji Childa-Pugha) i dlatego jego stosowanie u pacjentów z ciężkimi zaburzeniami czynności wątroby nie jest zalecane (patrz punkt 5.2).
Zaburzenia czynności nerek
Nie zaleca się modyfikowania dawki początkowej, gdy stosuje się sunitynib u pacjentów
z zaburzeniami czynności nerek (z łagodnymi do ciężkich) lub schyłkową niewydolnością nerek (ang. ESRD, End-Stage Renal Disease), którzy poddawani są hemodializie. Późniejsze modyfikacje dawkowania należy zastosować na podstawie oceny bezpieczeństwa stosowania i tolerancji leczenia u poszczególnych pacjentów (patrz punkt 5.2).
Sposób podawania
Produkt Sunitinib Glenmark stosuje się doustnie. Ten produkt leczniczy można przyjmować z posiłkiem lub niezależnie od posiłków.
W razie pominięcia jednej z dawek nie należy stosować dodatkowej dawki. Pacjent powinien przyjąć zwykłą przepisaną dawkę następnego dnia.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Należy unikać jednoczesnego stosowania z silnymi induktorami cytochromu CYP3A4, ponieważ może to powodować zmniejszenie stężenia sunitynibu w osoczu (patrz punkty 4.2 i 4.5).
Należy unikać jednoczesnego stosowania z silnymi inhibitorami cytochromu CYP3A4, ponieważ może to powodować zwiększenie stężenia sunitynibu w osoczu (patrz punkty 4.2 i 4.5).
Zaburzenia skóry i tkanki podskórnej
Pacjentów należy poinformować, że w trakcie leczenia sunitynibem może dojść do odbarwienia włosów lub skóry. Do innych możliwych objawów dermatologicznych należą suchość, zgrubienie lub pękanie skóry, pęcherze lub wysypka na dłoniach i na podeszwach stóp.
Powyższe reakcje nie kumulowały się, były na ogół odwracalne i zasadniczo nie prowadziły do przerwania leczenia. Zgłaszano przypadki wystąpienia piodermii zgorzelinowej, której objawy zazwyczaj ustępowały po przerwaniu leczenia sunitynibem. Zgłaszano ciężkie reakcje skórne, w tym przypadki rumienia wielopostaciowego (ang. EM, erythema multiforme) oraz przypadki przypominające zespół Stevensa-Johnsona (ang. SJS, Stevens-Johnson syndrome) oraz martwicze toksyczne oddzielanie się naskórka (ang. TEN, toxic epidermal necrolysis), niektóre prowadzące do zgonu. Jeżeli wystąpią objawy przedmiotowe lub podmiotowe SJS, TEN lub EM (np. postępująca wysypka skórna, często z pęcherzami lub zmianami na błonach śluzowych), należy przerwać leczenie sunitynibem. Jeśli rozpoznanie SJS lub TEN potwierdzi się, nie wolno wznawiać leczenia.
W niektórych przypadkach podejrzenia EM, pacjenci tolerowali ponowne wprowadzenie sunitynibu w mniejszej dawce po ustąpieniu reakcji skórnej; niektórzy z tych pacjentów byli również jednocześnie leczeni kortykosteroidami lub lekami przeciwhistaminowymi (patrz punkt 4.8).
Krwotoki i krwawienia z guza
Zdarzenia krwotoczne, w niektórych przypadkach prowadzące do zgonu, zgłaszane w badaniach klinicznych dotyczących sunitynibu oraz w ramach nadzoru po wprowadzeniu do obrotu, obejmowały krwotoki z przewodu pokarmowego, układu oddechowego, dróg moczowych oraz krwotoki śródmózgowe (patrz punkt 4.8).
Rutynowa ocena takich zdarzeń krwotocznych powinna obejmować pełną morfologię krwi oraz badanie przedmiotowe.
Krwotok z nosa był najczęstszym krwotocznym działaniem niepożądanym, zgłaszanym u około połowy pacjentów z guzami litymi, u których wystąpiły zdarzenia krwotoczne. Niektóre z tych krwotoków z nosa były ciężkie, ale bardzo rzadko prowadziły do zgonu.
Zgłaszano przypadki krwotoku z guza, czasami związane z martwicą nowotworu; niektóre z nich prowadziły do zgonu.
Krwawienia z guza mogą występować nagle, a w przypadku guzów płuc mogą mieć postać ciężkiego, zagrażającego życiu krwioplucia lub krwotoku płucnego. W badaniach klinicznych oraz po wprowadzeniu do obrotu, u pacjentów z MRCC, GIST i rakiem płuc leczonych sunitynibem, zgłaszano przypadki krwotoku płucnego, u niektórych pacjentów zakończone zgonem.
Sunitynib nie jest zarejestrowany do stosowania u pacjentów z rakiem płuc.
Pacjenci otrzymujący jednocześnie leki przeciwzakrzepowe (np. warfarynę, acenokumarol) mogą być okresowo monitorowani poprzez wykonanie morfologii krwi (z oznaczeniem liczby płytek krwi), badania czynników krzepnięcia [czas protrombinowy (PT) i (lub) wskaźnik INR] oraz badanie przedmiotowe.
Zaburzenia żołądka i jelit
Najczęściej zgłaszanymi działaniami niepożądanymi ze strony układu pokarmowego były biegunka, nudności i (lub) wymioty, ból brzucha, niestrawność oraz zapalenie jamy ustnej i (lub) ból w jamie ustnej; zgłaszano również przypadki zapalenia przełyku (patrz punkt 4.8).
W razie działań niepożądanych ze strony układu pokarmowego zastosowane leczenie wspomagające może obejmować stosowanie leków przeciwwymiotnych, przeciwbiegunkowych lub zobojętniających kwas w żołądku.
U pacjentów z nowotworami w jamie brzusznej, u których zastosowano sunitynib, zgłaszano ciężkie, czasem prowadzące do zgonu powikłania ze strony przewodu pokarmowego, w tym perforacje.
Nadciśnienie tętnicze
Podczas leczenia sunitynibem zgłaszano nadciśnienie tętnicze, w tym przypadki ciężkiego nadciśnienia tętniczego (ciśnienie skurczowe >200 mmHg lub ciśnienie rozkurczowe >110 mmHg).
Pacjentów należy poddać badaniom przesiewowym w celu wykrycia nadciśnienia tętniczego i odpowiednio ich kontrolować.
U pacjentów z ciężkim nadciśnieniem tętniczym, którego nie udaje się opanować farmakologicznie, zaleca się czasowe przerwanie leczenia sunitynibem. Można je ponownie rozpocząć po uzyskaniu odpowiedniej kontroli nadciśnienia (patrz punkt 4.8).
Zaburzenia hematologiczne
Podczas leczenia sunitynibem zgłaszano zmniejszenie bezwzględnej liczby granulocytów obojętnochłonnych i liczby płytek krwi (patrz punkt 4.8). Powyższe zdarzenia nie kumulowały się, zwykle były odwracalne i na ogół nie prowadziły do przerwania leczenia. Żadne z tych zdarzeń nie zakończyło się zgonem w badaniach III fazy, ale po wprowadzeniu sunitynibu do obrotu rzadko zgłaszano epizody hematologiczne zakończone zgonem, w tym krwotoki związane
z małopłytkowością i zakażenia w przebiegu neutropenii.
Zarówno we wczesnych, jak i w późniejszych etapach leczenia sunitynibem obserwowano przypadki niedokrwistości.
U pacjentów, u których stosuje się sunitynib, należy wykonać pełną morfologię krwi na początku każdego cyklu leczenia (patrz punkt 4.8).
Zaburzenia serca
U pacjentów leczonych sunitynibem zgłaszano zdarzenia sercowo-naczyniowe, w tym niewydolność serca, kardiomiopatię, zmniejszenie frakcji wyrzutowej lewej komory poniżej dolnej granicy normy, zapalenie mięśnia sercowego, niedokrwienie mięśnia sercowego oraz zawał mięśnia sercowego, przy czym niektóre przypadki kończyły się zgonem. Dane te wskazują, że sunitynib zwiększa ryzyko rozwoju kardiomiopatii. U leczonych pacjentów nie zidentyfikowano żadnych dodatkowych czynników ryzyka rozwoju kardiomiopatii wywołanej przez sunitynib poza wpływem samego leku. Sunitynib należy stosować ostrożnie u pacjentów z ryzykiem wystąpienia zdarzeń sercowo- naczyniowych lub, u których takie zdarzenia wystąpiły w przeszłości (patrz punkt 4.8).
Z badań klinicznych dotyczących sunitynibu wyłączono pacjentów, u których w ciągu 12 miesięcy przed podaniem sunitynibu wystąpiły incydenty związane z układem krążenia, takie jak zawał mięśnia sercowego [w tym ciężka i (lub) niestabilna dławica piersiowa], przeszczep pomostujący tętnicy wieńcowej i (lub) tętnicy obwodowej, objawowa zastoinowa niewydolność serca, epizod naczyniowo- mózgowy lub przejściowy napad niedokrwienny, lub zator tętnicy płucnej. Nie wiadomo, czy pacjenci z wymienionymi schorzeniami współistniejącymi mogą być narażeni na większe ryzyko dysfunkcji lewej komory związanej z sunitynibem.
Lekarz powinien rozważyć to ryzyko w porównaniu do potencjalnych korzyści wynikających ze stosowania sunitynibu. Podczas leczenia sunitynibem pacjentów należy uważnie monitorować, pod kątem występowania objawów przedmiotowych i podmiotowych zastoinowej niewydolności serca. Dotyczy to szczególnie pacjentów z czynnikami ryzyka wystąpienia zdarzeń sercowo-naczyniowych i (lub) choroby wieńcowej w wywiadzie. Należy również rozważyć wykonywanie oznaczeń LVEF na początku terapii i okresowo w trakcie leczenia sunitynibem. U pacjentów, u których nie występują czynniki ryzyka wystąpienia zdarzeń sercowo-naczyniowych należy rozważyć wykonanie oceny frakcji wyrzutowej na początku leczenia.
W razie wystąpienia klinicznych objawów zastoinowej niewydolności serca zaleca się przerwanie leczenia sunitynibem. U pacjentów bez klinicznych objawów zastoinowej niewydolności serca, ale
z frakcją wyrzutową 20% poniżej wartości wyjściowej, należy przerwać stosowanie sunitynibu i (lub) zmniejszyć jego dawkę.
Wydłużenie odstępu QT
U pacjentów przyjmujących sunitynib obserwowano wydłużenie odstępu QT oraz zaburzenia rytmu typu torsade de pointes. Wydłużenie odstępu QT może zwiększać ryzyko wystąpienia komorowych zaburzeń rytmu, w tym zaburzeń typu torsade de pointes.
Należy zachować ostrożność podczas stosowania sunitynibu u pacjentów z wydłużonym odstępem QT w wywiadzie, pacjentów przyjmujących produkty lecznicze przeciwarytmiczne lub mogące wydłużyć odstęp QT oraz u pacjentów z istotnymi chorobami serca w wywiadzie, bradykardią lub zaburzeniami elektrolitowymi. Należy ograniczyć jednoczesne podawanie sunitynibu z silnymi inhibitorami cytochromu CYP3A4, które mogą powodować zwiększenie stężenia sunitynibu w osoczu (patrz punkty 4.2, 4.5 i 4.8).
Żylne zdarzenia zakrzepowo-zatorowe
U pacjentów, którzy przyjmowali sunitynib zgłaszano związane z leczeniem żylne zdarzenia zakrzepowo-zatorowe, w tym przypadki zakrzepicy żył głębokich i zatorowości płucnej (patrz punkt 4.8). W ramach nadzoru po wprowadzeniu sunitynibu do obrotu obserwowano przypadki zatorowości płucnej zakończone zgonem.
Tętnicze zdarzenia zakrzepowo-zatorowe
U pacjentów leczonych sunitynibem obserwowano przypadki tętniczych zdarzeń zakrzepowo- zatorowych, czasem zakończonych zgonem. Do najczęstszych zdarzeń należały epizody naczyniowo- mózgowe, przemijający napad niedokrwienny i zawał mózgu. Do czynników ryzyka związanych
z tętniczymi zdarzeniami zakrzepowo-zatorowymi, poza chorobą nowotworową i wiekiem ≥65 lat, należały nadciśnienie tętnicze, cukrzyca i choroba zakrzepowo-zatorowa w wywiadzie.
Tętniak i rozwarstwienie tętnicy
Stosowanie inhibitorów szlaku czynnika wzrostu śródbłonka naczyniowego u pacjentów z nadciśnieniem lub bez nadciśnienia może przyczynić się do tworzenia tętniaka i (lub)
rozwarstwienia tętnicy. Przed rozpoczęciem stosowania sunitynibu należy starannie rozważyć to ryzyko, szczególnie u pacjentów z takimi czynnikami ryzyka, jak nadciśnienie lub tętniak
w wywiadzie.
Mikroangiopatia zakrzepowa
W razie wystąpienia niedokrwistości hemolitycznej, małopłytkowości, zmęczenia, zmiennych objawów neurologicznych, zaburzenia czynności nerek i gorączki należy wziąć pod uwagę rozpoznanie mikroangiopatii zakrzepowej, w tym zakrzepowej plamicy małopłytkowej i zespołu hemolityczno-mocznicowego, które czasami prowadzą do niewydolności nerek lub zgonu.
U pacjentów, u których wystąpiła mikroangiopatia zakrzepowa, należy przerwać terapię sunitynibem i szybko rozpocząć odpowiednie leczenie. Po zaprzestaniu leczenia sunitynibem obserwowano ustąpienie objawów mikroangiopatii zakrzepowej (patrz punkt 4.8).
Zaburzenia czynności tarczycy
Zaleca się wstępne badania laboratoryjne czynności tarczycy u wszystkich pacjentów. Pacjenci
z niedoczynnością tarczycy lub nadczynnością tarczycy w wywiadzie powinni być leczeni w sposób standardowy przed rozpoczęciem leczenia sunitynibem. W trakcie leczenia sunitynibem należy kontrolować regularnie co 3 miesiące czynność tarczycy. Ponadto, pacjenci w czasie leczenia powinni być starannie monitorowani, czy nie występują u nich przedmiotowe i podmiotowe objawy zaburzeń czynności tarczycy. U pacjentów, u których pojawią się objawy przedmiotowe i (lub) podmiotowe wskazujące na zaburzenia czynności tarczycy konieczne jest wykonywanie badań laboratoryjnych czynności tarczycy zgodnie ze wskazaniami klinicznymi. Pacjenci, u których rozwiną się zaburzenia czynności tarczycy powinni być leczeni zgodnie z obowiązującymi standardami praktyki medycznej.
Niedoczynność tarczycy obserwowano zarówno we wczesnym, jak i późniejszym okresie leczenia sunitynibem (patrz punkt 4.8).
Zapalenie trzustki
U pacjentów z różnymi guzami litymi otrzymujących sunitynib obserwowano zwiększenie aktywności lipazy i amylazy w surowicy. Zwiększenie aktywności lipazy było przemijające i na ogół, u pacjentów z różnymi nowotworami litymi, nie towarzyszyły mu objawy przedmiotowe i podmiotowe zapalenia trzustki (patrz punkt 4.8). Zgłaszano przypadki ciężkich działań niepożądanych ze strony trzustki,
w niektórych przypadkach prowadzące do zgonu. W przypadku wystąpienia u pacjenta objawów zapalenia trzustki, należy przerwać stosowanie sunitynibu i zapewnić właściwe leczenie wspomagające.
Hepatotoksyczność
Hepatotoksyczność obserwowano u pacjentów leczonych sunitynibem. Przypadki niewydolności wątroby, z których część zakończyła się zgonem, opisywano u <1% pacjentów z nowotworami litymi leczonych sunitynibem. Należy kontrolować parametry czynnościowe wątroby [aktywność aminotransferazy alaninowej (AlAT) i asparaginianowej (AspAT) oraz stężenie bilirubiny] przed rozpoczęciem leczenia, podczas każdego cyklu leczenia oraz w przypadku wystąpienia wskazań klinicznych. W przypadku wystąpienia objawów niewydolności wątroby, należy przerwać stosowanie sunitynibu i zapewnić odpowiednie leczenie podtrzymujące (patrz punkt 4.8).
Czynność nerek
Zgłaszano przypadki zaburzenia czynności nerek, niewydolności nerek i (lub) ostrej niewydolności nerek, które w niektórych przypadkach kończyły się zgonem (patrz punkt 4.8).
Do czynników ryzyka związanych z zaburzeniami czynności nerek i (lub) niewydolnością nerek u pacjentów otrzymujących sunitynib, poza podstawową chorobą nowotworową, czyli rakiem nerkowokomórkowym, należały podeszły wiek, cukrzyca, współistniejące zaburzenia czynności
nerek, niewydolność serca, nadciśnienie tętnicze, posocznica, odwodnienie i (lub) hipowolemia oraz rabdomioliza.
Bezpieczeństwo kontynuacji leczenia sunitynibem u pacjentów z umiarkowanym lub ciężkim białkomoczem nie było systematycznie oceniane.
Opisywano przypadki białkomoczu oraz rzadkie przypadki zespołu nerczycowego. Zaleca się przeprowadzenie początkowego badania moczu oraz monitorowanie pacjentów w celu wykrycia pojawienia się lub nasilenia białkomoczu. U pacjentów z zespołem nerczycowym należy przerwać stosowanie sunitynibu.
Przetoka
W razie pojawienia się przetoki, leczenie sunitynibem należy przerwać. Dostępne są jedynie ograniczona informacje dotyczące kontynuacji stosowania sunitynibu u pacjentów z przetokami (patrz punkt 4.8).
Zaburzenia gojenia się ran
Podczas leczenia sunitynibem opisywano przypadki zaburzeń gojenia się ran.
Nie przeprowadzano żadnych formalnych badań klinicznych oceniających wpływ stosowania sunitynibu na gojenie się ran. U pacjentów poddawanych dużym zabiegom chirurgicznym zaleca się, jako środek ostrożności, czasowe przerwanie leczenia sunitynibem. Istnieje ograniczone doświadczenie kliniczne dotyczące właściwego momentu ponownego włączenia sunitynibu po dużych interwencjach chirurgicznych. W związku z tym, decyzja o ponownym rozpoczęciu stosowania sunitynibu po dużych interwencjach chirurgicznych powinna być podejmowana w oparciu o kliniczną ocenę przebiegu rekonwalescencji po zabiegu.
Martwica żuchwy i (lub) szczęki (ang. ONJ, osteonecrosis of the jaw)
U pacjentów leczonych sunitynibem zgłaszano przypadki ONJ. Większość przypadków zgłaszano u osób przyjmujących wcześniej lub jednocześnie dożylnie bisfosfoniany, u których ONJ stanowi rozpoznane ryzyko. Z tego względu należy zachować ostrożność w przypadku jednoczesnego lub sekwencyjnego stosowania sunitynibu i dożylnych produktów bisfosfonianów.
Inwazyjne procedury dentystyczne są także znanym czynnikiem ryzyka rozwoju ONJ. Przed rozpoczęciem leczenia sunitynibem należy rozważyć przeprowadzenie badania stomatologicznego i wdrożyć odpowiednie działania zapobiegawcze. U pacjentów przyjmujących wcześniej lub stosujących obecnie dożylne produkty bisfosfonianów, jeśli to możliwe należy unikać inwazyjnych zabiegów dentystycznych (patrz punkt 4.8).
Nadwrażliwość i (lub) obrzęk naczynioruchowy
W razie wystąpienia obrzęku naczynioruchowego spowodowanego nadwrażliwością, leczenie sunitynibem należy przerwać, a pacjenci powinni zostać objęci standardową opieką medyczną (patrz punkt 4.8).
Drgawki
W trakcie badań klinicznych oraz w ramach nadzoru po wprowadzeniu sunitynibu do obrotu zgłaszano przypadki napadów drgawkowych. U pacjentów z napadami drgawkowymi i objawami podmiotowymi i (lub) przedmiotowymi zespołu odwracalnej tylnej leukoencefalopatii (ang. reversible posterior leukoencephalopathy syndrome; RPLS), takimi jak nadciśnienie tętnicze, ból głowy, obniżona czujność, zmiany psychiczne i utrata wzroku, w tym ślepota korowa, należy kontrolować występujące zaburzenia poprzez zastosowanie właściwego leczenia farmakologicznego, w tym kontroli nadciśnienia. Zaleca się tymczasowe przerwanie stosowania sunitynibu; po ustąpieniu objawów lekarz prowadzący może podjąć decyzję o kontynuacji leczenia (patrz punkt 4.8).
Zespół rozpadu guza (ang. tumour lysis syndrome; TLS)
W trakcie badań klinicznych oraz w ramach nadzoru po wprowadzeniu sunitynibu do obrotu
u pacjentów leczonych sunitynibem rzadko obserwowano przypadki TLS, niektóre zakończone zgonem. Czynniki ryzyka wystąpienia TLS obejmują dużą wielkość guza, przewlekłą niewydolność nerek w wywiadzie, skąpomocz, odwodnienie, niedociśnienie tętnicze i kwaśny odczyn moczu.
Pacjentów należy ściśle monitorować i podjąć leczenie w razie wystąpienia wskazań klinicznych. Należy także rozważyć profilaktyczne nawodnienie pacjenta.
Zakażenia
Zgłaszano ciężkie zakażenia, z neutropenią lub bez neutropenii, w tym niektóre zakończone zgonem. Zgłaszano niezbyt częste przypadki martwiczego zapalenia powięzi, w tym krocza, czasami prowadzące do zgonu (patrz punkt 4.8).
U pacjentów, u których wystąpi martwicze zapalenie powięzi, należy przerwać stosowanie sunitynibu i niezwłocznie wdrożyć odpowiednie leczenie.
Hipoglikemia
Podczas leczenia sunitynibem zgłaszano zmniejszenie stężenia glukozy we krwi, czasami
z klinicznymi objawami i wymagające hospitalizacji z powodu utraty przytomności. W razie objawów hipoglikemii należy tymczasowo przerwać podawanie sunitynibu. U pacjentów z cukrzycą należy regularnie kontrolować stężenie glukozy we krwi w celu oceny, czy konieczna jest modyfikacja dawkowania leku przeciwcukrzycowego w celu zminimalizowania ryzyka wystąpienia hipoglikemii (patrz punkt 4.8).
Sód
Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na kapsułkę, to znaczy produkt leczniczy uważa się za „wolny od sodu”.
Badania dotyczące interakcji przeprowadzono tylko u dorosłych. Produkty lecznicze, które mogą zwiększać stężenie sunitynibu w osoczu
Wpływ inhibitorów cytochromu CYP3A4
Jednoczesne podanie jednorazowej dawki sunitynibu z silnym inhibitorem cytochromu CYP3A4, ketokonazolem, powodowało u zdrowych ochotników zwiększenie wartości stężenia maksymalnego (Cmax) łącznie sunitynibu i jego głównego metabolitu odpowiednio o 49%, a pola powierzchni pod krzywą zależności stężenia od czasu (AUC0-∞) o 51%.
Podawanie sunitynibu jednocześnie z silnymi inhibitorami cytochromu CYP3A4 (np. rytonawirem, itrakonazolem, erytromycyną, klarytromycyną, sokiem grejpfrutowym) może wiązać się ze zwiększeniem stężenia sunitynibu.
Z tego względu należy unikać jednoczesnego podawania sunitynibu z inhibitorami cytochromu CYP3A4 lub należy rozważyć wybranie do leczenia skojarzonego innego produktu o minimalnym działaniu hamującym cytochrom CYP3A4 lub bez takiego działania.
Jeżeli nie jest to możliwe, może zaistnieć konieczność zmniejszenia dawki produktu Sunitinib Glenmark do minimalnej dawki dobowej 37,5 mg w przypadku GIST i MRCC lub 25 mg
w przypadku pNET, na podstawie dokładnie monitorowanej tolerancji (patrz punkt 4.2).
Wpływ inhibitorów białka oporności raka piersi (ang. breast cancer resistance protein; BCRP)
Dostępne są jedynie ograniczone dane kliniczne dotyczące interakcji między sunitynibem
a inhibitorami BCRP, dlatego nie można wykluczyć możliwości interakcji między sunitynibem a innymi inhibitorami BCRP (patrz punkt 5.2).
Produkty lecznicze, które mogą zmniejszać stężenie sunitynibu w osoczu
Wpływ induktorów cytochromu CYP3A4
Jednoczesne podanie jednorazowej dawki sunitynibu z induktorem cytochromu CYP3A4, ryfampicyną, powodowało u zdrowych ochotników zmniejszenie wartości Cmax i AUC0-∞ kompleksu [sunitynib + jego główny metabolit] odpowiednio o 23% i 46%.
Podawanie sunitynibu z silnymi induktorami cytochromu CYP3A4 (np. deksametazonem, fenytoiną, karbamazepiną, ryfampicyną, fenobarbitalem lub produktami roślinnymi zawierającymi ziele dziurawca (Hypericum perforatum) może prowadzić do zmniejszenia stężenia sunitynibu. Z tego względu nie należy jednocześnie stosować sunitynibu z induktorami cytochromu CYP3A4, bądź też należy rozważyć wybranie do leczenia skojarzonego alternatywnego produktu leczniczego,
o minimalnym działaniu indukującym cytochrom CYP3A4 lub bez takiego działania. Jeżeli nie jest to możliwe, może zaistnieć konieczność stopniowego zwiększania dawek produktu Sunitinib Glenmark, za każdym razem o 12,5 mg (do 87,5 mg na dobę w przypadku GIST i MRCC lub 62,5 mg na dobę
w przypadku pNET), na podstawie dokładnie monitorowanej tolerancji (patrz punkt 4.2).
Antykoncepcja u mężczyzn i kobiet
Kobietom w wieku rozrodczym należy doradzić stosowanie skutecznej metody antykoncepcyjnej oraz unikanie zajścia w ciążę podczas leczenia sunitynibem.
Ciąża
Nie przeprowadzono badań dotyczących stosowania sunitynibu u kobiet w ciąży. W badaniach na zwierzętach stwierdzono toksyczny wpływ sunitynibu na rozmnażanie, w tym, występowanie wad rozwojowych płodu (patrz punkt 5.3). Produktu Sunitinib Glenmark nie należy stosować w czasie ciąży lub u kobiet, które nie stosują skutecznej metody antykoncepcyjnej, chyba że możliwe korzyści z leczenia przeważają nad możliwym ryzykiem dla płodu. Jeżeli sunitynib jest stosowany w czasie ciąży lub jeżeli pacjentka zajdzie w ciążę w trakcie leczenia sunitynibem, należy ją poinformować
o możliwym zagrożeniu dla płodu.
Karmienie piersią
Sunitynib i (lub) jego metabolity przenikają do mleka szczurów. Nie wiadomo, czy sunitynib lub jego główny metabolit przenikają do mleka kobiecego. Ze względu na to, że substancje czynne często przenikają do mleka ludzkiego i ze względu na możliwe występowanie ciężkich działań niepożądanych u niemowląt karmionych piersią, kobiety nie powinny karmić piersią podczas przyjmowania sunitynibu.
Płodność
Na podstawie obserwacji nieklinicznych stwierdza się możliwość zmniejszenia płodności u mężczyzn i u kobiet w trakcie leczenia sunitynibem (patrz punkt 5.3).
Produkt Sunitinib Glenmark ma niewielki wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Pacjentów należy poinformować o możliwości wystąpienia zawrotów głowy w trakcie leczenia sunitynibem.
Podsumowanie profilu bezpieczeństwa
Najcięższe działania niepożądane związane z leczeniem sunitynibem, niektóre zakończone zgonem, to niewydolność nerek, niewydolność serca, zatorowość płucna, perforacja przewodu pokarmowego oraz krwotoki (np. krwotok z układu oddechowego, przewodu pokarmowego, guza, układu moczowego oraz krwotok mózgowy). Do najczęstszych działań niepożądanych o dowolnym stopniu nasilenia (występujących u pacjentów w badaniach rejestracyjnych RCC, GIST i pNET) należały: zmniejszenie apetytu, zaburzenia smaku, nadciśnienie tętnicze, uczucie zmęczenia, zaburzenia ze strony przewodu
pokarmowego (takie jak biegunka, nudności, zapalenie jamy ustnej, niestrawność i wymioty), przebarwienia skórne oraz erytrodysestezja dłoniowo-podeszwowa. Nasilenie tych objawów może się zmniejszać w miarę kontynuacji leczenia. Podczas leczenia może rozwinąć się niedoczynność tarczycy. Do najczęściej występujących działań niepożądanych należą zaburzenia hematologiczne (np. neutropenia, małopłytkowość i niedokrwistość).
Prowadzące do zgonu działania niepożądane inne niż wymienione w punkcie 4.4 powyżej lub w punkcie 4.8 poniżej, których związek ze stosowaniem sunitynibu uznano za możliwy, obejmowały niewydolność wielonarządową, rozsiane wykrzepianie wewnątrznaczyniowe, krwotok do jamy otrzewnowej, niewydolność nadnerczy, odmę opłucnową, wstrząs oraz nagły zgon.
Tabelaryczne zestawienie działań niepożądanych
Poniżej wymieniono działania niepożądane, zgłaszane przez pacjentów z GIST, MRCC i pNET, z danych zbiorczych obejmujących 7115 pacjentów, według klasyfikacji układów i narządów, częstości występowania i stopnia ciężkości (NCI-CTCAE). Uwzględniono również działania
niepożądane stwierdzone w badaniach klinicznych po dopuszczeniu sunitynibu do obrotu. W obrębie każdej grupy o określonej częstości występowania działań niepożądanych są one wymienione od najcięższych do najlżejszych.
Częstość występowania zdefiniowano jako: bardzo często (≥1/10), często (≥1/100 do <1/10), niezbyt często (≥1/1 000 do < 1/100), rzadko (≥1/10 000 do <1/1 000), bardzo rzadko (<1/10 000), częstość nieznana (częstości nie można określić na podstawie dostępnych danych).
Tabela 1. Działanie niepożądane zgłoszone w badaniach klinicznych
Klasyfikacja układów i narządów | Bardzo często | Często | Niezbyt często | Rzadko | Częstość nieznana |
Zakażenia i zarażenia pasożytnicze | Zakażenia wirusowea Zakażenia dróg oddechowychb,* Ropieńc,* Zakażenia grzybiczed Zakażenie układu moczowego Zakażenia skórye Posocznicaf,* | Martwicze zapalenie powięzi* Zakażenia bakteryjneg | |||
Zaburzenia krwi i układu chłonnego | Neutropenia Małopłytkowość Niedokrwistość Leukopenia | Limfopenia | Pancytopenia | Mikroangiopatia zakrzepowah,* | |
Zaburzenia układu immunologicz- nego | Nadwrażliwość | Obrzęk naczynioruchowy | |||
Zaburzenia endokrynolo- giczne | Niedoczynność tarczycy | Nadczynność tarczycy | Zapalenie tarczycy | ||
Zaburzenia metabolizmu i odżywiania | Zmniejszone łaknieniei | Odwodnienie Hipoglikemia | Zespół rozpadu guza* | ||
Zaburzenia psychiczne | Bezsenność | Depresja |
Zaburzenia układu nerwowego | Zawroty głowy Ból głowy Zaburzenia smakuj | Neuropatia obwodowa Parestezje Niedoczulica Przeczulica | Krwotok śródmózgowy* Incydent naczyniowo- mózgowy* Przemijający napad niedokrwienny | Zespół tylnej odwracalnej encefalopatii* | |
Zaburzenia oka | Obrzęk tkanek oczodołu Obrzęk powiek Nasilone łzawienie | ||||
Zaburzenia serca | Niedokrwienie mięśnia sercowegok,* Zmniejszenie frakcji wyrzutowejl | Zastoinowa niewydolność serca Zawał mięśnia sercowegom,* Niewydolność serca* Kardiomiopatia* Wysięk w worku osierdziowym Wydłużenie odstępu QT w EKG | Niewydolność lewokomorowa* Zaburzenia rytmu typu torsade de pointes | ||
Zaburzenia naczyniowe | Nadciśnienie tętnicze | Zakrzepica żył głębokich Uderzenia gorąca Nagłe zaczerwienienie twarzy | Krwotok z guza* | Tętniak i rozwar- stwienie tętnicy | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Duszność Krwawienie z nosa Kaszel | Zatorowość płucna* Wysięk opłucnowy* Krwioplucie Duszność wysiłkowa Ból jamy ustnej i gardłan Przekrwienie błony śluzowej nosa Suchość w nosie | Krwotok płucny* Niewydolność oddechowa* | ||
Zaburzenia żołądka i jelit | Zapalenie błony śluzowej jamy ustnejo Ból brzuchap Wymioty Biegunka Niestrawność Nudności Zaparcia | Choroba refluksowa przełyku Dysfagia Krwotok z przewodu pokarmowego* Zapalenie przełyku* Rozdęcie brzucha | Perforacja przewodu pokarmowegoq,* Zapalenie trzustki Przetoka okołoodbytnicza Zapalenie jelita grubego |
Odczucie dyskomfortu w obrębie jamy brzusznej Krwotok z odbytnicy Krwawienie z dziąseł Owrzodzenie jamy ustnej Ból odbytu Zapalenie kącików ust Guzki krwawnicze Zespół piekących ust Ból w jamie ustnej Suchość w jamie ustnej Wzdęcia Odczucie dyskomfortu w jamie ustnej Odbijanie się ze zwracaniem treści żołądkowej lub gazu | |||||
Zaburzenia | Niewydolność | Zapalenie wątroby | |||
wątroby i dróg | wątroby* | ||||
żółciowych | Zapalenie | ||||
pęcherzyka | |||||
żółciowegos,* | |||||
Zaburzenia | |||||
czynności wątroby | |||||
Zaburzenia skóry i tkanki podskórnej | Przebarwienie skóryt Zespół erytrodysestezji dłoniowo- podeszwowej Wysypkau Zmiana koloru włosów Suchość skóry | Złuszczanie skóry Reakcje skórnev Egzema Pęcherz Rumień Łysienie Trądzik Świąd Nadmierna pigmentacja skóry Uszkodzenie skóry Nadmierne rogowacenie Zapalenie skóry Zaburzenia płytki paznokciowejw | Rumień wielopostaciowy* Zespół Stevensa- Johnsona* Zgorzelinowe zapalenie skóry Toksyczne martwicze oddzielanie się naskórka* |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Bóle kończyn Bóle stawów Bóle pleców | Bóle mięśniowo- szkieletowe Skurcze mięśniowe Ból mięśni Osłabienie mięśni | Martwica żuchwy Przetoka* | Rozpad mięśni poprzecznie prążkowanych (rabdomioliza)* Miopatie | |
Zaburzenia czynności nerek i układu moczowego | Niewydolność nerek* Ostra niewydolność nerek* Zmiana barwy moczu Białkomocz | Krwotok z dróg moczowych | Zespół nerczycowy | ||
Zaburzenia ogólne i stany w miejscu podania | Zapalenie błon śluzowych Zmęczeniex Obrzękiy Gorączka | Ból w klatce piersiowej Ból Objawy grypopodobne Dreszcze | Zaburzenia gojenia się ran | ||
Badania diagnostyczne | Zmniejszenie masy ciała Zmniejszenie liczby krwinek białych we krwi Zwiększenie aktywności lipazy Zmniejszenie liczby płytek krwi Zmniejszenie stężenia hemoglobiny Zwiększenie aktywności amylazyz Zwiększenie aktywności aminotransferazy asparaginowej Zwiększenie aktywności aminotransferazy alaninowej Zwiększenie stężenia kreatyniny we krwi Wzrost ciśnienia tętniczego krwi Zwiększenie stężenia kwasu moczowego we krwi | Zwiększenie aktywności fosfokinazy kreatynowej we krwi Zwiększenie stężenia tyreotropiny we krwi |
* W tym zdarzenia zakończone zgonem Połączono następujące terminy:
a Zapalenie nosa i gardła oraz opryszczka warg
b Zapalenie oskrzeli, zakażenie dolnych dróg oddechowych, zapalenie płuc oraz zakażenie dróg oddechowych
c Ropień, ropień w obrębie kończyny, ropień odbytu, ropień dziąsła, ropień wątroby, ropień trzustki, ropień w kroczu, ropień okołoodbytniczy, ropień odbytniczy, ropień podskórny i ropień zęba
d Kandydoza przełyku i kandydoza jamy ustnej
e Zapalenie tkanki łącznej i zakażenie skóry
f Posocznica i wstrząs septyczny
g Ropień w jamie brzusznej, posocznica spowodowana zakażeniem w obrębie jamy brzusznej, zapalenie uchyłków i zapalenie kości i szpiku
h Mikroangiopatia zakrzepowa, zakrzepowa plamica małopłytkowa, zespół hemolityczno-mocznicowy
i Zmniejszenie łaknienia i jadłowstręt
j Dysgeuzja, ageuzja i zaburzenia smaku
k Ostry zespół wieńcowy, dławica piersiowa, niestabilna dławica piersiowa, niedrożność tętnicy wieńcowej, niedokrwienie mięśnia sercowego
l Obniżenie i (lub) nieprawidłowość frakcji wyrzutowej
m Zawał mięśnia sercowego w ostrej fazie, zawał mięśnia sercowego, bezobjawowy zawał mięśnia sercowego
n Ból jamy ustnej i gardła oraz ból gardła i krtani
o Zapalenie błony śluzowej jamy ustnej i aftowe zapalenie jamy ustnej
p Ból brzucha, ból w podbrzuszu i ból w nadbrzuszu
q Perforacja przewodu pokarmowego i perforacja jelita
r Zapalenie jelita grubego i niedokrwienne zapalenie jelita grubego
s Zapalenie pęcherzyka żółciowego i zapalenie pęcherzyka żółciowego niekamicze
t Zażółcenie skóry, przebarwienia skórne i zaburzenia pigmentacji
u Łuszczycopodobne zapalenie skóry, wysypka złuszczająca, wysypka, wysypka rumieniowa, wysypka pęcherzykowa, wysypka uogólniona, wysypka plamista, wysypka plamisto-grudkowa, wysypka grudkowa i swędząca wysypka
v Reakcje skórne i zaburzenia skórne
w Zaburzenia i odbarwienia płytki paznokciowej
x Zmęczenie i astenia
y Obrzęk twarzy, obrzęki oraz obrzęki obwodowe
z Zwiększona aktywność amylazy
Opis wybranych działań niepożądanych
Zakażenia i zarażenia pasożytnicze
Zgłaszano przypadki poważnych zakażeń (z neutropenią lub bez neutropenii), w tym niektóre zakończone zgonem. Zgłaszano przypadki martwiczego zapalenia powięzi, w tym krocza, czasami prowadzące do zgonu (patrz punkt 4.4).
Zaburzenia krwi i układu chłonnego
Zmniejszenie bezwzględnej liczby granulocytów obojętnochłonnych o nasileniu 3. i 4. stopnia stwierdzono odpowiednio u 10% i 1,7% pacjentów z GIST w badaniu III fazy, u 16% i 1,6% pacjentów z MRCC w badaniu III fazy i u 13% i 2,4% pacjentów z pNET w badaniu III fazy. Zmniejszenie liczby płytek krwi o nasileniu 3. i 4. stopnia obserwowano również odpowiednio u 3,7% i 0,4% pacjentów z GIST w badaniu III fazy, u 8,2% i 1,1% pacjentów z MRCC w badaniu III fazy
i u 3,7% i 1,2% pacjentów z pNET w badaniu III fazy (patrz punkt 4.4).
W badaniu klinicznym III fazy u pacjentów z nowotworami podścieliskowymi przewodu pokarmowego, krwawienia obserwowano u 18% pacjentów otrzymujących sunitynib w porównaniu do 17% pacjentów otrzymujących placebo. W grupie pacjentów z rakiem nerkowokomórkowym
z przerzutami, którzy dotychczas nie byli leczeni, a którym podawano sunitynib, krwawienia występowały u 39% pacjentów w porównaniu do 11% w grupie otrzymującej interferon-alfa (IFN-α). U siedemnastu (4,5%) pacjentów otrzymujących sunitynib w porównaniu do 5 (1,7%) pacjentów otrzymujących IFN-α wystąpiły krwawienia stopnia 3. lub wyższego. Krwawienia wystąpiły u 26% pacjentów otrzymujących sunitynib z powodu MRCC opornego na leczenie cytokinami. W badaniu klinicznym III fazy dotyczącym pNET, krwawienia (z wyjątkiem krwawienia z nosa) obserwowano
u 21,7% pacjentów otrzymujących sunitynib w porównaniu do 9,85% pacjentów otrzymujących placebo (patrz punkt 4.4).
W badaniach klinicznych krwotoki z guza występowały u około 2% pacjentów z nowotworami podścieliskowymi przewodu pokarmowego.
Zaburzenia układu immunologicznego
Zgłaszano reakcje nadwrażliwości, w tym obrzęk naczyniowy (patrz punkt 4.4).
Zaburzenia endokrynologiczne
W dwóch badaniach prowadzonych u pacjentów z rakiem nerkowokomórkowym z przerzutami otrzymujących sunitynib po niepowodzeniu leczenia cytokinami niedoczynność tarczycy była zgłaszana jako działanie niepożądane u 7 pacjentów (4%) stosujących sunitynib. W badaniu u pacjentów z rakiem nerkowokomórkowym z przerzutami, którzy dotychczas nie byli leczeni, niedoczynność tarczycy wystąpiła u 61 pacjentów (16%) otrzymujących sunitynib i u trzech pacjentów (<1%) w grupie otrzymującej IFN-α.
Ponadto u czterech pacjentów (2%) z rakiem nerkowokomórkowym z przerzutami, opornym na leczenie cytokinami, stwierdzono wzrost stężenia TSH. Ogółem u 7% populacji pacjentów z MRCC stwierdzono kliniczne lub laboratoryjne objawy niedoczynności tarczycy, które wystąpiły w trakcie leczenia. Nabytą niedoczynność tarczycy stwierdzono u 6,2% pacjentów z nowotworami podścieliskowymi przewodu pokarmowego otrzymujących sunitynib i u 1% pacjentów otrzymujących placebo. W badaniu III fazy dotyczącym pNET niedoczynność tarczycy stwierdzono u 6 pacjentów (7,2%) otrzymujących sunitynib i 1 pacjenta (1,2%) otrzymującego placebo.
Czynność tarczycy monitorowano prospektywnie w dwóch badaniach obejmujących pacjentki z rakiem piersi. Sunitynib nie jest zarejestrowany do leczenia raka piersi. W pierwszym badaniu
niedoczynność tarczycy zgłoszono u 15 (13,6%) pacjentek przyjmujących sunitynib oraz u 3 pacjentek (2,9%) poddanych leczeniu standardowemu. Wzrost stężenia TSH we krwi zgłoszono u 1 (0,9%) pacjentki przyjmującej sunitynib, natomiast nie stwierdzono tego u żadnej pacjentki w grupie poddanej leczeniu standardowemu. U żadnej z pacjentek w grupie leczonej sunitynibem nie zgłoszono nadczynności tarczycy, natomiast w grupie poddanej leczeniu standardowemu zaburzenie to wystąpiło u 1 (1,0%) pacjentki. W drugim badaniu niedoczynność tarczycy zgłoszono w sumie u 31 (13%) pacjentek przyjmujących sunitynib oraz u 2 pacjentek (0,8%) otrzymujących kapecytabinę. Wzrost stężenia TSH we krwi zgłoszono u 12 (5,0%) pacjentek przyjmujących sunitynib, natomiast nie stwierdzono tego u żadnej pacjentki w grupie leczonej kapecytabiną.
Nadczynność tarczycy zgłoszono u 4 (1,7%) pacjentek przyjmujących sunitynib, natomiast nie stwierdzono tego zaburzenia u żadnej pacjentki w grupie leczonej kapecytabiną. Obniżenie stężenia TSH we krwi zgłoszono u 3 (1,3%) pacjentek przyjmujących sunitynib, natomiast nie stwierdzono tego u żadnej pacjentki w grupie leczonej kapecytabiną. Wzrost stężenia T4 zgłoszono u 2 (0,8%) pacjentek przyjmujących sunitynib i u 1 (0,4%) pacjentki w grupie leczonej kapecytabiną. Wzrost stężenia T3 zgłoszono u 1 (0,8%) pacjentki przyjmującej sunitynib, natomiast nie stwierdzono tego u żadnej pacjentki w grupie leczonej kapecytabiną. Nasilenie wszystkich zgłaszanych zdarzeń związanych z czynnością tarczycy oceniono jako stopnia 1. lub 2. (patrz punkt 4.4).
Zaburzenia metabolizmu i odżywiania
Częstsze przypadki zdarzeń hipoglikemicznych zgłoszono u pacjentów z pNET w porównaniu
z pacjentami z MRCC i GIST. Jednak większość działań niepożądanych obserwowanych w badaniach klinicznych nie została uznana za powiązane z leczeniem zastosowanym w badaniu (patrz punkt 4.4).
Zaburzenia układu nerwowego
W badaniach klinicznych sunitynibu oraz w ramach nadzoru po wprowadzeniu do obrotu zgłoszono nieliczne przypadki (<1%) drgawek i objawów radiologicznych RPLS; niektóre z nich prowadziły do zgonu. Drgawki obserwowano u pacjentów z potwierdzonymi radiologicznie przerzutami do mózgu
i u pacjentów bez przerzutów do mózgu (patrz punkt 4.4).
Zaburzenia serca
W badaniach klinicznych, obniżenie frakcji wyrzutowej lewej komory (LVEF) o 20% i poniżej dolnej granicy normy wystąpiło u około 2% pacjentów z nowotworami podścieliskowymi przewodu pokarmowego, u 4% pacjentów z rakiem nerkowokomórkowym opornym na cytokiny i u 2% pacjentów z nowotworem podścieliskowym przewodu pokarmowego otrzymujących placebo. Nie wydaje się, aby spadek LVEF miał charakter postępujący, a ponadto często obserwowano poprawę w miarę kontynuacji leczenia. W badaniu klinicznym u pacjentów z rakiem nerkowokomórkowym z przerzutami, którzy dotychczas nie byli leczeni, wartości LVEF poniżej dolnej granicy normy wystąpiły u 27% pacjentów otrzymujących sunitynib i u 15% pacjentów, którym podawano IFN-α. U dwóch pacjentów (<1%) otrzymujących sunitynib rozpoznano zastoinową niewydolność serca.
U 1,2% pacjentów z nowotworem podścieliskowym przewodu pokarmowego leczonych sunitynibem i 1% pacjentów otrzymujących placebo stwierdzono: niewydolność serca, zastoinową niewydolność serca lub lewokomorową niewydolność serca. W głównym badaniu III fazy u pacjentów z GIST (n = 312) prowadzące do zgonu działania niepożądane ze strony układu krążenia związane z leczeniem zgłoszono u 1% pacjentów w każdej z grup badanych (tj. w grupie otrzymującej sunitynib i w grupie otrzymującej placebo). W badaniu fazy II z udziałem pacjentów z MRCC opornym na leczenie cytokinami u 0,9% pacjentów wystąpił związany z leczeniem zawał mięśnia sercowego zakończony zgonem, a spośród pacjentów z dotychczas nieleczonym MRCC w badaniu III fazy u 0,6% pacjentów w grupie leczonej IFN-α wystąpiły prowadzące do zgonu działania niepożądane ze strony układu krążenia, podczas gdy nie obserwowano takich zdarzeń (0%) w grupie leczonej sunitynibem.
W badaniu III fazy dotyczącym pNET u jednego pacjenta (1%) otrzymującego sunitynib stwierdzono zakończoną zgonem niewydolność serca związaną z zastosowanym leczeniem.
Zaburzenia naczyniowe
Nadciśnienie tętnicze
Nadciśnienie tętnicze było bardzo często zgłaszanym działaniem niepożądanym obserwowanym w badaniach klinicznych. U około 2,7% pacjentów, u których wystąpiło nadciśnienie tętnicze obniżono dawkę lub czasowo zawieszono podanie sunitynibu. U żadnego z tych pacjentów nie przerwano podawania sunitynibu na stałe. Ciężkie nadciśnienie tętnicze (ciśnienie skurczowe
>200 mmHg lub ciśnienie rozkurczowe >110 mmHg) zgłoszono u 4,7% pacjentów z guzami litymi. Nadciśnienie tętnicze obserwowano u około 33,9% pacjentów otrzymujących sunitynib z powodu dotychczas nieleczonego MRCC w porównaniu do 3,6% pacjentów otrzymujących IFN-α. Ciężkie nadciśnienie tętnicze wystąpiło u 12% dotychczas nieleczonych pacjentów otrzymujących sunitynib i <1% pacjentów otrzymujących IFN-α. Nadciśnienie tętnicze zgłoszono u 26,5% pacjentów otrzymujących sunitynib w badaniu III fazy dotyczącym pNET w porównaniu z 4,9% pacjentów otrzymujących placebo. Ciężkie nadciśnienie tętnicze stwierdzono u 10% pacjentów z pNET leczonych sunitynibem i u 3% pacjentów otrzymujących placebo.
Żylne zaburzenia zakrzepowo-zatorowe
Epizody żylnej choroby zakrzepowo-zatorowej związane z leczeniem zgłaszano u około 1,0% pacjentów z guzami litymi, w tym u pacjentów z GIST i RCC, którzy przyjmowali sunitynib w badaniach klinicznych.
W badaniu klinicznym III fazy u pacjentów z nowotworami podścieliskowymi przewodu pokarmowego, żylne zaburzenia zakrzepowo-zatorowe wystąpiły u siedmiu (3%) pacjentów otrzymujących sunitynib, natomiast nie wystąpiły one u żadnego z pacjentów w grupie otrzymującej placebo. U pięciu z siedmiu pacjentów rozpoznano zakrzepicę żył głębokich (DVT) o nasileniu 3. stopnia, a u dwóch – o nasileniu 1. lub 2. stopnia. U czterech z tych siedmiu pacjentów z GIST konieczne było przerwanie leczenia po zaobserwowaniu pierwszych objawów DVT.
Żylne zaburzenia zakrzepowo-zatorowe zgłoszono u trzynastu pacjentów (3%) z MRCC otrzymujących sunitynib, biorących udział w badaniu III fazy, którzy dotychczas nie byli leczeni
i u czterech (2%) pacjentów z MRCC opornym na cytokiny. U dziewięciu z tych pacjentów wystąpiła zatorowość płucna - u jednego pacjenta o nasileniu 2. stopnia, u ośmiu pacjentów o nasileniu 4. stopnia. U ośmiu z tych pacjentów rozpoznano zakrzepicę żył głębokich, jeden przypadek o nasileniu
1. stopnia, dwa przypadki o nasileniu 2. stopnia, cztery przypadki o nasileniu 3. stopnia i jeden przypadek o nasileniu 4. stopnia. U jednego pacjenta z zatorowością płucną w badaniu MRCC opornego na leczenie cytokinami przerwano podawanie sunitynibu.
U pacjentów z MRCC, którzy dotychczas nie byli leczeni, otrzymujących IFN-α, u 6 (2%) pacjentów zgłoszono żylne zaburzenia zakrzepowo-zatorowe, u 1 (< 1%) pacjenta wystąpiła zakrzepica żył głębokich o nasileniu 3. stopnia i u 5 (1%) pacjentów wystąpiła zatorowość płucna, u wszystkich pacjentów o nasileniu 4. stopnia.
W badaniu III fazy dotyczącym pNET żylne zaburzenia zakrzepowo-zatorowe zgłoszono u 1 (1,2%) pacjenta w grupie leczonej sunitynibem i u 5 (6,1%) pacjentów w grupie placebo. U dwóch spośród tych pacjentów przyjmujących placebo wystąpiła zakrzepica żył głębokich, u jednego o nasileniu 2. stopnia, a u drugiego o nasileniu 3. stopnia.
W badaniach rejestracyjnych u pacjentów z GIST, MRCC i pNET nie zgłoszono żadnych przypadków zakończonych zgonem, natomiast obserwowano takie przypadki po wprowadzeniu sunitynibu do obrotu.
Przypadki zatorowości płucnej obserwowano u około 3,1% pacjentów z GIST i u około 1,2% pacjentów z MRCC, którzy otrzymywali sunitynib w badaniach fazy III. Nie zgłoszono przypadków zatorowości płucnej u pacjentów z pNET, którzy otrzymywali sunitynib w ramach badania fazy III. Rzadkie przypadki zakończone zgonem obserwowano w ramach nadzoru po wprowadzeniu sunitynibu do obrotu.
Pacjenci, u których w okresie ostatnich 12 miesięcy stwierdzano zatorowość płucną, byli wyłączeni z badań klinicznych sunitynibu.
U około 17,8% pacjentów z GIST, u około 26,7% pacjentów z MRCC i u 12% pacjentów z pNET, otrzymujących sunitynib w badaniach rejestracyjnych III fazy, zgłoszono zdarzenia płucne (tj. duszność, wysięk opłucnowy, zatorowość płucną lub obrzęk płuc).
Zdarzenia płucne wystąpiły u około 22,2% pacjentów z guzami litymi, w tym z GIST i MRCC, którzy otrzymywali sunitynib w badaniach klinicznych.
Zaburzenia żołądka i jelit
U pacjentów przyjmujących sunitynib z powodu GIST lub MRCC niezbyt często (< 1%) obserwowano zapalenie trzustki. Nie zgłoszono żadnego przypadku zapalenia trzustki związanego z prowadzonym leczeniem w badaniu fazy III dotyczącym pNET (patrz punkt 4.4).
Prowadzące do zgonu krwawienie z przewodu pokarmowego wystąpiło u 0,98% pacjentów otrzymujących placebo w badaniu III fazy dotyczącym GIST.
Zaburzenia wątroby i dróg żółciowych
Zgłaszano zaburzenia czynności wątroby, w postaci nieprawidłowych wyników analiz parametrów czynności wątroby, zapalenia wątroby lub niewydolności wątroby (patrz punkt 4.4).
Zaburzenia skóry i tkanki podskórnej
Zgłaszano przypadki wystąpienia piodermii zgorzelinowej, której objawy zazwyczaj ustępowały po przerwaniu leczenia sunitynibem (patrz także punkt 4.4).
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej
Zgłaszano przypadki miopatii i (lub) rabdomiolizy, niektóre z ostrą niewydolnością nerek. Pacjentów z objawami przedmiotowymi lub podmiotowymi działania toksycznego na mięśnie należy leczyć zgodnie ze standardowymi zasadami postępowania (patrz punkt 4.4).
Zgłaszano przypadki tworzenia się przetok, czasem związane z martwicą i regresją guza nowotworowego, w niektórych przypadkach zakończone zgonem (patrz punkt 4.4).
U pacjentów leczonych sunitynibem zgłaszano przypadki ONJ, przy czym większość z nich wystąpiła u pacjentów, u których stwierdzono znane czynniki ryzyka rozwoju ONJ, zwłaszcza takie jak
przyjmowanie bisfosfonianów drogą dożylną i (lub) choroby stomatologiczne wymagające przeprowadzenia inwazyjnych procedur dentystycznych w wywiadzie (patrz również punkt 4.4).
Badania diagnostyczne
Dane z badań nieklinicznych (in vitro i in vivo), w których stosowano dawki większe niż zalecane
u ludzi, wskazują, że sunitynib może wydłużać proces repolaryzacji potencjału czynnościowego (np. wydłużać odstęp QT).
Wydłużenie odstępu QTc do ponad 500 ms zgłoszono u 0,5%, zaś zmianę jego długości w stosunku do stanu wyjściowego o ponad 60 ms zgłoszono u 1,1% spośród 450 pacjentów z guzami litymi; zmiany obu powyższych parametrów są uznawane za potencjalnie istotne. Wykazano, że sunitynib, w stężeniach w przybliżeniu dwukrotnie większych niż terapeutyczne, wydłuża odstęp QTcF (odstęp QT z korektą Fridericii).
Wydłużenie odstępu QTc oceniano w badaniu 24 pacjentów w wieku od 20 do 87 lat
z zaawansowanymi nowotworami złośliwymi. Wyniki badania wykazały, że sunitynib wpływał na odstęp QTc (określanym jako średnia zmiana skorygowana względem placebo >10 ms, przy czym górna granica 90% przedziału ufności [CI] wynosiła >15 ms) w stężeniu terapeutycznym (dzień 3.)
z zastosowaniem metody korygowania codziennym stanem początkowym oraz po uzyskaniu stężenia większego od terapeutycznego (dzień 9.) z zastosowaniem obu metod korygowania względem stanu początkowego. U żadnego pacjenta nie stwierdzono wartości QTc >500 ms. Mimo zaobserwowanego wpływu na odstęp QTcF w dniu 3. po 24 godzinach po podaniu dawki (tj. po uzyskaniu terapeutycznego stężenia w osoczu oczekiwanego po podaniu zalecanej dawki początkowej 50 mg) z zastosowaniem metody korygowania codziennym stanem początkowym, znaczenie kliniczne tej obserwacji jest nieznane.
Za pomocą dokładnych seryjnych badań EKG, wykonywanych w punktach czasowych odpowiadających ekspozycji terapeutycznej lub większej niż terapeutyczna, u żadnego z pacjentów populacji kwalifikującej się do oceny ani w populacji ITT nie obserwowano wydłużenia odstępu QTc, które byłoby uznane za “ciężkie” (tj. równe lub większe od stopnia 3. wg wersji 3.0 Wspólnych Kryteriów Terminologicznych dla Zdarzeń Niepożądanych [CTCAE]).
Po uzyskaniu stężeń terapeutycznych w osoczu, maksymalna średnia zmiana odstępu QTcF (z korektą Fridericii) w stosunku do stanu wyjściowego wynosiła 9,6 ms (90% CI: 15,1 ms). Po uzyskaniu stężeń około dwukrotnie większych od terapeutycznych, maksymalna zmiana odstępu QTcF w porównaniu ze stanem wyjściowym wyniosła 15,4 ms (90% CI: 22,4 ms). Moksyfloksacyna (400 mg) stosowana jako kontrola pozytywna wykazała maksymalną średnią zmianę odstępu QTcF o 5,6 ms w porównaniu ze stanem wyjściowym. U żadnego z pacjentów nie stwierdzono wydłużenia odstępu QTc o nasileniu większym niż 2. stopnia (CTCAE, wersja 3.0) (patrz punkt 4.4).
Bezpieczeństwo stosowania sunitynibu u pacjentów z MRCC w perspektywie długoterminowej Bezpieczeństwo leczenia sunitynibem pacjentów z MRCC w perspektywie długoterminowej analizowano w 9 ukończonych badaniach klinicznych przeprowadzonych z udziałem 5739 pacjentów opornych na leczenie pierwszego rzutu bewacyzumabem i opornych na cytokiny, spośród których 807 (14%) leczono przez okres do ≥ 2 lat do 6 lat. U 807 pacjentów, którzy otrzymali długoterminowe leczenie sunitynibem, większość działań niepożądanych związanych z leczeniem (TRAE) występowała początkowo w ciągu pierwszych 6 miesięcy - 1 roku, a następnie częstość ich występowania stabilizowała się lub obniżała w czasie, z wyjątkiem niedoczynności tarczycy, której częstość występowania z czasem rosła, a nowe przypadki pojawiały się w ciągu 6 letniego okresu obserwacji. Długotrwałe leczenie sunitynibem nie wiązało się z występowaniem nowych typów TRAE.
Dzieci i młodzież
Profil bezpieczeństwa sunitynibu ustalono na podstawie badania I fazy z eskalacją dawki, otwartego badania II fazy, badania fazy I/II z pojedynczą grupą badaną oraz na podstawie publikacji opisanych poniżej.
Badanie fazy I z eskalacją dawki sunitynibu podawanego doustnie przeprowadzono w grupie 35 pacjentów, obejmującej 30 pacjentów należących do populacji dzieci i młodzieży (w wieku od 3 do 17 lat) i 5 młodych osób dorosłych (w wieku od 18 do 21 lat) z opornymi nowotworami litymi,
w większości przypadków pierwotnymi guzami mózgu. U wszystkich uczestników badania wystąpiły działania niepożądane sunitynibu, w tym działania kardiotoksyczne, przy czym większość z nich miała przebieg ciężki (stopień toksyczności ≥ 3). Do najczęstszych działań niepożądanych sunitynibu należały działania toksyczne na przewód pokarmowy, neutropenia, uczucie zmęczenia i zwiększenie aktywności ALT. Ryzyko wystąpienia działań kardiotoksycznych okazało się większe u dzieci
i młodzieży wcześniej leczonych radioterapią, której zasięg obejmował serce lub antracyklinami niż w tej populacji wiekowej, u której nie stosowano takiego leczenia. U dzieci i młodzieży bez uprzedniej ekspozycji na antracykliny lub napromienianie serca ustalono maksymalną dawkę tolerowaną (MTD) (patrz punkt 5.1).
Otwarte badanie fazy II przeprowadzono w grupie 29 pacjentów, obejmującej 27 pacjentów należących do populacji dzieci i młodzieży (w wieku od 3 do 16 lat) i 2 młode osoby dorosłe (w wieku od 18 do 19 lat) z nawrotem/progresją/opornością glejaka o wysokim stopniu złośliwości lub wyściółczaka. W żadnej z grup nie stwierdzono działań niepożądanych w 5. stopniu nasilenia.
Najczęstszymi (≥10%) związanymi z leczeniem działaniami niepożądanymi były: obniżenie liczby neutrofilów [6 (20,7%) pacjentów] i krwotoki śródczaszkowe [3[(0,3%) pacjentów].
Badanie fazy I/II przeprowadzono z udziałem 6 pacjentów należących do populacji dzieci i młodzieży (w wieku od 13 do 16 lat) z zaawansowanymi nieresekcyjnymi GIST. Do najczęstszych działań niepożądanych sunitynibu należały: biegunka, nudności, obniżenie liczby leukocytów, neutropenia
i bóle głowy. Każde z tych działań, głównie o nasileniu 1. lub 2. stopnia wystąpiło u 3 (50%) pacjentów. U czworga spośród 6 pacjentów (66,7%) wystąpiły związane z leczeniem działania niepożądane o nasileniu stopnia 3.-4. (hipofosfatemia, neutropenia i małopłytkowość 3. stopnia - każde z tych działań u 1 pacjenta - oraz neutropenia 4. stopnia u 1 pacjenta). W tym badaniu nie wystąpiły ciężkie działania niepożądane (SAE) ani działania niepożądane sunitynibu o nasileniu stopnia 5. Zarówno w badaniach klinicznych, jak i w publikacjach profil bezpieczeństwa był zbieżny ze znanym profilem bezpieczeństwa sunitynibu u osób dorosłych.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C, 02-222 Warszawa Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie istnieje swoista odtrutka, którą można by zastosować w przypadku przedawkowania produktu Sunitinib Glenmark, a leczenie przedawkowania powinno polegać na zastosowaniu ogólnego leczenia podtrzymującego. Jeśli jest to wskazane, niewchłoniętą substancję czynną można usunąć poprzez wywołanie wymiotów lub płukanie żołądka. Zgłaszano przypadki przedawkowania; niektóre z nich wiązały się z występowaniem działań niepożądanych zgodnych ze znanym profilem bezpieczeństwa stosowania sunitynibu.
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Grupa farmakoterapeutyczna: Leki przeciwnowotworowe, inhibitory kinazy białkowej, kod ATC: L01EX01
Mechanizm działania
Sunitynib hamuje liczne receptory kinazy tyrozynowej (ang. receptor tyrosine kinase; RTK), które uczestniczą w procesach związanych ze wzrostem nowotworów, neoangiogenezą i powstawaniu przerzutów nowotworu. Ustalono, że sunitynib jest inhibitorem receptorów płytkowego czynnika wzrostu (PDGFRα i PDGFRβ), receptorów czynników wzrostu śródbłonka naczyniowego (VEGFR1, VEGFR2 i VEGFR3), receptorów czynnika komórek pnia (KIT), kinazy tyrozynowej podobnej do Fms-3 (FLT3), receptorów czynnika stymulującego powstawanie kolonii (CSF-1R) i receptorów glejopochodnego czynnika neurotroficznego (RET). W testach biochemicznych i komórkowych główny metabolit sunitynibu wykazuje siłę działania podobną do sunitynibu.
Skuteczność kliniczna i bezpieczeństwo stosowania
Skuteczność kliniczną i bezpieczeństwo stosowania sunitynibu badano podczas leczenia pacjentów
z GIST opornymi na imatynib (tj. pacjentów, u których doszło do progresji choroby w trakcie leczenia imatynibem lub po zakończeniu tego leczenia) lub nietolerujących imatynibu (tj. pacjentów, u których wystąpiły istotne objawy toksyczności w trakcie leczenia imatynibem, które uniemożliwiły dalsze leczenie), leczenia pacjentów z MRCC i leczenia pacjentów z nieoperacyjnymi pNET.
Skuteczność leczenia ustalano na podstawie czasu do wystąpienia progresji nowotworu (ang. time to tumour progression, TTP) oraz wydłużenia czasu przeżycia u pacjentów z nowotworami podścieliskowymi przewodu pokarmowego, na podstawie czasu przeżycia bez progresji choroby (ang. progression free survival, PFS) i wskaźników obiektywnych odpowiedzi (ang. objective response rates, ORR) u pacjentów z rakiem nerkowokomórkowym z przerzutami, którzy dotychczas nie byli leczeni lub u których stwierdzono oporność na cytokiny oraz na podstawie PFS u pacjentów z pNET.
Nowotwory podścieliskowe przewodu pokarmowego
Wstępne badanie otwarte z zastosowaniem zwiększanej dawki zostało przeprowadzone u pacjentów z GIST po niepowodzeniu leczenia imatynibem (mediana maksymalnej dawki dobowej wynosiła
800 mg) ze względu na oporność na leczenie lub nietolerancję leczenia. Do badania zakwalifikowano dziewięćdziesięciu siedmiu pacjentów, otrzymujących różne dawki, według różnych schematów terapii; 55 pacjentów otrzymywało dawkę 50 mg według zalecanego schematu leczenia: 4 tygodnie przyjmowania leku/2 tygodnie przerwy (schemat 4/2).
W badaniu tym mediana TTP wynosiła 34,0 tygodnie (95% CI: 22,0, 46,0).
Przeprowadzono randomizowane, kontrolowane placebo badanie fazy III z zastosowaniem podwójnie ślepej próby, oceniające sunitynib u pacjentów z GIST, którzy nie tolerowali leczenia imatynibem lub u których doszło do progresji choroby w trakcie leczenia imatynibem lub po zakończeniu tego leczenia (mediana maksymalnej dawki dobowej 800 mg). W badaniu tym 312 pacjentów w sposób losowy (w stosunku 2:1) przydzielono do grup otrzymujących odpowiednio sunitynib w dawce 50 mg lub placebo doustnie raz na dobę, według schematu 4/2, do momentu wystąpienia progresji choroby lub wycofania pacjenta z badania z innego powodu (207 pacjentów otrzymywało sunitynib, a 105 pacjentów otrzymywało placebo). Pierwszorzędowym punktem końcowym oceny skuteczności
w badaniu był TTP definiowany jako czas od randomizacji do pierwszego potwierdzenia obiektywnej progresji nowotworu. W chwili przeprowadzenia zaplanowanej z góry analizy okresowej, mediana TTP w grupie leczonej sunitynibem wynosiła 28,9 tygodnia (95% CI: 21,3, 34,1 tygodnia) w ocenie badacza i 27,3 tygodnia (95% CI: 16,0, 32,1 tygodnia) w ocenie niezależnej Komisji Weryfikującej
i była istotnie statystycznie dłuższa niż mediana TTP w grupie placebo, w której wynosiła 5,1 tygodnia (95% CI: 4,4, 10,1) w ocenie badacza i 6,4 tygodnia (95% CI: 4,4,10,0) w ocenie niezależnej Komisji Weryfikującej. Różnica przeżycia całkowitego (OS) statystycznie wskazywała na przewagę sunitynibu [iloraz ryzyka (HR): 0,491; (95% CI: 0,290, 0,831)]; ryzyko zgonu było 2 razy większe u pacjentów z grupy placebo w porównaniu do grupy leczonej sunitynibem.
Po przeprowadzeniu analizy okresowej skuteczności i bezpieczeństwa stosowania, zgodnie
z zaleceniem niezależnej Komisji ds. Monitorowania Danych i Bezpieczeństwa (ang. Data and Safety Monitoring Board; DSMB), badanie zostało odkodowane, a pacjentom z grupy placebo zaproponowano leczenie sunitynibem w otwartej fazie badania.
W fazie otwartej badania sunitynib otrzymało w sumie 255 pacjentów, w tym 99 pacjentów, którzy pierwotnie otrzymywali placebo.
Analizy pierwszo- i drugorzędowych punktów końcowych w fazie otwartej badania potwierdziły wyniki uzyskane w trakcie analizy okresowej, co przedstawiono w Tabeli 2:
Tabela 2. GIST - podsumowanie punktów końcowych oceny skuteczności (populacja ITT)
Leczenie z zastosowaniem metody podwójnie ślepej próbya | |||||
Mediana (95% CI) | Iloraz ryzyka | Grupa pierwotnie otrzymująca placebo leczona sunitynibempo odkodowaniu (cross-over)b | |||
Punkt końcowy | Sunitynib | Placebo | (95% CI) | Wartość p | |
Pierwszorzędowy | |||||
TTP (tygodnie) | |||||
Analiza okresowa | 27,3 (16,0, 32,1) | 6,4 (4,4, 10,0) | 0,329 (0,233, 0,466) | <0,001 | - |
Analiza końcowa | 26,6 (16,0, 32,1) | 6,4 (4,4, 10,0) | 0,339 (0,244, 0,472) | <0,001 | 10,4 (4,3, 22,0) |
Drugorzędowy | |||||
PFS (tygodnie)c | |||||
Analiza okresowa | 24,1 (11,1, 28,3) | 6,0 (4,4, 9,9) | 0,333 (0,238, 0,467) | <0,001 | - |
Analiza końcowa | 22,9 (10,9, 28,0) | 6,0 (4,4, 9,7) | 0,347 (0,253, 0,475) | <0,001 | - |
ORR (%)d | |||||
Analiza okresowa | 6,8 (3,7, 11,1) | 0 (-) | Nd | 0,006 | - |
Analiza końcowa | 6,6 (3,8, 10,5) | 0 (-) | Nd | 0,004 | 10,1 (5,0, 17,8) |
OS (tygodnie)e | |||||
Analiza okresowa | - | - | 0,491 (0,290, 0,831) | 0,007 | - |
Analiza końcowa | 72,7 (61,3, 83,0) | 64,9 (45,7, 96,0) | 0,876 (0,679, 1,129) | 0,306 | - |
Skróty: CI=przedział ufności; ITT=zamiar leczenia; Nd=nie dotyczy; ORR=odsetek odpowiedzi obiektywnych; OS=przeżycie całkowite; PFS=przeżycie wolne od progresji choroby; TTP=czas do progresji guza.
a Wyniki z okresu leczenia w warunkach podwójnie ślepej próby dotyczą populacji ITT i wykorzystują pomiary radiologiczne przeprowadzone centralnie, stosownie do sytuacji.
b Wyniki dotyczące skuteczności leczenia w grupie 99 pacjentów, których po odkodowaniu przestawiono z placebo na sunitynib (cross-over). W momencie zmiany z placebo na sunitynib ponownie wyznaczano wartości wyjściowe, a analizy skuteczności oparto na ocenie badaczy.
c Wartości PFS uzyskane na podstawie analizy okresowej uaktualniono po ponownym przeliczeniu danych oryginalnych.
d Wyniki dotyczące ORR podano jako odsetek pacjentów z potwierdzoną odpowiedzią na leczenie z 95% CI.
e Mediana nieustalona, ponieważ dane nie były jeszcze w pełni gotowe.
Mediana OS w populacji ITT wyniosła 72,7 tygodnia i 64,9 tygodnia (HR: 0,876; 95% CI: 0,679, 1,129; p = 0,306), odpowiednio w grupie leczonej sunitynibem i w grupie placebo. W tej analizie grupa placebo obejmowała pacjentów zrandomizowanych do grupy placebo, którzy w późniejszym czasie otrzymywali sunitynib w ramach otwartej fazy badania.
Rak nerkowokomórkowy z przerzutami (MRCC) u pacjentów, którzy dotychczas nie byli leczeni Przeprowadzono randomizowane, wieloośrodkowe, międzynarodowe badanie III fazy oceniające skuteczność i bezpieczeństwo stosowania sunitynibu w porównaniu z IFN-α u pacjentów z MRCC, którzy dotychczas nie byli leczeni. 750 pacjentów przydzielono losowo, w stosunku 1:1, do dwóch grup terapeutycznych otrzymujących odpowiednio sunitynib w powtarzanych cyklach sześciotygodniowych obejmujących codzienne podawanie sunitynibu doustnie przez 4 tygodnie
w dawce 50 mg, po czym następowały 2 tygodnie przerwy (schemat 4/2), albo IFN-α podawany
w postaci wstrzyknięć podskórnych w dawce 3 miliony jednostek (MU) w pierwszym tygodniu, 6 MU w drugim tygodniu i 9 MU w trzecim tygodniu oraz w następnych tygodniach, w 3 dawkach podawanych co drugi dzień.
Mediana okresu leczenia wynosiła 11,1 miesiąca (zakres: 0,4-46,1) w przypadku leczenia sunitynibem i 4,1 miesiąca (zakres: 0,1-45,6) w przypadku leczenia IFN-α. Ciężkie działania niepożądane związane z leczeniem (TRSAE) zgłaszano u 23,7% pacjentów otrzymujących sunitynib i 6,9% pacjentów otrzymujących IFN-α. Natomiast odsetek pacjentów, którzy przerwali leczenie z powodu działań niepożądanych wyniósł 20% w przypadku sunitynibu i 23% w przypadku IFN-α. Przerwy w leczeniu nastąpiły u 202 pacjentów (54%) przyjmujących sunitynib i 141 pacjentów (39%) przyjmujących IFN- α. Dawkę zmniejszono u 194 pacjentów (52%) leczonych sunitynibem i u 98 pacjentów (27%) leczonych IFN-α. Pacjenci byli leczeni do momentu stwierdzenia progresji choroby lub wycofania
z badania. Pierwszorzędowym punktem końcowym oceny skuteczności był okres przeżycia bez progresji choroby (PFS). W planowanej analizie okresowej z przebiegu badania stwierdzono istotną statystycznie przewagę sunitynibu nad IFN-α w omawianym badaniu. Mediana PFS w grupie leczonej sunitynibem wyniosła 47,3 tygodnia w porównaniu do 22,0 tygodni w grupie leczonej IFN-α.
Współczynnik ryzyka wyniósł 0,415 (95% CI: 0,320, 0,539, p<0,001). Inne punkty końcowe obejmowały odsetek odpowiedzi obiektywnych (ORR), OS i bezpieczeństwo stosowania. Podstawową ocenę radiologiczną przerwano po osiągnięciu pierwszorzędowego punktu końcowego. W ostatecznej analizie ORR w ocenie badaczy wynosił 46% (95% CI: 41%, 51%) w grupie pacjentów stosujących sunitynib i 12,0% (95% CI: 9%, 16%) w grupie pacjentów stosujących IFN-α (p<0,001).
Leczenie sunitynibem wiązało się z dłuższym przeżyciem w porównaniu z IFN-α. Mediana OS wynosiła 114,6 tygodnia w grupie pacjentów stosujących sunitynib (95% CI: 100,1, 142,9) i 94,9 tygodnia w grupie pacjentów stosujących IFN-α (95% CI: 77,7, 117,0) ze współczynnikiem ryzyka wynoszącym 0,821 (95% CI: 0,673, 1,001; p = 0,0510) według niestratyfikowanego testu logarytmicznego rang.
Ogólne wartości PFS i OS, stwierdzone w populacji ITT na podstawie oceny dokonanej przez centralną pracownię radiologiczną, podano w Tabeli 3.
Tabela 3 Podsumowanie punktów końcowych dotyczących skuteczności (populacja ITT) u pacjentów z MRCC, którzy nie otrzymywali wcześniej leczenia
Podsumowanie przeżycia wolnego od progresji choroby | Sunitynib (N = 375) | IFN-α (N = 375) |
Pacjent żyje, bez progresji choroby [n (%) | 161 (42,9) | 176 (46,9) |
U pacjenta stwierdzono progresję choroby lub zgon [n (%)] | 214 (57,1) | 199 (53,1) |
PFS (tygodnie) | ||
Kwartyl (95% CI) | ||
25% | 22,7 (18,0, 34,0) | 10,0 (7,3, 10,3) |
50% | 48,3 (46,4, 58,3) | 22,1 (17,1, 24,0) |
75% | 84,3 (72,9, 95,1) | 58,1 (45,6, 82,1) |
Analiza niestratyfikowana | ||
Iloraz ryzyka (sunitynib w porównaniu do IFN- α) | 0,5268 | |
95% CI dla ilorazu ryzyka | (0,4316, 0,6430) | |
Wartość pa | <0,0001 | |
Podsumowanie przeżycia całkowitego | ||
Nie wiadomo, czy pacjent zmarł [n (%)] | 185 (49,3) | 175 (46,7) |
U pacjenta stwierdzono zgon [n (%)] | 190 (50,7) | 200 (53,3) |
OS (tygodnie) | ||
Kwartyl (95% CI) | ||
25% | 56,6 (48,7, 68,4) | 41,7 (32,6, 51,6) |
50% | 114,6 (100,1, 142,9) | 94,9 (77,7, 117,0) |
75% | Nd (Nd, Nd) | Nd (Nd, Nd) |
Analiza niestratyfikowana | ||
Iloraz ryzyka (sunitynib wobec IFN-α) | 0,8209 | |
95% CI dla ilorazu ryzyka | (0,6730, 1,0013) | |
Wartość pa | 0,0510 | |
Skróty: CI=przedział ufności; INF-α=interferon alfa; ITT=zamiar leczenia; N=liczba pacjentów; Nd=nie dotyczy; OS=przeżycie całkowite; PFS=przeżycie wolne od progresji.
a Na podstawie dwustronnego testu logarytmicznego rang.
Rak nerkowokomórkowy z przerzutami oporny na cytokiny
Badanie II fazy sunitynibu przeprowadzono u pacjentów opornych na wcześniejsze leczenie cytokinami, tzn. interleukiną-2 lub IFN-α. Sześćdziesięciu trzech pacjentów otrzymało dawkę początkową 50 mg sunitynibu doustnie, raz na dobę przez 4 kolejne tygodnie, po czym następował dwutygodniowy okres przerwy, który kończył pełny cykl 6 tygodni (schemat 4/2). Pierwszorzędowym punktem końcowym oceny skuteczności był ORR ustalany na podstawie kryteriów oceny odpowiedzi u pacjentów z guzami litymi (ang. Response Evaluation Criteria in Solid Tumours; RECIST).
W tym badaniu wskaźnik obiektywnych odpowiedzi wynosił 36,5% (95% CI: 24,7%, 49,6%), a mediana czasu do progresji choroby (TTP) wynosiła 37,7 tygodnia (95% CI: 24,0, 46,4).
Przeprowadzono potwierdzające, otwarte, z jedną grupą badawczą, wieloośrodkowe badanie oceniające skuteczność i bezpieczeństwo stosowania sunitynibu u pacjentów z MRCC, którzy byli oporni na uprzednio stosowane leczenie cytokinami. Stu sześciu pacjentów otrzymało co najmniej jedną dawkę 50 mg sunitynibu według schematu 4/2.
Pierwszorzędowym punktem końcowym oceny skuteczności tego badania był ORR. Drugorzędowe punkty końcowe obejmowały TTP, okres utrzymywania się odpowiedzi (DR) i OS.
W tym badaniu wskaźnik ORR wynosił 35,8% (95% CI: 26,8%, 47,5 %). Wartości mediany DR i OS nie zostały jeszcze osiągnięte.
Nowotwory neuroendokrynne trzustki (pNET)
W dodatkowym wieloośrodkowym badaniu otwartym II fazy oceniano skuteczność i bezpieczeństwo stosowania sunitynibu w dawce 50 mg na dobę w monoterapii w schemacie 4/2 u pacjentów
z nieoperacyjnymi pNET. W kohorcie 66 pacjentów z wyspiakiem trzustki, odsetek odpowiedzi na leczenie (pierwszorzędowy punkt końcowy badania) wyniósł 17%.
U pacjentów z nieoperacyjnymi pNET przeprowadzono kluczowe, wieloośrodkowe, międzynarodowe, randomizowane, kontrolowane placebo badanie III fazy z zastosowaniem podwójnie ślepej próby,
w którym oceniano stosowanie sunitynibu w monoterapii.
Pacjentów z udokumentowaną w ostatnich 12 miesiącach progresją choroby ocenianą wg kryteriów RECIST zrandomizowano (w stosunku 1:1) do grupy otrzymującej sunitynib w dawce 37,5 mg raz na dobę w schemacie ciągłym (n = 86) lub do grupy placebo (n = 85).
Pierwszorzędowym celem badania było porównanie PFS u pacjentów otrzymujących sunitynib
i pacjentów otrzymujących placebo. Inne punkty końcowe obejmowały OS, ORR, ocenę wyników leczenia przez pacjenta (PRO) oraz parametry bezpieczeństwa.
Grupa otrzymująca sunitynib i grupa placebo były porównywalne pod względem charakterystyki demograficznej. Ponadto u 49% pacjentów otrzymujących sunitynib w porównaniu do 52% pacjentów z grupy placebo, występowały nowotwory nieczynne hormonalnie, a u 92% pacjentów w obu badanych grupach stwierdzano przerzuty do wątroby.
W badaniu dozwolone było stosowanie analogów somatostatyny.
Łącznie 66% pacjentów otrzymujących sunitynib i 72% pacjentów otrzymujących placebo otrzymało wcześniej leczenie ogólnoustrojowe. Ponadto 24% pacjentów otrzymujących sunitynib i 22% pacjentów z grupy placebo otrzymywało w przeszłości analogi somatostatyny.
Po zastosowaniu sunitynibu stwierdzono klinicznie istotne wydłużenie ocenianego przez badacza PFS w porównaniu z placebo. Mediana PFS wyniosła 11,4 miesiąca w grupie otrzymującej sunitynib, w porównaniu do 5,5 miesiąca w grupie placebo [współczynnik ryzyka: 0,418 (95% CI: 0,263, 0,662), p
= 0,0001]; podobne wyniki uzyskano, kiedy w celu ustalenia progresji choroby zastosowano pochodne oceny odpowiedzi na leczenie oparte na zastosowaniu kryteriów RECIST w pomiarach wielkości guza wykonywanych przez badaczy, co pokazano w Tabeli 4. We wszystkich podgrupach wyróżnionych ze względu na oceniane parametry wyjściowe, w tym liczbę rzutów wcześniejszego leczenia ogólnoustrojowego, stwierdzono współczynnik ryzyka przemawiający na korzyść sunitynibu. Łącznie 29 pacjentów z grupy otrzymującej sunitynib i 24 z grupy placebo nie otrzymało wcześniej żadnego leczenia ogólnoustrojowego; wśród tych pacjentów współczynnik ryzyka dla PFS wyniósł 0,365 (95% CI: 0,156, 0,857), p = 0,0156. Podobnie, wśród 57 pacjentów z grupy otrzymującej sunitynib (w tym 28 pacjentów z jednym rzutem leczenia ogólnoustrojowego w przeszłości i 29 z dwoma lub większą liczbą rzutów leczenia ogólnoustrojowego w przeszłości) oraz wśród 61 pacjentów z grupy placebo
(w tym 25 pacjentów z jednym rzutem leczenia ogólnoustrojowego w przeszłości i 36 z dwoma lub większą liczbą rzutów leczenia ogólnoustrojowego w przeszłości) współczynnik ryzyka dla PFS wyniósł 0,456 (95% CI: 0,264, 0,787), p = 0,0036.
Przeprowadzono analizę czułości PFS w przypadkach, w których progresja choroby stwierdzana była na podstawie zgłaszanych przez badacza wyników pomiaru wielkości guza, i w których dane wszystkich pacjentów cenzurowane z powodów innych niż przerwanie udziału w badaniu były traktowane jako zdarzenia PFS. Analiza umożliwiła konserwatywną ocenę leczenia sunitynibem
i dodatkowo wzmocniła analizę pierwotną, wykazując współczynnik ryzyka wynoszący 0,507 (95% CI: 0,350, 0,733), p = 0,000193. Kluczowe badanie dotyczące pNET przerwano zgodnie z zaleceniem niezależnej Komisji ds. Monitorowania Leków, a ocenę pierwszorzędowego punktu końcowego oparto na ocenie badaczy, oba czynniki mogły wpłynąć na ocenę efektu leczenia.
W celu wykluczenia tendencyjności w ocenie PFS przeprowadzanej przez badacza, przeprowadzono zaślepioną centralną ocenę wyników badań obrazowych (BICR), która potwierdziła oceny przeprowadzone przez badaczy, co pokazano w Tabeli 4.
Tabela 4. Wyniki dotyczące skuteczności leczenia pNET w badaniu III fazy
Parametr skuteczności | Sunitynib (N = 86) | Placebo (N = 85) | Współczynnik ryzyka (95% CI) | Wartość p |
Przeżycie wolne od progresji choroby [mediana, w miesiącach (95% CI)] na podstawie oceny badacza | 11,4 (7,4, 19,8) | 5,5 (3,6, 7,4) | 0,418 (0,263, 0,662) | 0,0001a |
Przeżycia wolne od progresji choroby [mediana, w miesiącach (95% CI)] na podstawie pochodnej oceny odpowiedzi na leczenie opartej na zastosowaniu kryteriów RECIST w pomiarach wielkości guza wykonywanych przez badaczy | 12,6 (7,4, 16,9) | 5,4 (3,5, 6,0) | 0,401 (0,252, 0,640) | 0,000066a |
Przeżycia wolne od progresji choroby [mediana, w miesiącach (95% CI)] na podstawie zaślepionej niezależnej centralnej oceny nowotworu | 12,6 (11,1, 20,6) | 5,8 (3,8, 7,2) | 0,315 (0,181, 0,546) | 0,000015a |
Przeżycie całkowite [5-letnia obserwacja kontrolna [mediana, w miesiącach (95% CI)] | 38,6 (25,6, 56,4) | 29,1 (16,4, 36,8) | 0,730 (0,504, 1,057) | 0,0940a |
Odsetek odpowiedzi obiektywnych [%, (95% CI)] | 9,3 (3,2, 15,4) | 0 | Nd | 0,0066b |
Skróty: CI=przedział ufności; N=liczba pacjentów; Nd=nie dotyczy; pNET=guzy neuroendokrynne trzustki; RECIST=kryteria oceny odpowiedzi w nowotworach litych.
a Dwustronny niestratyfikowany test logarytmiczny rang
b Dokładny test Fishera
Rycina 1. Krzywa Kaplana-Meiera dla PFS w badaniu III fazy dotyczącym pNET
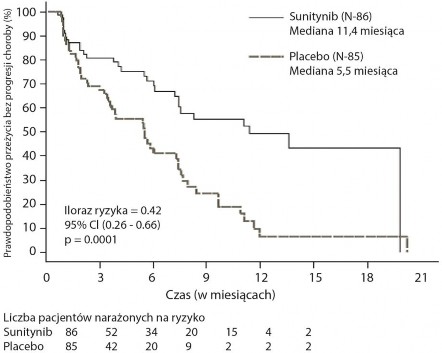
Skróty: CI=przedział ufności; N=liczba pacjentów; PFS=czas przeżycia wolny od progresji; pNET=nowotwory neuroendokrynne trzustki.
W momencie zamknięcia badania nie dysponowano dojrzałymi danymi na temat OS [20,6 miesiąca (95% CI 20,6, NR) w grupie otrzymującej sunitynib w porównaniu do NR (95% CI 15,5, NR)
w grupie otrzymującej placebo, współczynnik ryzyka: 0,409 (95% CI: 0,187, 0,894), p = 0,0204]. Odnotowano 9 zgonów w grupie leczonej sunitynibem i 21 w grupie placebo.
W momencie stwierdzenia progresji choroby dane pacjentów odkodowano i pacjentom, którzy otrzymywali placebo zaproponowano leczenie sunitynibem w oddzielnym, otwartym badaniu będącym przedłużeniem poprzedniego badania. W wyniku przedwczesnego przerwania badania dane pozostałych pacjentów odkodowano, a pacjentom tym zaproponowano leczenie sunitynibem
w otwartym badaniu będącym przedłużeniem poprzedniego badania. Łącznie 59 spośród 85 (69,4%) pacjentów z grupy placebo przeszło do otwartego badania sunitynibu po wystąpieniu progresji choroby lub odkodowaniu podczas zamknięcia badania. OS obserwowane po 5 latach kontroli podczas przedłużenia badania wykazywało współczynnik ryzyka wynoszący 0,730 (95% CI: 0,504, 1,057).
Ocena za pomocą kwestionariusza EORTC QLQ-C30 (European Organization for Research and Treatment of Cancer Quality of Life Questionnaire) wykazała, że ogólna globalna jakość życia związana ze stanem zdrowia oraz pięć domen funkcjonowania (fizyczna, ról społecznych, poznawcza, emocjonalna i społeczna) były utrzymane u pacjentów leczonych sunitynibem w porównaniu z grupą pacjentów otrzymujących placebo przy ograniczonych, objawowych działaniach niepożądanych.
W grupie pacjentów z progresją nieresekcyjnego zaawansowanego/rozsianego nowotworu pNET o wysokim stopniu zróżnicowania przeprowadzono międzynarodowe, wieloośrodkowe badanie
otwarte fazy IV z jedną grupą badaną, oceniające skuteczność i bezpieczeństwo leczenia sunitynibem.
Stu sześciu pacjentów (61 pacjentów w kohorcie dotychczas nieleczonej i 45 pacjentów, dla których badane leczenie było leczeniem kolejnego rzutu) otrzymało sunitynib doustnie w dawce 37,5 mg raz na dobę, w schemacie ciągłym (ang. continuous daily dosing; CDD).
Mediana PFS w ocenie badacza wyniosła 13,2 miesiąca, zarówno w całej populacji (95% CI: 10,9, 16,7), jak i w kohorcie uprzednio nieleczonej (95% CI: 7,4, 16,8).
Dzieci i młodzież
Dane dotyczące stosowania sunitynibu u dzieci i młodzieży są ograniczone (patrz punkt 4.2).
Przeprowadzono badanie I fazy ze zwiększeniem dawki sunitynibu podawanego doustnie w grupie 35 pacjentów, w tym z udziałem 30 pacjentów z populacji dzieci i młodzieży (w wieku od 3 do 17 lat) oraz 5 młodych osób dorosłych (w wieku od 18 do 21 lat) z nowotworami litymi opornymi na leczenie. U większości pacjentów pierwotnie rozpoznano guz mózgu. Kardiotoksyczność ograniczającą wielkość dawki zaobserwowano w pierwszym etapie badania, co wpłynęło na zmianę schematu badania w celu wyłączenia pacjentów z wcześniejszą ekspozycją na terapie potencjalnie kardiotoksyczne (w tym antracykliny) lub radioterapię, której zasięg obejmował serce. W drugim etapie badania, w którym uwzględniono pacjentów wcześniej poddawanych leczeniu przeciwnowotworowemu, jednakże bez czynników ryzyka wystąpienia kardiotoksyczności, sunitynib był ogólnie tolerowany przez pacjentów i możliwy do kontrolowania klinicznie w dawce 15 mg/m2 pc. na dobę według schematu 4/2. U żadnego z pacjentów nie osiągnięto całkowitej ani częściowej odpowiedzi. Stabilizację choroby zaobserwowano u 6 pacjentów (17%). W przypadku jednego pacjenta z nowotworem podścieliskowym przewodu pokarmowego przyjmującego dawkę 15 mg/m2 nie odnotowano korzyści z leczenia. Zaobserwowane działania niepożądane były na ogół podobne do działań niepożądanych występujących u dorosłych pacjentów (patrz punkt 4.8).
Otwarte badanie fazy II przeprowadzono w grupie 29 pacjentów, obejmującej 27 pacjentów należących do populacji dzieci i młodzieży (w wieku od 3 do 16 lat) i 2 młode osoby dorosłe (w wieku od 18 do 19 lat) z HGG lub wyściółczakiem. Badanie zamknięto w momencie zaplanowanej analizy okresowej ze względu na brak opanowania choroby. Mediana PFS wyniosła 2,3 miesiąca w grupie HGG i 2,7 miesiąca w grupie z rozpoznaniem wyściółczaka. Mediana OS wyniosła 5,1 miesiąca
w grupie HGG i 12,3 miesiąca w grupie z rozpoznaniem wyściółczaka. Najczęściej zgłaszanymi (≥10%) związanymi z leczeniem działaniami niepożądanymi u pacjentów z obu grup łącznie były: obniżenie liczby neutrofilów (6 pacjentów [20,7%]) i krwotoki śródczaszkowe (3 pacjentów [10,3%])
(patrz punkt 4.8).
Dane pochodzące z badania fazy I/II z zastosowaniem doustnego sunitynibu, przeprowadzonego u 6 pacjentów z grupy dzieci i młodzieży z GIST w wieku od 13 do 16 lat, którzy otrzymywali sunitynib
według schematu 4/2 w dawkach od 15 mg/m2 pc. na dobę do 30 mg/m2 pc. na dobę oraz dostępne dane opublikowane (20 pacjentów z grupy dzieci i młodzieży lub młodych osób dorosłych z GIST) wskazują, że leczenie sunitynibem powodowało stabilizację choroby u 18 spośród 26 (69,2%) pacjentów, po niepowodzeniu leczenia imatynibem lub nietolerujących tego leczenia (16 pacjentów ze stabilizacją choroby na 21 leczonych) lub leczonych de novo lub po zabiegu operacyjnym (2 pacjentów ze stabilizacją choroby na 5 leczonych). W badaniu fazy I/II stabilizację choroby
i progresję choroby stwierdzono w każdym przypadku u 3 z 6 pacjentów (1 pacjent otrzymał leczenie neoadiuwantowe, a 1 pacjent uzupełniające leczenie imatynibem). W tym samym badaniu u 4 spośród 6 pacjentów (66,7%) wystąpiły związane z leczeniem działania niepożądane o nasileniu stopnia 3.-4. (hipofosfatemia, neutropenia i małopłytkowość 3. stopnia, każde z tych działań u 1 pacjenta oraz neutropenia 4. stopnia u 1 pacjenta). Ponadto w publikacjach zgłaszano następujące działania niepożądane w 3. stopniu nasilenia, które wystąpiły u 5 pacjentów: uczucie zmęczenia (2), działania niepożądane sunitynibu na przewód pokarmowy (w tym biegunka) (2), hematologiczne działania niepożądane sunitynibu (w tym niedokrwistość) (2), zapalenie pęcherzyka żółciowego (1), nadczynność tarczycy (1) i zapalenie błon śluzowych (1).
Przeprowadzono populacyjną analizę farmakokinetyczną (PK) oraz farmakokinetyczno- farmakodynamiczną (PK/PD) w zakresie ekstrapolacji farmakokinetyki oraz głównych punktów końcowych wymaganych do oceny bezpieczeństwa stosowania i skuteczności sunitynibu u dzieci
i młodzieży z GIST (w grupie wiekowej od 6 – 17 lat). Analiza została oparta na danych zebranych
w grupach dorosłych pacjentów z GIST lub guzami litymi oraz w grupach dzieci i młodzieży z guzami litymi. Na podstawie analiz modelowania wydaje się, że młody wiek pacjentów oraz drobniejsza budowa ciała nie wpływają negatywnie na reakcje organizmu w zakresie skuteczności
i bezpieczeństwa ekspozycji osoczowej na sunitynib. Nie stwierdzono negatywnego wpływu młodego wieku lub drobniejszej budowy ciała pacjentów na stosunek korzyści do ryzyka leczenia sunitynibem. Na ten stosunek wpływa głównie ekspozycja osoczowa na sunitynib.
Europejska Agencja Leków (EMA) wstrzymała obowiązek dołączania wyników badań referencyjnego produktu leczniczego zawierającego sunitynib we wszystkich podgrupach populacji dzieci i młodzieży dotyczących leczenia raka nerki lub miedniczki nerkowej (z wyłączeniem nerczaka płodowego, nefroblastomatozy, mięsaka jasnokomórkowego, nerczaka mezoblastycznego, raka rdzeniastego nerki i nowotworu rabdoidalnego nerki) (patrz punkt 4.2).
EMA uchyliła obowiązek dołączania wyników badań referencyjnego produktu leczniczego zawierającego sunitynib we wszystkich podgrupach populacji dzieci i młodzieży w leczeniu nowotworów neuroendokrynnych żołądka, jelit i trzustki (z wyłączeniem nerwiaka zarodkowego, nerwiaka zarodkowego zwojowego i guza chromochłonnego nadnerczy) (patrz punkt 4.2).
Właściwości farmakokinetyczne sunitynibu oceniono w badaniach z udziałem 135 zdrowych ochotników i 266 pacjentów z guzami litymi. Parametry farmakokinetyczne były podobne we wszystkich badanych populacjach pacjentów z guzami litymi i u zdrowych ochotników.
W zakresie dawkowania od 25 do 100 mg pole pod krzywą zależności stężenia leku w osoczu od czasu (AUC) i wartość Cmax rosną proporcjonalnie do dawki. Po podaniu wielokrotnym w ciągu doby, sunitynib ulega kumulacji, przy czym jego stężenie zwiększa się 3-4-krotnie, a stężenie jego podstawowego czynnego metabolitu zwiększa się 7-10-krotnie. Stężenie sunitynibu i jego głównego czynnego metabolitu w stanie równowagi zostaje osiągnięte w ciągu 10 do 14 dni. Do 14. dnia łączne stężenie osoczowe sunitynibu i jego głównego czynnego metabolitu wynosi 62,9-101 ng/ml, co jest docelowym stężeniem przewidywanym na podstawie danych z badań przedklinicznych jako stężenie hamujące fosforylację receptorów in vitro, prowadzącym do zatrzymania i (lub) zmniejszenia wzrostu guzów in vivo. Podstawowy czynny metabolit odpowiada za 23-37% całkowitej ekspozycji na lek. Nie obserwuje się istotnych zmian farmakokinetyki sunitynibu lub jego podstawowego czynnego metabolitu podczas kilkakrotnego podawania sunitynibu w ciągu doby, lub w trakcie powtarzanych cyklów badanych schematów dawkowania.
Wchłanianie
Po podaniu doustnym sunitynibu, maksymalne stężenie (Cmax) stwierdza się na ogół po upływie 6- 12 godzin (tmax).
Pokarm nie wpływa na dostępność biologiczną sunitynibu. Dystrybucja
W badaniach in vitro stopień wiązania się sunitynibu i jego głównego czynnego metabolitu z ludzkimi
białkami osocza wynosił odpowiednio 95% i 90%, niezależnie od stężenia. Pozorna objętość dystrybucji (Vd) sunitynibu była znaczna, 2230 l, co wskazuje na penetrację leku do tkanek.
Interakcje metaboliczne
Obliczone in vitro wartości stałej Ki dla wszystkich badanych izoenzymów cytochromu P450 (CYP) (CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5
i CYP4A9/11) wskazują na to, że sunitynib i jego główny czynny metabolit prawdopodobnie nie przyspieszają w stopniu istotnym klinicznie metabolizmu substancji czynnych metabolizowanych przez te enzymy.
Metabolizm
Sunitynib jest metabolizowany głównie przez izoenzym CYP3A4 cytochromu CYP, który katalizuje reakcję powstawania głównego czynnego metabolitu dezetylosunitynibu, podlegającego dalszemu metabolizmowi katalizowanemu przez ten sam izoenzym.
Należy unikać jednoczesnego podawania sunitynibu z silnymi induktorami lub inhibitorami cytochromu CYP3A4, ponieważ stężenie sunitynibu w osoczu może ulec zmianie (patrz punkty 4.4 i 4.5).
Eliminacja
Wydalanie następuje głównie z kałem (61%), natomiast przez nerki wydalane jest 16% podanej dawki w postaci niezmienionej substancji czynnej i metabolitów. Sunitynib i jego główny czynny metabolit były głównymi substancjami wykrywanymi w osoczu, moczu i kale, odpowiadając odpowiednio za 91,5%, 86,4% i 73,8% radioaktywności w zebranych próbkach. Mniej istotne metabolity zostały zidentyfikowane w moczu i w kale, jednak na ogół nie były wykrywane w osoczu. Całkowity klirens po podaniu doustnym (CL/F) wynosił 34-62 1/h. Po podaniu doustnym zdrowym ochotnikom okres półtrwania w fazie eliminacji sunitynibu i jego głównego czynnego metabolitu dietylowego wynosił odpowiednio około 40-60 godzin i 80-110 godzin.
Jednoczesne podawanie z produktami leczniczymi, które są inhibitorami BCRP
In vitro, sunitynib jest substratem transportera BCRP usuwającego lek z komórki. W badaniu A6181038 jednoczesne podanie gefitynibu, inhibitora BCRP, nie miało istotnego klinicznie wpływu na wartości Cmax i AUC sunitynibu ani łącznie sunitynibu i jego metabolitu (patrz punkt 4.5). Było to wieloośrodkowe otwarte badanie fazy I/II oceniające bezpieczeństwo stosowania i tolerancję maksymalnej dawki tolerowanej oraz działania przeciwnowotworowego sunitynibu w skojarzeniu
z gefitynibem u pacjentów z MRCC. Drugorzędowym celem badania była ocena farmakokinetyki po jednoczesnym podaniu gefitynibu (w dawce 250 mg na dobę) i sunitynibu (w dawce 37,5 mg [kohorta 1, n=4] lub 50 mg [kohorta 2, n=7] na dobę podawanej przez 4 tygodnie, po których następowała 2- tygodniowa przerwa). Zmiany parametrów farmakokinetycznych sunitynibu nie miały znaczenia klinicznego i nie wskazywały na jakiekolwiek interakcje między lekami, jednak, biorąc pod uwagę stosunkowo małą liczbę uczestników badania (tj. N = 7 + 4) oraz umiarkowaną do dużej zmienność międzyosobniczą parametrów farmakokinetycznych, wyniki tego badania farmakokinetycznych interakcji lekowych należy interpretować z zachowaniem ostrożności.
Szczególne grupy pacjentów
Zaburzenia czynności wątroby
Sunitynib i jego główny metabolit są metabolizowane przede wszystkim przez wątrobę. Ekspozycja ogólnoustrojowa po podaniu pojedynczej dawki sunitynibu u pacjentów z łagodnymi lub
umiarkowanymi zaburzeniami czynności wątroby (stopnia A i B według klasyfikacji Childa-Pugha) była podobna jak u pacjentów z prawidłową czynnością wątroby. Nie przeprowadzono badań
z zastosowaniem sunitynibu u pacjentów z ciężkimi zaburzeniami czynności wątroby (stopnia C według klasyfikacji Childa-Pugha).
Z badań u pacjentów z nowotworami wyłączono pacjentów z aktywnością AlAT lub AspAT większą niż 2,5 x górna granica normy, lub o ponad 5,0 x górna granica normy, jeśli wzrost aktywności był wynikiem przerzutów do wątroby.
Zaburzenia czynności nerek
Analizy farmakokinetyki populacyjnej wykazały, że pozorny klirens całkowity sunitynibu (CL/F) nie zależy od klirensu kreatyniny w ocenianym zakresie (42-347 ml/min). Ekspozycja ogólnoustrojowa po podaniu pojedynczej dawki sunitynibu pacjentom z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny <30 ml/min) była podobna jak u pacjentów z prawidłową czynnością nerek (klirens kreatyniny >80 ml/min). Mimo, iż sunitynib i jego główny metabolit nie były eliminowane przez hemodializę u pacjentów z ESRD, całkowita ekspozycja ogólnoustrojowa sunitynibu była mniejsza
o 47% a głównego metabolitu o 31% w porównaniu z pacjentami z prawidłową czynnością nerek.
Masa ciała, sprawność fizyczna
Analiza danych demograficznych pod kątem farmakokinetyki populacyjnej wskazuje, że nie ma konieczności dostosowania dawki początkowej w zależności od masy ciała i stanu sprawności pacjenta ocenianego za pomocą kwestionariusza Eastern Cooperative Oncology Group (ECOG).
Płeć
Dostępne dane wskazują, że kobiety mogą mieć o około 30% mniejszy pozorny klirens (CL/F) sunitynibu w porównaniu do mężczyzn: różnica ta nie wymaga jednak modyfikacji dawki początkowej.
Dzieci i młodzież
Dane dotyczące stosowania sunitynibu u dzieci i młodzieży są ograniczone (patrz punkt 4.2). Analizy farmakokinetyki populacyjnej zbiorczych danych zebranych od dorosłych pacjentów z GIST i guzami litymi oraz od dzieci i młodzieży z guzami litymi zostały zakończone. Przeprowadzono analizy krokowego modelowania zmiennych kowariancji (ang. stepwise covariate modelling analyses) w celu oceny wpływu wieku oraz rozmiaru ciała (całkowitej masy ciała lub powierzchni ciała), jak również innych zmiennych kowariancji na istotne parametry farmakokinetyczne sunitynibu oraz jego czynnego metabolitu. Spośród analizowanych zmiennych kowariancji związanych z wiekiem i rozmiarem ciała, wiek znacząco wpływał na pozorny klirens sunitynibu (im młodszy wiek pacjenta należącego do populacji dzieci i młodzieży, tym mniejszy pozorny klirens). W podobny sposób powierzchnia ciała znacząco wpływała na pozorny klirens czynnego metabolitu (im mniejsza powierzchnia ciała, tym mniejszy pozorny klirens).
Ponadto, opierając się na zintegrowanej analizie farmakokinetyki populacyjnej danych uzyskanych łącznie z 3 badań przeprowadzonych u dzieci i młodzieży (2 badania dotyczące guzów litych i 1 badanie dotyczące GIST); wiek pacjentów: od 6 do 11 i od 12 do 17 lat), wyjściowa wartość pola powierzchni ciała (BSA) była istotną współzmienną dla klirensu pozornego sunitynibu i jego aktywnego metabolitu. Na podstawie tej analizy przewiduje się, że dawka wynosząca około 20 mg/m2 pc. na dobę u pacjentów należących do populacji dzieci i młodzieży o wartościach BSA od 1,10 do 1,87 m2, zapewni ekspozycję osoczową na sunitynib i jego aktywny metabolit porównywalną (między 75 a 125% AUC) z ekspozycją obserwowaną u dorosłych pacjentów z GIST przyjmujących sunitynib w dawce 50 mg na dobę według schematu 4/2 (AUC 1233 ng.h/ml). W badaniach u dzieci i młodzieży dawka początkowa sunitynibu wynosiła 15 mg/m2 pc. (na podstawie wartości MTD ustalonej
w badaniu fazy I z eskalacją dawki leku, patrz punkt 5.1), którą u dzieci i młodzieży z GIST zwiększono do 22,5 mg/m2 pc., a następnie do 30 mg/m2 pc. (nie była większa niż dawka całkowita wynosząca 50 mg na dobę), kierując się bezpieczeństwem stosowania i tolerancją każdego pacjenta. Ponadto, zgodnie z opublikowanymi pracami dotyczącymi dzieci i młodzieży z GIST, obliczona dawka początkowa wynosiła od 16,6 mg/m2 pc. do 36 mg/m2 pc., a następnie była zwiększana nawet do 40,4 mg/m2 pc. (nie była większa niż dawka całkowita wynosząca 50 mg na dobę).
W trwających do 9 miesięcy badaniach toksyczności po podaniu wielokrotnym prowadzonych na szczurach i małpach stwierdzono, że podstawowymi narządami, na które wpływa lek są przewód pokarmowy (wymioty i biegunki u małp); nadnercza (przekrwienie kory i (lub) krwotoki u szczurów i małp, z martwicą i następującym po niej włóknieniem u szczurów); układ limfatyczny
i krwiotwórczy (zmniejszenie liczby komórek szpiku kostnego i zanik tkanki limfoidalnej grasicy, śledziony i węzłów chłonnych), zewnątrzwydzielnicza część trzustki (degranulacja komórek pęcherzykowych z martwicą pojedynczych komórek), ślinianki (przerost gronek), stawy (zgrubienie płytki wzrostu), macica (zanik) i jajniki (zaburzenia rozwoju pęcherzyków). Wszystkie wyniki uzyskano przy istotnych klinicznie stężeniach sunitynibu w osoczu. Dodatkowe działania obserwowane w innych badaniach obejmowały: wydłużenie odstępu QTc, obniżenie LVEF, zanik kanalików jądrowych, rozrost komórek mezangium w nerkach, krwotok z przewodu pokarmowego
i błony śluzowej jamy ustnej oraz przerost komórek płata przedniego przysadki. Uważa się, że zmiany w obrębie macicy (zanik błony śluzowej) i płytki wzrostowej kości (zgrubienie nasad kostnych lub dysplazja chrząstki) są związane z działaniem farmakologicznym sunitynibu. Większość z tych zmian była odwracalna po upływie od 2 do 6 tygodni od zakończenia leczenia.
Genotoksyczność
Potencjalne działanie genotoksyczne sunitynibu oceniano zarówno in vitro i in vivo. Sunitynib nie wykazywał właściwości mutagennych w badaniach na bakteriach z zastosowaniem aktywacji metabolicznej przez wątrobę szczura. Sunitynib nie indukował strukturalnych aberracji chromosomalnych w ludzkich limfocytach krwi obwodowej in vitro. Obserwowano poliploidię (liczbowe aberracje chromosomalne) w ludzkich limfocytach krwi obwodowej in vitro, zarówno po aktywacji metabolicznej, jak i bez niej. Sunitynib nie wykazywał działania klastogennego
w szczurzym szpiku kostnym in vivo. Nie oceniano możliwego działania genotoksycznego jego podstawowego czynnego metabolitu.
Działanie rakotwórcze
W trwającym 1 miesiąc badaniu określającym zakres wielkości dawek dobowych podawanych doustnie (0, 10, 25, 75 lub 200 mg/kg mc. na dobę) w sposób ciągły u myszy transgenicznych rasH2, po zastosowaniu największej badanej dawki (200 mg/kg mc. na dobę) obserwowano raka i rozrost gruczołów Brunnera dwunastnicy.
Trwające 6 miesięcy badanie działania rakotwórczego po podaniu doustnym dawek dobowych (0, 8, 25, 75 [dawka zmniejszona do 50] mg/kg mc. na dobę), przeprowadzono na myszach transgenicznych rasH2. Podczas stosowania dawek ≥25 mg/kg mc. na dobę po 1 miesiącu lub 6 miesiącach leczenia (ekspozycja ≥7,3 razy większa niż AUC u pacjentów otrzymujących zalecaną dawkę dobową [RDD]) obserwowano przypadki raka żołądka i dwunastnicy, zwiększoną częstość występowania złośliwego śródbłoniaka krwionośnego w tle i (lub) hiperplazji błony śluzowej żołądka.
W trwającym 2 lata badaniu rakotwórczości na szczurach (0, 0,33, 1 lub 3 mg/kg mc. na dobę), podawanie sunitynibu w 28-dniowych cyklach, po których następowała 7-dniowa przerwa, powodowało wzrost częstości występowania guzów chromochłonnych i rozrostu rdzenia nadnerczy u samców szczurów po zastosowaniu leku w dawce 3 mg/kg mc. na dobę przez >1 rok (ekspozycja
≥ 7,8 razy większa niż AUC u pacjentów otrzymujących RDD). Rak gruczołów Brunnera
w dwunastnicy wystąpił po dawce ≥1 mg/kg mc. na dobę u samic szczurów i po dawce 3 mg/kg mc. na dobę u samców szczurów, a także stwierdzono wyraźny rozrost komórek błony śluzowej gruczołowej części żołądka po dawce 3 mg/kg mc. na dobę u samców szczurów, co stanowiło odpowiednio ≥0,9, 7,8 i 7,8 razy większą ekspozycję niż AUC u pacjentów otrzymujących RDD. Nie ustalono znaczenia wyników badań na występowanie nowotworów u ludzi, które obserwowano
u myszy transgenicznych rasH2 i szczurów w badaniach działania rakotwórczego sunitynibu.
Toksyczny wpływ na rozród i rozwój potomstwa
W badaniach toksycznego wpływu na rozród szczurów nie stwierdzono wpływu na płodność samców lub samic. Jednak w badaniach toksyczności po podaniu dawek wielokrotnych przeprowadzonych na
szczurach i małpach obserwowano wpływ na płodność samic w postaci atrezji pęcherzyków, zwyrodnienia ciałek żółtych, zmian błony śluzowej macicy oraz zmniejszenia masy macicy i jajników po klinicznie istotnej ekspozycji ogólnoustrojowej. U szczurów obserwowano wpływ na płodność samców w postaci zaniku kanalików jąder, zmniejszenia liczby plemników w najądrzach
i zmniejszenia ilości koloidu w obrębie gruczołu krokowego i pęcherzyków nasiennych po ekspozycji osoczowej 25 razy większej niż ekspozycja ogólnoustrojowa u ludzi.
U szczurów śmiertelność zarodków i płodów przejawiała się istotnym zmniejszeniem liczby żywych płodów, zwiększoną liczbą resorpcji, wzrostem liczby utrat ciąży po zagnieżdżeniu zarodka
i całkowitą utratą miotów u 8 z 28 samic ciężarnych po ekspozycji w osoczu 5,5 razy większej niż ekspozycja ogólnoustrojowa u ludzi. U królików zmniejszenie masy macicy samic ciężarnych i liczby żywych płodów była związana ze zwiększeniem liczby resorpcji, wzrostem liczby utrat ciąży po zagnieżdżeniu zarodka i całkowitą utratą miotów u 4 z 6 samic ciężarnych po ekspozycji w osoczu
3 razy większej niż ekspozycja ogólnoustrojowa u ludzi. Stosowanie sunitynibu u szczurów w okresie organogenezy w dawce ≥5 mg/kg mc. na dobę powodowało zmiany rozwojowe, polegające na zwiększonej częstości występowania wad rozwojowych szkieletu płodu, charakteryzujących się przede wszystkim opóźnieniem kostnienia kręgów piersiowych i (lub) lędźwiowych, obserwowanych po ekspozycji w osoczu 5,5 razy większej niż ekspozycja ogólnoustrojowa u ludzi. U królików wpływ na rozwój polegał na zwiększeniu częstości występowania rozszczepu wargi po ekspozycji w osoczu w przybliżeniu odpowiadającej ekspozycji obserwowanej w warunkach klinicznych u ludzi oraz rozszczepu wargi i rozszczepu podniebienia po ekspozycji w osoczu 2,7 razy większej niż ekspozycja ogólnoustrojowa u ludzi.
Sunitynib (0,3, 1,0 lub 3,0 mg/kg mc. na dobę) był oceniany w badaniu pre- i postnatalnego rozwoju potomstwa u szczurów. Po zastosowaniu dawki ≥1 mg/kg mc. na dobę przyrost masy ciała matki podczas ciąży i laktacji był mniejszy, ale nie obserwowano toksycznego wpływu na rozród do dawki 3 mg/kg mc. na dobę (szacowana ekspozycja ≥2,3 razy większa niż AUC u pacjentów otrzymujących RDD). Po dawce 3 mg/kg mc. na dobę obserwowano zmniejszenie masy ciała potomstwa w okresie przed odstawieniem od piersi i po odstawieniu od piersi. Nie obserwowano toksycznego wpływu na rozwój po dawce 1 mg/kg mc. na dobę (przybliżona ekspozycja ≥0,9 razy większa niż AUC
u pacjentów otrzymujących RDD).
Zawartość kapsułki Celuloza mikrokrystaliczna Mannitol
Kroskarmeloza sodowa Powidon K30 Magnezu stearynian
Sunitinib Glenmark, 12,5 mg, kapsułki, twarde
Osłonka kapsułki
Żelaza tlenek czerwony (E 172) Tytanu dwutlenek (E 171) Żelatyna
Tusz biały
Szelak
Tytanu dwutlenek (E 171) Glikol propylenowy
Sunitinib Stada, 25 mg, kapsułki, twarde
Osłonka kapsułki
Żelaza tlenek czarny (E 172) Żelaza tlenek czerwony (E 172) Żelaza tlenek żółty (E 172) Tytanu dwutlenek (E 171) Żelatyna
Tusz biały
Szelak
Tytanu dwutlenek (E 171) Glikol propylenowy
Sunitinib Stada, 50 mg, kapsułki, twarde
Osłonka kapsułki
Żelaza tlenek czarny (E 172) Żelaza tlenek czerwony (E 172) Żelaza tlenek żółty (E 172) Tytanu dwutlenek (E 171) Żelatyna
Tusz biały
Szelak
Tytanu dwutlenek (E 171) Glikol propylenowy
Nie dotyczy.
3 lata.
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Tekturowe pudełko z blistrami jednodawkowymi, perforowane z folii Aluminium/OPA/Aluminium/PVC zawierającymi blistry po 28 x 1 lub 30 x 1 kapsułek twardych. Butelka z HDPE z zakrętką z PP, zabezpieczającą przed dostępem dzieci w tekturowym pudełku zawierającym 30 kapsułek twardych.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Glenmark Pharmaceuticals s.r.o.
Hvězdova 1716/2B 140 78 Praga 4 Republika Czeska
Sunitinib Glenmark, 12,5 mg: 26494
Sunitinib Glenmark, 25 mg: 26495
Sunitinib Glenmark, 50 mg: 26496
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 02.07.2021
06.01.2022











