Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
lek przeciwhistaminowy (5 mg dekschlorfenyraminy lub 25 mg difenhydraminy albo lek o równoważnej sile działania),
kortykosteroid (8 mg deksametazonu albo lek o równoważnej sile działania), oraz
antagonista receptora H2 (ranitydyna albo lek o równoważnej sile działania) (patrz punkt 4.4).
Przeciwwskazania
Nadwrażliwość na kabazytaksel, inne taksany, na polisorbat 80 lub na którąkolwiek substancję pomocniczą produktu wymienioną w punkcie 6.1.
Liczba neutrofilów poniżej 1500/mm3.
Ciężkie zaburzenia czynności wątroby (stężenie bilirubiny całkowitej >3 x GGN).
Jednoczesne podanie szczepionki przeciwko żółtej gorączce (patrz punkt 4.5).
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Działania niepożądane wszystkich stopni występujące z częstością większą niż 10%
Działania niepożądane stopnia ≥ 3 występujące z częstością większą niż 5%
Na podstawie wyników badań laboratoryjnych
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Cabazitaxel G.L., 20 mg/ml, koncentrat do sporządzania roztworu do infuzji.
Jeden ml koncentratu do sporządzania roztworu do infuzji zawiera 20 mg kabazytakselu.
Każda fiolka zawierająca 3 ml koncentratu do sporządzania roztworu do infuzji zawiera 60 mg kabazytakselu.
Substancja pomocnicza o znanym działaniu
Każdy ml koncentratu do sporządzania roztworu do infuzji zawiera 395 mg etanolu.
Każda fiolka zawierająca 3 ml koncentratu do sporządzania roztworu do infuzji zawiera 1185 mg etanolu (39,5% v/v).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Koncentrat do sporządzania roztworu do infuzji (jałowy koncentrat)
Koncentrat jest przejrzystym, oleistym roztworem o barwie żółtej do brązowożółtej.
Produkt leczniczy Cabazitaxel G.L. w skojarzeniu z prednizonem lub prednizolonem jest wskazany do leczenia pacjentów dorosłych z opornym na kastrację rakiem gruczołu krokowego z przerzutami, leczonych wcześniej schematem chemioterapii zawierającym docetaksel (patrz punkt 5.1).
Produkt leczniczy Cabazitaxel G.L. należy stosować wyłącznie w oddziałach wyspecjalizowanych w podawaniu leków cytotoksycznych i należy go podawać tylko pod kontrolą lekarza mającego odpowiednie kwalifikacje do stosowania chemioterapii przeciwnowotworowej. Produkt leczniczy można podawać jedynie w przypadku dysponowania odpowiednimi pomieszczeniami i wyposażeniem zapewniającym możliwość leczenia ciężkich reakcji nadwrażliwości, takich jak niedociśnienie i skurcz oskrzeli (patrz punkt 4.4).
Premedykacja
W celu zmniejszenia ryzyka wystąpienia i nasilenia reakcji nadwrażliwości, zalecany schemat premedykacji powinien być wykonany przynajmniej 30 minut przed każdym podaniem produktu leczniczego Cabazitaxel G.L. poprzez dożylne podanie następujących produktów leczniczych:
Zaleca się stosować profilaktycznie leki przeciwwymiotne, które można podawać doustnie lub dożylnie, w zależności od potrzeby.
Podczas leczenia należy zapewnić odpowiednie nawodnienie pacjenta, aby zapobiec powikłaniom, takim jak niewydolność nerek.
Dawkowanie
Zalecana dawka produktu leczniczego Cabazitaxel G.L. wynosi 25 mg/m2 pc., podawana w 1-godzinnej infuzji dożylnej co 3 tygodnie, w skojarzeniu z doustnym prednizonem lub prednizolonem w dawce 10 mg, podawanym codziennie podczas leczenia.
Dostosowanie dawki
Dawkę należy zmodyfikować, jeśli u pacjentów pojawią się następujące działania niepożądane [stopnie odnoszą się do klasyfikacji zdarzeń niepożądanych wg Common Terminology Criteria for Adverse Events (CTCAE 4.0)]:
Tabela 1 - Zalecana modyfikacja dawki w przypadku wystąpienia działań niepożądanych u pacjentów otrzymujących kabazytaksel
Działania niepożądane | Modyfikacja dawki |
Długotrwała (powyżej 1 tygodnia) neutropenia stopnia ≥3. pomimo zastosowania odpowiedniego leczenia, w tym G-CSF | Leczenie należy odroczyć do czasu osiągnięcia liczby neutrofilów >1500 komórek/mm3, a następnie zmniejszyć dawkę kabazytakselu z 25 mg/m2 pc. do 20 mg/m2 pc. |
Gorączka neutropeniczna lub zakażenie w przebiegu neutropenii | Leczenie należy odroczyć do czasu poprawy bądź ustąpienia objawów oraz osiągnięcia liczby neutrofilów >1500 komórek/mm3, a następnie zmniejszyć dawkę kabazytakselu z 25 mg/m2 pc. do 20 mg/m2 pc. |
Biegunka stopnia ≥3. albo biegunka utrzymująca się pomimo zastosowania odpowiedniego leczenia, w tym uzupełnienia niedoborów płynu i elektrolitów | Leczenie należy odroczyć do czasu poprawy bądź ustąpienia objawów, a następnie zmniejszyć dawkę kabazytakselu z 25 mg/m2 pc. do 20 mg/m2 pc. |
Obwodowa neuropatia stopnia ≥2. | Leczenie należy odroczyć do czasu poprawy, a następnie zmniejszyć dawkę kabazytakselu z 25 mg/m2 pc. do 20 mg/m2 pc. |
Jeśli u pacjentów nadal występują którekolwiek z opisanych działań niepożądanych po zastosowaniu dawki 20 mg/m2 pc., należy rozważyć dalsze zmniejszenie dawki do 15 mg/m2pc. lub przerwanie leczenia produktem leczniczym Cabazitaxel G.L. Dane dotyczące pacjentów stosujących dawkę mniejszą niż 20 mg/m2 pc. są ograniczone.
Specjalne grupy pacjentów
Pacjenci z zaburzeniami czynności wątroby
Kabazytaksel jest intensywnie metabolizowany w wątrobie. U pacjentów z łagodnymi zaburzeniami czynności wątroby (stężenie bilirubiny całkowitej od >1 do ≤ 1,5 x górna granica normy (GGN) lub aminotransferazy asparaginianowej AspAT >1,5 x GGN), należy zmniejszyć dawkę kabazytakselu do 20 mg/m2 pc. U pacjentów z łagodnymi zaburzeniami czynności wątroby należy zachować ostrożność i dokładnie monitorować bezpieczeństwo stosowania podczas podawania kabazytakselu.
U pacjentów z umiarkowanymi zaburzeniami czynności wątroby (stężenie bilirubiny całkowitej od
>1,5 do ≤ 3 x GGN), maksymalna tolerowana dawka to 15 mg/m2 pc. W przypadku leczenia u pacjentów z umiarkowanymi zaburzeniami czynności wątroby dawka kabazytakselu nie powinna być
większa niż 15 mg/m2 pc. Dane dotyczące skuteczności leczenia z zastosowaniem tej dawki są ograniczone.
Nie należy podawać kabazytakselu pacjentom z ciężkimi zaburzeniami czynności wątroby (stężenie bilirubiny całkowitej >3 x GGN) (patrz punkty 4.3, 4.4 i 5.2).
Pacjenci z zaburzeniami czynności nerek
Kabazytaksel jest w minimalnym stopniu wydalany przez nerki. Nie ma konieczności dostosowania dawki u pacjentów z zaburzeniami czynności nerek, niewymagających hemodializy. U pacjentów ze schyłkową niewydolnością nerek (klirens kreatyniny (CLCR<15 ml/min/1,73 m2) ze względu na ich stan oraz ograniczone dane, należy zachować ostrożność podczas leczenia i uważnie ich monitorować w trakcie leczenia (patrz punkty 4.4 i 5.2).
Pacjenci w podeszłym wieku
Nie ma specjalnych zaleceń dotyczących dostosowania dawki kabazytakselu u pacjentów w podeszłym wieku (patrz również punkty 4.4, 4.8 i 5.2).
Jednoczesne stosowanie innych produktów leczniczych
Należy unikać jednoczesnego stosowania produktów leczniczych będących silnymi induktorami lub silnymi inhibitorami CYP3A. Jednak, jeśli pacjent wymaga jednoczesnego przyjmowania silnego inhibitora CYP3A, należy rozważyć zmniejszenie dawki kabazytakselu o 25% (patrz punkty 4.4 i 4.5).
Dzieci i młodzież
Produkt leczniczy Cabazitaxel G.L. nie ma odpowiedniego zastosowania u dzieci i młodzieży. Nie określono dotychczas bezpieczeństwa stosowania i skuteczności produktu leczniczego Cabazitaxel G.L. u dzieci i młodzieży w wieku poniżej 18 lat (patrz punkt 5.1).
Sposób podawania
Kabazytaksel jest przeznaczony do podawania dożylnego.
Instrukcja dotycząca przygotowania i podania produktu leczniczego, patrz punkt 6.6.
Nie należy używać worków infuzyjnych wykonanych z PVC i poliuretanowych zestawów do infuzji. Produktu leczniczego Cabazitaxel G.L. nie wolno mieszać z innymi produktami leczniczymi oprócz wymienionych w punkcie 6.6.
Reakcje nadwrażliwości
Wszyscy pacjenci powinni otrzymać premedykację przed rozpoczęciem wlewu kabazytakselu (patrz punkt 4.2).
Należy uważnie obserwować pacjentów w kierunku wystąpienia reakcji nadwrażliwości, zwłaszcza podczas pierwszego i drugiego wlewu dożylnego. Ponieważ reakcje nadwrażliwości mogą wystąpić w ciągu kilku minut po rozpoczęciu infuzji dożylnej kabazytakselu, należy zabezpieczyć dostępność pomieszczeń i wyposażenia niezbędnego do leczenia niedociśnienia i skurczu oskrzeli. Mogą wystąpić ciężkie reakcje nadwrażliwości, które mogą obejmować uogólnioną wysypkę i (lub) rumień, niedociśnienie i skurcz oskrzeli. Ciężkie reakcje nadwrażliwości wymagają natychmiastowego przerwania infuzji kabazytakselu i wdrożenia odpowiedniego leczenia. Należy przerwać stosowanie produktu leczniczego Cabazitaxel G.L. u pacjentów, u których wystąpi reakcja nadwrażliwości (patrz punkt 4.3).
Zahamowanie czynności szpiku kostnego
Podczas stosowania produktu leczniczego może wystąpić zahamowanie czynności szpiku kostnego objawiające się neutropenią, niedokrwistością, małopłytkowością lub pancytopenią (patrz poniżej
„Ryzyko neutropenii” i „Niedokrwistość” w punkcie 4.4).
Ryzyko neutropenii
Pacjenci leczeni kabazytakselem mogą profilaktycznie otrzymywać G-CSF, zgodnie z zaleceniami Amerykańskiego Stowarzyszenia Onkologii Klinicznej (ang. American Society of Clinical Oncology, ASCO) i (lub) aktualnymi wytycznymi ośrodka prowadzącego leczenie, w celu zmniejszenia ryzyka lub opanowania powikłań neutropenii (gorączka neutropeniczna, przedłużona neutropenia lub zakażenie w przebiegu neutropenii). Pierwotną profilaktykę przy użyciu G-CSF należy rozważyć u pacjentów z cechami klinicznymi wysokiego ryzyka (wiek >65 lat, zły stan czynnościowy, wcześniejsze epizody gorączki neutropenicznej, rozległe obszary ciała poddane wcześniej napromienianiu, zły stan odżywienia lub inne ciężkie choroby współistniejące), które predysponują do zwiększenia powikłań wynikających z przedłużonej neutropenii. Wykazano, że zastosowanie G-CSF ogranicza częstość występowania i stopień ciężkości neutropenii.
Neutropenia jest najczęstszym działaniem niepożądanym występującym po zastosowaniu kabazytakselu (patrz punkt 4.8). Niezbędne jest wykonywanie badań pełnej morfologii krwi, co tydzień podczas 1. cyklu leczenia oraz przed każdym kolejnym cyklem tak, aby w razie potrzeby można było dostosować dawkę.
Należy zmniejszyć dawkę w przypadku wystąpienia gorączki neutropenicznej lub przedłużającej się neutropenii, pomimo zastosowania odpowiedniego leczenia (patrz punkt 4.2).
Ponowne leczenie pacjentów można rozpocząć jedynie w przypadku, gdy liczba neutrofilów powróci do poziomu ≥1500/mm3 (patrz punkt 4.3).
Zaburzenia żołądka i jelit
Objawy takie jak ból i tkliwość brzucha, gorączka, uporczywe zaparcie, biegunka z towarzyszącą neutropenią lub bez mogą być wczesnymi objawami ciężkiej toksyczności układu pokarmowego, którą należy niezwłocznie ocenić oraz leczyć. Może zajść konieczność odroczenia lub zaprzestania leczenia kabazytakselem.
Ryzyko nudności, wymiotów, biegunki i odwodnienia
Jeśli u pacjentów wystąpi biegunka po podaniu kabazytakselu, można ich leczyć powszechnie stosowanymi lekami przeciwbiegunkowymi. Należy podjąć odpowiednie czynności w celu przywrócenia stanu nawodnienia pacjentów. Biegunka może występować częściej u pacjentów, którzy uprzednio poddani byli napromienianiu okolicy brzucha i miednicy. Odwodnienie dotyczy częściej pacjentów w wieku 65 lat i starszych. Należy podjąć odpowiednie kroki w celu ponownego nawodnienia pacjentów oraz monitorowania i skorygowania stężenia elektrolitów w surowicy krwi, szczególnie potasu. W przypadku biegunki stopnia ≥3. może być konieczne odroczenie leczenia albo zmniejszenie dawki kabazytakselu (patrz punkt 4.2). Jeśli u pacjentów wystąpią nudności lub wymioty, można ich leczyć powszechnie stosowanymi lekami przeciwwymiotnymi.
Ryzyko ciężkich zaburzeń żołądka i jelit
U pacjentów leczonych kabazytakselem zgłaszano krwotok z przewodu pokarmowego oraz perforację przewodu pokarmowego, niedrożność porażenną jelit, zapalenie jelita grubego, w tym zakończone zgonem (patrz punkt 4.8). Zaleca się zachowanie ostrożności podczas leczenia pacjentów najbardziej zagrożonych wystąpieniem powikłań ze strony przewodu pokarmowego: u pacjentów z neutropenią, w podeszłym wieku, stosujących jednocześnie niesteroidowe leki przeciwzapalne, leczenie przeciwpłytkowe, leczenie przeciwzakrzepowe, u pacjentów z uprzednią radioterapią miednicy lub u pacjentów z chorobą przewodu pokarmowego taką jak owrzodzenie i krwawienie z przewodu pokarmowego.
Neuropatia obwodowa
U pacjentów otrzymujących kabazytaksel obserwowano przypadki neuropatii obwodowej, obwodowej neuropatii czuciowej (np. parestezje, dyzestezje) i obwodowej neuropatii ruchowej. Pacjentów
leczonych kabazytakselem należy pouczyć o konieczności poinformowania lekarza przed kontynuowaniem leczenia o wystąpieniu objawów neuropatii, takich jak ból, pieczenie, mrowienie, drętwienie lub osłabienie. Lekarz powinien ocenić obecność lub pogorszenie neuropatii przed każdym leczeniem. Leczenie należy odroczyć do czasu poprawy objawów. Należy zmniejszyć dawkę kabazytakselu z 25 mg/m2 pc. do 20 mg/m2 pc. w przypadku utrzymującej się neuropatii obwodowej stopnia ≥2. (patrz punkt 4.2).
Niedokrwistość
Obserwowano występowanie niedokrwistości u pacjentów przyjmujących kabazytaksel (patrz punkt 4.8). Należy skontrolować wartość hemoglobiny i hematokrytu przed rozpoczęciem stosowania kabazytakselu oraz u pacjentów z objawami przedmiotowymi i podmiotowymi niedokrwistości lub utraty krwi. Należy zachować ostrożność u pacjentów ze stężeniem hemoglobiny <10 g/dl i zastosować odpowiednie środki wynikające ze wskazań klinicznych.
Ryzyko niewydolności nerek
Opisywano zaburzenia czynności nerek w połączeniu z sepsą, ciężkim odwodnieniem spowodowanym biegunką, wymiotami oraz zaporową uropatią. Odnotowano niewydolność nerek, w tym przypadki zgonów. Jeśli powyższe objawy wystąpią, należy podjąć odpowiednie środki w celu określenia ich przyczyny oraz intensywnie leczyć pacjentów.
Podczas stosowania kabazytakselu należy zapewnić odpowiednie nawodnienie pacjentów. Pacjentów należy pouczyć o konieczności natychmiastowego zgłaszania lekarzowi każdej znaczącej zmiany objętości moczu wydalanego w ciągu doby. Należy oznaczyć stężenie kreatyniny w surowicy przed rozpoczęciem leczenia, podczas wszystkich badań morfologii krwi oraz każdorazowo w przypadku zgłoszenia przez pacjenta zmiany objętości moczu. Należy przerwać stosowanie kabazytakselu w przypadku wystąpienia niewydolności nerek stopnia ≥3. wg CTCAE 4.0.
Zaburzenia układu oddechowego
Podczas stosowania produktu leczniczego zgłaszano przypadki występowania śródmiąższowego nieinfekcyjnego zapalenia płuc i (lub) zapalenia płuc oraz śródmiąższowych chorób płuc, które czasem kończyły się zgonem (patrz punkt 4.8).
Jeżeli u pacjenta wystąpią lub nasilą się objawy niepożądane ze strony płuc, należy uważnie monitorować stan pacjenta, a w razie konieczności niezwłocznie przeprowadzić odpowiednie badania i podjąć leczenie. Zalecane jest zaprzestanie leczenia kabazytakselem do czasu postawienia rozpoznania. Wczesne rozpoczęcie leczenia wspomagającego może przynieść poprawę stanu pacjenta. Należy staranie rozważyć korzyści wynikające z wznowienia leczenia kabazytakselem.
Ryzyko zaburzeń rytmu serca
Odnotowano zaburzenia rytmu serca, najczęściej tachykardię i migotanie przedsionków (patrz punkt 4.8).
Osoby w podeszłym wieku
Osoby w podeszłym wieku (≥65 lat) są zazwyczaj narażone na zwiększone ryzyko pewnych działań niepożądanych, w tym neutropenii i gorączki neutropenicznej (patrz punkt 4.8).
Pacjenci z zaburzeniami czynności wątroby
Stosowanie produktu Cabazitaxel G.L. jest przeciwwskazane u pacjentów z ciężkimi zaburzeniami czynności wątroby (stężenie bilirubiny całkowitej >3 x GGN) (patrz punkty 4.3 i 5.2).
Należy zmniejszyć dawkę u pacjentów z łagodnymi zaburzeniami czynności wątroby (stężenie bilirubiny całkowitej >1 do ≤1,5 x GGN lub AspAT >1,5 x GGN) (patrz punkty 4.2 i 5.2).
Interakcje
Należy unikać jednoczesnego stosowania silnych inhibitorów CYP3A, ponieważ mogą zwiększać stężenie kabazytakselu w osoczu (patrz punkty 4.2 i 4.5). Jeśli nie można uniknąć jednoczesnego stosowania z silnym inhibitorem CYP3A, należy rozważyć uważne monitorowanie w celu wykrycia toksyczności oraz zmniejszenie dawki kabazytakselu (patrz punkty 4.2 i 4.5).
Należy unikać jednoczesnego stosowania silnych induktorów CYP3A4, ponieważ mogą zmniejszać stężenie kabazytakselu w osoczu (patrz punkty 4.2 i 4.5).
Substancje pomocnicze
Ten produkt leczniczy zawiera 50% obj. etanol (alkohol) tj. do 1185 mg (1,5 ml) na fiolkę, co jest równoważne 30 ml piwa lub 12 ml wina.
Produkt szkodliwy dla osób z chorobą alkoholową.
Należy wziąć pod uwagę w przypadku kobiet w ciąży lub karmiących piersią, dzieci i grup wysokiego ryzyka, takich jak pacjenci z chorobami wątroby lub padaczką.
Badania in vitro wykazały, że kabazytaksel jest metabolizowany głównie za pośrednictwem CYP3A (80% do 90%) (patrz punkt 5.2).
Inhibitory CYP3A
Wielokrotne przyjmowanie ketokonazolu (400 mg raz na dobę), który jest silnym inhibitorem CYP3A prowadziło do zmniejszenia klirensu kabazytakselu o 20%, co odpowiada zwiększeniu AUC o 25%. Dlatego, z uwagi na możliwość zwiększenia stężenia kabazytakselu w osoczu, należy unikać jednoczesnego stosowania silnych inhibitorów CYP3A (np. ketokonazol, itrakonazol, klarytromycyna, indynawir, nefazodon, nelfinawir, rytonawir, sakwinawir, telitromycyna, worykonazol) (patrz punkty 4.2 i 4.4).
Jednoczesne stosowanie aprepitantu, umiarkowanego inhibitora CYP3A nie miało wpływu na klirens kabazytakselu.
Induktory CYP3A
Wielokrotne przyjmowanie ryfampicyny (600 mg raz na dobę), która jest silnym induktorem CYP3A prowadziło do zwiększenia klirensu kabazytakselu o 21%, co odpowiada zmniejszeniu AUC o 17%. Dlatego, z uwagi na możliwość zmniejszenia stężenia kabazytakselu w osoczu należy unikać jednoczesnego stosowania silnych induktorów CYP3A (np. fenytoina, karbamazepina, ryfampicyna, ryfabutyna, ryfapentyna, fenobarbital) (patrz punkty 4.2 i 4.4). Ponadto, pacjenci nie powinni przyjmować produktów zawierających ziele dziurawca zwyczajnego.
OATP1B1
Wykazano również, że w warunkach in vitro kabazytaksel hamuje białka transportowe z grupy polipeptydów transportujących aniony organiczne OATP1B1. Ryzyko interakcji z substratami OATP1B1 (np. statyny, walsartan, repaglinid) jest możliwe, zwłaszcza w czasie trwania infuzji
(1 godzina) i aż do 20 minut po zakończeniu infuzji. Zalecany jest 12-godzinny odstęp czasu przed infuzją i przynajmniej 3-godzinny po zakończeniu infuzji przed podaniem substratu OATP1B1.
Szczepienia
Stosowanie żywych lub żywych atenuowanych szczepionek, u pacjentów z obniżoną odpornością na skutek podawania chemioterapii, może prowadzić do ciężkich lub śmiertelnych zakażeń. Należy unikać szczepienia za pomocą żywej atenuowanej szczepionki u pacjentów otrzymujących kabazytaksel. Można stosować martwe lub inaktywowane szczepionki, ale reakcja na takie szczepionki może być osłabiona.
Ciąża
Brak danych dotyczących stosowania kabazytakselu u kobiet w okresie ciąży. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję po zastosowaniu dawek toksycznych dla ciężarnych samic (patrz punkt 5.3) oraz przenikanie kabazytakselu przez barierę łożyskową (patrz punkt 5.3). Podobnie
jak inne cytotoksyczne produkty lecznicze, kabazytaksel może powodować uszkodzenie płodu u narażonych ciężarnych kobiet.
Kabazytaksel nie powinien być stosowany w okresie ciąży oraz u kobiet w wieku rozrodczym niestosujących skutecznej metody antykoncepcji.
Karmienie piersią
Dostępne dane dotyczące farmakokinetyki u zwierząt wykazały przenikanie kabazytakselu i jego metabolitów do mleka samic (patrz punkt 5.3). Nie można wykluczyć zagrożenia dla karmionego dziecka. Nie należy stosować kabazytakselu podczas karmienia piersią.
Płodność
Badania na zwierzętach wykazały wpływ kabazytakselu na układ rozrodczy samców szczurów i psów, bez żadnego oddziaływania funkcjonalnego na płodność (patrz punkt 5.3). Biorąc jednak pod uwagę właściwości farmakologiczne taksanów, ich potencjał genotoksyczny i wpływ kilku związków z tej grupy na płodność w badaniach na zwierzętach, nie można wykluczyć wpływu kabazytakselu na płodność u mężczyzn.
Ze względu na potencjalny wpływ kabazytakselu na gamety męskie i możliwość wpływu na organizm za pośrednictwem nasienia, mężczyźni otrzymujący kabazytaksel powinni stosować skuteczną metodę antykoncepcji w trakcie leczenia i do 6 miesięcy od podania ostatniej dawki kabazytakselu. Mężczyźni otrzymujący kabazytaksel powinni zapobiegać kontaktowi innych osób ze swoim ejakulatem w trakcie leczenia, ze względu na potencjalny wpływ kabazytakselu na organizm za pośrednictwem nasienia.
Mężczyźni otrzymujący kabazytaksel powinni zwrócić się o poradę w sprawie przechowania swojego nasienia przed rozpoczęciem leczenia.
Kabazytaksel wywiera umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn, ponieważ powoduje zmęczenie i zawroty głowy. Pacjentów należy pouczyć, aby nie prowadzili pojazdów i nie obsługiwali maszyn w przypadku pojawienia się powyższych działań niepożądanych w trakcie leczenia.
Podsumowanie profilu bezpieczeństwa
Bezpieczeństwo kabazytakselu w skojarzeniu z prednizonem lub prednizolonem oceniano w 3 randomizowanych, prowadzonych metodą otwartej próby, kontrolowanych badaniach (TROPIC, PROSELICA oraz CARD), z udziałem 1092 pacjentów z opornym na kastrację rakiem gruczołu krokowego z przerzutami, otrzymujących kabazytaksel w dawce 25 mg/m2 pc. co 3 tygodnie. Średnio pacjenci otrzymywali 6 do 7 cykli leczenia kabazytakselem.
Częstości występowania działań niepożądanych, ustalone na podstawie zbiorczej analizy danych z tych 3 badań, przedstawiono poniżej oraz w tabelarycznym zestawieniu.
Najczęstszymi działaniami niepożądanymi wszystkich stopni były: niedokrwistość (99,0%), leukopenia (93,0%), neutropenia (87,9%), trombocytopenia (41,1%), biegunka (42,1%), zmęczenie (25,0%) i astenia (15,4%). Najczęstszymi działaniami niepożądanymi stopnia ≥3. występującymi u co najmniej 5% pacjentów były: neutropenia (73,1%), leukopenia (59,5%), niedokrwistość (12,0%),
gorączka neutropeniczna (8,0%) i biegunka (4,7%).
Przerwanie stosowania kabazytakselu z powodu wystąpienia u pacjentów działań niepożądanych odnotowano z podobną częstością we wszystkich 3 badaniach (18,3% w badaniu TROPIC, 19,5% w PROSELICA i 19,8% w CARD). Najczęstszymi działaniami niepożądanymi (>1,0%) prowadzącymi do przerwania stosowania kabazytakselu były: krwiomocz, zmęczenie i neutropenia.
Tabelaryczne zestawienie działań niepożądanych
Działania niepożądane przedstawione w Tabeli 2 wymieniono zgodnie z klasyfikacją układów
i narządów MedDRA i częstością występowania. W obrębie każdej grupy o określonej częstości występowania, działania niepożądane wymieniono zgodnie ze zmniejszającym się nasileniem. Nasilenie działań niepożądanych sklasyfikowano wg CTCAE 4.0 (stopień ≥3 = G≥3). Częstość występowania dotyczy wszystkich stopni ciężkości i jest zdefiniowana następująco: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1000 do <1/100); rzadko (≥1/10 000 do
<1/1000); bardzo rzadko (<1/10 000); częstość nieznana (nie może być określona na podstawie dostępnych danych).
Tabela 2 - Zgłaszane działania niepożądane i zaburzenia hematologiczne u pacjentów otrzymujących kabazytaksel w skojarzeniu z prednizonem lub prednizolonem, pochodzące ze zbiorczej analizy danych (n=1092)
Klasyfikacja układów i narządów | Działanie niepożądane | Wszystkie stopnie n (%) | Stopień ≥3 n (%) | ||
Bardzo często | Często | Niezbyt często | |||
Zakażenia i zarażenia pasożytnicze | Zakażenie neutropeniczne/ posocznica* | 48 (4,4) | 42 (3,8) | ||
Wstrząs septyczny | 10 (0,9) | 10 (0,9) | |||
Sepsa | 13 (1,2) | 13 (1,2) | |||
Zapalenie tkanki łącznej | 8 (0,7) | 3 (0,3) | |||
Zakażenia dróg moczowych | 103 (9,4) | 19 (1,7) | |||
Grypa | 22 (2,0) | 0 | |||
Zapalenie pęcherza moczowego | 22 (2,0) | 2 (0,2) | |||
Zakażenie górnych dróg oddechowych | 23 (2,1) | 0 | |||
Półpasiec | 14 (1,3) | 0 | |||
Grzybica | 11 (1,0) | 1 (< 0,1) | |||
Zaburzenia krwi i układu chłonnego | Neutropeniaa* | 950 (87,9) | 790 (73,1) | ||
Niedokrwistośća | 1073 (99,0) | 130 (12,0) | |||
Leukopeniaa | 1008 (93,0) | 645 (59,5) | |||
Małopłytkowośća | 478 (44,1) | 44 (4,1) | |||
Gorączka neutropeniczna | 87 (8,0) | 87 (8,0) | |||
Zaburzenia układu immunologicznego | Nadwrażliwość | 7 (0,6) | 0 | ||
Zaburzenia metabolizmu i odżywiania | Zmniejszony apetyt | 192 (17,6) | 11 (1,0) | ||
Odwodnienie | 27 (2,5) | 11 (1,0) | |||
Hiperglikemia | 11 (1,0) | 7 (0,6) | |||
Hipokaliemia | 8 (0,7) | 2 (0,2) | |||
Klasyfikacja układów i narządów | Działanie niepożądane | Wszystkie stopnie n (%) | Stopień ≥3 n (%) | ||
Bardzo często | Często | Niezbyt często | |||
Zaburzenia psychiczne | Bezsenność | 45 (4,1) | 0 | ||
Niepokój | 13 (1,2) | 0 | |||
Stan dezorientacji | 12 (1,1) | 2 (0,2) | |||
Zaburzenia układu nerwowego | Utrata smaku | 64 (5,9) | 0 | ||
Zaburzenia smaku | 56 (5,1) | 0 | |||
Obwodowa neuropatia | 40 (3,7) | 2 (0,2) | |||
Obwodowa neuropatia czuciowa | 89 (8,2) | 6 (0,5) | |||
Polineuropatia | 9 (0,8) | 2 (0,2) | |||
Parestezje | 46 (4,2) | 0 | |||
Niedoczulica | 18 (1,6) | 1 (< 0,1) | |||
Zawroty głowy pochodzenia ośrodkowego | 63 (5,8) | 0 | |||
Ból głowy | 56 (5,1) | 1 (< 0,1) | |||
Letarg | 15 (1,4) | 1 (< 0,1) | |||
Rwa kulszowa | 9 (0,8) | 1 (< 0,1) | |||
Zaburzenia oka | Zapalenie spojówek | 11 (1,0) | 0 | ||
Zwiększone łzawienie | 22 (2,0) | 0 | |||
Zaburzenia ucha i błędnika | Szumy uszne | 7 (0,6) | 0 | ||
Zawroty głowy pochodzenia obwodowego (błędnikowego) | 15 (1,4) | 1 (< 0,1) | |||
Zaburzenia serca* | Migotanie przedsionków | 14 (1,3) | 5 (0,5) | ||
Tachykardia | 11 (1,0) | 1 (< 0,1) | |||
Zaburzenia naczyniowe | Niedociśnienie | 38 (3,5) | 5 (0,5) | ||
Zakrzepica żył głębokich | 12 (1,1) | 9 (0,8) | |||
Nadciśnienie tętnicze | 29 (2,7) | 12 (1,1) | |||
Niedociśnienie ortostatyczne | 6 (0,5) | 1 (< 0,1) | |||
Uderzenia gorąca | 23 (2,1) | 1 (< 0,1) | |||
Napadowe zaczerwienienie skóry | 9 (0,8) | 0 | |||
Klasyfikacja układów i narządów | Działanie niepożądane | Wszystkie stopnie n (%) | Stopień ≥3 n (%) | ||
Bardzo często | Często | Niezbyt często | |||
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Duszność | 97 (8,9) | 9 (0,8) | ||
Kaszel | 79 (7,2) | 0 | |||
Ból jamy ustnej i gardła | 26 (2,4) | 1 (< 0,1) | |||
Zapalenie płuc | 26 (2,4) | 16 (1,5) | |||
Zatorowość płucna | 30 (2,7) | 23 (2,1) | |||
Zaburzenia żołądka i jelit | Biegunka | 460 (42,1) | 51 (4,7) | ||
Nudności | 347 (31,8) | 14 (1,3) | |||
Wymioty | 207 (19,0) | 14 (1,3) | |||
Zaparcie | 202 (18,5) | 8 (0,7) | |||
Ból brzucha | 105 (9,6) | 15 (1,4) | |||
Niestrawność | 53 (4,9) | 0 | |||
Ból w nadbrzuszu | 46 (4,2) | 1 (< 0,1) | |||
Guzki krwawnicze | 22 (2,0) | 0 | |||
Choroba refluksowa przełyku | 26 (2,4) | 1 (< 0,1) | |||
Krwawienie z odbytnicy | 14 (1,3) | 4 (0,4) | |||
Suchość w ustach | 19 (1,7) | 2 (0,2) | |||
Wzdęcia | 14 (1,3) | 1 (< 0,1) | |||
Zapalenie jamy ustnej | 46 (4,2) | 2 (0,2) | |||
Niedrożność porażenna jelit* | 7 (0,6) | 5 (0,5) | |||
Zapalenie żołądka | 10 (0,9) | 0 | |||
Zapalenie jelita grubego* | 10 (0,9) | 5 (0,5) | |||
Perforacja przewodu pokarmowego | 3 (0,3) | 1 (< 0,1) | |||
Krwawienie z przewodu pokarmowego | 2 (0,2) | 1 (< 0,1) | |||
Zaburzenia skóry i tkanki podskórnej | Nadmierne wypadanie włosów | 80 (7,3) | 0 | ||
Suchość skóry | 23 (2,1) | 0 | |||
Rumień | 8 (0,7) | 0 | |||
Zaburzenia paznokci | 18 (1,6) | 0 | |||
Zaburzenia | Ból pleców | 166 (15,2) | 24 (2,2) | ||
Klasyfikacja układów i narządów | Działanie niepożądane | Wszystkie stopnie n (%) | Stopień ≥3 n (%) | ||
Bardzo często | Często | Niezbyt często | |||
Mięśniowo- szkieletowe i tkanki łącznej | Ból stawów | 88 (8,1) | 9 (0,8) | ||
Ból kończyn | 76 (7,0) | 9 (0,8) | |||
Kurcze mięśni | 51 (4,7) | 0 | |||
Ból mięśni | 40 (3,7) | 2 (0,2) | |||
Ból w klatce piersiowej pochodzenia mięśniowo- szkieletowego | 34 (3,1) | 3 (0,3) | |||
Osłabienie mięśni | 31 (2,8) | 1 (< 0,1) | |||
Ból w bocznej części ciała | 17 (1,6) | 5 (0,5) | |||
Zaburzenia nerek i dróg moczowych | Ostra niewydolność nerek | 21 (1,9) | 14 (1,3) | ||
Niewydolność nerek | 8 (0,7) | 6 (0,5) | |||
Trudności w oddawaniu moczu | 52 (4,8) | 0 | |||
Kolka nerkowa | 14 (1,3) | 2 (0,2) | |||
Krwiomocz | 205 (18,8) | 33 (3,0) | |||
Częstomocz | 26 (2,4) | 2 (0,2) | |||
Wodonercze | 25 (2,3) | 13 (1,2) | |||
Zatrzymanie moczu | 36 (3,3) | 4 (0,4) | |||
Nietrzymanie moczu | 22 (2,0) | 0 | |||
Niedrożność moczowodów | 8 (0,7) | 6 (0,5) | |||
Zaburzenia układu rozrodczego i piersi | Ból miednicy | 20 (1,8) | 5 (0,5) | ||
Zaburzenia ogólne | Zmęczenie | 333 (30,5) | 42 (3,8) | ||
Klasyfikacja układów i narządów | Działanie niepożądane | Wszystkie stopnie n (%) | Stopień ≥3 n (%) | ||
Bardzo często | Często | Niezbyt często | |||
i stany w miejscu podania | Astenia | 227 (20,8) | 32 (2,9) | ||
Gorączka | 90 (8,2) | 5 (0,5) | |||
Obrzęk obwodowy | 96 (8,8) | 2 (0,2) | |||
Zapalenie śluzówek | 23 (2,1) | 1 (< 0,1) | |||
Ból | 36 (3,3) | 7 (0,6) | |||
Ból w klatce piersiowej | 11 (1,0) | 2 (0,2) | |||
Obrzęk | 8 (0,7) | 1 (< 0,1) | |||
Dreszcze | 12 (1,1) | 0 | |||
Złe samopoczucie | 21 (1,9) | 0 | |||
Badania diagnostyczne | Zmniejszenie masy ciała | 81 (7,4) | 0 | ||
Wzrost aktywności AspAT | 13 (1,2) | 1 (< 0,1) | |||
Wzrost aktywności aminotransferaz | 7 (0,6) | 1 (< 0,1) | |||
a na podstawie badań laboratoryjnych
* szczegółowe informacje patrz punkt poniżej
Opis wybranych działań niepożądanych
Neutropenia i towarzyszące jej zaburzenia kliniczne
Wykazano, że G-CSF ogranicza częstość występowania i stopień ciężkości neutropenii (patrz punkty 4.2 i 4.4).
Częstość występowania neutropenii stopnia ≥3. na podstawie wyników badań laboratoryjnych różniła się w zależności od zastosowania G-CSF od 44,7% do 76,7%, z najniższą odnotowaną częstością, gdy zastosowano profilaktycznie G-CSF. Podobnie, częstość występowania gorączki neutropenicznej stopnia ≥3. wahała się od 3,2% do 8,6%.
Powikłania neutropeniczne (w tym gorączka neutropeniczna, zakażenie neutropeniczne/posocznica i neutropeniczne zapalenie okrężnicy), które w niektórych przypadkach prowadziły do zgonu, wystąpiły u 4,0% pacjentów, u których zastosowano profilaktycznie G-CSF oraz u 12,8% pozostałych pacjentów.
Zaburzenia czynności serca i zaburzenia rytmu serca
W zbiorczej analizie danych, przypadki zaburzeń czynności serca odnotowano u 5,5% pacjentów z czego u 1,1% występowały zaburzenia rytmu serca stopnia ≥3. Częstość występowania tachykardii po zastosowaniu kabazytakselu wynosiła 1,0%, z czego u mniej niż 0,1% była stopnia ≥3. Częstość występowania migotania przedsionków wynosiła 1,3%. Zgłoszono przypadki niewydolności serca u 2 pacjentów (0,2%), z których jeden zakończył się zgonem. U 1 pacjenta (0,3%) odnotowano
migotanie komór zakończone zgonem, a u 3 pacjentów (0,5%) zatrzymanie akcji serca. Żadne z powyższych nie zostało uznane przez badacza za związane ze stosowaniem kabazytakselu.
Krwiomocz
W zbiorczej analizie danych, częstość występowania krwiomoczu wszystkich stopni wynosiła 18,8% z
zastosowaniem dawki 25 mg/m2 pc. (patrz punkt 5.1). W blisko połowie przypadków zidentyfikowano czynniki sprzyjające, takie jak progresja choroby, jej nasilenie, infekcja lub leczenie antykoagulantami/NLPZ/kwasem acetylosalicylowym.
Inne nieprawidłowości w wynikach badań laboratoryjnych
W zbiorczej analizie danych, częstość występowania niedokrwistości stopnia ≥3., zwiększonej aktywności AspAT, AlAT i stężenia bilirubiny na podstawie wyników badań laboratoryjnych wynosiła odpowiednio 12,0%, 1,3%, 1,0% i 0,5%.
Zaburzenia żołądka i jelit
Obserwowano występowanie: zapalenia jelita grubego (w tym zapalenia jelit i neutropenicznego zapalenia jelit) oraz zapalenia żołądka. Zgłaszano także krwawienie z przewodu pokarmowego, perforację przewodu pokarmowego oraz niedrożność porażenną jelit (niedrożność jelit)
(patrz punkt 4.4).
Zaburzenia układu oddechowego
Zgłaszano przypadki występowania (częstość występowania nieznana - nie można określić na podstawie dostępnych danych) śródmiąższowego nieinfekcyjnego zapalenia płuc i (lub) zapalenia płuc oraz śródmiąższowych chorób płuc, które czasem kończyły się zgonem (patrz punkt 4.4).
Zaburzenia nerek i dróg moczowych
Niezbyt często zgłaszano występowanie zapalenia pęcherza moczowego spowodowane nawrotem objawów popromiennych (ang. radiation recall phenomenon), w tym krwotoczne zapalenie pęcherza moczowego.
Dzieci i młodzież Patrz punkt 4.2
Inne szczególne grupy pacjentów
Pacjenci w podeszłym wieku
Spośród 1092 pacjentów otrzymujących kabazytaksel w dawce 25 mg/m2 pc. w badaniach dotyczących raka gruczołu krokowego, 755 pacjentów było w wieku 65 lat lub starszych, w tym 238 pacjentów w wieku powyżej 75 lat.
Następujące niehematologiczne działania niepożądane występujące z częstością ≥5% zgłaszano częściej u pacjentów w wieku 65 lat lub starszych w porównaniu do młodszych pacjentów: zmęczenie (33,5% vs 23,7%), astenia (23,7% vs 14,2%), zaparcia (20,4% vs 14,2%) i duszność (10,3% vs 5,6%).
Neutropenia (90,9% vs 81,2%) i małopłytkowość (48,8% vs 36,1%) występowały również o 5% częściej u pacjentów w wieku 65 lat lub starszych w porównaniu z młodszymi pacjentami.
Neutropenia stopnia ≥3. i gorączka neutropeniczna były zgłaszane z większą różnicą w częstości występowania między obiema grupami pacjentów (odpowiednio 14% i 4% większą u pacjentów w wieku ≥65 lat w porównaniu do pacjentów <65. roku życia) (patrz punkty 4.2 i 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego, Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem
Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al, Jerozolimskie 181C, 02-222 Warszawa
tel.: + 48 22 49 21 301
faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie jest znane antidotum dla kabazytakselu. Potencjalne powikłania po przedawkowaniu mogą obejmować zaostrzenie działań niepożądanych w postaci supresji szpiku kostnego oraz zaburzenia żołądka i jelit. W przypadku przedawkowania, pacjenta należy umieścić na specjalistycznym oddziale i uważnie monitorować. W przypadku rozpoznania przedawkowania, należy najszybciej, jak to możliwe podać pacjentowi dawkę leczniczą G-CSF. Należy wdrożyć inne odpowiednie leczenie objawowe.
Grupa farmakoterapeutyczna: leki przeciwnowotworowe, taksany, kod ATC: L01CD04 Mechanizm działania
Kabazytaksel jest lekiem przeciwnowotworowym działającym przez zakłócenie sieci połączeń
mikrotubul w komórkach. Kabazytaksel wiąże się z tubuliną i pobudza proces odkładania się tubuliny do mikrotubul, hamując równocześnie ich rozpad. Prowadzi to do stabilizacji mikrotubul, co powoduje zahamowanie mitotycznych i interfazowych podziałów komórki.
Działanie farmakodynamiczne
Kabazytaksel wykazuje szerokie spektrum działania przeciwnowotworowego przeciwko zaawansowanym nowotworom ludzkim wszczepionym myszom. Kabazytaksel wykazuje aktywność wobec nowotworów podatnych na działanie docetakselu. Ponadto, kabazytaksel wykazuje aktywność w modelach nowotworów niewrażliwych na chemioterapię zawierającą docetaksel.
Skuteczność kliniczna i bezpieczeństwo stosowania
Skuteczność i bezpieczeństwo stosowania kabazytakselu w skojarzeniu z prednizonem lub prednizolonem oceniano w międzynarodowym, wieloośrodkowym badaniu III fazy (badanie EFC6193), prowadzonym z randomizacją metodą otwartej próby, w grupie pacjentów z opornym na kastrację rakiem gruczołu krokowego z przerzutami leczonych wcześniej schematem leczenia zawierającym docetaksel.
Pierwszorzędowym punktem końcowym skuteczności badania było całkowite przeżycie (OS, ang. Overall Survival).
Drugorzędowe punkty końcowe obejmowały przeżycie bez progresji choroby (PFS, ang. progression free survival) [definiowane, jako czas od randomizacji do progresji guza, progresji według stężenia swoistego antygenu sterczowego (PSA, ang. prostatic specific antigen), progresji bólu lub zgonu
z jakiejkolwiek przyczyny, bez względu na to, który pojawił się pierwszy], wskaźnik odpowiedzi terapeutycznej ze strony guza wg klasyfikacji RECIST (ang. response evaluation criteria in solid tumors), progresję wg PSA (definiowaną, jako wzrost ≥25% u pacjentów, u których początkowo nie stwierdzono spadku PSA lub >50% u pacjentów, u których stężenie antygenu zmniejszyło się), odpowiedź PSA na leczenie (zmniejszenie stężenia PSA w surowicy przynajmniej o 50%), progresję bólu [ocenianą przy użyciu skali aktualnego nasilenia bólu (PPI, ang. Present Pain Intensity) według kwestionariusza McGilla i Melzacka oraz skali uwzględniającej rodzaj leków przeciwbólowych (AS, ang. analgesic score)] oraz odpowiedź bólowa (definiowana jako zmniejszenie nasilenia
w porównaniu do wartości wyjściowych o ponad 2 punkty według PPI bez równoczesnego zwiększenia AS, albo zmniejszenie stosowanych leków przeciwbólowych o ≥50% w porównaniu do wartości wyjściowych AS bez równoczesnego zwiększenia bólu).
W badaniu uczestniczyło łącznie 755 pacjentów, których losowo przydzielono do grupy otrzymującej
kabazytaksel w dawce 25 mg/m2 pc. dożylnie co 3 tygodnie przez maksymalnie 10 cykli, z doustnym prednizonem lub prednizolonem w dawce dobowej 10 mg (n=378) albo mitoksantron w dawce 12 mg/m2 pc. dożylnie co 3 tygodnie przez maksymalnie 10 cykli, z doustnym prednizonem lub prednizolonem w dawce dobowej 10 mg (n=377).
Do badania kwalifikowano pacjentów w wieku powyżej 18 lat z opornym na kastrację rakiem gruczołu krokowego z przerzutami, u których choroba była mierzalna wg kryteriów RECIST lub niemierzalna, z równoczesnym wzrostem stężenia PSA albo pojawieniem się nowych zmian,
i wskaźnikiem sprawności 0 do 2 wg skali ECOG (ang. Eastern Cooperative Oncology Group). Pacjenci musieli również spełnić następujące kryteria laboratoryjne: liczba neutrofilów >1500/mm3, płytek krwi >100 000/mm3, stężenie hemoglobiny >10 g/dl, kreatyniny <1,5 x GGN, całkowitej bilirubiny <1 x GGN, aktywność AspAT i AlAT <1,5 x GGN.
Do badania nie kwalifikowano pacjentów z zastoinową niewydolnością serca w wywiadzie, zawałem mięśnia sercowego w ciągu ostatnich 6 miesięcy, pacjentów z nieleczonymi zaburzeniami rytmu serca, dusznicą bolesną i (lub) nadciśnieniem tętniczym.
Cechy demograficzne, w tym wiek, rasa i stan sprawności wg ECOG (0 do 2) były podobne w obydwu grupach. Średnia wieku w grupie pacjentów otrzymujących kabazytaksel wynosiła 68 lat, zakres (46-92) a dystrybucja rasowa wynosiła 83,9% osób rasy kaukaskiej, 6,9% rasy azjatyckiej i (lub) orientalnej, 5,3% rasy czarnej i 4% innej.
Mediana liczby cykli wynosiła 6 w grupie kabazytakselu i 4 w grupie mitoksantronu. Liczba pacjentów, którzy ukończyli leczenie w ramach badania (10 cykli) wynosił odpowiednio 29,4% i 13,5%. Całkowite przeżycie było znamiennie dłuższe u pacjentów przyjmujących kabazytaksel w porównaniu do mitoksantronu (odpowiednio 15,1 vs 12,7 miesiąca), z 30% zmniejszeniem ryzyka zgonu w porównaniu do mitoksantronu (patrz Tabela 3 i Rycina 1).
Podgrupa 59 pacjentów otrzymywała wcześniej skumulowaną dawkę docetakselu <225 mg/m2 pc. (29 pacjentów w grupie kabazytakselu, 30 pacjentów w grupie mitoksantronu). Nie odnotowano znamiennej różnicy w całkowitym przeżyciu (HR (95%CI) 0,96 (0,49-1,86)).
Tabela 3 - Skuteczność kabazytakselu w badaniu EFC6193, w leczeniu pacjentów z opornym na kastrację rakiem gruczołu krokowego z przerzutami
n = 378 | ||
Całkowite przeżycie | ||
Liczba zgonów (%) | 234 (61,9 %) | 279 (74 %) |
Mediana przeżycia (miesiące) (95% CI) | 15,1 (14,1–16,3) | 12,7 (11,6–13,7) |
kabazytaksel + prednizon
mitoksantron + prednizon n = 377
Współczynnik ryzyka (HR, ang. Hazard Ratio)1 (95% CI)
0,70 (0,59–0,83)
p-wartość < 0,0001
1HR oszacowany przy użyciu modelu Coxa; współczynnik ryzyka poniżej 1 przemawia na korzyść kabazytakselu
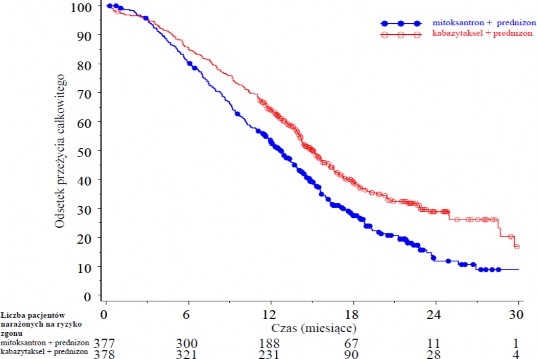
Rycina 1 - Krzywe przeżycia całkowitego wg Kaplana i Meiera (EFC6193)
W grupie otrzymującej kabazytaksel odnotowano poprawę przeżycia bez progresji choroby (PFS) w porównaniu do grupy otrzymującej mitoksantron, odpowiednio 2,8 (2,4-3,0) miesiąca vs 1,4 (1,4-1,7)
miesiąca, HR (95%CI) 0,74 (0,64-0,86), p<0,0001.
Odnotowano znamiennie większy odsetek odpowiedzi guza wynoszący 14,4% (95%CI: 9,6-19,3) u pacjentów otrzymujących kabazytaksel w porównaniu do 4,4% (95%CI: 1,6-7,2) u pacjentów w grupie mitoksantronu, p=0,0005.
Drugorzędowe punkty końcowe dotyczące PSA były korzystne w grupie otrzymującej kabazytaksel. Mediana czasu progresji wg PSA wynosiła 6,4 miesiąca (95%CI: 5,1-7,3) u pacjentów w grupie kabazytakselu w porównaniu do 3,1 miesiąca (95%CI: 2,2-4,4) w grupie mitoksantronu, HR 0,75 miesiąca (95%CI: 0,63-0,90), p=0,0010. Odpowiedź według stężenia PSA wynosiła 39,2% u pacjentów w grupie kabazytakselu (95%CI: 33,9-44,5) vs 17,8% u pacjentów otrzymujących mitoksantron (95% CI: 13,7-22,0), p=0,0002.
Pomiędzy obiema grupami nie stwierdzono znamiennych statystycznie różnic w progresji bólu i odpowiedzi bólowej.
W międzynarodowym, wieloośrodkowym badaniu III fazy (EFC11785) typu non-inferiority (badanie typu badana interwencja nie jest gorsza), prowadzonym z randomizacją metodą otwartej próby, 1200 pacjentów z opornym na kastrację rakiem gruczołu krokowego z przerzutami leczonych wcześniej schematem leczenia zawierającym docetaksel, przydzielono losowo do dwóch grup otrzymujących albo dawkę 25 mg/m2 pc. (n=602) kabazytakselu lub dawkę 20 mg/m2 pc. (n=598).
Pierwszorzędowym punktem końcowym skuteczności było całkowite przeżycie (ang. Overall survival). Badanie osiągnęło podstawowy cel wskazujący, że dawka 20 mg/m2 pc. kabazytakselu nie jest gorsza w porównaniu do dawki 25 mg/m2 pc. (patrz Tabela 4). Statystycznie istotny, większy procent (p<0,001) pacjentów wykazał odpowiedź PSA na leczenie w grupie otrzymującej dawkę 25 mg/m2 pc. (42,9%) w porównaniu z grupą otrzymującą dawkę 20 mg/m2 pc. (29,5%). Zaobserwowano statystycznie istotne, większe ryzyko progresji wg PSA u pacjentów otrzymujących dawkę 20 mg/m2 pc. w porównaniu do dawki 25 mg/m2 pc. (HR 1,195; 95% CI: 1,025 do 1,393). Nie stwierdzono znamiennych statystycznych różnic w odniesieniu do innych drugorzędowych punktów końcowych
(PFS, odpowiedzi guza i bólowej, progresji guza i bólu oraz czterech podkategorii FACT-P [ang.
Functional Assessment of Cancer Therapy-Prostate]).
Tabela 4 - Całkowite przeżycie w badaniu EFC11785 w grupie otrzymującej kabazytaksel w dawce 25 mg/m2 pc. vs grupa otrzymująca kabazytaksel w dawce 20 mg/m2 pc. (analiza Intent-to–treat) – Pierwszorzędowy punkt końcowy skuteczności
CBZ20+PRED n = 598 | CBZ25+PRED n = 602 | |
Całkowite przeżycie | ||
Liczba zgonów, n (%) | 497 (83,1 %) | 501 (83,2%) |
Mediana przeżycia (95% CI) (miesiące) | 13,4 (12,19 to 14,88) | 14,5 (13,47 to 15,28) |
Współczynnik ryzykaa | ||
vs CBZ25+PRED | 1,024 | – |
1-stronny 98,89% UCI | 1,184 | – |
1-stronny 95% LCI | 0,922 | – |
CBZ20=Kabazytaksel 20 mg/m2 pc., CBZ25=Kabazytaksel 25 mg/m2 pc., PRED=Prednizon/Prednizolon
CI=przedział ufności, LCI=dolna granica przedziału ufności, UCI=górna granica przedziału ufności a Współczynnik ryzyka oszacowany pryz użyciu modelu Regresji Proporcjonalnego Ryzyka Coxa. Współczynnik ryzyka < 1 wskazuje na niższe ryzyko kabazytakselu 20 mg/m2 pc. w odniesieniu do 25 mg/m2 pc.
Profil bezpieczeństwa zaobserwowany w badaniu EFC11785 dla kabazytakselu 25 mg/m2 pc. był jakościowo i ilościowo podobny do zaobserwowanego w badaniu EFC6193. Badanie EFC11785 wykazało lepszy profil bezpieczeństwa kabazytakselu w dawce 20 mg/m2 pc.
Tabela 5 - Podsumowanie danych dotyczących bezpieczeństwa stosowania dla kabazytaksel w dawce 25 mg/m2 pc. vs kabazytaksel w dawce 20 mg/m2 pc.
Średnia liczba cykli/
CBZ20+PRED n = 580
CBZ25+PRED n = 595
średnia
długość leczenia
6 / 18 tygodni 7 / 21 tygodni
Liczba pacjentów z redukcją dawki
n (%)
z 20 do 15 mg/m2 pc.: 58
(10,0%)
z 15 do 12 mg/m2 pc.: 9 (1,6%)
z 25 do 20 mg/m2 pc.: 128
(21,5%)
z 20 do 15 mg/m2 pc.: 19 (3,2%)
z 15 do 12 mg/m2 pc.: 1 (0,2%)
CBZ20+PRED | CBZ25+PRED |
n = 580 | n = 595 |
Działania niepożądane wszystkich stopni a [%] | |
Biegunka 30,7 | 39,8 |
Nudności 24,5 | 32,1 |
Zmęczenie 24,7 | 27,1 |
Krwiomocz 14,1 | 20,8 |
Astenia 15,3 | 19,7 |
Zmniejszony apetyt 13,1 | 18,5 |
Wymioty 14,5 | 18,2 |
Zaparcia 17,6 | 18,0 |
Ból pleców 11,0 | 13,9 |
Kliniczna neutropenia 3,1 | 10,9 |
Zakażenia układu 6,9 | 10,8 |
moczowego | |
Obwodowa neuropatia 6,6 | 10,6 |
czuciowa | |
Zaburzenia smaku 7,1 | 10,6 |
Działania niepożądane stopnia ≥ 3b [%] | |
Kliniczna neutropenia 2,4 | 9,6 |
Gorączka neutropeniczna 2,1 | 9,2 |
Nieprawidłowości hematologiczne c [%] Neutropenia stopnia ≥ 3 41,8 | 73,3 |
Niedokrwistość stopnia ≥ 3 9,9 | 13,7 |
Małopłytkowość stopnia ≥ 3 2,6 | 4,2 |
CBZ20: kabazytaksel 20 mg/m2 pc., CBZ25: kabazytaksel 25 mg/m2 pc.,
PRED: Prednizon/Prednizolon
W prospektywnym, międzynarodowym, randomizowanym, aktywnie kontrolowanym i prowadzonym metodą otwartej próby badaniu IV fazy (badanie LPS14201/CARD) 255 pacjentów z opornym na kastrację rakiem gruczołu krokowego z przerzutami (mCRPC, ang. metastatic castration-resistant prostate cancer), wcześniej leczonych w dowolnej kolejności schematem leczenia zawierającym docetaksel i lekiem działającym na receptory androgenowe (AR, ang. androgen receptor) (abirateron lub enzalutamid, z progresją choroby w ciągu 12 miesięcy od rozpoczęcia leczenia), przydzielono losowo do grupy otrzymującej kabazytaksel w dawce 25 mg/m2 pc. dożylnie co 3 tygodnie i prednizon/prednizolon w dawce 10 mg na dobę (n=129) lub lek działający na AR (1000 mg abirateronu raz na dobę i prednizon/prednizolon w dawce 5 mg dwa razy na dobę lub 160 mg enzalutamidu raz na dobę) (n=126). Przeżycie bez progresji choroby potwierdzonej radiologicznie (rPFS ang. radiographic progression free survival) zdefiniowane przez grupę roboczą ds. badań klinicznych raka prostaty (PCWG2, ang. Prostate Cancer Working Group-2) było pierwszorzędowym punktem końcowym. Drugorzędowe punkty końcowe obejmowały całkowite przeżycie, przeżycie bez progresji choroby, odpowiedź PSA oraz odpowiedź ze strony guza.
Cechy demograficzne i charakterystyka choroby były podobne w obydwu grupach. Przed rozpoczęciem leczenia ogólna mediana wieku wynosiła 70 lat, 95% pacjentów miało stan sprawności wg punktacji skali ECOG wynoszący 0 lub 1 i średnią punktację w skali Gleasona wynoszącą 8.
Sześćdziesiąt jeden procent (61%) pacjentów było wcześniej leczonych lekiem działającym na AR, po wcześniejszym leczeniu docetakselem.
W badaniu osiągnięto pierwszorzędowy punkt końcowy: rPFS było znamiennie dłuższe u pacjentów
przyjmujących kabazytaksel w porównaniu do leków działających na AR (odpowiednio 8,0 miesięcy vs 3,7 miesiąca), z 46% zmniejszonym ryzykiem progresji choroby potwierdzonej radiologicznie w porównaniu do tego obserwowanego u pacjentów otrzymujących lek działający na AR (patrz Tabela 6 i Rycina 2).
Tabela 6 - Skuteczność kabazytakselu w badaniu CARD, w leczeniu pacjentów z opornym na kastrację rakiem gruczołu krokowego z przerzutami (analiza populacji zgodnej z zamiarem leczenia, ang.
Intent-to-treat analysis) - Przeżycie bez progresji choroby potwierdzonej radiologicznie (rPFS)
Kabazytaksel
+ prednizon/prednizolon
+ G-CSF
Lek działający na AR: abirateron + prednizon/prednizolon lub
enzalutamid
Liczba zdarzeń w dniu granicznym (%)
n = 129 n = 126
95 (73,6 %) 101 (80,2 %)
Mediana rPFS (miesiące) (95% CI) 8,0 (5,7 to 9,2) 3,7 (2,8 to 5,1)
Współczynnik ryzyka (HR) (95% CI) 0,54 (0,40 to 0,73)
p-wartość1 < 0,0001
1 stratyfikowany test log-rank, próg istotności=0,05
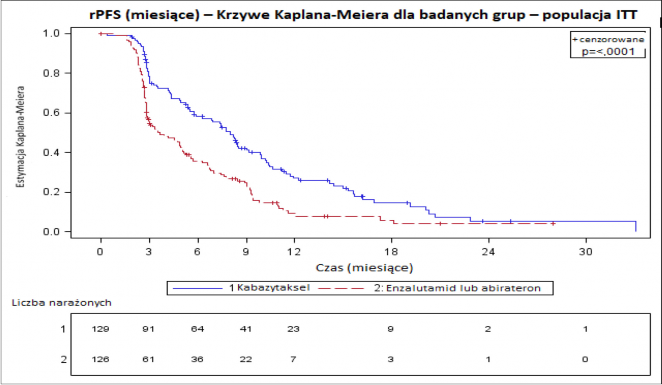
Rycina 2 – Pierwszorzędowy punkt końcowy: Wykres potwierdzonego radiologicznie PFS (populacja zgodna z zamiarem leczenia, ITT ang. intent-to-treat). Znaczniki oznaczają ocenzurowane dane.
Planowane analizy podgrup dla rPFS oparte na czynnikach stratyfikacyjnych podczas randomizacji dały współczynnik ryzyka wynoszący 0,61 (95% CI: 0,39 do 0,96) u pacjentów, którzy otrzymali wcześniej lek działający na AR przed podaniem docetakselu i współczynnik ryzyka wynoszący 0,48 (95% CI: 0,32 do 0,70) u pacjentów, którzy wcześniej otrzymali lek działający na AR po
podaniu docetakselu.
Kabazytaksel wykazał statystycznie istotną wyższość nad lekiem porównawczym działającym na AR pod względem każdego z alfa-kontrolowanych, kluczowych drugorzędowych punktów końcowych, w tym całkowitego przeżycia (13,6 miesiąca u pacjentów otrzymujących kabazytaksel w porównaniu do 11,0 miesięcy u pacjentów otrzymujących lek działający na AR, HR 0,64, 95% CI: 0,46 do 0,89; p=0,008), przeżycia bez progresji choroby (4,4 miesiąca u pacjentów otrzymujących kabazytaksel w porównaniu do 2,7 miesięcy u pacjentów otrzymujących lek działający na AR, HR 0,52, 95% CI: 0,40 do 0,68), potwierdzonej odpowiedzi PSA (36,3% u pacjentów otrzymujących kabazytaksel w porównaniu z 14,3% u pacjentów otrzymujących lek działający na AR, p=0,0003) i lepszej odpowiedzi ze strony guza (36,5% u pacjentów otrzymujących kabazytaksel w porównaniu z 11,5% u pacjentów otrzymujących lek działający na AR, p=0,004).
Profil bezpieczeństwa stosowania kabazytakselu w dawce 25 mg/m2 pc. zaobserwowany w badaniu CARD był zgodny z zaobserwowanym w badaniach TROPIC i PROSELICA (patrz punkt 4.8).
Częstość występowania działań niepożądanych stopnia ≥3 wynosiła 53,2% u pacjentów otrzymujących kabazytaksel w porównaniu z 46,0% u pacjentów otrzymujących lek działający na AR. Częstość występowania ciężkich działań niepożądanych stopnia ≥3 wynosiła 31,7% u pacjentów otrzymujących kabazytaksel w porównaniu z 37,1% u pacjentów otrzymujących lek działający na AR. Częstość odnotowanych trwałych rezygnacji pacjentów z udziału w badaniu z powodu działań niepożądanych, wynosiła 19,8% u pacjentów otrzymujących kabazytaksel w porównaniu z 8,1% u pacjentów otrzymujących lek działający na AR. Częstość występowania działań niepożądanych prowadzących do zgonu pacjenta wynosiła 5,6% u pacjentów otrzymujących kabazytaksel w porównaniu z 10,5% u pacjentów otrzymujących lek działający na AR.
Dzieci i młodzież
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań dla produktu referencyjnego zawierającego kabazytaksel we wszystkich populacjach dzieci i młodzieży we wskazaniu rak gruczołu krokowego (patrz punkt 4.2, informacje na temat stosowania u dzieci i młodzieży).
Kabazytaksel oceniano w otwartym, wieloośrodkowym badaniu fazy 1/2 przeprowadzonym na grupie 39 pacjentów pediatrycznych (w wieku pomiędzy 4 do 18 lat w fazie 1. części badania oraz pomiędzy 3 do 16 lat w fazie 2. części badania). W fazie 2. nie wykazano skuteczności kabazytakselu w monoterapii u dzieci i młodzieży leczonych dawką 30 mg/m2 pc. w nawracającym lub opornym na leczenie rozlanym glejaku pnia mózgu (DIPG, ang. diffuse intrinsic pontine glioma) oraz glejaku o wysokim stopniu złośliwości (HGG, ang. high grade glioma).
Analizę farmakokinetyki populacji przeprowadzono w grupie 170 pacjentów, włączając pacjentów z zaawansowanymi nowotworami litymi (n=69), rakiem piersi z przerzutami (n=34) i rakiem gruczołu krokowego z przerzutami (n=67). Pacjenci otrzymywali kabazytaksel w dawkach od 10 mg/m2 pc. do 30 mg/m2 pc. co tydzień lub co 3 tygodnie.
Wchłanianie
Po 1-godzinnej infuzji dożylnej kabazytakselu w dawce 25 mg/m2 pc. u pacjentów z rakiem gruczołu krokowego z przerzutami (n=67), Cmax wynosiło 226 ng/ml (współczynnik zmienności [ang. CV, Coefficient of Variation]: 107%) i wartość ta została osiągnięta pod koniec trwania 1-godzinnej infuzji (Tmax). Średnia wartość AUC wynosiła 991 ng·h/ml (CV: 34%).
Nie obserwowano większych odchyleń od proporcjonalności dawki w zakresie dawek od 10 do 30 mg/m² pc. u pacjentów z zaawansowanymi nowotworami litymi (n=126).
Dystrybucja
Objętość dystrybucji w stanie równowagi (Vss) wynosiła 4870 l (2640 l/m² pc. dla pacjenta z medianą powierzchni ciała 1,84 m²).
W warunkach in vitro, wiązanie kabazytakselu z ludzkimi białkami surowicy wynosiło 89-92% i proces ten nie osiągnął stanu wysycenia do 50 000 ng/ml, co odpowiada najwyższemu stężeniu
odnotowanemu w badaniach klinicznych. Kabazytaksel wiąże się głównie z ludzkimi albuminami surowicy (82,0%) i lipoproteinami (87,9% dla HDL, 69,8% dla LDL i 55,8% dla VLDL).
Współczynnik stężenia we krwi i osoczu w badaniach in vitro w ludzkiej krwi wahał się od 0,90 do 0,99, co wskazuje na równomierną dystrybucję kabazytakselu we krwi i osoczu.
Metabolizm
Kabazytaksel jest intensywnie metabolizowany w wątrobie (>95%), głównie za pośrednictwem izoenzymu CYP3A (80 do 90%). Kabazytaksel jest głównym związkiem krążącym w osoczu u ludzi. W osoczu stwierdzono obecność 7 metabolitów (w tym 3 aktywne metabolity powstałe w wyniku
O-demetylacji), z których główny stanowił 5% wpływu substancji czynnej na organizm. Około 20 metabolitów kabazytakselu jest wydalanych u ludzi z moczem i kałem.
Badania in vitro wskazują, że kabazytaksel w klinicznie istotnych stężeniach może potencjalnie hamować metabolizm produktów leczniczych, głównie będących substratami CYP3A. Jednakże badanie kliniczne wykazało, że kabazytaksel (w dawce 25 mg/m2 pc. Podawany w pojedynczej infuzji trwającej 1 godzinę) nie zmieniał w osoczu stężenia midazolamu, który jest substratem wzorcowym dla CYP3A. Dlatego też u pacjentów otrzymujących w dawkach
terapeutycznych jednocześnie substraty CYP3A razem z kabazytakselem nie jest spodziewany żaden wpływ kliniczny.
Nie istnieje ryzyko zahamowania przemian metabolicznych produktów leczniczych
będących substratami innych enzymów CYP (1A2, 2B6, 2C9, 2C8, 2C19, 2E1 i 2D6) ani indukcji przez kabazytaksel metabolizmu produktów leczniczych będących substratami CYP1A, CYP2C9 i CYP3A. Kabazytaksel nie hamował w warunkach in vitro głównego szlaku biotransformacji warfaryny do 7-hydroksywarfaryny, zachodzącego za pośrednictwem CYP2C9. Dlatego nie przewiduje się interakcji farmakokinetycznych kabazytakselu i warfaryny w warunkach in vivo.
W badaniach in vitro kabazytaksel nie hamował białek oporności wielolekowej (ang. Multidrug- Resistant Proteins MRP): MRP1 i MRP2 lub organicznych transporterów kationów (OCT1).
Kabazytaksel hamował transport za pośrednictwem P-glikoproteiny (P-gp) (digoksyna, winblastyna), białek oporności raka piersi (ang. BCRP, Breast-Cancer-Resistant-Proteins) (metotreksat)
i polipeptydów transportujących aniony organiczne OATP1B3 (CCK8) w stężeniach przynajmniej
15-krotnie większych od obserwowanych w warunkach klinicznych, podczas gdy transport OATP1B1 (estradiolu-17β-glukuronid) hamował w stężeniu tylko 5-krotnie wyższym od obserwowanych
w warunkach klinicznych. Z tego względu ryzyko interakcji z substratami MRP, OCT1, Pgp, BCRP oraz OATP1B3 w warunkach in vivo po podaniu dawki 25 mg/m2 pc. jest mało prawdopodobne.
Ryzyko interakcji z transporterami OATP1B1 jest możliwe, zwłaszcza w czasie trwania infuzji (1 godzina) i aż do 20 minut po zakończeniu infuzji (patrz punkt 4.5).
Eliminacja
Po 1-godzinnej infuzji dożylnej [14C]-kabazytakselu w dawce 25 mg/m2 pc., około 80% podanej dawki zostało wydalone w ciągu 2 tygodni. Kabazytaksel jest głównie wydalany z kałem w postaci licznych metabolitów (76% dawki), podczas gdy wydalanie kabazytakselu i metabolitów przez nerki stanowi mniej niż 4% dawki (2,3% w postaci niezmienionego leku w moczu).
Kabazytaksel wykazuje wysoki klirens osoczowy wynoszący 48,5 l/h (26,4 l/h/m² pc. dla pacjenta o medianie powierzchni ciała wynoszącej 1,84 m²) i długi okres półtrwania w fazie eliminacji wynoszący 95 godzin.
Szczególne grupy pacjentów
Pacjenci w podeszłym wieku
W populacyjnej analizie farmakokinetyki obejmującej 70 pacjentów w wieku 65 lat i starszych (57 pacjentów w wieku od 65 do 75 lat i 13 pacjentów powyżej 75 lat), nie stwierdzono wpływu wieku na farmakokinetykę kabazytakselu.
Dzieci i młodzież
Nie określono dotychczas bezpieczeństwa stosowania i skuteczności kabazytakselu u dzieci i młodzieży w wieku poniżej 18 lat.
Zaburzenia czynności wątroby
Kabazytaksel jest wydalany głównie w wyniku metabolizmu wątrobowego.
W badaniu przeprowadzonym z udziałem 43 pacjentów chorych na raka z łagodnymi (stężenie bilirubiny całkowitej od > 1do ≤ 1,5 xGGN lub AspAT >1,5 x GGN) lub umiarkowanymi (stężenie bilirubiny całkowitej od >1,5 do ≤ 3,0 x GGN) zaburzeniami czynności wątroby nie wykazano, aby wywierały one wpływ na farmakokinetykę kabazytakselu. Maksymalna tolerowana dawka kabazytakselu to odpowiednio 20 mg/m2 pc. i 15 mg/m2 pc.
U 3 pacjentów z ciężkimi zaburzeniami czynności wątroby (stężenie bilirubiny całkowitej >3 x GGN), zaobserwowano zmniejszenie klirensu o 39% w porównaniu do pacjentów z łagodnymi zaburzeniami czynności wątroby, co wskazuje na pewien wpływ ciężkich zaburzeń czynności wątroby na farmakokinetykę kabazytakselu. Nie ustalono wielkości maksymalnej tolerowanej dawki dla pacjentów z ciężkimi zaburzeniami czynności wątroby.
Bazując na danych dotyczących bezpieczeństwa stosowania oraz tolerancji kabazytakselu, jego dawka powinna zostać zmniejszona u pacjentów z łagodnymi zaburzeniami czynności wątroby
(patrz punkty 4.2 i 4.4). Kabazytaksel jest przeciwskazany do stosowania u pacjentów z ciężkimi zaburzeniami czynności wątroby (patrz punkt 4.3).
Zaburzenia czynności nerek
Kabazytaksel jest w minimalnym stopniu wydalany przez nerki (2,3% dawki). Analiza farmakokinetyki populacyjnej przeprowadzona z udziałem 170 pacjentów, w tym 14 pacjentów
z umiarkowanymi zaburzeniami czynności nerek (klirens kreatyniny 30-50 ml/min) i 59 pacjentów z łagodnymi zaburzeniami czynności nerek (klirens kreatyniny 50-80 ml/min) wykazała, że łagodne do umiarkowanych zaburzenia czynności nerek nie wpływają znacząco na farmakokinetykę kabazytakselu. Zostało to potwierdzone w dedykowanych, porównawczych badaniach
farmakokinetycznych u pacjentów z rakiem narządów miąższowych, z prawidłową czynnością nerek (8 pacjentów), umiarkowanymi zaburzeniami czynności nerek (8 pacjentów) i ciężkimi zaburzeniami czynności nerek (9 pacjentów), którzy otrzymali kilka cykli leczenia kabazytakselem w pojedynczych infuzjach dożylnych, w dawce do 25 mg/m2 pc.
Działania niepożądane nieobserwowane w badaniach klinicznych, lecz obserwowane u psów po podaniu pojedynczej dawki, po zastosowaniu kabazytakselu przez 5 dni i w odstępach tygodniowych, przy poziomach ekspozycji niższych niż kliniczne poziomy ekspozycji i mogące mieć znaczenie
w stosowaniu klinicznym, obejmowały: zmiany martwicze tętniczek wątrobowych lub w ich sąsiedztwie, hiperplazję nabłonka kanalików żółciowych i (lub) martwicę hepatocytów (patrz punkt 4.2).
Działania niepożądane nieobserwowane w badaniach klinicznych, lecz obserwowane u szczurów w badaniach toksyczności po podaniu wielokrotnym, przy poziomach ekspozycji wyższych niż kliniczne poziomy ekspozycji i mogące mieć znaczenie przy stosowaniu klinicznym, obejmowały zaburzenia oka charakteryzujące się podtorebkowym obrzękiem i (lub) zwyrodnieniem włókien soczewki. Te zmiany były częściowo odwracalne po 8 tygodniach.
Dotychczas nie przeprowadzono badań dotyczących działania rakotwórczego kabazytakselu. Kabazytaksel nie indukował mutacji w teście rewersji mutacji u bakterii (Amesa). Nie stwierdzono działania klastogennego w badaniu in vitro przy użyciu limfocytów ludzkich (brak indukcji strukturalnych aberracji chromosomalnych, ale wzrosła liczby komórek poliploidalnych). Odnotowano natomiast wzrost liczby mikrojąderek w teście in vivo u szczurów. Jednak ustalenia dotyczące genotoksyczności są naturalnym elementem aktywności farmakologicznej związku (hamowanie depolimeryzacji tubuliny) i były obserwowane także w przypadku produktów leczniczych wykazujących analogiczną aktywność farmakologiczną.
Kabazytaksel nie wpływał na kopulację i płodność u samców szczurów. Jednak w badaniu toksyczności po podaniu wielokrotnym, obserwowano zwyrodnienie pęcherzyków nasiennych i atrofię
kanalików wyprowadzających jąder u szczurów oraz zwyrodnienie jąder (niewielkiego stopnia martwica pojedynczych komórek nabłonka najądrza) u psów. Ekspozycja u zwierząt była podobna lub niższa od obserwowanej u ludzi otrzymujących klinicznie odpowiadające dawki kabazytakselu.
Kabazytaksel podawany dożylnie raz dziennie w okresie od 6. do 17. dnia ciąży wywierał toksyczny wpływ na zarodki i płody u samic szczura, a także toksyczny wpływ na samice, prowadząc do obumarcia płodów i spadku średniej masy ciała płodu z towarzyszącym opóźnieniem procesu kostnienia szkieletu. Ekspozycja u zwierząt była niższa od obserwowanej u ludzi otrzymujących klinicznie odpowiadające dawki kabazytakselu. Kabazytaksel przechodził przez barierę łożyskową u szczurów.
U szczurów kabazytaksel i jego metabolity przenikają do mleka samic w ilości do 1,5% dawki podanej w ciągu 24 godzin.
Ocena ryzyka dla środowiska
Wyniki badań nad ryzykiem dla środowiska wykazały, że kabazytaksel nie będzie powodował znaczącego ryzyka dla środowiska wodnego (patrz punkt 6.6 dotyczący usuwania niezużytego produktu leczniczego).
Polisorbat 80 Etanol bezwodny Kwas cytrynowy
Nie mieszać produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 6.6
Nie należy używać worków infuzyjnych wykonanych z PVC lub poliuretanowych zestawów do infuzji.
Nieotwarta fiolka 30 miesięcy
Po otwarciu fiolki
Wykazano stabilność chemiczną i fizyczną przez okres 4 tygodni w temperaturze 2-8°C.
Z mikrobiologicznego punktu widzenia, produkt należy zużyć natychmiast po przygotowaniu.
W przeciwnym wypadku użytkownik ponosi odpowiedzialność za czas oraz warunki przechowywania i zwykle czas przechowywania nie powinien przekraczać 24 godzin w temperaturze 2-8°C. Z mikrobiologicznego punktu widzenia rozcieńczenie należy wykonać w kontrolowanych
i zwalidowanych warunkach aseptycznych.
Po dodaniu do pojemnika infuzyjnego
Wykazano chemiczną i fizyczną stabilność użytkową w pojemnikach do infuzji niezawierających PVC przez 14 dni w temperaturze 2-8°C i przez 48 godzin w temperaturze 25°C.
Z mikrobiologicznego punktu widzenia produkt należy zużyć natychmiast. Jeśli nie zostanie zużyty natychmiast, za czas i warunki przechowywania przed użyciem odpowiada użytkownik i zwykle nie powinien on przekraczać 24 godzin w temperaturze od 2-8°C, chyba że rozcieńczenie przeprowadzono w kontrolowanych i zwalidowanych warunkach aseptycznych.
Brak szczególnych środków ostrożności dotyczących przechowywania produktu leczniczego. Warunki przechowywania produktu leczniczego po otwarciu i rozcieńczeniu, patrz punkt 6.3.
Fiolka z bezbarwnego szkła (typ I) z korkiem z gumy halobutylowej, aluminiowym uszczelnieniem typu „flip-off”, zawierająca 3 ml koncentratu w tekturowym pudełku. Jedno opakowanie zawiera jedną fiolkę koncentratu.
Kabazytaksel powinien być przygotowywany i podawany jedynie przez personel przeszkolony w obchodzeniu się z substancjami cytotoksycznymi. Kobiety w ciąży należące do personelu nie powinny mieć kontaktu z produktem. Podobnie jak w przypadku innych leków przeciwnowotworowych, należy zachować ostrożność podczas obchodzenia się z kabazytakselem i przygotowywania jego roztworów, biorąc pod uwagę użycie wyposażenia ograniczającego ekspozycję, środków ochrony indywidualnej (np. rękawiczki) i procedur przygotowania do użycia. W przypadku kontaktu kabazytakselu ze skórą na dowolnym etapie obchodzenia się z nim, należy natychmiast dokładnie umyć zanieczyszczone miejsce wodą z mydłem. W przypadku kontaktu z błoną śluzową, miejsce zanieczyszczone należy natychmiast dokładnie zmyć wodą.
Przygotowanie gotowego do użycia roztworu do infuzji
NIE stosować innych produktów leczniczych zawierających kabazytaksel w 2 fiolkach (koncentratu i rozpuszczalnika) z produktem leczniczym Cabazitaxel G.L. 20 mg/ml koncentrat do sporządzania roztworu do infuzji, który zawiera tylko 1 fiolkę z 3 ml (60 mg/3 ml).
Cabazitaxel G.L. 20 mg/ml koncentrat do sporządzania roztworu do infuzji NIE wymaga wcześniejszego rozcieńczenia rozpuszczalnikiem i jest gotowy do dodania do roztworu do infuzji.
Krok 1
Jeśli fiolki są przechowywane w lodówce, przed użyciem należy odstawić wymaganą liczbę fiolek kabazytakselu koncentrat do sporządzania roztworu do infuzji w temperaturze 20–25°C na 5 minut. W celu uzyskania wymaganej dawki dla pacjenta, może być potrzebna więcej niż jedna fiolka leku Cabazitaxel G.L. 20 mg/ml koncentrat do sporządzania roztworu do infuzji. Aseptycznie pobrać wymaganą ilość koncentratu kabazytakselu do sporządzania roztworu do infuzji za pomocą skalibrowanej strzykawki wyposażonej w igłę 21G.
Każdy ml produktu leczniczego zawiera 20 mg kabazytakselu.
Krok 2
Wymaganą objętość koncentratu kabazytakselu do sporządzania roztworu do infuzji (20 mg/ml kabazytakselu) należy wstrzyknąć do jałowego pojemnika niezawierającego PVC zawierającego 5% roztwór glukozy lub 9 mg/ml (0,9%) roztwór chlorku sodu do infuzji. Na przykład dawka 45 mg kabazytakselu wymagałaby 2,25 ml koncentratu pobranego bezpośrednio z fiolki produktu.
Stężenie roztworu do infuzji powinno wynosić od 0,10 mg/ml do 0,26 mg/ml.
Krok 3
Wyjąć strzykawkę i ręcznie wymieszać zawartość worka lub butelki infuzyjnej, wykonując ruch kołysania.
Krok 4
Podobnie jak w przypadku wszystkich produktów do podawania pozajelitowego, otrzymany roztwór do infuzji należy obejrzeć przed użyciem. Ponieważ roztwór do infuzji jest przesycony, w miarę
upływu czasu może krystalizować. W takim przypadku roztworu nie wolno używać i należy go wyrzucić.
Roztwór do infuzji należy zużyć natychmiast. Czas przechowywania przygotowanego roztworu może być jednak dłuższy w określonych warunkach opisanych w punkcie 6.3.
Podczas podawania wymagany jest filtr o nominalnej wielkości porów 0,22 mikrometra (określany również jako 0,2 mikrometra).
Do przygotowywania i podawania kabazytakselu nie należy używać worków do infuzji wykonanych z PVC lub poliuretanowych zestawów do infuzji.
Kabazytakselu nie wolno mieszać z innymi produktami leczniczymi niż wymienione.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
G.L. Pharma GmbH Schlossplatz 1
8502 Lannach Austria
Pozwolenie nr
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











