Spis treści:
- NAZWA PRODUKTU LECZNICZEGO Cifoban, 136 mmol/L, roztwór do infuzji
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO Cifoban, 136 mmol/L, roztwór do infuzji
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Dzieci (w wieku od 2 do 11 lat): przepływ krwi nie powinien przekraczać 5-6 mL/kg/min;
dawkowanie cytrynianu może być rozpoczęte od około 4 mmol/L krwi, zgodnie z protokołem.
Młodzież (w wieku od 12 do 17 lat): przepływ krwi nie powinien być wystarczający do osiągnięcia celów terapii i ogólnie nie przekraczać przepływów krwi u osób dorosłych o podobnej masie ciała. Dawkowanie cytrynianu może być rozpoczęte od około 4 mmol/L krwi, zgodnie z protokołem.
Noworodki i niemowlęta (w wieku od 0 do 23 miesięcy): jeśli wymagany jest przepływ krwi
Cifoban może być stosowany wyłącznie zgodnie z właściwym protokołem RCA. Może on być stosowany wyłącznie przez lub pod kierunkiem lekarza kompetentnego w zakresie stosowania RCA i przez fachowych pracowników ochrony zdrowia, którzy są odpowiednio przeszkoleni we wskazanych terapiach i w stosowaniu powiązanych produktów.
Należy przestrzegać instrukcji obsługi używanego urządzenia do pozaustrojowego oczyszczania krwi i układu drenów dostarczonych przez producenta.
Cifoban może być używany w RCA w oddziałach intensywnej terapii lub w podobnych warunkach, gdzie musi być stosowany pod ścisłym nadzorem medycznym i ciągłą kontrolą.
Instrukcja postępowania z produktem leczniczym przed podaniem, patrz punkt 6.6.
Przeciwwskazania
Nadwrażliwość na substancję czynną
Znane ciężkie zaburzenie metabolizmu cytrynianu (patrz punkt 4.4 Kumulacja cytrynianu z powodu
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Zjonizowany wapń u pacjenta, pH i wodorowęglan, sód oraz mleczan zgodnie z potrzebą kliniczną, muszą być mierzone na początku lub co najmniej w ciągu pierwszej godziny od rozpoczęcia terapii. Następne przykładowe częstości pomiarów wynoszą: co 1 godzinę dla TPE, co 3-4 godziny dla SLEDD, do co 6-8 godzin dla CVVHD i CVVHDF.
Jeśli stosowane są zbilansowane roztwory, wystarczyć mogą pomiary magnezu i całkowitego
wapnia przed i po zabiegu (TPE, SLEDD) lub raz na dobę (CVVHD, CVVHDF).
Bardziej intensywna kontrola ogólnie wymaga częstości większej o 2-4 razy.
Analizator gazów krwi powinien być bezpośrednio dostępny.
Do pobierania próbek preferowany jest osobny dostęp tętniczy. Port do pobierania próbek jest często dostępny na linii dostępu, jednak jego użycie może powodować fałszywe wyniki pomiarów w przypadku recyrkulacji przy końcówce cewnika.
Pacjenci ze znaną ciężką dysfunkcją mitochondriów (np. zatrucia paracetamolem i metforminą) powinni być raczej leczeni według alternatywnego protokołu antykoagulacji, aby zmniejszyć ryzyko kumulacji cytrynianu (patrz w tym punkcie 4.4 powyżej). Jeśli rozpoczęto leczenie produktem leczniczym Cifoban, należy przestrzegać dawkowania dla szczególnych populacji w punkcie 4.2.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego
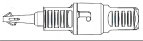
Usunąć kapturek ochronny z łącznika SecuNect z zielonym pierścieniem i połączyć łącznik z odpowiadającą mu częścią o tym samym kolorze, aby zapobiec nieprawidłowemu połączeniu. Nie dotykać żadnych części wewnętrznych, a szczególnie końcówki łącznika. Część wewnętrzna łącznika jest dostarczana w stanie jałowym i nie jest przeznaczona do późniejszego traktowania chemicznymi środkami dezynfekującymi. Połączyć łącznik worka ręcznie ruchem skręcającym z łącznikiem linii drenów, pokonując pewną siłę, aż do słyszalnego “klik”, które potwierdza połączenie.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Cifoban jest dostarczany w worku zawierającym 1500 mL roztworu gotowego do użycia. 1000 mL roztworu zawiera:
Sodu cytrynian 40,0 g
Na+ 408 mmol
Cytrynian3- 136 mmol
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do infuzji
Podanie pozaustrojowe. Wyłącznie do infuzji do pozaustrojowego obiegu krwi.
Roztwór jest przezroczysty i bezbarwny. Nie zawiera widocznych cząstek.
Osmolarność teoretyczna: 544 mOsm/L
pH: 7,1 – 7,5
Cifoban jest stosowany w miejscowej antykoagulacji cytrynianowej (ang.: regional citrate anticoagulation, RCA) w ciągłej żylno-żylnej hemodializie (CVVHD), ciągłej żylno-żylnej hemodiafiltracji (CVVHDF), powolnej niskoprzepływowej codziennej dializie (SLEDD) i terapeutycznej wymianie osocza (TPE) za pomocą przezbłonowej separacji osocza.
Cifoban jest wskazany do stosowania u osób dorosłych i dzieci we wszystkich grupach wiekowych (z wyjątkiem wcześniaków).
Cifoban powinien być przepisywany wyłącznie przez lekarza kompetentnego w stosowaniu miejscowej antykoagulacji cytrynianowej (RCA) w określonym trybie zabiegu CVVHD, CVVHDF, SLEDD i (lub) TPE. W przypadku stosowania u dzieci Cifoban powinien być przepisywany i kontrolowany przez lekarzy kompetentnych w zakresie wyżej wymienionych trybów zabiegu u dzieci.
Dawkowanie
Dorośli
Produkt leczniczy Cifoban podawany w infuzji przed filtrem powinien być dawkowany proporcjonalnie do przepływu krwi w obiegu pozaustrojowym, aby osiągnąć wystarczającą supresję zjonizowanego wapnia we krwi w obrębie filtra, zgodną ze stosowanym protokołem RCA. Ogólnie, należy dążyć do stężenia zjonizowanego wapnia za filtrem poniżej 0,3-0,35 mmol/L, które zwykle jest osiągane przy dawkowaniu 4-5 mmol cytrynianu na litr przepływającej krwi. Wymagany przepływ produktu leczniczego Cifoban (w mL/min) można obliczyć mnożąc to zamierzone dawkowanie cytrynianu przez przepływ krwi (w mL/min) i dzieląc przez 136 mmol/L (tj. stężenie cytrynianu w produkcie leczniczym Cifoban). Ogólnoustrojowe stężenie zjonizowanego wapnia pacjenta powinno być utrzymywane w prawidłowym zakresie fizjologicznym, co zwykle wymaga suplementacji wapnia.
Stosowana objętość produktu leczniczego Cifoban u pacjentów dorosłych nie powinna przekraczać 10,4 litra na dobę. Pozaustrojowy przepływ krwi powinien być wystarczający dla osiągnięcia celów terapii, ale utrzymywany na tyle mały, aby uniknąć niepotrzebnej infuzji cytrynianu i sprzyjać klirensowi cytrynianu w stosowanym filtrze. Zmniejsza to ryzyko nadmiernego obciążenia cytrynianem i jego kumulacji (patrz punkt 4.4). Większe przepływy krwi w połączeniu z mniejszym dawkowaniem produktu leczniczego Cifoban mogą niepotrzebnie zmniejszyć drożność filtra. Jeśli chodzi o skład płynów dializacyjnych i substytucyjnych we wskazanym protokole zabiegu, należy rozważyć roztwory bezwapniowe, niskosodowe i niskowodorowęglanowe. Przy ich wyborze powinny być uwzględniane sód i bufor dostarczane zgodnie ze stosowanym protokołem wraz z produktem leczniczym Cifoban.
Bezwapniowy roztwór dializacyjny należy rozważyć zwłaszcza w przypadku terapii stosowanych w trybie ciągłym. Roztwór dializacyjny zawierający wapń może być rozważony dla zabiegu SLEDD, gdy nie jest dostępny odpowiedni roztwór bezwapniowy. W takim przypadku akceptowane może być większe stężenie wapnia zjonizowanego za filtrem wobec względnie krótkiego czasu trwania zabiegu lub, alternatywnie, produkt leczniczy Cifoban może być dawkowany w większym stężeniu na litr przepływającej krwi. Akceptowanie większych stężeń wapnia zjonizowanego za filtrem może być również właściwe podczas zabiegu TPE, szczególnie gdy płyn substytucyjny zawiera cytrynian (patrz punkt 4.4). Produkt leczniczy Cifoban powinien być wówczas podawany w mniejszym stężeniu na litr przepływającej krwi.
W przypadku stosowania w zabiegu CVVHD lub CVVHDF w połączeniu z roztworem dializacyjnym bezwapniowym o stężeniu sodu 133 mmol/L i stężeniu wodorowęglanu 20 mmol/L, ilość cytrynianu dodawana do krwi przed wejściem do filtra dializacyjnego powinna być utrzymywana pomiędzy
3 a 5 mmol/L krwi podczas zabiegu CVVHD i pomiędzy 3 a 5,5 mmol/L krwi podczas zabiegu CVVHDF. Podobne wytyczne dawkowania mogą mieć zastosowanie w protokołach innych zabiegów.
Szczególne populacje
Pacjenci z zaburzeniem metabolizmu cytrynianu
Cifoban może być stosowany u pacjentów, u których występuje ryzyko wystąpienia zaburzenia metabolizmu cytrynianu (np. wstrząs z ciężką kwasicą mleczanową, ciężka niewydolność wątroby).
Zabieg powinien być rozpoczynany z wystarczająco małą dawką cytrynianu.
W czasie zabiegów CVVHD lub CVVHDF z przepływem krwi nieprzekraczającym 100-120 mL/min zazwyczaj utrzymywany jest wystarczająco mały ładunek cytrynianu. Dawkowanie cytrynianu może być rozpoczęte od 4-5 mmol/L krwi, zgodnie z protokołem, i może być ono zmniejszone tylko przy wyraźnych oznakach kumulacji cytrynianu (patrz punkt 4.4).
W przypadku zabiegu SLEDD z przepływami krwi nieprzekraczającymi około 150-200 mL/min, co najmniej takim samym przepływie dializatu i czasie zabiegu nie dłuższym niż 12 godzin utrzymywane jest zwykle wystarczająco małe obciążenie pacjenta cytrynianem. Jeśli stosuje się dializat zawierający wapń, dawkowanie cytrynianu może być rozpoczęte od dawki do 6-7 mmol/L krwi, zgodnie z protokołem, i może wymagać zmniejszenia tylko przy wyraźnych oznakach kumulacji cytrynianu (patrz punkt 4.4).
W zabiegach TPE klirens cytrynianu w filtrze jest ogólnie ograniczony i stosunkowo mały z powodu maksymalnych akceptowanych frakcji filtracyjnych. Ekspozycja na cytrynian może być dodatkowo zwiększona poprzez użycie w wymianie świeżo mrożonego osocza (FFP). Przy wymianach z użyciem FFP zalecany jest przepływ krwi nieprzekraczający 100-120 mL/min. Dawkowanie cytrynianu może być rozpoczęte od 3-4 mmol/L krwi, zgodnie z protokołem, i może wymagać zmniejszenia tylko przy wyraźnych oznakach kumulacji cytrynianu (patrz punkt 4.4).
We wszystkich tych terapiach zalecana jest ścisła kontrola, aby zapobiec wystąpieniu kumulacji cytrynianu (patrz punkt 4.4).
Pacjenci w wieku podeszłym
U pacjentów w wieku podeszłym może istnieć ryzyko zaburzenia metabolizmu cytrynianu. Nie jest wymagane zmniejszenie dawki. Zalecana jest częsta kontrola w celu wykrycia kumulacji cytrynianu (patrz punkt 4.4).
Dzieci i młodzież
Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego Cifoban
u wcześniaków. Dostępne dane są niewystarczające (patrz punkt 4.4).
Cifoban może być stosowany u dzieci we wszystkich grupach wiekowych (od noworodków urodzonych w terminie aż do młodzieży), gdy obciążenie pacjenta cytrynianem pozostaje wystarczająco małe. Należy zwrócić uwagę, że dla najmniejszych dzieci dostępne są tylko nieliczne dane. Użyte wyposażenie musi być odpowiednie dla zastosowań u dzieci o odpowiedniej masie ciała, włącznie z wymaganymi małymi przepływami krwi.
Wytyczne przepływu krwi i dawki cytrynianu dla grup wiekowych
7-8 mL/kg/min (lub wyższy) zgodnie z użytym wyposażeniem, dawkowanie cytrynianu powinno być rozpoczęte od około 3 mmol/L krwi.
Może być konieczne zmniejszenie dawkowania cytrynianu przy wyraźnych oznakach kumulacji cytrynianu (patrz punkt 4.4). W czasie zabiegów CVVHD lub CVVHDF preferowane docelowe stężenie zjonizowanego wapnia za filtrem wynosi mniej niż 0,3-0,35 mmol/L, ale ten cel zależy od możliwej do osiągnięcia dawki cytrynianu.
Aby zapobiec nadmiernemu obciążeniu cytrynianem i jego kumulacji (patrz punkt 4.4) wymagana jest u noworodków i niemowląt, a zalecana u dzieci i młodzieży, ścisła kontrola. Ponadto należy uwzględnić podane powyżej rozważania dotyczące dawkowania u pacjentów z zaburzeniami metabolizmu cytrynianu. Gdy wskazana jest wymiana z zastosowaniem świeżo mrożonego osocza, w
celu ograniczenia obciążenia pacjenta cytrynianem wymagana jest umiarkowana szybkość wymiany oraz zalecana jest równoległa substytucja wapnia, aby utrzymać prawidłowe systemowe stężenie wapnia zjonizowanego.
Maksymalne objętości infuzji dla przykładowych mas ciała dzieci, od urodzonych w terminie noworodków aż do młodzieży, podano w poniższej tabeli. Należy zauważyć, że stosowane typowe dobowe objętości pozostają wyraźnie poniżej tych ograniczeń, wynikających z zastosowania umiarkowanych przepływów krwi opisanych powyżej.
Masa ciała (kg) | Maksymalna stosowana objętość (litry/doba) |
2,5 | 1,6 |
3 | 1,9 |
5 | 2,2 |
10 | 3,2 |
20 | 4,9 |
30 | 6,4 |
40 | 8,5 |
50 i powyżej | 10,4 |
Sposób podawania
Podanie pozaustrojowe. Wyłącznie do infuzji do pozaustrojowego obiegu krwi.
Infuzja wyłącznie za pomocą pompy zintegrowanej z urządzeniem do pozaustrojowego oczyszczania krwi, którą producent przeznaczył do infuzji stężonego roztworu cytrynianu poprzez segment układu drenów dostępu zlokalizowany przed pompą (“linia dostępu krwi”), aby zmniejszyć ryzyko niezamierzonego przedawkowania (patrz punkt 4.9). Urządzenie powinno również usuwać wraz z płynem wypływającym (efluentem) objętość dostarczaną przez Cifoban, aby zapobiec nadmiernemu obciążeniu płynem (patrz punkt 4.8).
Przestrzegać należy wymienionych w punkcie 4.4 specjalnych ostrzeżeń i środków ostrożności dotyczących stosowania, szczególnie dotyczących kontrolowania i potrzeby dodatkowych substytucji.
Dodatkowo:
zaburzenia metabolizmu)
Ostrzeżenia
Częstość kontrolowania podlegających wpływowi wartości w surowicy pacjenta
Wskazane terapie wymagają ścisłego kontrolowania stanu hemodynamicznego, równowagi płynów, stężenia glukozy, elektrolitów i równowagi kwasowo-zasadowej pacjenta przed i podczas zabiegu. Dokładna częstość zależy od stanu pacjenta i od tego, jak szybko zabieg może spowodować zmiany objętości i składu krwi pacjenta: np., TPE może wywołać te zmiany szybciej niż CVVHD. Muszą to uwzględniać protokoły zabiegu i RCA.
Podczas stosowania produktu leczniczego Cifoban mogą one obejmować następujące częstości kontroli i szczegóły:
Jeśli częścią stosowanego protokołu RCA jest kontrolowanie zjonizowanego wapnia w obiegu pozaustrojowym, wymagany jest odpowiedni port do pobierania próbek. Protokół RCA może wymagać pierwszego pomiaru w ciągu 20-30 minut po rozpoczęciu zabiegu, aby potwierdzić prawidłową instalację obiegu, i kolejnych pomiarów po każdym dostosowaniu dawki produktu leczniczego Cifoban (należy odczekać > 5 minut od dostosowania przed pobraniem próbki dla określenia nowego stężenia zjonizowanego wapnia).
Kumulacja cytrynianu wskutek zaburzenia metabolizmu
U dzieci i osób dorosłych ze zmniejszonym metabolizmem cytrynianu, np. u pacjentów ze zmniejszoną czynnością wątroby, hipoksją (hipoksemią) lub zaburzeniem metabolizmu tlenu, RCA może prowadzić do nagromadzenia cytrynianu. Oznaką jest zjonizowana hipokalcemia, zwiększone zapotrzebowanie na substytucję wapnia, stosunek wapnia całkowitego do wapnia zjonizowanego powyżej 2,25 i (lub) kwasica metaboliczna. Wczesne oznaki mogą obejmować zmniejszony klirens mleczanu podczas terapii. Konieczne może być zwiększenie przepływu dializatu, zmniejszenie przepływu krwi, zmniejszenie dawkowania cytrynianu lub zaprzestanie stosowania produktu leczniczego Cifoban do antykoagulacji. Zaleca się ścisłe kontrolowanie.
Nadmierne obciążenie cytrynianem
Cifoban jest hipernatremiczny i po zmetabolizowaniu stanowi źródło wodorowęglanu. Decydując o składzie innych płynów w ramach protokołu RCA należy preferować koncentraty niskosodowe i niskowodorowęglanowe (patrz punkt 4.2 Dawkowanie i sposób podawania). Pomimo to wystąpić może jatrogenna zasadowica metaboliczna i hipernatremia, którym można przeciwdziałać poprzez zmniejszenie przepływu krwi lub, jeśli jest to zgodne ze stosowanym protokołem RCA, przez zwiększenie przepływu dializatu. Te interwencje zmniejszają obciążenie pacjenta cytrynianem sodu. Ponadto, w przypadku zasadowicy metabolicznej, można rozważyć kontrolowaną infuzję, np. 0,9% chlorku sodu. Podobnie, w przypadku hipernatremii, można rozważyć kontrolowaną infuzję, np. roztworu 5% glukozy. W obu przypadkach lekarz leczący powinien wziąć pod uwagę dodatkowy ładunek objętości.
W przypadku nadmiernego obciążenia cytrynianem wystąpić również może wykrzepianie w filtrze (tj. zmniejszona przepuszczalność filtra). Wykrzepianie w filtrze może zmniejszyć usuwanie wapnia, cytrynianu, sodu i innych substancji oraz powodować hiperkalcemię, zasadowicę metaboliczną, hipernatremię i inne odchylenia od spodziewanego wyniku terapii. W takiej sytuacji jest prawdopodobne, że nie będzie już można skorygować nieprawidłowości za pomocą interwencji wymienionych powyżej. Wówczas filtr należy wymienić.
Niezamierzone przedawkowanie produktu leczniczego, patrz punkt 4.9.
Niewystarczający ładunek cytrynianu
Jeśli inne roztwory stosowane w protokole RCA nadmiernie kompensują efekt dostarczania przez Cifoban sodu i buforu wodorowęglanowego, może wystąpić jatrogenna kwasica metaboliczna i hiponatremia. Tym zaburzeniom równowagi w surowicy można przeciwdziałać, zwiększając przepływ krwi lub, jeśli jest to zgodne ze stosowanym protokołem RCA, zmniejszając przepływ dializatu. Te interwencje zwiększają obciążenie pacjenta cytrynianem sodu. Ponadto, utrzymującej się kwasicy metabolicznej i hiponatremii można również przeciwdziałać, podając kontrolowaną infuzję roztworu wodorowęglanu sodu.
Przedłużone unieruchomienie pacjenta
Podczas stosowania RCA wczesne oznaki zjonizowanej hiperkalcemii mogą być maskowane przez zmniejszenie szybkości infuzji wapnia. Szczególnie u pacjentów pozostających długo w unieruchomionej pozycji może dochodzić do przebudowy/demineralizacji kości, w wyniku której dochodzi do uwalniania wapnia z kości. Może to ostatecznie prowadzić do złamań kości. U pacjentów poddanych RCA w trybie ciągłym przez okres dłuższy niż 2 tygodnie, lub u których dawka podawanego w infuzji wapnia zmniejsza się w sposób postępujący, należy ściśle kontrolować markery obrotu kostnego.
Wczesne wykrzepianie pomimo stosowania RCA
Wczesne wykrzepianie może wystąpić pomimo stosowania adekwatnej RCA u pacjentów w stanie (lub podejrzeniem stanu) nadkrzepliwości (np. indukowana przez heparynę trombocytopenia typu II). W takim przypadku wymagane może być stosowanie odpowiednio wybranego antykoagulanta systemowego. RCA może być stosowana dodatkowo, w celu dalszej poprawy drożności filtra.
Środki ostrożności
Zatrucia powodujące dysfunkcję mitochondriów
Wcześniej występująca hipokalcemia
U pacjentów w stanie krytycznym może występować hipokalcemia. Podczas pierwszych godzin zabiegu z zastosowaniem RCA może dojść do spadku stężenia zjonizowanego wapnia systemowego, który następnie się cofa. Dlatego wcześniej występująca hipokalcemia jest leczona raczej przed rozpoczęciem procedury, aby zmniejszyć ryzyko objawów klinicznie istotnej hipokalcemii po rozpoczęciu zabiegu.
Kompleksowanie i klirens wapnia i magnezu
Cytrynian chelatuje jony wapnia i magnezu, co wskutek następującej potem eliminacji w filtrze, może powodować hipokalcemię (patrz punkty 4.8 i 4.9) i (lub) hipomagnezemię (patrz punkt 4.8). Infuzja
wapnia w celu wyrównania strat jest często praktyką standardową, a konieczna może być również suplementacja magnezu. Konieczność wyrównywania tych strat musi być częścią protokołu RCA.
Substytucja produktami krwiopochodnymi (TPE)
Protokół wymiany w TPE u pacjentów w stanie krytycznym często zawiera podawanie preparatów osocza zawierających cytrynian, np. osocza świeżo mrożonego. Produkty krwiopochodne, oprócz tego, że dostarczają ładunek cytrynianu, mogą być również hipernatremiczne. Zwiększa się więc ryzyko zarówno kumulacji cytrynianu, jak i nadmiernego obciążenia cytrynianem (patrz powyżej). Protokół RCA musi uwzględniać odpowiednie postępowanie.
Interakcje związane z produktem
Nie są spodziewane farmakodynamiczne interakcje lekowe pomiędzy składnikami produktu leczniczego Cifoban. Interakcji można się spodziewać w wyniku nieadekwatnego lub nieprawidłowego stosowania roztworu (patrz punkty 4.4 i 4.9).
Badania interakcji i zgodności z innymi produktami leczniczymi nie zostały przeprowadzone. Dlatego nie wolno do produktu leczniczego Cifoban dodawać żadnych substancji ani roztworów (patrz także punkt 6.2).
Roztwory zawierające wapń stosowane na poziomie filtra (tj. płyn dializacyjny) lub przed filtrem mogą zmniejszyć efekt produktu leczniczego Cifoban.
Interakcje są możliwe z produktami wzbogaconymi sodem, które mogą zwiększać ryzyko hipernatremii (patrz punkt 4.8). Analogicznie, produkty zawierające wodorowęglan (lub prekursory metabolizowane do wodorowęglanu, np. octan) mogą zwiększać ryzyko dużego stężenia wodorowęglanu we krwi (zasadowica metaboliczna, patrz punkt 4.8). Analogicznie, produkty krwiopochodne zawierające cytrynian mogą zwiększać ryzyko większego stężenia cytrynianu we krwi (hipokalcemia, kwasica metaboliczna, patrz punkt 4.8) oraz zwiększenie ryzyka dużego stężenia wodorowęglanu we krwi (zasadowica metaboliczna, patrz punkt 4.8).
Ciąża i karmienie piersią
Brak danych dotyczących stosowania produktu leczniczego Cifoban u kobiet w okresie ciąży i karmienia piersią. Badania na zwierzętach są niewystarczające dla oceny toksycznego wpływu na reprodukcję.
Produktu Cifoban nie należy stosować w okresie ciąży i karmienia piersią, chyba że stan kliniczny
kobiety wymaga zabiegu z RCA.
Płodność
Nie są dostępne dane dotyczące wpływu sodu i cytrynianu na płodność u ludzi.
Nieistotny
Działania niepożądane mogą wynikać ze stosowania roztworu Cifoban lub być związane z samym
zabiegiem dializy.
Klasyfikacja układów i narządów | Częstość występowania | Działania niepożądane (termin preferowany) |
Zaburzenia układu immunologicznego | Nieznana | Nadwrażliwość |
Zaburzenia metabolizmu i odżywiania | Bardzo często (≥1/10) | Hipokalcemia (<1,1 mmol/L) (patrz punkt 4.4) |
Hipernatremia (>145 mmol/L) (patrz punkt 4.4) | ||
Zasadowica metaboliczna (pH >7,45) (patrz nadmierne obciążenie cytrynianem w punkcie 4.4) | ||
Często (≥1/100 do <1/10) | Ciężka hipokalcemia (<0,9 mmol/L) (patrz punkty 4.4 i 4.9) | |
Hipomagnezemia (<0,7 mmol/L) (patrz chelacja przez cytrynian w punkcie 4.4) | ||
Ciężka hipernatremia (>155 mmol/L) (patrz punkty 4.4 and 4.9) | ||
Ciężka zasadowica metaboliczna (pH >7,55) (patrz nadmierne obciążenie cytrynianem w punkcie 4.4) | ||
Ciężka kwasica metaboliczna (pH <7,2) (patrz kumulacja cytrynianu w punkcie 4.4) | ||
Nieznana | Nadmierne obciążenie płynem (patrz sposób podawania w punkcie 4.2) | |
Zaburzenia układu nerwowego | Nieznana | Ból głowy * |
Napad padaczkowy * | ||
Śpiączka *# | ||
Zaburzenia serca | Nieznana | Zaburzenia rytmu serca * |
Zatrzymanie akcji serca *# | ||
Obrzęk płuc (spowodowany ciężką kwasicą metaboliczną) | ||
Zaburzenia naczyniowe | Nieznana | Niedociśnienie tętnicze* |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Nieznana | Skurcz oskrzeli * |
Zatrzymanie oddychania*# | ||
Przyspieszenie oddechu (oddech Kussmaula spowodowany ciężką kwasicą metaboliczną) | ||
Zaburzenia żołądka i jelit | Nieznana | Wymioty * |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Nieznana | Skurcze mięśni/mioklonie * |
* Z powodu (ciężkich) zaburzeń elektrolitowych (np. hipokalcemii, hipernatremii, hipomagnezemii) lub zasadowicy metabolicznej
# potencjalnie zagrażające życiu
Działania niepożądane mogą również wynikać ze stosowania w terapii wyposażenia lub innych roztworów. Należy zapoznać się z mającymi zastosowanie ulotkami produktów/instrukcjami użycia.
Zgłaszanie podejrzenia działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181 C, PL- 02-222 Warszawa, Tel.: + 48 22 49 21 301,
Faks: + 48 22 49 21 309, Strona internetowa: https://smz.ezdrowie.gov.pl. Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Niezamierzone podanie zbyt dużych objętości produktu leczniczego Cifoban może prowadzić do przedawkowania, które może spowodować stan zagrożenia życia pacjenta.
Nieprawidłowa infuzja zbyt dużej ilości cytrynianu powoduje ostrą hipokalcemię (oraz zasadowicę metaboliczną i hipernatremię) i może wywołać u pacjenta powikłania neurologiczne oraz sercowe. Taka sytuacja wymaga skorygowania poprzez natychmiastowe wstrzymanie/zmniejszenie ilości roztworu Cifoban i dożylne podanie wapnia.
Grupa farmakoterapeutyczna: Roztwory do hemodializy i hemofiltracji, roztwory do hemofiltracji
Kod ATC: B05ZB
Roztwór do RCA w CVVHD, CVVHDF, SLEDD i TPE.
RCA jest metodą miejscowej antykoagulacji krwi w obiegu pozaustrojowym przeznaczonym do oczyszczania krwi, bez konieczności stosowania antykoagulantu systemowego. RCA może być używana w obiegach pozaustrojowych, które działają z małymi lub średnimi przepływami krwi. Najlepiej, gdy w tych obiegach pewna frakcja cytrynianu jest usuwana poprzez zabieg oczyszczania krwi. Dane z literatury naukowej wskazują, że RCA może być używana jako antykoagulant pierwszego wyboru we wskazanych terapiach i może być szczególnie korzystna u pacjentów z czynnym krwawieniem lub ze zwiększonym ryzykiem krwawienia. Można zwykle uzyskiwać wyższy stopień antykoagulacji w porównaniu z antykoagulacją systemową, co sprzyja drożności obiegu i wydajności zabiegu.
Podczas pozaustrojowych terapii oczyszczania krwi z antykoagulacją cytrynianową z krwi pacjenta usuwany jest wapń, w ilościach różnych, zależnych od indywidualnej terapii. Powoduje to konieczność substytucji wapnia. Ponadto, część cytrynianu podanego w infuzji podczas RCA zawsze dostaje się do systemowego krążenia pacjenta z powracającą z obiegu krwią. Powoduje to zwiększenie stężenia systemowego cytrynianu, które generalnie stabilizuje się na nowym poziomie, zależnie od aktualnej szybkości infuzji cytrynianu i metabolizmu cytrynianu w wątrobie i innych tkankach.
Kompleksy chelatowe wapń-cytrynian obecne we krwi pacjenta rozpadają się, gdy więcej cytrynianu zostaje zmetabolizowane niż jest podawane systemowo w infuzji. W efekcie netto wolny zjonizowany wapń pozostaje we krwi pacjenta, a następnie ulega redystrybucji w organizmie pacjenta, gdzie ma
istotne znaczenie dla przebudowy kości i jako elektrolit o kluczowych funkcjach komórkowych w całym organizmie (np. w komórkach mięśni i neuronach).
Cytrynian jest prawidłowym metabolitem w organizmie człowieka i substancją pośrednią w cyklu Krebsa. Ten szlak fizjologiczny w połączeniu z łańcuchem oddechowym ma zdolność przetwarzania u większości pacjentów dużych ilości cytrynianu. Cykl Krebsa przebiega w mitochondriach i wszystkie komórki posiadające te organella komórkowe mogą metabolizować cytrynian. Dlatego tkanki bogate w mitochondria, takie jak wątroba, mięśnie szkieletowe i nerki mają większą zdolność tworzenia i eliminacji cytrynianu.
Wchłanianie i dystrybucja
Wchłanianie i dystrybucja sodu i cytrynianu są określane przez stan kliniczny pacjenta, stan metaboliczny i resztkową czynność nerek.
Metabolizm
U człowieka, jak wspomniano powyżej, cytrynian jest substancją pośrednią centralnego szlaku metabolicznego zwanego cyklem Krebsa. Cytrynian jest szybko metabolizowany w kilku narządach/tkankach.
Eliminacja
Znaczna część cytrynianu jest usuwana z płynem wypływającym (efluentem).
Ilość cytrynianu podawana w infuzji ogólnoustrojowo jest metabolizowana w większości komórek somatycznych.
Brak danych przedklinicznych istotnych dla lekarza przepisującego produkt leczniczy.
Woda do wstrzykiwań
Kwas solny 25%
Tego produktu leczniczego nie wolno mieszać z innymi produktami leczniczymi, gdyż brak badań
dotyczących zgodności.
2 lata.
Okres ważności po otwarciu:
Z mikrobiologicznego punktu widzenia produkt należy użyć niezwłocznie. Jeśli nie zostanie użyty niezwłocznie, czas i warunki przechowywania do momentu użycia pozostają odpowiedzialnością użytkownika.
Nie przechowywać w lodówce ani nie zamrażać.
Przechowywać worki w opakowaniu zewnętrznym– tekturowym pudełku w celu ochrony przed światłem.
Produkt leczniczy jest dostarczany parami jako dwa identyczne worki z roztworem, umieszczone w worku ochronnym, połączone perforowanym szwem, który umożliwia ich całkowite rozdzielenie. Worek z roztworem wykonany jest z wielowarstwowej folii będącej mieszaniną polipropylenu i elastomerów, Każdy worek wyposażony jest w rurkę łączącą wykonaną z poliolefin oraz łącznik z poliwęglanu.
Wielkości opakowań
System łącznika SecuNect:
8 worków po 1500 mL
System łącznika Safe●Lock:
8 worków po 1500 mL
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
do stosowania
Usuwanie
Roztwór przeznaczony wyłącznie do jednorazowego użycia. Wszelkie niewykorzystane resztki
roztworu i uszkodzony pojemnik należy usunąć zgodnie z lokalnymi przepisami.
Sposób obchodzenia się z produktem leczniczym
Worki z roztworem wyposażone są w łącznik SecuNect albo w łącznik Safe●Lock.
Przed użyciem worka z roztworem należy przestrzegać następujących punktów:
Przez cały czas podawania produktu leczniczego pacjentowi należy stosować zasady aseptyki. Roztwór powinien być użyty bezpośrednio po otwarciu, aby uniknąć zanieczyszczenia mikrobiologicznego.
Podanie pozaustrojowe. Wyłącznie do infuzji do pozaustrojowego obiegu krwi.
Dla worków z roztworem wyposażonych w łącznik SecuNect (przezroczysty z zielonym pierścieniem):
DOPUSZCZENIE DO OBROTU
Fresenius Medical Care Deutschland GmbH Else-Kröner-Strasse 1
61352 Bad Homburg v.d.H.
Niemcy
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











