Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Egoropal, 25 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Egoropal, 50 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Egoropal, 75 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Egoropal, 100 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Egoropal, 150 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce
25 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Każda ampułko-strzykawka zawiera 39 mg palmitynianu paliperydonu co odpowiada 25 mg paliperydonu.
50 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce Każda ampułko-strzykawka zawiera 78 mg palmitynianu paliperydonu co odpowiada 50 mg paliperydonu.
75 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce
Każda ampułko-strzykawka zawiera 117 mg palmitynianu paliperydonu co odpowiada 75 mg paliperydonu.
100 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce
Każda ampułko-strzykawka zawiera 156 mg palmitynianu paliperydonu co odpowiada 100 mg paliperydonu.
150 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce
Każda ampułko-strzykawka zawiera 234 mg palmitynianu paliperydonu co odpowiada 150 mg paliperydonu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Zawiesina do wstrzykiwań o przedłużonym uwalnianiu w ampułko-strzykawce.
Zawiesina ma kolor biały do białawego. Odczyn pH zawiesiny jest obojętny (około 7,0). Osmolarność zawiesiny wynosi 220-320 mOsm/kg.
Egoropal jest wskazany w leczeniu podtrzymującym w schizofrenii u dorosłych pacjentów, u których uzyskano stabilizację choroby za pomocą paliperydonu lub rysperydonu.
U wybranych dorosłych pacjentów ze schizofrenią, u których wcześniej wystąpiła odpowiedź na leczenie doustne paliperydonem lub rysperydonem, Egoropal można stosować bez uprzedniej stabilizacji leczeniem doustnym, jeśli objawy psychotyczne są łagodne lub umiarkowane i konieczne jest zastosowanie długo działającego leczenia w postaci iniekcji.
Dawkowanie
Zaleca się rozpoczęcie stosowania produktu leczniczego Egoropal od dawki 150 mg w pierwszym dniu leczenia i 100 mg tydzień później (w ósmym dniu leczenia), obie dawki podawane są w mięsień naramienny, w celu szybkiego osiągnięcia stężenia terapeutycznego (patrz punkt 5.2). Trzecia dawka powinna być podana po upływie miesiąca od drugiej dawki inicjującej. Zalecana dawka podtrzymująca wynosi 75 mg, podawane co miesiąc; u niektórych pacjentów korzystne może być stosowanie mniejszej lub większej dawki w zalecanym zakresie od 25 do 150 mg, zależnie od indywidualnej tolerancji leku i (lub) skuteczności. Pacjenci z nadwagą lub otyli mogą wymagać dawek z górnego zakresu (patrz punkt 5.2). Po podaniu drugiej dawki inicjującej można podawać comiesięczne dawki podtrzymujące w mięsień naramienny lub pośladkowy.
Dostosowanie dawki podtrzymującej można przeprowadzać co miesiąc. Podczas dostosowywania dawki należy uwzględnić charakterystykę przedłużonego uwalniania produktu leczniczego Egoropal (patrz punkt 5.2), ponieważ całkowity efekt leczniczy podawania dawek podtrzymujących może nie być widoczny przez kilka miesięcy.
Zmiana z doustnego paliperydonu o przedłużonym uwalnianiu lub doustnego rysperydonu na produkt leczniczy Egoropal
Stosowanie produktu leczniczego Egoropal należy rozpocząć w sposób opisany na początku punktu 4.2, powyżej. Podczas miesięcznego leczenia podtrzymującego produktem leczniczym Egoropal, pacjenci, u których wcześniej uzyskano stabilizację różnymi dawkami paliperydonu w postaci tabletek o przedłużonym uwalnianiu, mogą osiągnąć podobną ekspozycję na paliperydon w stanie stacjonarnym poprzez wstrzyknięcie. Dawki podtrzymujące produktu leczniczego Egoropal potrzebne do osiągnięcia podobnej ekspozycji w stanie stacjonarnym, przedstawiono poniżej:
Dawki paliperydonu w postaci tabletek o przedłużonym uwalnianiu i produktu leczniczego Egoropal potrzebne do uzyskania podobnej ekspozycji na paliperydon w stanie stacjonarnym w czasie terapii podtrzymującej | |
Poprzednia dawka paliperydonu w tabletkach o przedłużonym uwalnianiu | Wstrzyknięcie produktu leczniczego Egoropal |
3 mg dziennie | 25-50 mg miesięcznie |
6 mg dziennie | 75 mg miesięcznie |
9 mg dziennie | 100 mg miesięcznie |
12 mg dziennie | 150 mg miesięcznie |
Wcześniejsze stosowanie doustnego paliperydonu lub doustnego rysperydonu można przerwać w momencie rozpoczynania leczenia produktem leczniczym Egoropal. U niektórych pacjentów korzystne może być stopniowe odstawianie leku. U niektórych pacjentów zmieniających większe dawki doustne paliperydonu (np. 9-12 mg na dobę) na produkt leczniczy Egoropal podawany do mięśnia pośladkowego może wystąpić mniejsza ekspozycja na lek w osoczu w ciągu pierwszych 6 miesięcy po zmianie. Dlatego alternatywnie można rozważyć podawanie zastrzyków w mięsień naramienny przez pierwsze 6 miesięcy.
Zamiana z długo działających iniekcji rysperydonu na produkt leczniczy Egoropal
W przypadku zmiany leczenia z długo działających iniekcji rysperydonu należy rozpocząć leczenie produktem leczniczym Egoropal zamiast następnego zaplanowanego wstrzyknięcia. Stosowanie produktu leczniczego Egoropal należy następnie kontynuować w odstępach miesięcznych. Nie jest wymagany tygodniowy schemat dawkowania początkowego obejmujący wstrzyknięcia domięśniowe (odpowiednio w 1. dniu i 8. dniu), jak opisano powyżej w punkcie 4.2. Pacjenci, których stan został uprzednio ustabilizowany za pomocą różnych dawek długo działających iniekcji rysperydonu mogą osiągnąć podobną ekspozycję na paliperydon w stanie stacjonarnym podczas leczenia podtrzymującego miesięcznymi dawkami produktu leczniczego Egoropal, zgodnie z poniższym:
Dawki długo działających iniekcji rysperydonu i dawki produktu leczniczego Egoropal, wymagane do osiągnięcia podobnej ekspozycji na paliperydon w stanie stacjonarnym | |
Poprzednia dawka długo działających iniekcji rysperydonu | Wstrzyknięcie produktu leczniczego Egoropal |
25 mg co 2 tygodnie | 50 mg co miesiąc |
37,5 mg co 2 tygodnie | 75 mg co miesiąc |
50 mg co 2 tygodnie | 100 mg co miesiąc |
Leki przeciwpsychotyczne należy odstawiać zgodnie z odpowiednimi informacjami dotyczącymi przepisywania produktu. Przerywając stosowanie produktu leczniczego Egoropal, należy wziąć pod uwagę przedłużony charakter jego uwalniania. Należy okresowo oceniać potrzebę kontynuacji stosowania leku zwalczającego objawy pozapiramidowe (ang. extrapyramidal symptoms, EPS).
Pominięte dawki
Unikanie pominiętych dawek
Zaleca się, aby druga dawka inicjująca produktu leczniczego Egoropal została podana tydzień po pierwszej dawce. Aby uniknąć pominięcia dawki, pacjent może otrzymać drugą dawkę 4 dni przed lub po upływie tygodniowego (8. dzień) terminu. Podobnie, trzecie i kolejne wstrzyknięcia po schemacie inicjującym zaleca się podawać co miesiąc. Aby uniknąć pominięcia dawki miesięcznej, pacjent może otrzymać wstrzyknięcie do 7 dni przed lub po upłynięciu miesięcznego terminu.
Jeśli nie zostanie dotrzymany termin drugiego wstrzyknięcia produktu leczniczego Egoropal (dzień 8 ± 4 dni), zalecane ponowne rozpoczęcie leczenia zależy od czasu, jaki upłynął od pierwszego wstrzyknięcia.
Pominięcie drugiej dawki inicjującej (< 4 tygodnie od pierwszego wstrzyknięcia)
Jeśli od pierwszego wstrzyknięcia upłynęło mniej niż 4 tygodnie, pacjent powinien jak najszybciej otrzymać drugie wstrzyknięcie 100 mg w mięsień naramienny. Trzecie wstrzyknięcie produktu leczniczego Egoropal w dawce 75 mg w mięsień naramienny lub pośladkowy powinno być wykonane po upływie 5 tygodni od pierwszego wstrzyknięcia (niezależnie od czasu wykonania drugiego wstrzyknięcia). Następnie należy stosować zwykły miesięczny cykl wstrzyknięć w mięsień naramienny lub pośladkowy w dawce od 25 mg do 150 mg, w zależności od tolerancji i (lub) skuteczności u danego pacjenta.
Pominięcie drugiej dawki inicjującej (4-7 tygodni od pierwszego wstrzyknięcia)
Jeśli od pierwszego wstrzyknięcia produktu leczniczego Egoropal upłynęło od 4 do 7 tygodni, należy wznowić dawkowanie dwoma wstrzyknięciami 100 mg w następujący sposób:
Nadwrażliwość na substancję czynną, rysperydon lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Zastosowanie u pacjentów w stanie silnego pobudzenia lub w ostrym stanie psychotycznym
Produktu leczniczego Egoropal nie należy stosować do leczenia silnego pobudzenia ani ostrych stanów psychotycznych, gdy wymagane jest natychmiastowe złagodzenie objawów.
Odstęp QT
Należy zachować ostrożność, gdy paliperydon przepisywany jest pacjentom z rozpoznaną chorobą układu sercowo-naczyniowego lub z wydłużeniem odstępu QT w wywiadzie rodzinnym, a także podczas jednoczesnego stosowania innych produktów leczniczych, które wydłużają odstęp QT.
Złośliwy zespół neuroleptyczny
Podczas przyjmowania paliperydonu zgłaszano występowanie złośliwego zespołu neuroleptycznego (ang. Neuroleptic Malignant Syndrome, NMS), charakteryzującego się: podwyższeniem temperatury ciała, sztywnością mięśni, niestabilnością układu autonomicznego, zaburzeniami świadomości i zwiększeniem aktywności fosfokinazy kreatynowej w surowicy. Ponadto może wystąpić mioglobinuria (rabdomioliza) i ostra niewydolność nerek. Jeśli u pacjenta rozwiną się objawy przedmiotowe lub podmiotowe wskazujące na zespół NMS, należy przerwać stosowanie paliperydonu.
Późne dyskinezy/objawy pozapiramidowe
Produkty lecznicze o właściwościach antagonistycznych w stosunku do receptorów dopaminy były związane z pojawianiem się późnych dyskinez, charakteryzujących się rytmicznymi ruchami mimowolnymi, głównie języka i (lub) twarzy. Jeśli wystąpią przedmiotowe lub podmiotowe objawy późnych dyskinez, należy rozważyć przerwanie stosowania wszystkich leków przeciwpsychotycznych, w tym paliperydonu.
Należy zachować ostrożność u pacjentów otrzymujących jednocześnie leki psychostymulujące (np. metylofenidat) i paliperydon, gdyż mogą wystąpić objawy pozapiramidowe podczas dostosowywania dawki jednego lub obu leków. Zaleca się stopniowe wycofywanie terapii stymulantem (patrz punkt 4.5)
Leukopenia, neutropenia i agranulocytoza
Podczas stosowania produktu leczniczego Egoropal stwierdzano wystąpienie leukopenii, neutropenii i agranulocytozy. Agranulocytozę po wprowadzeniu paliperydonu do obrotu zgłaszano bardzo rzadko (< 1/10 000 pacjentów). Pacjentów z istotną klinicznie leukopenią lub polekową leukopenią/neutropenią w wywiadzie należy obserwować przez pierwsze kilka miesięcy leczenia. Należy rozważyć odstawienie produktu leczniczego Egoropal przy pierwszym objawie istotnego klinicznie zmniejszenia liczby
leukocytów, wobec braku innych czynników przyczynowych. Pacjentów ze znaczącą klinicznie neutropenią należy uważnie obserwować, czy nie występuje u nich gorączka lub inne objawy przedmiotowe lub podmiotowe infekcji, oraz podjąć natychmiastowe leczenie w razie wystąpienia takich objawów. U pacjentów z ciężką neutropenią (bezwzględna liczba neutrofilów < 1 x 109/L) należy przerwać stosowanie produktu leczniczego Egoropal i badać liczbę leukocytów do momentu powrotu wyniku do normy.
Reakcje nadwrażliwości
Po wprowadzeniu paliperydonu do obrotu rzadko stwierdzano reakcje anafilaktyczne u pacjentów, którzy wcześniej tolerowali doustny rysperydon lub doustny paliperydon (patrz punkty 4.1 i 4.8).
Jeśli wystąpią reakcje nadwrażliwości należy przerwać stosowanie produktu leczniczego Egoropal, rozpocząć ogólne leczenie wspomagające, zgodnie z potrzebami klinicznymi i obserwować pacjenta do czasu ustąpienia objawów przedmiotowych i podmiotowych (patrz punkty 4.3 i 4.8).
Hiperglikemia i cukrzyca
Podczas leczenia paliperydonem stwierdzano wystąpienie hiperglikemii, cukrzycy i zaostrzenia przebiegu wcześniej występującej cukrzycy w tym śpiączkę cukrzycową i kwasicę ketonową. Zaleca się prowadzenie odpowiedniej obserwacji klinicznej zgodnie z wytycznymi terapii przeciwpsychotycznej. Pacjentów leczonych produktem leczniczym Egoropal, należy obserwować pod kątem występowania objawów hiperglikemii (takich jak: polidypsja, poliuria, nadmierne łaknienie i osłabienie), a pacjentów z cukrzycą należy regularnie badać, czy nie pogarsza się u nich kontrola glikemii.
Zwiększenie masy ciała
Podczas stosowania produktu leczniczego Egoropal zgłaszano znaczne zwiększenie masy ciała. Należy regularnie kontrolować masę ciała.
Stosowanie u pacjentów z nowotworami zależnymi od prolaktyny
Badania z wykorzystaniem hodowli tkankowych wskazują, że prolaktyna może stymulować wzrost komórek nowotworów piersi u ludzi. Chociaż w badaniach klinicznych i epidemiologicznych nie wykazano dotychczas wyraźnego związku ze stosowaniem leków przeciwpsychotycznych, zaleca się zachowanie ostrożności u pacjentek z wywiadem medycznym w tym kierunku. Paliperydon należy stosować ostrożnie u pacjentów z wcześniej występującym nowotworem, który może być zależny od prolaktyny.
Niedociśnienie ortostatyczne
Ze względu na działanie blokujące receptory alfa-adrenergiczne paliperydon może wywoływać u niektórych pacjentów niedociśnienie ortostatyczne.
Na podstawie zebranych danych pochodzących z trzech sześciotygodniowych, kontrolowanych placebo badań z użyciem podawanych doustnie tabletek paliperydonu o przedłużonym uwalnianiu w ustalonej dawce (3, 6, 9 i 12 mg) stwierdzono niedociśnienie ortostatyczne u 2,5% badanych przyjmujących doustnie paliperydon i 0,8% badanych przyjmujących placebo. Produkt leczniczy Egoropal należy stosować ostrożnie u pacjentów z rozpoznaną chorobą układu sercowo-naczyniowego (np. niewydolnością serca, zawałem lub niedokrwieniem serca albo zaburzeniami przewodnictwa), chorobą naczyń mózgowych lub stanami predysponującymi pacjenta do niedociśnienia tętniczego (np. odwodnienie i hipowolemia).
Drgawki
Należy zachować ostrożność podczas stosowania produktu leczniczego Egoropal u pacjentów, u których występowały wcześniej drgawki lub stany mogące obniżać próg drgawkowy.
Zaburzenia czynności nerek
Stężenia paliperydonu w osoczu są zwiększone u pacjentów z zaburzeniami czynności nerek i dlatego u pacjentów z łagodnymi zaburzeniami czynności nerek zaleca się dostosowanie dawki. Nie zaleca się stosowania produktu leczniczego Egoropal u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (klirens kreatyniny < 50 mL/min) (patrz punkty 4.2 i 5.2).
Zaburzenia czynności wątroby
Brak dostępnych danych dotyczących pacjentów z ciężkimi zaburzeniami czynności wątroby (klasa C wg Childa-Pugh). Zaleca się ostrożność podczas stosowania paliperydonu u tych pacjentów.
Pacjenci w podeszłym wieku z otępieniem
Nie badano stosowania produktu leczniczego Egoropal u pacjentów w podeszłym wieku z otępieniem. U pacjentów w podeszłym wieku z otępieniem, u których występuje ryzyko udaru mózgu, należy zachować ostrożność podczas stosowania produktu leczniczego Egoropal.
Prezentowane poniżej informacje uzyskano dla rysperydonu, ale przyjmuje się je jako wiążące również dla paliperydonu.
Śmiertelność ogólna
W metaanalizie 17 badań klinicznych z grupą kontrolną, w grupie pacjentów w podeszłym wieku z otępieniem leczonych innymi atypowymi lekami przeciwpsychotycznymi, w tym rysperydonem, arypiprazolem, olanzapiną i kwetiapiną, stwierdzono większe ryzyko zgonu niż w grupie placebo. Wśród pacjentów leczonych rysperydonem śmiertelność wyniosła 4% w porównaniu do 3,1% u pacjentów przyjmujących placebo.
Naczyniowo-mózgowe działania niepożądane
W randomizowanych badaniach klinicznych z grupą kontrolną placebo przeprowadzonych u pacjentów z otępieniem stosujących niektóre atypowe leki przeciwpsychotyczne, w tym rysperydon, arypiprazol i olanzapinę, wystąpiło około 3-krotne zwiększenie ryzyka naczyniowo-mózgowych działań niepożądanych. Mechanizm tego zwiększonego ryzyka nie jest znany.
Choroba Parkinsona i otępienie z obecnością ciał Lewy'ego
Lekarz przepisujący produkt leczniczy Egoropal pacjentowi z chorobą Parkinsona lub otępieniem z obecnością ciał Lewy'ego (ang. Dementia with Lewy Bodies, DLB) powinien rozważyć stosunek ryzyka do korzyści, ze względu na podwyższone w tych grupach pacjentów ryzyko wystąpienia złośliwego zespołu neuroleptycznego (ang. Neuroleptic Malignant Syndrome, NMS), jak również zwiększoną wrażliwość na leki przeciwpsychotyczne. Zwiększona wrażliwość na leki przeciwpsychotyczne może manifestować się splątaniem, zaburzeniem świadomości, niestabilnością postawy ciała z częstymi upadkami, co towarzyszy objawom pozapiramidowym.
Priapizm
Donoszono o przypadkach priapizmu wywołanych przez leki przeciwpsychotyczne (do których należy rysperydon) o działaniu blokującym receptory alfa-adrenergiczne. Podczas obserwacji po wprowadzeniu produktu leczniczego do obrotu odnotowano również przypadki priapizmu wywołane przez paliperydon podawany doustnie, będący aktywnym metabolitem rysperydonu. Należy poinformować pacjentów, aby zgłosili się pilnie do lekarza, jeśli objawy priapizmu nie ustąpią w ciągu 4 godzin.
Regulacja temperatury ciała
Lekom przeciwpsychotycznym przypisywano właściwość zakłócania zdolności organizmu do obniżania temperatury podstawowej ciała. Zaleca się zachowanie odpowiedniej ostrożności w przypadku przypisywania produktu leczniczego Egoropal pacjentom, którzy mogą znaleźć się w sytuacjach sprzyjających podwyższeniu podstawowej temperatury ciała, np.: podejmujących intensywny wysiłek fizyczny, narażonych na działanie skrajnie wysokich temperatur, przyjmujących jednocześnie leki o działaniu przeciwcholinergicznym lub odwodnionych.
Żylna choroba zakrzepowo-zatorowa
Podczas stosowania leków przeciwpsychotycznych zgłaszano incydenty żylnej choroby zakrzepowo- zatorowej (ang. venous thromboembolism, VTE). U pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka zakrzepicy z zatorami w układzie żylnym, z tego względu przed rozpoczęciem oraz w trakcie leczenia produktem leczniczym Egoropal należy rozpoznać wszystkie potencjalne czynniki zwiększające ryzyko wystąpienia żylnej choroby zakrzepowo-zatorowej oraz podjąć odpowiednie środki zapobiegawcze.
Działanie przeciwwymiotne
W badaniach przedklinicznych z użyciem paliperydonu obserwowano działanie przeciwwymiotne. W przypadku stosowania leku u ludzi działanie to może maskować objawy przedmiotowe i podmiotowe przedawkowania niektórych leków lub stany, takie jak niedrożność jelit, zespół Reye’a i nowotwór mózgu.
Sposób podawania
Należy uważać, aby uniknąć nieumyślnego podania produktu leczniczego Egoropal do naczynia krwionośnego.
Śródoperacyjny zespół wiotkiej tęczówki
U pacjentów przyjmujących produkty lecznicze o działaniu antagonistycznym na receptory alfa 1a- adrenergiczne, takie jak Egoropal, stwierdzano podczas operacji usunięcia zaćmy śródoperacyjny zespół wiotkiej tęczówki (ang. intraoperative floppy iris syndrome, IFIS) (patrz punkt 4.8).
Zespół IFIS może zwiększać ryzyko powikłań ocznych w trakcie i po zabiegu. Przed zabiegiem trzeba poinformować wykonującego go okulistę o aktualnym lub wcześniejszym przyjmowaniu produktów leczniczych o działaniu antagonistycznym na receptory alfa 1a-adrenergiczne. Nie ustalono możliwych korzyści z odstawienia leków blokujących receptory alfa 1 przed zabiegiem usunięcia zaćmy i należy to rozważyć wobec ryzyka przerwania leczenia przeciwpsychotycznego.
Substancje pomocnicze
Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) w dawce, to znaczy produkt uznaje się za „wolny od sodu”.
Zaleca się zachowanie ostrożności w przypadku przepisywania produktu leczniczego Egoropal wraz z innymi produktami leczniczymi wydłużającymi ostęp QT, np. lekami przeciwarytmicznymi klasy IA (np. chinidyna, dyzopyramid) oraz lekami przeciwarytmicznymi klasy III (np. amiodaron, sotalol), niektórymi lekami przeciwhistaminowymi, niektórymi innymi lekami przeciwpsychotycznymi, a także niektórymi lekami przeciwmalarycznymi (np. meflokina). Powyższa lista ma charakter informacyjny i nie jest listą wyczerpującą.
Możliwość wpływu produktu leczniczego Egoropal na inne leki
Nie przewiduje się istotnych klinicznie interakcji farmakokinetycznych paliperydonu z produktami leczniczymi, które są metabolizowane przez izoenzymy cytochromu P-450.
Biorąc pod uwagę zasadniczy wpływ paliperydonu na ośrodkowy układ nerwowy (OUN) (patrz punkt 4.8), należy zachować ostrożność, stosując produkt leczniczy Egoropal w połączeniu z innymi produktami leczniczymi działającymi ośrodkowo, np. anksjolitykami, większością leków przeciwpsychotycznych, lekami nasennymi, opioidami, itp. lub alkoholem.
Paliperydon może antagonizować działanie lewodopy i innych agonistów dopaminergicznych. Jeśli to połączenie leków wydaje się konieczne, szczególnie w schyłkowej fazie choroby Parkinsona, należy zastosować najmniejsze skuteczne dawki obu leków.
Z powodu możliwości wywoływania hipotonii ortostatycznej (patrz punkt 4.4), można zaobserwować efekt addytywny w przypadku stosowania produktu leczniczego Egoropal wraz z innymi produktami leczniczymi o takim samym potencjale, np. innymi lekami przeciwpsychotycznymi, lekami trójpierścieniowymi.
Zaleca się ostrożność, jeśli paliperydon podawany jest z innymi produktami leczniczymi, które obniżają próg drgawkowy (tj.: fenotiazyny lub butyrofenony, leki trójpierścieniowe lub selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI), tramadol, meflokina, itd.).
Jednoczesne doustne podawanie tabletek paliperydonu o przedłużonym uwalnianiu w stanie stacjonarnym (12 mg raz na dobę) wraz z tabletkami diwalproinianu sodu o przedłużonym uwalnianiu (od 500 mg do 2000 mg raz na dobę) nie wpływało na farmakokinetykę walproinianu w stanie stacjonarnym.
Nie przeprowadzono badań dotyczących interakcji produktu leczniczego Egoropal i litu, jednak jest ona mało prawdopodobna.
Możliwość wpływu innych leków na produkt leczniczy Egoropal
Badania in vitro wykazały, że w metabolizmie paliperydonu w minimalnym stopniu mogą uczestniczyć enzymy CYP2D6 i CYP3A4, nie ma jednak wyników badań in vitro ani in vivo wskazujących, że te izoenzymy odgrywają znaczącą rolę w metabolizmie paliperydonu. Jednoczesne podawanie doustne paliperydonu z paroksetyną, silnym inhibitorem enzymu CYP2D6, nie miało istotnego klinicznie wpływu na farmakokinetykę paliperydonu.
Jednoczesne podawanie doustnego paliperydonu o przedłużonym uwalnianiu raz na dobę wraz z karbamazepiną w dawce 200 mg dwa razy na dobę spowodowało zmniejszenie średniej wartości Cmax w stanie stacjonarnym oraz wartości AUC paliperydonu o około 37%. Jest to w znacznym stopniu spowodowane zwiększeniem o 35% klirensu nerkowego paliperydonu, prawdopodobnie w wyniku pobudzenia przez karbamazepinę aktywności glikoproteiny P (P-gp) znajdującej się w nerkach. Niewielkie zmniejszenie ilości substancji czynnej wydalonej z moczem w postaci niezmienionej wskazuje
na niewielki wpływ na metabolizm zależny od enzymów CYP lub dostępność biologiczną paliperydonu w przypadku skojarzonego stosowania z karbamazepiną. Większe spadki stężenia paliperydonu w osoczu mogą nastąpić po większych dawkach karbamazepiny.
Rozpoczynając stosowanie karbamazepiny, dawkę produktu leczniczego Egoropal należy ponownie ocenić i, w razie potrzeby, zwiększyć. I odwrotnie, w przypadku przerwania stosowania karbamazepiny, dawkę produktu leczniczego Egoropal należy ponownie ocenić i, w razie potrzeby, zmniejszyć.
Jednoczesne doustne podawanie pojedynczej dawki paliperydonu w postaci tabletek o przedłużonym uwalnianiu (12 mg) wraz z diwalproinianem sodu w postaci tabletek o przedłużonym uwalnianiu (dwie tabletki 500 mg raz dziennie) spowodowało zwiększenie o ok. 50% wartości Cmax i AUC paliperydonu, prawdopodobnie w wyniku zwiększonego wchłaniania po podaniu doustnym.
Ponieważ nie zaobserwowano wpływu na klirens ogólnoustrojowy, nie oczekuje się istotnej klinicznie interakcji między diwalproinianem sodu w postaci tabletek o przedłużonym uwalnianiu i produktu leczniczego Egoropal podawanego we wstrzyknięciu domięśniowym. Nie zbadano tej interakcji w przypadku stosowania produktu leczniczego Egoropal.
Jednoczesne stosowanie produktu leczniczego Egoropal z rysperydonem lub paliperydonem podawanym doustnie
Ponieważ paliperydon jest głównym aktywnym metabolitem rysperydonu, należy zachować ostrożność w razie jednoczesnego stosowania przez dłuższy czas rysperydonu lub doustnego paliperydonu z produktem leczniczym Egoropal. Dane dotyczące bezpieczeństwa stosowania produktu Egoropal jednocześnie z innymi lekami przeciwpsychotycznymi są ograniczone.
Jednoczesne stosowanie produktu leczniczego Egoropal z lekami psychostymulującymi
Jednoczesne stosowanie leków psychostymulujących (np. metylofenidatu) z paliperydonem może prowadzić do wystąpienia objawów pozapiramidowych po zmianie jednego lub obu leków (patrz punkt 4.4).
Ciąża
Brak wystarczających danych dotyczących stosowania paliperydonu w okresie ciąży. Podawany domięśniowo palmitynian paliperydonu i podawany doustnie paliperydon nie wywoływały wad rozwojowych w badaniach przeprowadzonych na zwierzętach, jednak zaobserwowano inne rodzaje szkodliwego wpływu na rozród (patrz punkt 5.3). Noworodki narażone na działanie paliperydonu w czasie trzeciego trymestru ciąży są w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) objawy odstawienia o różnym nasileniu i czasie trwania po porodzie. Obserwowano pobudzenie, wzmożone napięcie mięśniowe, obniżone napięcie mięśniowe, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być uważnie monitorowane. Produktu leczniczego Egoropal nie należy stosować w okresie ciąży, jeśli nie jest to konieczne.
Karmienie piersią
Paliperydon przenika do mleka ludzkiego w takiej ilości, że może wpływać na organizm dziecka karmionego piersią, jeśli kobieta karmiąca przyjmuje dawki terapeutyczne leku. Produkt leczniczy Egoropal nie powinien być stosowany podczas karmienia piersią.
Płodność
W badaniach nieklinicznych nie zaobserwowano istotnego wpływu na płodność.
Paliperydon może wywierać niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn ze względu na potencjalne działanie na układ nerwowy i wzrok, wiążące się z objawami takimi jak sedacja, senność, omdlenia, niewyraźne widzenie (patrz punkt 4.8). Dlatego należy poinformować pacjentów, aby nie prowadzili pojazdów mechanicznych ani nie obsługiwali maszyn, aż do ustalenia indywidualnej podatności na działanie produktu leczniczego Egoropal.
Podsumowanie profilu bezpieczeństwa
W badaniach klinicznych najczęściej zgłaszano następujące działania niepożądane leku: bezsenność, ból głowy, lęk, infekcję górnych dróg oddechowych, reakcje w miejscu wstrzyknięć, parkinsonizm, zwiększenie masy ciała, akatyzję, pobudzenie, sedację/senność, nudności, zaparcia, zawroty głowy pochodzenia ośrodkowego, ból mięśniowo-szkieletowy, częstoskurcz serca, drżenie, ból w jamie brzusznej, wymioty, biegunkę, zmęczenie i dystonię. Akatyzja i sedacja/senność były zależne od wielkości dawki.
Tabelaryczne zestawienie zdarzeń niepożądanych
Poniżej wymieniono wszystkie działania niepożądane zgłoszone podczas stosowania paliperydonu zgodnie z kategoriami częstości występowania w badaniach klinicznych palmitynianu paliperydonu.
Przyjęto następujące określenia odnoszące się do częstości występowania działań niepożądanych: bardzo często (≥ 1/10 ); często (≥ /100 do < 1/10); niezbyt często (≥ 1/1000 do < 1/100); rzadko (≥ 1/10 000 do < 1/1000); bardzo rzadko (< 1/10 000); częstość nieznana (nie można oszacować częstości na podstawie dostępnych danych).
Klasyfikacja układów i narządów | Działania niepożądane produktu leczniczego | ||||
Częstość | |||||
Bardzo często | Często | Niezbyt często | Rzadko | Częstość nieznana a | |
Zakażenia i zarażenia pasożytnicze | zakażenie górnych dróg oddechowych, zakażenie dróg moczowych, grypa | zapalenie płuc, zapalenie oskrzeli, zakażenie dróg oddechowych, zapalenie zatok, zapalenie pęcherza moczowego, zakażenie ucha, zapalenie migdałków, grzybica paznokci, zapalenie tkanki łącznej | zakażenie oka, zapalenie skóry wywołane przez roztocza, ropień podskórny | ||
Zaburzenia krwi i układu | zmniejszenie liczby | neutropenia, zwiększenie | agranulocyto za | ||
chłonnego | leukocytów, trombocytope- nia, niedokrwistość | liczby eozynofilów | |||
Zaburzenia układu immunologiczne go | nadwrażliwość | reakcja anafilaktycz na | |||
Zaburzenia endokrynologicz ne | hiperprolaktyne miab | nieprawidłowe wydzielanie hormonu antydiurety- cznego, obecność glukozy w moczu | |||
Zaburzenia metabolizmu i odżywiania | hiperglikemia, zwiększenie masy ciała, zmniejszenie masy ciała, zmniejszenie apetytu | cukrzycad, hiperinsuline- mia, zwiększenie apetytu, jadłowstręt, zwiększenie stężenia triglicerydów we krwi, zwiększone stężenie cholesterolu we krwi | cukrzycowa kwasica ketonowa, hipoglikemia, polidypsja | zatrucie wodne | |
Zaburzenia psychiczne | bezsennośće | pobudzenie, depresja, lęk | zaburzenia snu, mania, zmniejszone libido, nerwowość, koszmary senne | katatonia, stan splątania, somnambu- lizm, przytępiony afekt, anorgazmia | zaburzenia odżywiania związane ze snem |
Zaburzenia układu nerwowego | parkinsonizmc, akatyzjac, sedacja/sennoś ć, dystoniac, zawroty głowy pochodzenia ośrodkowego, dyskinezac, drżenie, ból głowy | późne dyskinezy, omdlenia, hiperaktywność psychomotoryczn a, zawroty głowy związane z pozycją ciała, zaburzenia koncentracji, dyzartria, zaburzenia smaku, niedoczulica, parestezje | złośliwy zespół neurolep- tyczny, niedokrwie-nie mózgu, brak reakcji na bodźce, utrata świadomości, zmniejszony poziom świadomości, napady drgawkowee, zaburzenia równowagi, nieprawidło- | śpiączka cukrzycowa, kiwanie głową |
wa koordynacja, | |||||
Zaburzenia oka | niewyraźne widzenie, zapalenie spojówek, suche oko | jaskra, zaburzenia ruchów gałki ocznej, rotacyjne ruchy gałek ocznych, światło-wstręt, zwiększone łzawienie, przekrwienie oczu | zespół wiotkiej tęczówki (śródoperacy jny) | ||
Zaburzenia ucha i błędnika | zawroty głowy pochodzenia błednikowego, szum w uszach, ból ucha | ||||
Zaburzenia serca | tachykardia | blok przedsionkowo- komorowy, zaburzenia przewodzenia wydłużenie odstępu QT, zespół tachykardii postawno- ortostatycznej, bradykardia, nieprawidłowy zapis EKG, kołatanie serca | migotanie przedsion- ków, niemiarowość zatokowa | ||
Zaburzenia naczyniowe | nadciśnienie tętnicze | niedociśnienie tętnicze, niedociśnienie ortostatyczne | zakrzepica żył głębokich, napady zaczerwienieni a | zatorowość płucna, niedokrwieni e | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | kaszel, przekrwienie błony śluzowej nosa | duszność, przekrwienie dróg oddechowych, sapanie, ból gardła i krtani, krwawienie z nosa | zespół bezdechu sennego, zastój krwi w płucach, szmery oddechowe | hiperwentyla cja, zachłystowe zapalenie płuc, dysfonia | |
Zaburzenia żołądka i jelit | ból w jamie brzusznej, wymioty, nudności, | dyskomfort w jamie brzusznej, zapalenie | zapalenie trzustki, obrzęk języka, | niedrożność jelit |
zaparcia, biegunka, niestrawność, ból zęba | żołądka i jelit, dysfagia, suchość śluzówki jamy ustnej, wzdęcia | nietrzymanie stolca, kamienie kałowe, zapalenie warg | |||
Zaburzenia wątroby i dróg żółciowych | zwiększenie aktywności aminotransfera z | zwiększenie aktywności gammaglutamylo transferazy, zwiększenie aktywności enzymów wątrobowych | żółtaczka | ||
Zaburzenia skóry i tkanki podskórnej | pokrzywka, świąd, wysypka, łysienie, wyprysk, sucha skóra, rumień, trądzik | wysypka polekowa, hiperkeratoza, łupież | zespół Stevensa- Johnsona/tok sycz-na nekroliza naskórka, obrzęk naczynioruc howy, odbarwienie skóry, łojotokowe zapalenie skóry | ||
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | ból mięśniowo- szkieletowy, bóle pleców, bóle stawów | zwiększone aktywności kinazy fosfokreaty- nowej we krwi, skurcze mięśni, sztywność stawów, osłabienie mięśni, ból szyi | rabdomioliza, obrzęk stawów | nieprawidło wa postawa ciała | |
Zaburzenia nerek i układu moczowego | nietrzymanie moczu, częstomocz, dysuria | zastój moczu | |||
Ciąża, połóg i okres okołoporodowy | noworodkow y zespół odstawienia (patrz punkt 4.6) | ||||
Zaburzenia układu rozrodczego i piersi | brak miesiączki, mlekotok | zaburzenia erekcji, zaburzenia ejakulacji, zaburzenia | dyskomfort w obrębie piersi, obrzmienie, piersi, | priapizm |
miesiączkow- aniae ginekomastia, zaburzenia seksualne, ból piersi | powiększenie piersi, wydzielina z pochwy | ||||
Zaburzenia ogólne i stany w miejscu podania | gorączka, astenia, zmęczenie, reakcja w miejscu wstrzyknięcia | obrzęk twarzy, obrzęke, zwiększenie temperatury ciała, nieprawidłowy sposób chodzenia, ból w klatce piersiowej, dyskomfort w klatce piersiowej, złe samopoczucie, stwardnienie | hipotermia, dreszcze, pragnienie, zespół odstawienia leku, ropień w miejscu wstrzyknię- cia, zapalenie tkanki łącznej w miejscu wstrzyknię- cia, torbiel w miejscu wstrzyknię- cia, krwiak w miejscu wstrzyknięcia | zmniejszenie temperatury ciała, martwica w miejscu wstrzyknięci a, wrzód w miejscu wstrzyknię- cia | |
Urazy, zatrucia i powikłania po zabiegach | upadki |
a Częstość występowania tych działań niepożądanych została zakwalifikowana jako „nieznana”, gdyż nie stwierdzano ich w badaniach klinicznych palmitynianu paliperydonu. Pochodziły one albo ze zgłoszeń spontanicznych po wprowadzeniu paliperydonu do obrotu, których częstości nie da się określić, albo z danych dotyczących rysperydonu (jakiejkolwiek postaci) lub doustnego paliperydonu uzyskanych z badań klinicznych i (lub) zgłoszeń po wprowadzeniu do obrotu.
b Patrz poniżej „Hiperprolaktynemia”.
c Patrz poniżej „Objawy pozapiramidowe”.
d W badaniach z kontrolą placebo cukrzycę zgłaszano u 0,32% osób leczonych produktem leczniczym Egoropal w porównaniu do 0,39% w grupie placebo. Całkowita częstość występowania cukrzycy we wszystkich badaniach klinicznych wyniosła 0,65% u wszystkich osób leczonych palmitynianem paliperydonu.
e Bezsenność obejmuje: trudności z zasypianiem, bezsenność śródnocną; Napady drgawkowe obejmują: uogólniony napad toniczno-kloniczny; Obrzęk obejmuje: obrzęk uogólniony, obrzęk obwodowy, obrzęk ciastowaty. Zaburzenia miesiączkowania obejmują: opóźnienia miesiączki, nieregularne miesiączkowanie, skąpe miesiączkowanie.
Działania niepożądane stwierdzone podczas stosowania postaci farmaceutycznych rysperydonu
Paliperydon jest czynnym metabolitem rysperydonu, dlatego profile działań niepożądanych tych substancji (w tym zarówno postaci doustnych, jak i postaci we wstrzyknięciach) odpowiadają sobie wzajemnie.
Opis wybranych działań niepożądanych
Reakcja anafilaktyczna
Po wprowadzeniu paliperydonu do obrotu zgłaszano rzadkie przypadki reakcji anafilaktycznej po wstrzyknięciu paliperydonu u pacjentów, którzy wcześniej tolerowali doustne postacie rysperydonu lub paliperydonu (patrz punkt 4.4).
Reakcje w miejscu wstrzyknięcia
Najczęściej zgłaszanym działaniem niepożądanym związanym z miejscem wstrzyknięcia był ból. Nasilenie większości zgłaszanych reakcji określano jako łagodne do umiarkowanego. We wszystkich badaniach fazy 2 i 3 w ocenie bólu w miejscu wstrzyknięcia paliperydonu przez badanych opartej na skali wzrokowo-analogowej wykazano tendencję do zmniejszania częstości występowania i natężenia odczucia z czasem. Wstrzyknięcia do mięśnia naramiennego były postrzegane jako nieznacznie bardziej bolesne od analogicznego wstrzyknięcia do mięśnia pośladkowego. Pozostałe reakcje w miejscu wstrzyknięcia charakteryzowały się przeważnie łagodnym nasileniem i obejmowały stwardnienie (często), świąd (niezbyt często) i guzki (rzadko).
Objawy pozapiramidowe (ang. Extrapyramidal symptoms, EPS)
Objawy pozapiramidowe uwzględniały łącznie następujące zespoły objawów: parkinsonizm (w tym zwiększone wydzielanie śliny, sztywność mięśni szkieletowych, parkinsonizm, ślinienie się, sztywność typu koła zębatego, bradykinezja, hipokinezja, maskowata twarz, napięcie mięśni, akinezja, sztywność karku, sztywność mięśni, chód parkinsonowski, nieprawidłowy odruch gładziznowy oraz drżenie spoczynkowe w parkinsonizmie), akatyzja (w tym akatyzja, niepokój psychoruchowy, hiperkinezja, zespół niespokojnych nóg), dyskineza (dyskineza, drganie mięśni, choreoatetoza, atetoza i mioklonia), dystonia (w tym dystonia, wzmożone napięcie mięśni, kręcz szyi, mimowolne skurcze mięśni, przykurcze mięśni, kurcz powiek, rotacja gałek ocznych, porażenie języka, skurcz mięśni twarzy, skurcz mięśni krtani, miotonia, opistotonus, skurcz części ustnej gardła, pleurototonus, skurcz języka i szczękościsk) oraz drżenie. Należy zauważyć, że uwzględniono szersze spektrum objawów, które niekoniecznie mają pochodzenie pozapiramidowe.
Zwiększenie masy ciała
W trwającym 13 tygodni badaniu u pacjentów przyjmujących dawkę początkową 150 mg, częstość występowania nieprawidłowego zwiększenia masy ciała ≥ 7% była zależna od dawki i wynosiła 5% u badanych z grupy przyjmującej placebo oraz 6%, 8% i 13% w grupach stosujących wstrzyknięcia paliperydonu w dawkach odpowiednio 25 mg, 100 mg i 150 mg.
W trwającej 33 tygodnie otwartej fazie przejściowej/podtrzymującej długoterminowego badania dotyczącego zapobiegania nawrotom, 12% badanych przyjmujących wstrzyknięcia paliperydonu spełniło to kryterium (zwiększenie masy ciała ≥ 7% od fazy podwójnie ślepej próby aż do punktu końcowego badania); średnia (SD, ang. standard deviation) zmiana masy ciała od punktu wyjścia fazy otwartej wyniosła + 0,7 (4,79) kg.
Hiperprolaktynemia
W badaniach klinicznych zaobserwowano wzrost mediany stężenia prolaktyny w surowicy u badanych obu płci przyjmujących wstrzyknięcia paliperydonu.
Działania niepożądane, które mogą wskazywać na zwiększone stężenie prolaktyny (np. brak miesiączki, mlekotok, zaburzenia menstruacji, ginekomastia) wystąpiły ogółem u < 1% badanych.
Efekt klasy terapeutycznej
W związku z przyjmowaniem leków przeciwpsychotycznych mogą wystąpić następujące działania niepożądane: wydłużenie odstępu QT, niemiarowości komorowe (migotanie komór, tachykardia komorowa), nagły zgon z niewyjaśnionych przyczyn, zatrzymanie krążenia oraz częstoskurcz komorowy typu torsade de pointes.
Zgłaszano przypadki żylnej choroby zakrzepowo-zatorowej, w tym zatorowości płucnej oraz zakrzepicy żył głębokich, związane ze stosowaniem leków przeciwpsychotycznych (częstość występowania nieznana).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, 02-222 Warszawa,
Tel.: + 48 22 49 21 301,
Faks: + 48 22 49 21 309,
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy
Na ogół spodziewane objawy przedmiotowe i podmiotowe są takie same, jak znane skutki farmakologiczne związane z przedawkowaniem paliperydonu, tj. senność i sedacja, częstoskurcz i niedociśnienie tętnicze, wydłużenie odstępu QT oraz objawy pozapiramidowe. U pacjentów, którzy przedawkowali przyjmowany doustnie paliperydon zgłaszano przypadki częstoskurczu komorowego typu torsade de pointes oraz migotanie komór. W razie ostrego stanu związanego z przedawkowaniem należy rozważyć możliwość jednoczesnego wpływu różnych leków.
Postępowanie
Oceniając potrzeby terapeutyczne oraz powrót do zdrowia należy uwzględnić przedłużone uwalnianie produktu leczniczego i długi okres półtrwania paliperydonu. Nie ma określonej odtrutki na paliperydon. Należy zastosować doraźne środki zaradcze. Należy zapewnić i podtrzymywać drożność dróg oddechowych oraz zapewnić właściwe natlenienie i wentylację.
Należy natychmiast rozpocząć obserwację układu sercowo-naczyniowego, w tym stałe monitorowanie EKG pod kątem potencjalnych niemiarowości. W razie niedociśnienia tętniczego i zapaści krążeniowej należy podjąć odpowiednie środki zaradcze, takie jak dożylne podawanie płynu i (lub) środków sympatykomimetycznych. W przypadku ciężkich objawów pozapiramidowych należy podać środki przeciwcholinergiczne. Należy kontynuować ścisły nadzór i obserwację, aż do wyzdrowienia pacjenta.
Grupa farmakoterapeutyczna: leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX13
Egoropal zawiera mieszaninę racemiczną (+)- i (-)-paliperydonu.
Mechanizm działania
Paliperydon jest selektywnym czynnikiem blokującym działanie monoamin, którego właściwości farmakologiczne różnią się od właściwości neuroleptyków klasycznych. Paliperydon silnie wiąże się z receptorami serotoninergicznymi 5-HT2 i dopaminergicznymi D2. Blokuje także receptory alfa 1- adrenergiczne i nieznacznie słabiej receptory H1-histaminergiczne i alfa 2-adrenergiczne. Aktywność farmakologiczna enancjomerów (+)- i (-)-paliperydonu jest podobna pod względem jakościowym i ilościowym.
Paliperydon nie wiąże się z receptorami cholinergicznymi. Chociaż paliperydon jest silnym antagonistą receptorów D2, co, jak się uważa, łagodzi objawy wytwórcze schizofrenii, powoduje rzadziej stany kataleptyczne i w mniejszym stopniu hamuje funkcje motoryczne niż klasyczne neuroleptyki. Dominujący ośrodkowy antagonizm serotoniny może zmniejszać tendencję paliperydonu do powodowania pozapiramidowych działań niepożądanych.
Skuteczność kliniczna
Leczenie ostrej fazy schizofrenii
Skuteczność paliperydonu w postaci iniekcji w leczeniu ostrego nawrotu schizofrenii oceniono w czterech podwójnie zaślepionych, randomizowanych, kontrolowanych placebo krótkoterminowych badaniach (jedno trwające 9 tygodni i trzy trwające 13 tygodni), polegających na podawaniu stałej dawki dorosłym, hospitalizowanym pacjentom z nawrotem, spełniających kryteria klasyfikacji schizofrenii DSM-IV. W badaniach tych stałą dawkę paliperydonu w postaci iniekcji podawano w dniach: 1., 8. i 36. badania trwającego 9 tygodni oraz dodatkowo w 64. dniu badania trwającego 13 tygodni. Podczas leczenia nawrotu schizofrenii nie było potrzebne doustne podawanie dodatkowych leków przeciwpsychotycznych. Pierwszorzędowym punktem końcowym było zmniejszenie całkowitej punktacji skali objawów pozytywnych i negatywnych (ang. Positive and Negative Syndrome Scale, PANSS), co przedstawiono w poniższej tabeli. Skala PANSS to zwalidowany wielopozycyjny spis składający się z pięciu czynników do oceny objawów pozytywnych, negatywnych, dezorganizacji myślenia, niekontrolowanej wrogości/podniecenia oraz lęku/depresji. Funkcjonowanie oceniono za pomocą skali funkcjonowania indywidualnego i społecznego (ang. Personal and Social Performance, PSP). Skala PSP jest zwalidowaną skalą, używaną przez lekarzy klinicystów, służącą do określania funkcjonowania indywidualnego i społecznego w czterech obszarach: aktywności użytecznych społecznie (praca i nauka), związków osobistych i społecznych, dbałości o higienę osobistą oraz zachowań agresywnych i zakłócających porządek.
W badaniu trwającym 13 tygodni (n = 636), porównującym działanie trzech stałych dawek paliperydonu w postaci iniekcji (początkowe wstrzyknięcie do mięśnia naramiennego 150 mg, a następnie 3 dawki podane do mięśnia pośladkowego lub naramiennego: 25 mg/4 tygodnie, 100 mg/4 tygodnie lub 150 mg/4 tygodnie) do placebo, wszystkie trzy dawki paliperydonu w postaci iniekcji wykazały działanie lepsze od placebo pod względem poprawy całkowitej punktacji w skali PANSS. W tym badaniu w grupach leczonych dawkami 100 mg/4 tygodnie oraz 150 mg/4 tygodnie wykazano statystyczną przewagę nad placebo pod względem punktacji w skali PSP. Nie dotyczyło to dawki 25 mg/4 tygodnie. Wyniki te potwierdzają skuteczność produktu w ciągu całego okresu leczenia i poprawę punktacji w skali PANSS. Zaobserwowano je już w 4. dniu, natomiast do 8. dnia nastąpiło wyraźne rozróżnienie wyników w grupach przyjmujących paliperydon w postaci iniekcji w dawkach 25 mg i 150 mg w porównaniu do grupy przyjmującej placebo.
Inne badania dostarczyły statystycznie istotnych wyników przemawiających na korzyść paliperydonu w postaci iniekcji, oprócz dawki 50 mg w jednym badaniu (patrz tabela poniżej).
Całkowita punktacja w skali objawów pozytywnych i negatywnych w schizofrenii (PANSS) — zmiana z punktu wyjścia do punktu końcowego — ekstrapolacja ostatniej obserwacji (ang. Last Observation Carried Forward, LOCF) dla badań R092670-SCH-201, R092670-PSY-3003, R092670-PSY-3004 i R092670-PSY-3007: Zestaw analiz skuteczności podstawowej | |||||
Placebo | 25 mg | 50 mg | 100 mg | 150 mg | |
R092670-PSY-3007* | n = 160 | n = 155 | n = 161 | n = 160 | |
Średnia wyjściowa (SD) | 86,8 (10,31) | 86,9 (11,99) | -- | 86,2 (10,77) | 88,4 (11,70) |
Średnia zmiana (SD) | -2,9 (19,26) | -8,0 (19,90) | -11,6 (17,63) | -13,2 (18,48) | |
Wartość p (vs. placebo) | -- | 0,034 | < 0,001 | < 0,001 | |
R092670-PSY-3003 | n = 132 | n = 93 | n = 94 | n = 30 | |
Średnia wyjściowa (SD) | 92,4 (12,55) | -- | 89,9 (10,78) | 90,1 (11,66) | 92,2 (11,72) |
Średnia zmiana (SD) | -4,1 (21,01) | -7,9 (18,71) | -11,0 (19,06) | -5,5 (19,78) | |
Wartość p (vs. placebo) | -- | 0,193 | 0,019 | -- | |
R092670-PSY-3004 | n = 125 | n = 129 | n = 128 | n = 131 | |
Średnia wyjściowa (SD) | 90,7 (12,22) | 90,7 (12,25) | 91,2 (12,02) | 90,8 (11,70) | -- |
Średnia zmiana (SD) | -7,0 (20,07) | -13,6 (21,45) | -13,2 (20,14) | -16,1 (20,36) | |
Wartość p (vs. placebo) | -- | 0,015 | 0,017 | < 0,001 | |
R092670-SCH-201 | n = 66 | n = 63 | n = 68 | ||
Średnia wyjściowa (SD) | 87,8 (13,90) | -- | 88,0 (12,39) | 85,2 (11,09) | -- |
Średnia zmiana (SD) | 6,2 (18,25) | -5,2 (21,52) | -7,8 (19,40) | ||
Wartość p (vs. placebo) | -- | 0,001 | < 0,0001 | ||
*W przypadku badania R092670-PSY-3007 dawkę początkową wynoszącą 150 mg podano wszystkim pacjentom przyjmującym paliperydon w postaci iniekcji w 1. dniu, a następnie podawano im później przydzieloną dawkę.
Uwaga: ujemna zmiana punktacji oznacza poprawę.
Utrzymywanie kontroli objawów i opóźnianie nawrotu schizofrenii
Skuteczność paliperydonu w postaci iniekcji w utrzymywaniu kontroli objawów i opóźnianiu nawrotu schizofrenii ustalono w długoterminowym, podwójnie zaślepionym, kontrolowanym placebo badaniu przy użyciu zmiennych dawek, przeprowadzonym z udziałem 849 osób dorosłych, niebędących w podeszłym wieku i spełniających kryteria klasyfikacji schizofrenii DSM-IV. Badanie to składało się z otwartego trwającego 33 tygodnie etapu leczenia fazy ostrej i stabilizacji, randomizowanego podwójnie zaślepionego kontrolowanego placebo etapu obserwacji pod kątem nawrotu choroby oraz trwającego 52 tygodnie otwartego okresu dodatkowego. W tym badaniu dawki paliperydonu w postaci iniekcji wynosiły 25, 50, 75 i 100 mg i były podawane co miesiąc; dawka 75 mg była dozwolona wyłącznie w trwającym 52 tygodnie otwartym okresie dodatkowym. Badane osoby początkowo otrzymywały odpowiednio dobierane dawki (25-100 mg) paliperydonu w postaci iniekcji w 9-tygodniowym okresie przejściowym, po czym nastąpił trwający 24 tygodnie okres podtrzymujący, w którym wymagano, aby punktacja w skali PANSS wyniosła dla badanych ≤ 75. Dostosowanie dawki było dozwolone jedynie w ciągu pierwszych 12 tygodni okresu podtrzymującego. Łącznie 410 stabilnych pacjentów przydzielono losowo do grupy przyjmującej paliperydon w postaci iniekcji [mediana czasu trwania wynosiła 171 dni (zakres: od 1 do 407 dni)] lub grupy przyjmującej placebo [mediana czasu trwania wynosiła 105 dni (zakres: od 8 do 441 dni)] aż do nawrotu objawów schizofrenii w trakcie podwójnie zaślepionego etapu badania o różnym czasie trwania.
Badanie przerwano wcześniej ze względu na skuteczność, gdyż zaobserwowano znacznie
dłuższy czas do nawrotu choroby (p < 0,0001, Rys. 1) u pacjentów przyjmujących paliperydon w postaci iniekcji w porównaniu do placebo (współczynnik ryzyka = 4,32; 95% przedział ufności (CI): 2,4-7,7).
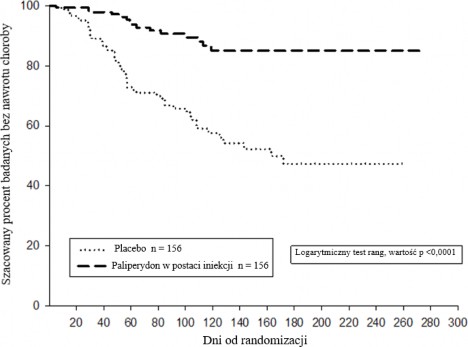
Rysunek 1: Wykres Kaplan-Meier'a przedstawiający czas do nawrotu — analiza pośrednia (zestaw analiz pośrednich według zamiaru leczenia ITT)
Dzieci i młodzież
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań paliperydonu w postaci iniekcji we wszystkich podgrupach populacji dzieci i młodzieży ze schizofrenią (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
Wchłanianie i dystrybucja
Palmitynian paliperydonu jest estrem palmitynowym, prolekiem paliperydonu. Z powodu bardzo małej rozpuszczalności w wodzie, palmitynian paliperydonu po wstrzyknięciu domięśniowo rozpuszcza się powoli, zanim zostanie zhydrolizowany do paliperydonu i wchłonięty do krążenia ustrojowego. Po podaniu domięśniowym pojedynczej dawki stężenie paliperydonu w osoczu stopniowo wzrasta, osiągając wartość maksymalną przy medianie czasu Tmax wynoszącej 13 dni.
Uwalnianie substancji czynnej rozpoczyna się już w 1. dniu i trwa przez co najmniej 4 miesiące.
Po wstrzyknięciu domięśniowo pojedynczych dawek (25-150 mg) do mięśnia naramiennego zaobserwowano stężenie Cmax większe o ok. 28% w porównaniu do wstrzyknięcia do mięśnia pośladkowego. Dwa początkowe wstrzyknięcia do mięśnia naramiennego dawki 150 mg w 1. Dniu i dawki 100 mg w 8. dniu (przy użyciu palmitynianu paliperydonu do wstrzykiwań do leczenia początkowego) ułatwiają szybkie uzyskanie stężeń terapeutycznych. Profil uwalniania i schemat dawkowania paliperydonu w postaci iniekcji umożliwia utrzymanie tych stężeń. Całkowita ekspozycja na paliperydon po podaniu paliperydonu w postaci iniekcji była proporcjonalna do dawki w zakresie 25-150 mg i mniejsza niż proporcjonalna do dawki pod względem Cmax dla dawek przekraczających 50 mg. Średnia proporcja stężenia maksymalnego do stężenia minimalnego w stanie stacjonarnym w przypadku dawki 100 mg paliperydonu w postaci iniekcji wyniosła 1,8 po podaniu do mięśnia pośladkowego i 2,2 po
podaniu do mięśnia naramiennego. Mediana pozornego okresu półtrwania paliperydonu po podaniu paliperydonu w postaci iniekcji w dawce z zakresu 25-150 mg wynosiła od 25 do 49 dni.
Całkowita dostępność biologiczna palmitynianu paliperydonu po podaniu paliperydonu w postaci iniekcji wynosi 100%.
Po podaniu palmitynianu paliperydonu enancjomery (+) i (-) paliperydonu przechodzą przemianę wzajemną, osiągając stosunek (+) do (-) wartości AUC wynoszący około 1,6-1,8.
Wiązanie mieszaniny racemicznej paliperydonu przez białka osocza wynosi 74%. Metabolizm i eliminacja
Tydzień po podaniu doustnym pojedynczej dawki 1 mg natychmiast uwalnianego 14C-paliperydonu 59% dawki było wydalane w postaci niezmienionej z moczem, co oznacza, że paliperydon nie jest w znacznym stopniu metabolizowany przez wątrobę. Około 80% podanej dawki znakowanej radioaktywnie wykryto w moczu, a 11% w kale. Zidentyfikowano in vivo cztery szlaki metaboliczne, z których żaden nie odpowiadał za metabolizm więcej niż 6,5% dawki: dealkilację, hydroksylację, odwodornienie i odłączenie benzizoksazolu. Chociaż wyniki badań in vitro wskazywały, że w metabolizmie paliperydonu mogą uczestniczyć izoenzymy CYP2D6 i CYP3A4, w badaniach in vivo nie uzyskano dowodów na to, że odgrywają one istotną rolę w metabolizmie paliperydonu.
Analizy farmakokinetyki przeprowadzone w populacji wskazują na brak dostrzegalnej różnicy klirensu paliperydonu po podaniu doustnym tego leku między osobami metabolizującymi substraty CYP2D6 w stopniu znacznym i niewielkim. Badania in vitro na ludzkich mikrosomach wątrobowych wykazały, że paliperydon nie hamuje w znaczącym stopniu metabolizmu produktów leczniczych metabolizowanych przez izoenzymy cytochromu P450, w tym CYP1A2, CYP2A6, CYP2C8/9/10,CYP2D6, CYP2E1, CYP3A4 i CYP3A5.
Badania in vitro wykazały, że paliperydon jest substratem P-gp i w wysokich stężeniach hamuje w nieznacznym stopniu P-gp. Znaczenie kliniczne tego faktu nie jest znane; brak danych in vivo.
Porównanie iniekcji długodziałającego palmitynianu paliperydonu do doustnego paliperydonu o przedłużonym uwalnianiu.
Paliperydon w postaci iniekcji opracowano w taki sposób, że paliperydon jest dostarczany przez miesiąc, podczas gdy paliperydon doustny o przedłużonym uwalnianiu jest podawany codziennie. Początkowy schemat dawkowania paliperydonu w postaci iniekcji (150 mg/100 mg do mięśnia naramiennego w 1. dniu/ 8. dniu) ma na celu szybkie osiągnięcie stanu stacjonarnego stężenia paliperydonu podczas rozpoczynania terapii bez dodatkowego stosowania leku doustnie.
Ogólnie, całkowite stężenia początkowe paliperydonu w postaci iniekcji znajdują się w zakresie ekspozycji obserwowanym po podaniu doustnym dawki 6-12 mg paliperydonu o przedłużonym uwalnianiu. Zastosowanie schematu początkowego dawkowania paliperydonu w postaci iniekcji umożliwiło pacjentom zachowanie zakresu ekspozycji odpowiadającego doustnej dawce 6-12 mg paliperydonu o przedłużonym uwalnianiu, nawet w dniach przed podaniem dawki (8. dzień i 36. dzień). Ze względu na różnicę w medianie profilu farmakokinetycznego pomiędzy tymi dwoma produktami leczniczymi, należy zachować ostrożność podczas bezpośredniego porównywania ich właściwości farmakokinetycznych.
Zaburzenia czynności wątroby
Paliperydon nie jest w znacznym stopniu metabolizowany przez wątrobę. Chociaż nie zbadano skutków stosowania paliperydonu w postaci iniekcji u pacjentów z zaburzeniami czynności wątroby, dostosowanie dawki nie jest wymagane u pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby.
W badaniu pacjentów z umiarkowanymi zaburzeniami czynności wątroby (klasa B wg Child-Pugh), którym podawano doustnie paliperydon, stężenia wolnego paliperydonu w osoczu były podobne do stężeń u osób z prawidłową czynnością wątroby. Nie przeprowadzono badań dotyczących podawania paliperydonu pacjentom z ciężkimi zaburzeniami czynności wątroby.
Zaburzenia czynności nerek
Zbadano skutki podawania doustnego pojedynczej dawki paliperydonu wynoszącej 3 mg w postaci tabletek o przedłużonym uwalnianiu pacjentom z różną czynnością nerek. Eliminacja paliperydonu zmniejszała się wraz ze zmniejszaniem szacunkowego klirensu kreatyniny. Całkowity klirens paliperydonu był zmniejszony średnio o 32% u osób z łagodnymi zaburzeniami czynności nerek (CrCl = 50 do < 80 mL/min), o 64% w przypadku umiarkowanych zaburzeń czynności nerek (CrCl = 30 do < 50 mL/min) i 71% w przypadku ciężkich zaburzeń czynności nerek (CrCl = 10 do < 30 mL/min), co odpowiada odpowiednio 1,5; 2,6 i 4,8-krotnemu średniemu wzrostowi ekspozycji (AUCinf) w porównaniu do osób z prawidłową czynnością nerek. Na podstawie ograniczonej liczby obserwacji pacjentów z łagodnym zaburzeniem czynności nerek, u których stosowano paliperydon w postaci iniekcji, oraz symulacji farmakokinetycznych, zaleca się zmniejszenie dawki (patrz punkt 4.2).
Osoby w podeszłym wieku
Analiza farmakokinetyki w populacji nie wykazała różnic farmakokinetyki związanych z wiekiem.
Wskaźnik masy ciała (ang. Body Mass Index, BMI)/masa ciała
Badania farmakokinetyki palmitynianu paliperydonu wykazały nieznacznie niższe stężenia paliperydonu w osoczu (10-20%) u pacjentów z nadwagą lub otyłych w porównaniu do pacjentów o prawidłowej masie ciała (patrz punkt 4.2).
Rasa
Analiza farmakokinetyki w populacji danych z badań dotyczących doustnego przyjmowania paliperydonu nie ujawniła zależnej od rasy różnicy w farmakokinetyce paliperydonu po podaniu paliperydonu w postaci iniekcji.
Płeć
Nie zaobserwowano istotnych klinicznie różnic pomiędzy mężczyznami i kobietami.
Palenie tytoniu
Na podstawie wyników badań in vitro przeprowadzonych z wykorzystaniem ludzkich enzymów wątrobowych stwierdzono, że paliperydon nie jest substratem dla izoenzymu CYP1A2; palenie tytoniu nie powinno mieć zatem wpływu na farmakokinetykę paliperydonu. Nie badano wpływu palenia tytoniu na farmakokinetykę paliperydonu w postaci iniekcji. Analiza farmakokinetyki w populacji na podstawie danych z badań dotyczących doustnego przyjmowania paliperydonu w postaci tabletek o przedłużonym uwalnianiu ujawniła nieznacznie mniejszą ekspozycję na paliperydon u osób palących w porównaniu do osób niepalących. Jednak jest mało prawdopodobne, aby ta różnica miała znaczenie kliniczne.
Badania toksyczności po wielokrotnym podaniu domięśniowym palmitynianu paliperydonu (postać podawana co miesiąc) oraz doustnym podaniu paliperydonu u szczurów i psów wykazały skutki głównie farmakologiczne, takie jak sedacja i efekty związane z działaniem prolaktyny na gruczoły sutkowe i narządy płciowe. U zwierząt, którym podawano palmitynian paliperydonu, zaobserwowano reakcję zapalną w miejscu wstrzyknięcia domięśniowego. Sporadycznie tworzył się ropień.
W badaniach reprodukcji u szczurów z zastosowaniem rysperydonu podawanego doustnie, który u szczurów i ludzi jest w znacznym stopniu przekształcany do paliperydonu, obserwowano niepożądane działania na masę urodzeniową i przeżywalność potomstwa. Po domięśniowym podaniu palmitynianu
paliperydonu ciężarnym samicom szczurów w dawkach do 160 mg/kg mc./dobę włącznie, co odpowiada 4,1-krotności poziomu ekspozycji u ludzi przy maksymalnej zalecanej dawce wynoszącej 150 mg, nie zaobserwowano embriotoksyczności ani wad rozwojowych. Po podaniu ciężarnym zwierzętom innych antagonistów dopaminy wystąpił negatywny wpływ na zdolność uczenia się i rozwój motoryczny potomstwa.
Palmitynian paliperydonu oraz paliperydon nie wykazują działania genotoksycznego. W badaniach działania rakotwórczego doustnie podanego rysperydonu u szczurów i myszy obserwowano zwiększenie częstości występowania gruczolaków przysadki mózgowej (myszy), hormonalnie czynnych gruczolaków trzustki (szczury) i gruczolaków gruczołu sutkowego (u obu gatunków). Potencjał rakotwórczy podawanego domięśniowo palmitynianu paliperydonu oceniono u szczurów. Badania wykazały statystycznie istotne zwiększenie częstości występowania gruczolakoraka gruczołu sutkowego u samic szczurów po dawkach 10, 30 i 60 mg/kg mc./miesiąc. U samców szczurów wykazano statystycznie istotne zwiększenie częstości występowania gruczolaków i nowotworów złośliwych gruczołu sutkowego po dawkach 30 i 60 mg/kg/miesiąc, co odpowiada 1,2- oraz 2,2-krotności poziomu ekspozycji po najwyższej zalecanej u ludzi dawce, wynoszącej 150 mg. Guzy te mogą być związane z przedłużonym antagonizmem receptorów D2 oraz hiperprolaktynemią. Znaczenie tych wyników badań dotyczących guzów u gryzoni w odniesieniu do ryzyka u ludzi jest nieznane.
Polisorbat 20
Makrogol 4000
Kwas cytrynowy jednowodny Disodu fosforan
Sodu diwodorofosforan jednowodny Sodu wodorotlenek (do ustalenia pH) Woda do wstrzykiwań
Nie mieszać produktu leczniczego z innymi produktami leczniczymi.
30 miesięcy
Nie przechowywać w temperaturze powyżej 30°C.
Ampułko-strzykawka z kopolimeru cykloolefinowego, z korkiem z gumy chlorobutylowej (końcówka tłoka), z blokadą i nasadką typu „tip-cap” z gumy chlorobutylowej oraz dwie igły (22G 1½ cala i 23G 1-cala), w tekturowym pudełku.
Wielkości opakowań:
Tekturowe pudełko zawiera 1 ampułko-strzykawkę i 2 igły.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Wyłącznie do jednorazowego użytku.
Egis Pharmaceuticals PLC Keresztúri út 30-38
1106 Budapeszt Węgry
Pozwolenie Egoropal, 25 mg, nr:
Pozwolenie Egoropal, 50 mg, nr:
Pozwolenie Egoropal, 75 mg, nr:
Pozwolenie Egoropal, 100 mg, nr:
Pozwolenie Egoropal, 150 mg, nr:
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











