Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
nadwrażliwość na substancje czynne (rozuwastatyna, ezetymib) lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1;
czynna choroba wątroby lub niewyjaśnione, utrzymujące się zwiększenie aktywności aminotransferaz w surowicy i zwiększenie aktywności którejkolwiek
z aminotransferaz w surowicy przekraczające 3-krotnie górną granicę normy (GGN);
ciąża, karmienie piersią oraz u kobiet w wieku rozrodczym, które nie stosują skutecznych metod zapobiegania ciąży;
u pacjentów z ciężkimi zaburzeniami czynności nerek (klirens kreatyniny
<30 ml/min);
u pacjentów z miopatią;
u pacjentów otrzymujących jednocześnie skojarzenie sofosbuwiru, welpataswiru z woksylaprewirem (patrz punkt 4.5);
u pacjentów otrzymujących jednocześnie cyklosporynę.
Stosowanie produktu leczniczego Crosuvo Plus, 40 mg+10 mg, tabletki jest przeciwwskazane
u pacjentów z czynnikami predysponującymi do miopatii/rabdomiolizy. Czynniki te to:
umiarkowane zaburzenia czynności nerek (klirens kreatyniny < 60 ml/min);
niedoczynność tarczycy;
dziedziczne choroby układu mięśniowego w wywiadzie pacjenta lub w wywiadzie rodzinnym;
wystąpienie objawów uszkodzenia mięśni podczas wcześniejszego leczenia innym inhibitorem reduktazy HMG-CoA lub fibratem;
nadużywanie alkoholu;
sytuacje, w których może wystąpić zwiększenie stężenia rozuwastatyny w osoczu;
pacjenci pochodzenia azjatyckiego;
jednoczesne stosowanie fibratów. (Patrz punkty 4.4, 4.5 i 5.2).
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
zaburzenia czynności nerek;
niedoczynność tarczycy;
dziedziczne choroby układu mięśniowego w wywiadzie pacjenta lub w wywiadzie rodzinnym;
wystąpienie objawów uszkodzenia mięśni podczas wcześniejszego leczenia innym inhibitorem reduktazy HMG-CoA lub fibratem;
nadużywanie alkoholu;
wiek > 70 lat;
sytuacje, w których może wystąpić zwiększone stężenie w osoczu (patrz punkt 5.2);
jednoczesne stosowanie fibratów.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
zaburzenia seksualne;
bardzo rzadkie przypadki śródmiąższowej choroby płuc, szczególnie w przypadku długotrwałej terapii (patrz punkt 4.4).
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
godzin w przypadku glukuronianu ezetymibu oraz 4–12 godzin w przypadku ezetymibu. Nie można określić bezwzględnej biodostępności ezetymibu, ponieważ substancja ta jest prawie całkowicie nierozpuszczalna w wodnych roztworach odpowiednich do wstrzykiwań. Jednoczesne przyjmowanie pokarmów (z dużą lub małą zawartością tłuszczu) nie ma wpływu na biodostępność ezetymibu po podaniu doustnym. Ezetymib można przyjmować niezależnie od posiłku.
Dystrybucja: ezetymib i glukuronian ezetymibu wiążą się z białkami ludzkiego osocza odpowiednio w 99,7% oraz w 88–92%.
Metabolizm: ezetymib jest metabolizowany głównie w jelicie cienkim i w wątrobie poprzez sprzęganie z kwasem glukuronowym (reakcja fazy II), a następnie wydalany z żółcią.
U wszystkich badanych gatunków zwierząt obserwowano również minimalny metabolizm oksydacyjny (reakcja fazy I). Ezetymib i glukuronian ezetymibu są dwiema głównymi pochodnymi leku wykrywanymi w osoczu, stanowiącymi odpowiednio 10–20% oraz 80–90% całkowitego stężenia leku w osoczu. Zarówno ezetymib, jak i glukuronian ezetymibu są powoli wydalane z osocza ze znacznym krążeniem jelitowo-wątrobowym tych substancji.
Okres półtrwania ezetymibu i glukuronianu ezetymibu wynosi około 22 godziny.
Eliminacja: po doustnym podaniu ludziom ezetymibu znakowanego izotopem 14C (20 mg) całkowity ezetymib w osoczu krwi stanowił około 93% całkowitej aktywności promieniotwórczej. W stolcu i w moczu odzyskano odpowiednio około 78% i 11% całkowitej dawki izotopu promieniotwórczego w okresie 10-dniowej zbiórki. Po 48 godzinach od podania nie stwierdzono wykrywalnego poziomu aktywności promieniotwórczej w osoczu.
Szczególne grupy pacjentów
Wiek i płeć: stężenia w osoczu całkowitego ezetymibu są około 2-krotnie większe
u pacjentów w podeszłym wieku (≥ 65 lat) niż u młodszych pacjentów (18–45 lat). Nie stwierdzono różnic pod względem zmniejszenia stężenia LDL-C i profilu bezpieczeństwa pomiędzy pacjentami w podeszłym wieku i u osób młodszych leczonych ezetymibem.
Dlatego u pacjentów w podeszłym wieku nie ma konieczności dostosowania dawki.
U kobiet stwierdzono nieco większe (o około 20%) stężenia w osoczu całkowitego ezetymibu niż u mężczyzn. Nie stwierdzono różnic pod względem zmniejszenia stężenia LDL-C oraz profilu bezpieczeństwa pomiędzy kobietami a mężczyznami leczonymi ezetymibem. Dlatego nie jest wymagane dostosowanie dawki w zależności od płci pacjenta.
Niewydolność nerek: po podaniu pojedynczej dawki 10 mg ezetymibu pacjentom z ciężką chorobą nerek (n = 8; średni CrCl ≤ 30 ml/min/1,73 m2) średnia wartość AUC całkowitego ezetymibu uległa zwiększeniu około 1,5-krotnie w porównaniu ze zdrowymi osobami (n = 9). Wynik ten nie jest uważany za klinicznie istotny. Nie jest konieczne dostosowanie dawki leku u pacjentów z zaburzeniami czynności nerek.
U dodatkowego pacjenta uczestniczącego w tym badaniu (po przeszczepieniu nerki oraz otrzymującego wiele leków, w tym cyklosporynę) narażenie na całkowity ezetymib było 12- krotnie większe.
Niewydolność wątroby: po podaniu pojedynczej dawki 10 mg ezetymibu średnia wartość AUC całkowitego ezetymibu uległa zwiększeniu około 1,7-krotnie u pacjentów z łagodną niewydolnością wątroby (5 lub 6 punktów w skali Childa-Pugha) w porównaniu z osobami zdrowymi. W trwającym 14 dni badaniu, w którym podawano dawki wielokrotne leku (10 mg
na dobę) pacjentom z umiarkowaną niewydolnością wątroby (7 do 9 punktów w skali Childa- Pugha), stwierdzono około 4-krotne zwiększenie średniej wartości AUC całkowitego ezetymibu pomiędzy dniem 1 a dniem 14. w porównaniu ze zdrowymi osobami. Nie jest konieczne dostosowanie dawki leku u pacjentów z łagodnymi zaburzeniami czynności wątroby. Ponieważ wpływ wzrastającej ekspozycji na ezetymib u pacjentów z umiarkowaną lub ciężką niewydolnością wątroby (> 9 punktów w skali Childa-Pugha) nie jest znany, nie zaleca się stosowania ezetymibu u tych pacjentów (patrz punkt 4.4).
Dzieci i młodzież: farmakokinetyka ezetymibu u dzieci w wieku ≥ 6 lat jest podobna do farmakokinetyki u dorosłych. Brak dostępnych danych farmakokinetycznych u dzieci poniżej 6 lat. Doświadczenie kliniczne obejmuje dzieci i młodzież z hipercholesterolemią rodzinną homozygotyczną (HoFH) i heterozygotyczną (HeFH) lub z sitosterolemią.
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
lata
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Crosuvo Plus, 5 mg + 10 mg, tabletki powlekane Crosuvo Plus, 10 mg + 10 mg, tabletki powlekane Crosuvo Plus, 20 mg + 10 mg, tabletki powlekane Crosuvo Plus, 40 mg + 10 mg, tabletki powlekane
Crosuvo Plus, 5 mg + 10 mg: każda tabletka powlekana zawiera 5,20 mg rozuwastatyny
wapniowej (co odpowiada 5 mg rozuwastatyny) oraz 10 mg ezetymibu.
Crosuvo Plus, 10 mg + 10 mg: każda tabletka powlekana zawiera 10,40 mg rozuwastatyny
wapniowej (co odpowiada 10 mg rozuwastatyny) oraz 10 mg ezetymibu.
Crosuvo Plus, 20 mg + 10 mg: każda tabletka powlekana zawiera 20,80 mg rozuwastatyny
wapniowej (co odpowiada 20 mg rozuwastatyny) oraz 10 mg ezetymibu.
Crosuvo Plus, 40 mg + 10 mg: każda tabletka powlekana zawiera 41,60 mg rozuwastatyny
wapniowej (co odpowiada 40 mg rozuwastatyny) oraz 10 mg ezetymibu.
Substancje pomocnicze o znanym działaniu:
Crosuvo Plus, 5 mg + 10 mg: każda tabletka powlekana zawiera 200,50 mg laktozy jednowodnej (co odpowiada 190,47 mg laktozy bezwodnej).
Crosuvo Plus, 10 mg + 10 mg: każda tabletka powlekana zawiera 200,50 mg laktozy jednowodnej (co odpowiada 190,47 mg laktozy bezwodnej).
Crosuvo Plus, 20 mg + 10 mg: każda tabletka powlekana zawiera 200,50 mg laktozy jednowodnej (co odpowiada 190,47 mg laktozy bezwodnej).
Crosuvo Plus, 40 mg + 10 mg: każda tabletka powlekana zawiera 205,54 mg laktozy jednowodnej (co odpowiada 195,26 mg laktozy bezwodnej).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletki powlekane
Crosuvo Plus, 5 mg + 10 mg: jasnożółte, okrągłe, obustronnie wypukłe tabletki powlekane
o średnicy około 10 mm, z wytłoczonym napisem „EL5” po jednej stronie.
Crosuvo Plus, 10 mg + 10 mg: beżowe, okrągłe, obustronnie wypukłe tabletki powlekane
o średnicy około 10 mm, z wytłoczonym napisem „EL4” po jednej stronie.
Crosuvo Plus, 20 mg + 10 mg: żółte, okrągłe, obustronnie wypukłe tabletki powlekane
o średnicy około 10 mm, z wytłoczonym napisem „EL3” po jednej stronie.
Crosuvo Plus, 40 mg + 10 mg: białe, okrągłe, obustronnie wypukłe tabletki powlekane
o średnicy około 10 mm, z wytłoczonym napisem „EL2” po jednej stronie.
Produkt leczniczy Crosuvo Plus jest wskazany jako leczenie zastępcze, wspomagające dietę u dorosłych pacjentów z pierwotną hipercholesterolemią, u których uzyskano odpowiednią kontrolę za pomocą terapii skojarzonej opartej o ezetymib i rozuwastatynę, które podawano
jednocześnie w tych samych dawkach jak w produkcie złożonym, ale w postaci oddzielnych produktów leczniczych.
Dawkowanie
Produkt leczniczy Crosuvo Plus jest wskazany do stosowania u dorosłych pacjentów, u których uzyskano odpowiednią kontrolę hipercholesterolemii podczas stosowania podawanych oddzielnie składników produktu złożonego w takich samych dawkach jak w produkcie złożonym.
Pacjent powinien stosować odpowiednią dietę zmniejszającą stężenie lipidów i kontynuować tę dietę podczas leczenia produktem leczniczym Crosuvo Plus.
Zalecana dawka dobowa to jedna tabletka o danej mocy przyjmowana niezależnie od posiłku. Produkt leczniczy Crosuvo Plus nie jest odpowiedni do rozpoczynania leczenia. Rozpoczęcie leczenia lub w razie konieczności dostosowanie dawki powinno się odbywać przez podanie tych samych substancji czynnych w postaci oddzielnych produktów. Dopiero po ustaleniu odpowiednich dawek możliwe jest zastosowanie produktu złożonego o odpowiedniej mocy.
Jednoczesne stosowanie z produktami wiążącymi kwasy żółciowe
Podanie produktu leczniczego Crosuvo Plus powinno nastąpić ≥ 2 godziny przed podaniem środka wiążącego kwasy żółciowe lub po ≥ 4 godzinach od jego zażycia.
Dzieci i młodzież
Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego Crosuvo Plus u dzieci w wieku poniżej 18 lat. Aktualnie dostępne dane przedstawiono
w punktach 4.8, 5.1 i 5.2, ale nie można sformułować żadnych zaleceń dotyczących dawkowania.
Pacjenci w podeszłym wieku
U pacjentów w wieku powyżej 70 lat zalecana dawka początkowa wynosi 5 mg rozuwastatyny (patrz punkt 4.4). Złożony produkt leczniczy nie jest odpowiedni do rozpoczynania leczenia. Rozpoczęcie leczenia lub w razie konieczności dostosowanie dawki powinno się odbywać przez podanie tych samych substancji czynnych w postaci oddzielnych produktów. Dopiero po ustaleniu odpowiednich dawek możliwe jest zastosowanie produktu złożonego o odpowiedniej mocy.
Dawkowanie u pacjentów z zaburzeniami czynności nerek
U pacjentów z łagodnymi zaburzeniami czynności nerek nie jest konieczne dostosowanie dawki.
U pacjentów z umiarkowanymi zaburzeniami czynności nerek (klirens kreatyniny
< 60 ml/min) zalecana dawka początkowa rozuwastatyny wynosi 5 mg. Zastosowanie złożonego produktu leczniczego nie jest odpowiednie do rozpoczęcia leczenia. Do rozpoczęcia leczenia lub modyfikacji dawki należy stosować pojedyncze substancje czynne w postaci oddzielnych produktów leczniczych.
U pacjentów z ciężkimi zaburzeniami czynności nerek stosowanie rozuwastatyny jest
przeciwwskazane niezależnie od dawki (patrz punkty 4.3 i 5.2).
Stosowanie produktu leczniczego Crosuvo Plus 40 mg + 10 mg, tabletki powlekane jest
przeciwwskazane u pacjentów z umiarkowanymi zaburzeniami czynności nerek.
Dawkowanie u pacjentów z zaburzeniami czynności wątroby
U pacjentów z łagodnymi zaburzeniami czynności wątroby (od 5 do 6 punktów w skali Childa-Pugha) nie jest wymagane dostosowanie dawki. U pacjentów z umiarkowanymi zaburzeniami czynności wątroby (od 7 do 9 punktów w skali Childa-Pugha) lub ciężkimi zaburzeniami czynności wątroby (> 9 punktów w skali Childa-Pugha) nie zaleca się
stosowania produktu leczniczego Crosuvo Plus (patrz punkty 4.4 i 5.2). Stosowanie produktu leczniczego Crosuvo Plus jest przeciwwskazane u pacjentów z czynną chorobą wątroby (patrz punkt 4.3).
Rasa
Obserwowano zwiększoną ekspozycję układową na rozuwastatynę u pacjentów pochodzących z Azji (patrz punkty 4.4 i 5.2). U pacjentów pochodzących z Azji zalecaną początkową dawką jest 5 mg rozuwastatyny. Zastosowanie złożonego produktu leczniczego nie jest odpowiednie do rozpoczęcia leczenia. Do rozpoczęcia leczenia lub modyfikacji dawki należy stosować pojedyncze substancje czynne w postaci oddzielnych produktów leczniczych.
Stosowanie produktu leczniczego Crosuvo Plus 40 mg + 10 mg, tabletki powlekane jest
przeciwwskazane u tych pacjentów (patrz punkty 4.3 i 5.2).
Polimorfizmy genetyczne
Znane są określone typy polimorfizmów genetycznych, które mogą prowadzić do zwiększonej ekspozycji na rozuwastatynę (patrz punkt 5.2). U pacjentów, u których stwierdzono występowanie określonych rodzajów polimorfizmów, zaleca się stosowanie mniejszej dawki dobowej produktu leczniczego Crosuvo Plus.
Dawkowanie u pacjentów z czynnikami predysponującymi do miopatii
U pacjentów z czynnikami predysponującymi do miopatii zalecana dawka początkowa rozuwastatyny wynosi 5 mg (patrz punkt 4.4). Zastosowanie złożonego produktu leczniczego nie jest odpowiednie do rozpoczęcia leczenia. Do rozpoczęcia leczenia lub modyfikacji dawki należy stosować pojedyncze substancje czynne w postaci oddzielnych produktów leczniczych.
Stosowanie produktu leczniczego Crosuvo Plus 40 mg + 10 mg, tabletki powlekane jest
przeciwwskazane u niektórych z tych pacjentów (patrz punkt 4.3).
Leczenie skojarzone
Rozuwastatyna jest substratem różnych białek transportowych (np. OATP1B1 i BCRP). Ryzyko miopatii (w tym rabdomiolizy) jest zwiększone, gdy produkt leczniczy Crosuvo Plus jest jednocześnie stosowany z niektórymi produktami leczniczymi, które w wyniku interakcji z tymi białkami transportującymi mogą zwiększać stężenie rozuwastatyny w osoczu (np. cyklosporyna i niektóre inhibitory proteazy, w tym połączenia rytonawiru z atazanawirem, lopinawirem i (lub) typranawirem; patrz punkty 4.4 i 4.5).
Jeśli to możliwe, należy rozważyć zastosowanie innych produktów leczniczych, a w razie konieczności tymczasowe przerwanie leczenia produktem leczniczym Crosuvo Plus.
W sytuacjach, gdy nie można uniknąć jednoczesnego podawania tych produktów leczniczych i produktu leczniczego Crosuvo Plus, należy dokładnie rozważyć korzyści i ryzyko jednoczesnego leczenia oraz dostosowanie dawkowania rozuwastatyny (patrz punkt 4.5).
Sposób podawania Podanie doustne.
Produkt leczniczy Crosuvo Plus należy przyjmować każdego dnia o tej samej porze, z posiłkiem lub bez posiłku.
Tabletkę należy połykać w całości, popijając wodą.
Stosowanie produktu leczniczego Crosuvo Plus jest przeciwwskazane w następujących przypadkach:
Wpływ na mięśnie szkieletowe
U pacjentów leczonych rozuwastatyną we wszystkich dawkach, a w szczególności dawkami większymi niż 20 mg, odnotowano wpływ na mięśnie szkieletowe, np. ból mięśni, miopatię i rzadko rabdomiolizę.
Po wprowadzeniu ezetymibu do obrotu zgłaszano przypadki wystąpienia miopatii oraz rabdomiolizy. Zgłaszano bardzo rzadkie przypadki rabdomiolizy u pacjentów otrzymujących ezetymib w monoterapii oraz otrzymujących ezetymib jednocześnie z innymi produktami leczniczymi, których stosowanie zwiększa ryzyko rabdomiolizy. Jeśli na podstawie objawów ze strony mięśni podejrzewa się miopatię lub jeśli miopatia zostanie potwierdzona badaniem aktywności kinazy kreatynowej, należy natychmiast zaprzestać stosowania ezetymibu, wszystkich statyn i innych produktów leczniczych związanych z podwyższonym ryzykiem rabdomiolizy, które pacjent jednocześnie stosuje. Wszystkich pacjentów rozpoczynających leczenie należy poinformować o konieczności natychmiastowego zgłaszania jakiegokolwiek niewyjaśnionego bólu mięśni, ich tkliwości lub osłabienia (patrz punkt 4.8).
Wpływ na wątrobę
W badaniach z grupą kontrolną, w których pacjentom podawano jednocześnie ezetymib
i statynę, obserwowano stopniowe zwiększanie się aktywności aminotransferaz (≥ 3 x górna granica normy [GGN]).
Zaleca się wykonanie badań czynności wątroby 3 miesiące po rozpoczęciu leczenia rozuwastatyną. Jeśli aktywność aminotransferaz w surowicy krwi jest większa niż 3-krotność górnej granicy normy, rozuwastatynę należy odstawić lub zmniejszyć jej dawkę.
U pacjentów z wtórną hipercholesterolemią wywołaną niedoczynnością tarczycy lub zespołem nerczycowym przed rozpoczęciem leczenia produktem leczniczym Crosuvo Plus należy wdrożyć leczenie choroby podstawowej.
Nie zaleca się stosowania produktu leczniczego Crosuvo Plus u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności wątroby w związku z nieznanym wpływem zwiększonej ekspozycji na ezetymib (patrz punkt 5.2).
Wpływ na nerki
U pacjentów leczonych większymi dawkami rozuwastatyny, zwłaszcza dawką 40 mg, stwierdzano białkomocz wykrywany testem paskowym, głównie pochodzenia kanalikowego, który w większości przypadków był sporadyczny lub okresowy. Nie wykazano, aby występowanie białkomoczu poprzedzało wystąpienie ostrej lub postępującej choroby nerek (patrz punkt 4.8).
Częstość zgłaszania ciężkich działań niepożądanych związanych z nerkami po wprowadzeniu do obrotu jest wyższa w przypadku dawki 40 mg. Należy rozważyć ocenę czynności nerek (co najmniej co 3 miesiące) podczas rutynowej kontroli pacjentów leczonych dawką 40 mg.
Oznaczenie aktywności kinazy kreatynowej
Aktywności kinazy kreatynowej (CK) nie należy oznaczać po intensywnym wysiłku fizycznym lub w przypadku istnienia jakiejkolwiek innej prawdopodobnej przyczyny zwiększonej aktywności CK, gdyż może to utrudniać interpretację wyników.
Jeśli aktywność CK jest istotnie zwiększona przed rozpoczęciem leczenia (> 5 x GGN),
w ciągu 5–7 dni należy wykonać badanie potwierdzające. Jeśli powtórne badanie potwierdzi, że początkowa aktywność CK ponad 5-krotnie przekracza GGN, leczenia nie należy rozpoczynać.
Przed rozpoczęciem leczenia
Podobnie jak w przypadku innych inhibitorów reduktazy HMG-CoA, podczas przepisywania produktu leczniczego Crosuvo Plus należy zachować ostrożność u pacjentów, u których występują czynniki predysponujące do wystąpienia miopatii/rabdomiolizy. Czynniki te to:
W powyższych przypadkach należy rozważyć ryzyko leczenia w zestawieniu z możliwymi korzyściami wynikającymi z leczenia. Zalecana jest kontrola stanu klinicznego pacjenta.
Jeżeli aktywność CK przed rozpoczęciem leczenia jest znacznie podwyższona (> 5 x GGN), nie należy rozpoczynać leczenia.
Podczas leczenia
Pacjentom należy zalecić niezwłoczne zgłaszanie niewyjaśnionego bólu mięśni, osłabienia lub skurczy mięśni, szczególnie jeśli towarzyszy im złe samopoczucie lub gorączka. U tych pacjentów należy oznaczyć aktywność CK. Leczenie należy przerwać, jeśli aktywność CK jest znacząco zwiększona (> 5 x GGN) lub jeśli objawy mięśniowe mają ciężkie nasilenie
i powodują dyskomfort w codziennym życiu (nawet jeśli aktywność CK jest > 5 x GGN). Brak podstaw do rutynowego kontrolowania aktywności CK u pacjentów, u których nie występują objawy.
Obserwowano bardzo rzadkie przypadki wystąpienia immunozależnej miopatii martwiczej (ang. immune-mediated necrotizing myopathy, IMNM) w trakcie leczenia statynami, w tym rozuwastatyną, lub po jego zakończeniu. Cechy kliniczne IMNM to utrzymujące się osłabienie mięśni proksymalnych oraz zwiększona aktywność kinazy kreatynowej
w surowicy, utrzymująca się mimo przerwania leczenia statynami.
W badaniach klinicznych nie wykazano zwiększonego wpływu na mięśnie szkieletowe
u niewielkiej liczby pacjentów otrzymujących rozuwastatynę i leczenie skojarzone. Jednakże u pacjentów otrzymujących inne inhibitory reduktazy HMG-CoA razem z pochodnymi kwasu fibrynowego, w tym z gemfibrozylem, cyklosporyną, kwasem nikotynowym, azolowymi lekami przeciwgrzybiczymi, inhibitorami proteazy i antybiotykami makrolidowymi, obserwowano zwiększoną częstość występowania zapalenia mięśni i miopatii. Gemfibrozyl podawany jednocześnie z niektórymi inhibitorami reduktazy HMG-CoA zwiększa ryzyko miopatii. Dlatego nie zaleca się skojarzonego stosowania produktu leczniczego Crosuvo Plus i gemfibrozylu. Należy starannie rozważyć korzyści płynące z dalszych zmian stężenia lipidów w wyniku skojarzonego stosowania produktu leczniczego Crosuvo Plus i fibratów lub niacyny wobec możliwego ryzyka związanego z takim leczeniem.
Produkt leczniczy Crosuvo Plus nie powinien być stosowany u jakiegokolwiek pacjenta z ostrym, ciężkim stanem wskazującym na miopatię lub predysponującym do rozwoju niewydolności nerek wtórnej do rabdomiolizy (np. posocznica, niedociśnienie tętnicze,
rozległy zabieg chirurgiczny, uraz, ciężkie zaburzenia metaboliczne, endokrynologiczne lub
elektrolitowe albo niekontrolowane napady padaczkowe).
Kwas fusydowy
Produktu leczniczego Crosuvo Plus nie wolno stosować jednocześnie z kwasem fusydowym podawanym ogólnoustrojowo lub w ciągu 7 dni po zakończeniu przyjmowania kwasu fusydowego. U pacjentów, u których podawanie ogólnoustrojowo kwasu fusydowego uważa się za konieczne, leczenie statynami należy przerwać na czas przyjmowania kwasu fusydowego. Zgłaszano przypadki rabdomiolizy (w tym także przypadki śmiertelne)
u pacjentów leczonych jednocześnie kwasem fusydowym i statynami (patrz punkt 4.5). Pacjentowi należy zalecić, aby w razie wystąpienia jakichkolwiek objawów osłabienia, bólu lub tkliwości mięśni niezwłocznie zgłosił się do lekarza.
Leczenie statynami można wznowić po upływie siedmiu dni od daty podania ostatniej dawki kwasu fusydowego.
W wyjątkowych okolicznościach, gdy konieczne jest przedłużone podawanie ogólnoustrojowo kwasu fusydowego, np. w leczeniu ciężkich zakażeń, jednoczesne stosowanie produktu leczniczego Crosuvo Plus i kwasu fusydowego można rozważyć wyłącznie w przypadkach indywidualnych i pod ścisłym nadzorem lekarza.
Rasa
W badaniach farmakokinetycznych wykazano zwiększoną ekspozycję na rozuwastatynę
u osób rasy azjatyckiej w porównaniu z rasą kaukaską (patrz punkty 4.2 i 5.2).
Inhibitory proteazy
U pacjentów otrzymujących rozuwastatynę jednocześnie z różnymi inhibitorami proteazy w skojarzeniu z rytonawirem obserwowano zwiększoną ekspozycję układową na rozuwastatynę. Należy wziąć pod uwagę zarówno korzyści wynikające ze zmniejszenia stężenia lipidów podczas stosowania produktu leczniczego Crosuvo Plus u pacjentów zakażonych wirusem HIV otrzymujących inhibitory proteazy, jak i możliwość zwiększenia stężenia rozuwastatyny w osoczu podczas rozpoczynania leczenia i zwiększania dawki rozuwastatyny u pacjentów leczonych inhibitorami proteazy. Nie zaleca się jednoczesnego stosowania z niektórymi inhibitorami proteazy, o ile nie zostanie odpowiednio dostosowana dawka produktu leczniczego Crosuvo Plus (patrz punkty 4.2 i 4.5).
Śródmiąższowa choroba płuc
Podczas stosowania, zwłaszcza długotrwałego, niektórych statyn opisywano pojedyncze przypadki śródmiąższowej choroby płuc (patrz punkt 4.8). Występujące objawy mogą obejmować duszność, nieproduktywny kaszel oraz pogorszenie ogólnego stanu zdrowia (zmęczenie, zmniejszenie masy ciała i gorączka). Jeśli istnieje podejrzenie, że u pacjenta doszło do rozwoju śródmiąższowej choroby płuc, należy przerwać leczenie statyną.
Cukrzyca
Niektóre dowody wskazują, że wszystkie leki z grupy statyn zwiększają stężenie glukozy we krwi, a u niektórych pacjentów z wysokim ryzykiem rozwoju cukrzycy w przyszłości mogą powodować hiperglikemię wymagającą odpowiedniej opieki diabetologicznej. Nad tym ryzykiem przeważa jednak korzyść w postaci zmniejszenia ryzyka rozwoju chorób naczyniowych dzięki stosowaniu statyn, dlatego nie powinno się z tego powodu przerywać leczenia statynami. Pacjenci z grupy ryzyka (stężenie glukozy na czczo 5,6–6,9 mmol/l, BMI
> 30 kg/m2, zwiększone stężenie trójglicerydów, nadciśnienie tętnicze) powinni być monitorowani z wykorzystaniem oceny stanu klinicznego i badań biochemicznych zgodnie z wytycznymi krajowymi.
W badaniu JUPITER zaobserwowana całkowita częstość występowania cukrzycy wyniosła 2,8% w grupie przyjmującej rozuwastatynę i 2,3% w grupie przyjmującej placebo,
a u większości pacjentów stężenie glukozy na czczo wynosiło 5,6–6,9 mmol/l.
Ciężkie skórne działania niepożądane
Podczas stosowania rozuwastatyny występowały ciężkie skórne działania niepożądane w tym zespół Stevensa-Johnsona (ang. Stevens-Johnson syndrome, SJS) i reakcja polekowa
z eozynofilią oraz objawami ogólnymi (ang. drug reaction with eosinophilia and systemic symptoms, DRESS), mogące zagrażać życiu lub zakończyć się zgonem. Przepisując lek, należy poinformować pacjenta o przedmiotowych i podmiotowych objawach ciężkich reakcji skórnych oraz uważnie go obserwować w czasie leczenia. Jeśli objawy przedmiotowe
i podmiotowe wskazują na wystąpienie tej reakcji, należy natychmiast przerwać stosowanie produktu leczniczego Crosuvo Plus i rozważyć alternatywne leczenie. Jeśli u pacjenta wystąpi ciężka reakcja, taka jak SJS lub DRESS, podczas stosowania produktu leczniczego Crosuvo Plus nie należy nigdy ponownie stosować tego leku u tego pacjenta.
Fibraty
Nie ustalono bezpieczeństwa stosowania i skuteczności ezetymibu podawanego jednocześnie z fibratami.
Jeśli u pacjenta otrzymującego produkt leczniczy Crosuvo Plus i fenofibrat istnieje podejrzenie kamicy żółciowej, wskazane jest przeprowadzenie badania pęcherzyka żółciowego oraz przerwanie leczenia (patrz punkty 4.5 i 4.8).
Leki przeciwzakrzepowe
Jeśli produkt leczniczy Crosuvo Plus jest stosowany z warfaryną, innym lekiem przeciwzakrzepowym z grupy pochodnych kumaryny lub fluindionem, należy odpowiednio monitorować wartość międzynarodowego współczynnika znormalizowanego (ang.
International Normalised Ratio, INR) (patrz punkt 4.5). Cyklosporyna: patrz punkty 4.3 i 4.5.
Dzieci i młodzież
Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego Crosuvo Plus u dzieci w wieku poniżej 18 lat, dlatego takie skojarzenie nie jest zalecane w tej grupie wiekowej.
Choroba wątroby i alkohol
Produkt leczniczy Crosuvo Plus należy stosować ostrożnie u pacjentów nadużywających alkoholu i (lub) z chorobami wątroby w wywiadzie.
Laktoza:
Tabletki produktu leczniczego Crosuvo Plus zawierają laktozę. Produktu leczniczego nie powinni stosować pacjenci z rzadko występującą dziedziczną nietolerancją galaktozy, brakiem laktazy (typu Lapp) lub zespołem złego wchłaniania glukozy-galaktozy.
Skojarzenia przeciwwskazane
Cyklosporyna: podczas jednoczesnego stosowania rozuwastatyny i cyklosporyny wartości AUC dla rozuwastatyny były średnio 7-krotnie większe niż obserwowane u zdrowych ochotników (patrz punkt 4.3). Jednoczesne stosowanie nie wpływało na stężenie cyklosporyny w osoczu.
Podawanie produktu leczniczego Crosuvo Plus jednocześnie z cyklosporyną jest przeciwwskazane (patrz punkt 4.3).
W badaniu z udziałem ośmiu pacjentów po przeszczepieniu nerki z klirensem kreatyniny
> 50 ml/min, otrzymujących stałą dawkę cyklosporyny podanie pojedynczej dawki 10 mg ezetymibu spowodowało 3,4-krotne (zakres od 2,3- do 7,9-krotność) zwiększenie średniej wartości AUC całkowitego ezetymibu w porównaniu z kontrolną populacją zdrowych osób otrzymujących ezetymib w monoterapii w ramach innego badania (n = 17). W innym badaniu wykazano, że w porównaniu z pacjentami z grupy kontrolnej otrzymującymi wyłącznie ezetymib ekspozycja na całkowity ezetymib u pacjenta po przeszczepieniu nerki, z ciężką niewydolnością nerek, otrzymującego cyklosporynę i wiele innych leków była 12-krotnie większa. W badaniu prowadzonym w układzie naprzemiennym w dwóch okresach, obejmującym dwanaście zdrowych osób codzienne podawanie 20 mg ezetymibu przez 8 dni wraz z pojedynczą dawką 100 mg cyklosporyny w dniu 7. badania powodowało średnie zwiększenie wartości AUC cyklosporyny o 15% (zakres od zmniejszenia o 10% do zwiększenia o 51%) w porównaniu z podaniem wyłącznie cyklosporyny w pojedynczej dawce 100 mg. Nie przeprowadzono badania z grupą kontrolną oceniającego wpływ jednoczesnego podawania ezetymibu na ekspozycję na cyklosporynę u pacjentów po przeszczepieniu nerki.
Gemfibrozyl i inne produkty obniżające stężenia lipidów: stosowanie rozuwastatyny w dawce
40 mg jest przeciwwskazane podczas jednoczesnego stosowania fibratu (patrz punkty 4.3
i 4.4).
Niezalecane połączenia
Inhibitory proteazy: chociaż dokładny mechanizm interakcji nie jest znany, jednoczesne stosowanie inhibitorów proteazy może znacznie zwiększyć ekspozycję na rozuwastatynę (patrz tabela w punkcie 4.5). Przykładowo w badaniu farmakokinetycznym jednoczesne podawanie 10 mg rozuwastatyny oraz połączenia dwóch inhibitorów proteazy (300 mg atazanawiru i 100 mg rytonawiru) zdrowym ochotnikom spowodowało odpowiednio około trzy- i siedmiokrotne zwiększenie wartości AUC i Cmax rozuwastatyny. Jednoczesne stosowanie rozuwastatyny i niektórych połączeń inhibitorów proteazy można rozważyć po starannie przemyślanym dostosowaniu dawki rozuwastatyny na podstawie spodziewanego zwiększenia ekspozycji na rozuwastatynę (patrz punkty 4.2 i 4.4 oraz tabela w punkcie 4.5). Złożony produkt leczniczy nie jest odpowiedni do rozpoczynania leczenia. Rozpoczęcie leczenia lub w razie konieczności dostosowanie dawki powinno się odbywać przez podanie tych samych substancji czynnych w postaci oddzielnych produktów. Dopiero po ustaleniu odpowiednich dawek możliwe jest zastosowanie produktu złożonego o odpowiedniej mocy.
Inhibitory białek transportujących: rozuwastatyna jest substratem niektórych białek transportujących, w tym transportera wychwytu wątrobowego OATP1B1 i transportera wypompowującego BCRP. Jednoczesne stosowanie produktu leczniczego Crosuvo Plus z produktami leczniczymi, które są inhibitorami tych białek transportujących, może powodować zwiększenie stężenia rozuwastatyny w osoczu i zwiększone ryzyko miopatii (patrz punkty 4.2 i 4.4 oraz tabela w punkcie 4.5).
Gemfibrozyl i inne produkty obniżające stężenia lipidów: jednoczesne stosowanie rozuwastatyny i gemfibrozylu powodowało 2-krotne zwiększenie wartości Cmax i AUC rozuwastatyny (patrz punkt 4.4). Na podstawie danych z badań dotyczących określonych interakcji nie oczekuje się żadnych istotnych interakcji farmakokinetycznych z fenofibratem, jednak mogą wystąpić interakcje farmakodynamiczne.
Gemfibrozyl, fenofibrat, inne fibraty i niacyna (kwas nikotynowy) w dawkach zmniejszających stężenie lipidów (przekraczających lub równych 1 g/dobę) zwiększają ryzyko wystąpienia miopatii, gdy są podawane jednocześnie z inhibitorami reduktazy HMG- CoA, prawdopodobnie ze względu na fakt, że produkty te podawane pojedynczo mogą powodować miopatię.
W przypadku pacjentów otrzymujących fenofibrat i ezetymib lekarze powinni być świadomi możliwego ryzyka kamicy żółciowej i choroby pęcherzyka żółciowego (patrz punkty 4.4
i 4.8). Jeśli podejrzewa się kamicę żółciową u pacjenta otrzymującego ezetymib i fenofibrat, wskazane jest badanie pęcherzyka żółciowego i przerwanie leczenia (patrz punkt 4.8).
Jednoczesne podawanie fenofibratu lub gemfibrozylu nieznacznie zwiększało całkowite stężenie ezetymibu (odpowiednio około 1,5- i 1,7-krotnie). Nie badano jednoczesnego podawania ezetymibu z innymi fibratami. Fibraty mogą zwiększać wydalanie cholesterolu z żółcią, prowadząc do kamicy żółciowej. W badaniach na zwierzętach ezetymib czasami zwiększał zawartość cholesterolu w żółci, ale nie u wszystkich gatunków (patrz punkt 5.3).
Nie można wykluczyć ryzyka działania przyśpieszającego tworzenie złogów związanego z leczeniem ezetymibem.
Kwas fusydowy: jednoczesne podawanie kwasu fusydowego stosowanego ogólnoustrojowo i statyn może zwiększać ryzyko miopatii, włącznie z rabdomiolizą. Mechanizm tej interakcji (czy jest to interakcja farmakodynamiczna, farmakokinetyczna czy obie) nie został dotychczas wyjaśniony. Istnieją doniesienia o występowaniu rabdomiolizy (w tym przypadków zakończonych zgonem) u pacjentów otrzymujących takie leczenie skojarzone. Jeśli leczenie kwasem fusydowym stosowanym ogólnoustrojowo jest konieczne, leczenie rozuwastatyną należy przerwać na czas podawania kwasu fusydowego. Patrz również
punkt 4.4.
Inne interakcje
Leki zobojętniające sok żołądkowy: jednoczesne stosowanie rozuwastatyny i zawiesiny zmniejszającej kwaśność soku żołądkowego, zawierającej wodorotlenek glinu i magnezu, powodowało zmniejszenie stężenia rozuwastatyny w osoczu o około 50%. Działanie to było mniejsze, gdy lek zobojętniający był podawany 2 godziny po podaniu rozuwastatyny.
Znaczenie kliniczne tej interakcji nie było badane.
Jednoczesne stosowanie leków zobojętniających zmniejsza szybkość wchłaniania ezetymibu, ale nie wpływa na jego biodostępność. Zmniejszenie szybkości wchłaniania nie jest uznawane za klinicznie istotne.
Erytromycyna: jednoczesne stosowanie rozuwastatyny i erytromycyny powodowało zmniejszenie wartości AUC0-t dla rozuwastatyny o 20% i zmniejszenie wartości Cmax o 30%. Przyczyną tej interakcji może być zwiększenie motoryki jelit przez erytromycynę.
Enzymy cytochromu P450: badania w warunkach in vitro i in vivo wykazały, że rozuwastatyna nie jest inhibitorem ani induktorem izoenzymów układu cytochromu P450, a ponadto jest dla nich słabym substratem. Dlatego nie należy spodziewać się interakcji wynikających z metabolizmu zachodzącego za pośrednictwem układu enzymatycznego cytochromu P450. Nie stwierdzono klinicznie istotnych interakcji rozuwastatyny
z flukonazolem (inhibitorem CYP2C9 i CYP3A4) ani z ketokonazolem (inhibitorem CYP2A6
i CYP3A4).
W badaniach przedklinicznych wykazano, że ezetymib nie indukuje aktywności enzymów cytochromu P450 uczestniczących w metabolizmie leków. Nie obserwowano istotnych klinicznie interakcji farmakokinetycznych między ezetymibem a lekami metabolizowanymi przez izoenzymy cytochromu P450 1A2, 2D6, 2C8, 2C9 i 3A4 lub N-acetylotransferazę.
Antagoniści witaminy K: podobnie jak w przypadku innych inhibitorów reduktazy HMG- CoA, rozpoczęcie leczenia lub zwiększenie dawki rozuwastatyny u pacjentów leczonych jednocześnie antagonistami witaminy K (np. warfaryną lub innym lekiem przeciwzakrzepowym z grupy pochodnych kumaryny) może spowodować zwiększenie wartości międzynarodowego współczynnika znormalizowanego (INR). Przerwanie leczenia lub zmniejszenie dawki rozuwastatyny może spowodować obniżenie INR. W takich sytuacjach pożądane jest odpowiednie kontrolowanie wartości INR.
Jednoczesne podawanie ezetymibu (10 mg raz na dobę) nie miało istotnego wpływu na biodostępność warfaryny i czas protrombinowy w badaniu z udziałem dwunastu zdrowych dorosłych mężczyzn. Jednak istnieją doniesienia z okresu po wprowadzeniu do obrotu dotyczące zwiększenia wartości międzynarodowego współczynnika znormalizowanego (INR) u pacjentów, którzy otrzymywali ezetymib podczas leczenia warfaryną lub fluindionem. Jeśli produkt leczniczy <nazwa produktu leczniczego> jest jednocześnie stosowany z warfaryną, innym lekiem przeciwzakrzepowym z grupy pochodnych kumaryny lub fluindionem, należy odpowiednio monitorować wartość INR (patrz punkt 4.4).
Doustna antykoncepcja/hormonalna terapia zastępcza (HTZ): jednoczesne stosowanie rozuwastatyny i doustnych środków antykoncepcyjnych powodowało zwiększenie wartości AUC dla etynyloestradiolu o 26%, a dla norgestrelu — o 34%. Przy wyborze dawki doustnego środka antykoncepcyjnego należy uwzględnić zwiększone stężenia w osoczu. Brak dostępnych danych farmakokinetycznych dotyczących jednoczesnego stosowania rozuwastatyny i HTZ, dlatego nie można wykluczyć podobnego działania. Połączenie to było jednak szeroko stosowane u kobiet w badaniach klinicznych i było dobrze tolerowane.
W badaniach klinicznych dotyczących interakcji ezetymib nie miał wpływu na farmakokinetykę doustnych środków antykoncepcyjnych (etynyloestradiolu
i lewonorgestrelu).
Kolestyramina: jednoczesne podawanie kolestyraminy zmniejsza średnią wartość pola powierzchni pod krzywą (AUC) całkowitego ezetymibu (ezetymib + glukuronian ezetymibu)
o około 55%. W wyniku tej interakcji po włączeniu ezetymibu do leczenia kolestyraminą efekt zwiększonej redukcji stężenia cholesterolu frakcji lipoprotein niskiej gęstości (LDL-C) może ulec osłabieniu (patrz punkt 4.2).
Statyny: nie obserwowano istotnych klinicznie interakcji farmakokinetycznych podczas jednoczesnego podawania ezetymibu z atorwastatyną, symwastatyną, prawastatyną, lowastatyną, fluwastatyną lub rozuwastatyną.
Tikagrelor: tikagrelor może powodować niewydolność nerek i wpływać na wydalanie rozuwastatyny przez nerki, zwiększając ryzyko akumulacji rozuwastatyny. W niektórych przypadkach jednoczesne podawanie tikagreloru i rozuwastatyny prowadziło do obniżenia czynności nerek, wzrostu aktywności CPK i rabdomiolizy. Zaleca się kontrolowanie czynności nerek oraz aktywności CPK podczas jednoczesnego stosowania tikagreloru
i rozuwastatyny.
Inne produkty lecznicze: na podstawie danych pochodzących z badań dotyczących określonych interakcji nie oczekuje się żadnych istotnych klinicznie interakcji między rozuwastatyną a digoksyną.
W badaniach klinicznych dotyczących interakcji ezetymib nie miał wpływu na farmakokinetykę dapsonu, dekstrometorfanu, digoksyny, glipizydu, tolbutamidu ani midazolamu podczas jednoczesnego stosowania. Cymetydyna, podawana razem
z ezetymibem, nie miała wpływu na biodostępność ezetymibu.
Interakcje wymagające dostosowania dawki rozuwastatyny (patrz także tabela poniżej): jeśli konieczne jest jednoczesne stosowanie rozuwastatyny i innych produktów leczniczych, które zwiększają ekspozycję na rozuwastatynę, dawki należy dostosować. Jeśli spodziewane zwiększenie ekspozycji (AUC) jest około 2-krotne lub większe, leczenie rozuwastatyną należy rozpocząć od dawki 5 mg raz na dobę. Maksymalną dawkę dobową rozuwastatyny należy dostosować tak, aby przewidywana ekspozycja na rozuwastatynę nie była większa niż uzyskiwana po podaniu rozuwastatyny w dawce dobowej 40 mg bez wchodzących z nią
w interakcję produktów leczniczych. Przykładowo należy podawać 20 mg rozuwastatyny z gemfibrozylem (1,9-krotne zwiększenie ekspozycji) oraz 10 mg rozuwastatyny
z połączeniem atazanawiru i rytonawiru (3,1-krotne zwiększenie ekspozycji).
Wpływ jednocześnie stosowanych produktów leczniczych na ekspozycję na rozuwastatynę (AUC; w kolejności malejącego stopnia zwiększenia ekspozycji) na podstawie danych z opublikowanych badań klinicznych
2-krotne lub większe niż 2-krotne zwiększenie wartości AUC rozuwastatyny | ||
Schemat dawkowania leku powodującego interakcję | Schemat dawkowania rozuwastatyny | Zmiana AUC rozuwastatyny* |
Sofosbuwir/welpataswir/woksylaprewir (400 mg/100 mg/100 mg) + woksylaprewir (100 mg) raz na dobę przez 15 dni | 10 mg, pojedyncza dawka | 7,4-krotny ↑ |
Cyklosporyna w dawce od 75 mg do 200 mg BID, 6 miesięcy | 10 mg OD, 10 dni | 7,1-krotny ↑ |
Darolutamid 600 mg BID, 5 dni | 5 mg, dawka pojedyncza | 5,2-krotny ↑ |
Regorafenib 160 mg, OD, 14 dni | 5 mg, pojedyncza dawka | 3,8-krotny ↑ |
Atazanawir 300 mg/rytonawir 100 mg OD, 8 dni | 10 mg, dawka pojedyncza | 3,1-krotny ↑ |
Ombitaswir 25 mg/parytaprewir 150 mg/rytonawir 100 mg OD/ dazabuwir 400 mg BID, 14 dni | 5 mg, dawka pojedyncza | 2,6-krotny ↑ |
Grazoprewir 200 mg/elbaswir 50 mg OD, 11 dni | 10 mg, dawka pojedyncza | 2,3-krotny ↑ |
Glekaprewir 400 mg/pibrentaswir 120 mg OD, 7 dni | 5 mg OD, 7 dni | 2,2-krotny ↑ |
Lopinawir 400 mg/rytonawir 100 mg BID, 17 dni | 20 mg OD, 7 dni | 2,1-krotny ↑ |
Klopidogrel w dawce nasycającej 300 mg, a następnie 75 mg na 24 godziny | 20 mg, pojedyncza dawka | 2-krotny ↑ |
Mniej niż 2-krotne zwiększenie AUC rozuwastatyny | ||
Schemat dawkowania leku powodującego interakcję | Schemat dawkowania rozuwastatyny | Zmiana AUC rozuwastatyny* |
Gemfibrozil 600 mg BID, 7 dni | 80 mg, pojedyncza dawka | 1,9-krotny ↑ |
Eltrombopag 75 mg OD, 5 dni | 10 mg, dawka pojedyncza | 1,6-krotny ↑ |
Darunawir 600 mg/rytonawir 100 mg BID, 7 dni | 10 mg OD, 7 dni | 1,5-krotny ↑ |
Typranawir 500 mg/rytonawir 200 mg BID, 11 dni | 10 mg, dawka pojedyncza | 1,4-krotny ↑ |
Dronedaron 400 mg BID | Dane niedostępne | 1,4-krotny ↑ |
Itrakonazol 200 mg OD, 5 dni | 10 mg, dawka pojedyncza | ** 1,4-krotny ↑ |
Ezetymib 10 mg OD, 14 dni | 10 mg, OD, 14 dni | ** 1,2-krotny ↑ |
Zmniejszenie AUC rozuwastatyny | ||
Schemat dawkowania leku powodującego interakcję | Schemat dawkowania rozuwastatyny | Zmiana AUC rozuwastatyny* |
Erytromycyna 500 mg QID, 7 dni | 80 mg, pojedyncza dawka | 20% ↓ |
Bajkalina 50 mg TID, 14 dni | 20 mg, pojedyncza dawka | 47% ↓ |
* Dane podane jako krotność zmiany przedstawiają prostą proporcję między ekspozycją na rozuwastatynę podczas jednoczesnego stosowania z innymi lekami a ekspozycją podczas podawania samej rozuwastatyny. Dane w % przedstawiają procentową różnicę względem samej rozuwastatyny. „↑” oznacza zwiększenie, „↓” oznacza zmniejszenie. ** Przeprowadzono szereg badań dotyczących interakcji dla różnych dawek rozuwastatyny. W tabeli przedstawiono najbardziej istotną proporcję. AUC = pole powierzchni pod krzywą (ang. area under curve); OD = raz na dobę; BID = dwa razy na dobę; TID = trzy razy na dobę; QID = cztery razy na dobę. | ||
Następujące produkty lecznicze/skojarzenia nie miały klinicznie istotnego wpływu na stosunek AUC rozuwastatyny przy jednoczesnym podawaniu:
Aleglitazar 0,3 mg dawkowanie przez 7 dni; fenofibrat 67 mg dawkowanie przez 7 dni TID; flukonazol 200 mg dawkowanie przez 11 dni OD; fosamprenawir 700 mg/rytonawir 100 mg dawkowanie przez 8 dni BID; ketokonazol 200 mg dawkowanie przez 7 dni BID; ryfampicyna 450 mg dawkowanie przez 7 dni OD; sylimaryna 140 mg dawkowanie przez
5 dni TID.
Złożony produkt leczniczy nie jest odpowiedni do rozpoczynania leczenia. Rozpoczęcie leczenia lub w razie konieczności dostosowanie dawki powinno się odbywać przez podanie tych samych substancji czynnych w postaci oddzielnych produktów. Dopiero po ustaleniu odpowiednich dawek możliwe jest zastosowanie produktu złożonego o odpowiedniej mocy.
Dzieci i młodzież
Badania dotyczące interakcji przeprowadzono wyłącznie u dorosłych.
Stosowanie produktu leczniczego Crosuvo Plus jest przeciwwskazane w okresie ciąży
i karmienia piersią.
Kobiety w wieku rozrodczym powinny stosować odpowiednie metody antykoncepcji.
Ciąża
Rozuwastatyna:
Ponieważ cholesterol i inne produkty jego biosyntezy mają zasadnicze znaczenie dla rozwoju płodu, potencjalne ryzyko wynikające z hamowania aktywności reduktazy HMG-CoA przeważa nad korzyścią z leczenia w okresie ciąży. Badania na zwierzętach dostarczają ograniczoną ilość danych dotyczących toksycznego wpływu na reprodukcję (patrz punkt 5.3). Jeśli pacjentka zajdzie w ciążę podczas stosowania produktu leczniczego Crosuvo Plus, leczenie należy natychmiast przerwać.
Ezetymib:
Brak danych klinicznych dotyczących stosowania ezetymibu w okresie ciąży.
Badania na zwierzętach dotyczące stosowania ezetymibu w monoterapii nie wykazały bezpośredniego lub pośredniego szkodliwego wpływu na ciążę, rozwój zarodka i płodu, poród ani na rozwój pourodzeniowy (patrz punkt 5.3).
Karmienie piersią
Rozuwastatyna:
Rozuwastatyna przenika do mleka karmiących samic szczura. Brak danych dotyczących przenikania leku do mleka kobiecego (patrz punkt 4.3).
Ezetymib:
Badania na szczurach wykazały, że ezetymib przenika do mleka karmiących samic szczura. Nie wiadomo, czy ezetymib przenika do mleka kobiecego.
Płodność
Nie ma dostępnych danych z badań klinicznych dotyczących wpływu ezetymibu na płodność
u ludzi. Ezetymib nie miał wpływu na płodność samców ani samic szczurów (patrz
punkt 5.3).
Produkt leczniczy Crosuvo Plus nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Nie przeprowadzono badań dotyczących wpływu rozuwastatyny i (lub) ezetymibu na zdolność prowadzenia pojazdów i obsługiwania maszyn. Jednak podczas wykonywania tych czynności należy brać pod uwagę możliwość wystąpienia zawrotów głowy w trakcie leczenia.
Podsumowanie profilu bezpieczeństwa
Działania niepożądane obserwowane podczas stosowania rozuwastatyny były na ogół łagodne i przemijające. W badaniach klinicznych z grupą kontrolną mniej niż 4% pacjentów leczonych rozuwastatyną przerwało leczenie z powodu działań niepożądanych.
W trwających do 112 tygodni badaniach klinicznych ezetymib w dawce dobowej 10 mg stosowano w monoterapii u 2396 pacjentów, w skojarzeniu ze statyną u 11 308 pacjentów lub w skojarzeniu z fenofibratem u 185 pacjentów. Działania niepożądane były zwykle łagodne
i przemijające. Całkowita częstość działań niepożądanych ezetymibu i placebo była podobna. Również liczba pacjentów, którzy przerwali leczenie z powodu działań niepożądanych, była porównywalna w grupach otrzymujących ezetymib i placebo.
Zgodnie z dostępnymi danymi 1200 uczestników badań klinicznych otrzymywało rozuwastatynę w skojarzeniu z ezetymibem. Zgodnie z informacjami w opublikowanym piśmiennictwie najczęstszymi działaniami niepożądanymi związanymi z takim leczeniem skojarzonym u pacjentów z hipercholesterolemią są zwiększona aktywność aminotransferaz wątrobowych, zaburzenia żołądkowo-jelitowe i ból mięśni. Są to znane działania niepożądane
substancji czynnych. Nie można jednak wykluczyć interakcji farmakodynamicznej między rozuwastatyną i ezetymibem w postaci działań niepożądanych (patrz punkt 5.2).
Tabelaryczne zestawienie działań niepożądanych
Częstość występowania działań niepożądanych uszeregowano zgodnie z następującą konwencją: często (≥ 1/100 do ≥ 1/10); niezbyt często (≥ 1/1000 do ≥ 1/100); rzadko
(≥ 1/10 000 do ≥ 1/1000), bardzo rzadko (≥ 1/10 000) i częstość nieznana (częstość nie może być określona na podstawie dostępnych danych).
Klasyfikacja układów i narządów wg MedDRA | Często | Niezbyt często | Rzadko | Bardzo rzadko | Częstość nieznana |
Zaburzenia krwi i układu chłonnego | małopłytkowość2 | małopłytkowość5 | |||
Zaburzenia układu immunologicznego | reakcje nadwrażliwości, w tym obrzęk naczynioruchowy2 | nadwrażliwość (w tym wysypka, pokrzywka, anafilaksja i obrzęk naczynioruchowy)5 | |||
Zaburzenia endokrynologiczne | cukrzyca1,2 | ||||
Zaburzenia metabolizmu i odżywiania | zmniejszenie apetytu3 | ||||
Zaburzenia psychiczne | depresja2,5 | ||||
Zaburzenia układu nerwowego | ból głowy2,4, zawroty głowy2 | parestezja4 | polineuropatia2, utrata pamięci2 | neuropatia obwodowa2 zaburzenia snu (w tym bezsenność i koszmary senne)2 zawroty głowy5; parestezja5 | |
Zaburzenia naczyniowe | uderzenia gorąca3; nadciśnienie tętnicze3 | ||||
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | kaszel3 | kaszel2 duszność2,5 |
Zaburzenia żołądka i jelit | zaparcie2, nudności2, ból w jamie brzusznej2,3 biegunka3; wzdęcia3 | niestrawność3; choroba refluksowa przełyku3; nudności3 suchość w jamie ustnej4; zapalenie błony śluzowej żołądka4 | zapalenie trzustki2 | biegunka2 zapalenie trzustki5; zaparcie5 | |
Zaburzenia wątroby i dróg żółciowych | zwiększona aktywność aminotransferaz wątrobowych2 | żółtaczka2, zapalenie wątroby2 | zapalenie wątroby5, kamica żółciowa5, zapalenie pęcherzyka żółciowego5 | ||
Zaburzenia skóry i tkanki podskórnej | świąd2,4, wysypka2,4, pokrzywka2,4 | zespół Stevensa- Johnsona2 rumień wielopostaciowy5 reakcja polekowa z eozynofilią i objawami ogólnymi (DRESS) | |||
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | ból mięśni2, 4 | ból stawów3; skurcze mięśni3; ból szyi3 ból pleców4, osłabienie mięśni4, ból kończyn4 | miopatia (w tym zapalenie mięśni)2, rabdomioliza2 zespół toczniopodobny zerwanie mięśnia | ból stawów2 | ból stawów5, immunozależna miopatia martwicza2, zaburzenia ścięgien (czasami powikłane zerwaniem)2, ból mięśni5, miopatia/ rabdomioliza5 (patrz punkt 4.4) |
Zaburzenia nerek i dróg moczowych | krwiomocz2 |
Zaburzenia układu rozrodczego i piersi | ginekomastia2 | ||||
Zaburzenia ogólne i stany w miejscu podania | astenia2 zmęczenie3 | ból w klatce piersiowej3, ból3, astenia4, obrzęk obwodowy4 | obrzęk2 astenia5 | ||
Badania diagnostyczne | zwiększenie aktywności AlAT i (lub) AspAT4 | zwiększenie aktywności AlAT i (lub) AspAT3 zwiększenie aktywności CPK we krwi3, zwiększenie aktywności gamma- glutamylotransferazy3, nieprawidłowe wyniki badań czynności wątroby3 |
1 Częstość zależy od obecności lub braku czynników ryzyka (stężenie glukozy na czczo
≥ 5,6 mmol/l, BMI > 30 kg/m2, zwiększone stężenie trójglicerydów, nadciśnienie tętnicze
w wywiadzie) - dla rozuwastatyny.
2 Profil działań niepożądanych rozuwastatyny na podstawie danych z badań klinicznych
i dużego doświadczenia po wprowadzeniu rozuwastatyny do obrotu.
3 Ezetymib w monoterapii. Działania niepożądane, które obserwowano u pacjentów leczonych ezetymibem (N = 2396) i które występowały z większą częstością niż po podaniu placebo (N = 1159).
4 Ezetymib podawany jednocześnie ze statyną. Działania niepożądane, które obserwowano u pacjentów otrzymujących ezetymib w skojarzeniu ze statyną (N = 11 308) i które występowały z większą częstością niż po podaniu statyn w monoterapii (N = 9361).
5 Dodatkowe działania niepożądane ezetymibu zgłaszane po wprowadzeniu do obrotu. Ponieważ zdarzenia niepożądane identyfikowano na podstawie spontanicznych doniesień, prawdziwa częstość ich występowania nie jest znana i nie może zostać oszacowana.
Tak jak w przypadku innych inhibitorów reduktazy HMG-CoA, częstość działań niepożądanych leku jest uzależniona od dawki.
Wpływ na nerki: u pacjentów leczonych rozuwastatyną obserwowano białkomocz wykrywany testem paskowym, głównie pochodzenia kanalikowego. Zwiększenie ilości białka w moczu (od „brak” lub „ślad” do „+ +” albo więcej) stwierdzano na pewnym etapie leczenia u mniej niż 1% pacjentów otrzymujących dawki 10 mg i 20 mg oraz u około 3% pacjentów leczonych dawką 40 mg. Niewielkie zwiększenie ilości białka (od „brak” lub „ślad” do „+”) zaobserwowano u pacjentów otrzymujących dawkę 20 mg. W większości przypadków białkomocz zmniejsza się lub samoistnie ustępuje podczas leczenia. W analizie danych
z badań klinicznych i doświadczenia po wprowadzeniu produktu do obrotu nie wykazano związku przyczynowego między białkomoczem a ostrą lub postępującą chorobą nerek.
U pacjentów leczonych rozuwastatyną obserwowano krwiomocz, a dane z badań klinicznych wykazały niewielką częstość jego występowania.
Wpływ na mięśnie szkieletowe: u pacjentów leczonych rozuwastatyną we wszystkich dawkach, ale w szczególności w dawkach większych niż 20 mg, opisywano wpływ na mięśnie szkieletowe, np. ból mięśni, miopatię (w tym zapalenie mięśni) oraz rzadko rabdomiolizę z ostrą niewydolnością nerek lub bez niej.
U pacjentów otrzymujących rozuwastatynę obserwowano zależne od dawki zwiększenie aktywności CK. W większości przypadków było ono łagodne, bezobjawowe i przemijające. Jeśli aktywność CK zwiększy się (> 5 x GGN), leczenie należy przerwać (patrz punkt 4.4).
Wpływ na wątrobę: podobnie jak w przypadku innych inhibitorów reduktazy HMG-CoA, u niewielkiej liczby pacjentów leczonych rozuwastatyną obserwowano zależne od dawki zwiększenie aktywności aminotransferaz. W większości przypadków było ono łagodne, bezobjawowe i przemijające.
W przypadku stosowania niektórych statyn opisywano następujące działania niepożądane:
Ilość zaobserwowanych przypadków rabdomiolizy, ciężkich zdarzeń dotyczących nerek oraz ciężkich zdarzeń dotyczących wątroby (obejmujących głównie zwiększenie aktywności aminotransferaz wątrobowych) jest wyższa w przypadku rozuwastatyny w dawce 40 mg.
Wyniki badań laboratoryjnych
W badaniach klinicznych z grupą kontrolną dotyczących monoterapii częstość występowania klinicznie istotnego zwiększenia aktywności aminotransferaz w surowicy (AlAT i (lub) AspAT ≥ 3 × GGN, stopniowo) była podobna dla ezetymibu (0,5%) i placebo (0,3%).
W badaniach z zastosowaniem leczenia skojarzonego częstość ta wynosiła 1,3% u pacjentów otrzymujących jednocześnie ezetymib i statynę oraz 0,4% u pacjentów leczonych statyną
w monoterapii. Zmiany te były zwykle bezobjawowe, nie wiązały się z zastojem żółci
i powracały do wartości wyjściowych po przerwaniu leczenia lub podczas dalszej terapii (patrz punkt 4.4).
W badaniach klinicznych aktywność CPK > 10 x GGN zaobserwowano u 4 z 1674 (0,2%) pacjentów otrzymujących ezetymib w monoterapii, u 1 z 786 (0,1%) pacjentów otrzymujących placebo, u 1 z 917 (0,1%) pacjentów otrzymujących jednocześnie ezetymib i statynę oraz u 4 z 929 (0,4%) pacjentów otrzymujących statynę w monoterapii. Nie
odnotowano częstszego występowania miopatii lub rabdomiolizy u pacjentów otrzymujących ezetymib w porównaniu z odpowiednią grupą kontrolną badania (placebo lub statyna
w monoterapii) (patrz punkt 4.4).
Dzieci i młodzież
Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego
Crosuvo Plus u dzieci w wieku poniżej 18 lat (patrz punkt 5.1).
Rozuwastatyna: w trwającym 52 tygodnie badaniu klinicznym zwiększenie aktywności kinazy kreatynowej > 10 x GGN oraz objawy dotyczące mięśni po wysiłku lub zwiększonej aktywności fizycznej obserwowano częściej u dzieci i młodzieży niż u dorosłych. Pod innymi względami profil bezpieczeństwa stosowania rozuwastatyny u dzieci i młodzieży oraz
u dorosłych był podobny.
Ezetymib: w badaniu obejmującym nastoletnich pacjentów (w wieku od 10 do 17 lat)
z heterozygotyczną hipercholesterolemią rodzinną (n = 248) zwiększenie aktywności AlAT i (lub) AspAT (≥ 3 x GGN, stopniowo) zaobserwowano u 4 pacjentów (3%) w grupie otrzymującej ezetymib w skojarzeniu z symwastatyną w porównaniu z 2 pacjentami (2%) w grupie otrzymującej symwastatynę w monoterapii; odsetki te wynosiły odpowiednio 2% (2 pacjentów) i 0% w przypadku zwiększenia aktywności CPK (≥ 10 x GGN). Nie opisano przypadków miopatii. Badanie to nie było skonstruowane w sposób umożliwiający porównanie rzadkich działań niepożądanych leku.
Dzieci i młodzież (w wieku 6–17 lat)
W badaniu z udziałem dzieci (w wieku od 6 do 10 lat) z heterozygotyczną rodzinną lub nierodzinną hipercholesterolemią (n = 138) u 1,1% pacjentów (1 pacjent) leczonych ezetymibem zaobserwowano zwiększenie aktywności AlAT i (lub) AspAT (≥ 3 x GGN, stopniowo) w porównaniu z 0% w grupie otrzymującej placebo. Nie odnotowano zwiększenia aktywności CPK (≥ 10 x GGN). Nie opisano przypadków miopatii.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49-21-301, fax: +48 22 49-21-309
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie ma opublikowanych danych literaturowych dotyczących przedawkowania rozuwastatyny. Nie ma specyficznego leczenia w przypadku przedawkowania rozuwastatyny.
W badaniach klinicznych wykazano, że ezetymib podawany w dawce 50 mg/dobę
15 zdrowym osobom przez okres do 14 dni lub w dawce 40 mg/dobę 18 pacjentom
z pierwotną hipercholesterolemią przez okres do 56 dni był zasadniczo dobrze tolerowany. U zwierząt nie obserwowano toksyczności po zastosowaniu ezetymibu w pojedynczych dawkach doustnych wynoszących 5000 mg/kg mc. u szczurów i myszy oraz 3000 mg/kg mc. u psów.
Zgłoszono kilka przypadków przedawkowania ezetymibu. Większość z nich nie wiązała się z wystąpieniem działań niepożądanych, a działania niepożądane, które zgłoszono, nie były ciężkie.
W przypadku przedawkowania należy zastosować leczenie objawowe i wspomagające. Należy monitorować czynność wątroby i aktywność CK. Jest mało prawdopodobne, aby hemodializa przyniosła korzyści.
Grupa farmakoterapeutyczna: czynniki modyfikujące lipidy, połączenie różnych czynników modyfikujących lipidy.
Kod ATC: C10BA06
Mechanizm działania
Rozuwastatyna
Rozuwastatyna jest selektywnym i kompetycyjnym inhibitorem reduktazy HMG-CoA, enzymu ograniczającego szybkość przemiany 3-hydroksy-3-metyloglutarylo-koenzymu A do mewalonianu, prekursora cholesterolu. Rozuwastatyna działa przede wszystkim w wątrobie, narządzie docelowym dla leków zmniejszających stężenie cholesterolu.
Rozuwastatyna zwiększa liczbę receptorów LDL na powierzchni komórek wątroby, co ułatwia wychwytywanie i katabolizm LDL oraz hamuje syntezę VLDL w wątrobie, co prowadzi do zmniejszenia całkowitej ilości cząstek VLDL i LDL.
Ezetymib
Ezetymib należy do nowej klasy leków, które zmniejszają stężenia lipidów i selektywnie hamują wchłanianie cholesterolu oraz pochodnych steroli roślinnych w jelitach. Ezetymib działa po podaniu doustnym. Jego mechanizm działania różni się od mechanizmu działania innych grup leków zmniejszających stężenia cholesterolu (np. statyn, żywic wiążących kwasy żółciowe, pochodnych kwasu fibrynowego i stanoli roślinnych). Celem działania ezetymibu na poziomie molekularnym jest nośnik steroli, białko Niemann-Pick C1-Like 1 (NPC1L1), które odgrywa rolę w wychwytywaniu cholesterolu i fitosteroli w jelicie.
Działanie farmakodynamiczne
Rozuwastatyna
Rozuwastatyna obniża podwyższone stężenie cholesterolu frakcji LDL, cholesterolu całkowitego i trójglicerydów oraz zwiększa stężenie cholesterolu frakcji HDL. Powoduje również zmniejszenie stężenia lipoproteiny ApoB, frakcji nie-HDL-C, VLDL-C, VLDL-TG i zwiększa stężenie lipoproteiny ApoA-I (patrz tabela 1). Rozuwastatyna obniża również stosunek LDL-C/HDL-C, cholesterol całkowity/HDL-C, nie-HDL-C/HDL-C oraz ApoB/ApoA-I.
Tabela 1: Reakcja na zastosowaną dawkę leku u pacjentów z pierwotną hipercholesterolemią (typu IIa i IIb)
(uśredniona zmiana w procentach w odniesieniu do wartości początkowych)
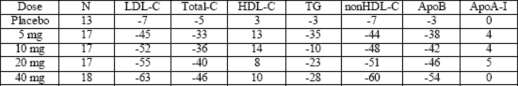
Działanie lecznicze jest osiągane w ciągu 1 tygodnia od rozpoczęcia leczenia, a 90% maksymalnej odpowiedzi występuje w ciągu 2 tygodni. Pełna odpowiedź na leczenie pojawia się zazwyczaj w ciągu 4 tygodni i utrzymuje się po tym czasie.
Ezetymib
Ezetymib wiąże się z rąbkiem szczoteczkowym jelita cienkiego i hamuje wchłanianie cholesterolu, co prowadzi do zmniejszenia ilości cholesterolu transportowanego do wątroby. Z kolei statyny zmniejszają syntezę cholesterolu w wątrobie. Ze względu na różne mechanizmy działania obu leków możliwe jest uzupełniające się zmniejszenie stężenia cholesterolu. W trwającym 2 tygodnie badaniu klinicznym w grupie 18 pacjentów
z hipercholesterolemią ezetymib hamował wchłanianie cholesterolu w jelitach o 54%
w porównaniu z placebo.
Przeprowadzono szereg badań przedklinicznych w celu określenia selektywności hamowania wchłaniania cholesterolu przez ezetymib. Ezetymib hamował wchłanianie cholesterolu znakowanego izotopem węgla [14C], nie miał zaś wpływu na wchłanianie trójglicerydów, kwasów tłuszczowych, kwasów żółciowych, progesteronu, etynyloestradiolu czy rozpuszczalnych w tłuszczach witamin A i D.
Skuteczność kliniczna i bezpieczeństwo stosowania
W trwającym 6 tygodni randomizowanym badaniu klinicznym prowadzonym
z zastosowaniem metody podwójnie ślepej próby w grupach równoległych oceniano bezpieczeństwo i skuteczność ezetymibu (w dawce 10 mg) dodawanego do stabilnej terapii rozuwastatyną w porównaniu ze zwiększaniem dawki rozuwastatyny z 5 mg do 10 mg lub z 10 mg do 20 mg (n = 440). Zbiorcze dane wykazały, że dodanie ezetymibu do stabilnego
leczenia rozuwastatyną w dawce 5 mg lub 10 mg obniżyło stężenie cholesterolu frakcji LDL o 21%. Dla porównania, podwajając dawkę rozuwastatyny do 10 mg lub 20 mg osiągano redukcję stężenia cholesterolu frakcji LDL o 5,7% (różnica między grupami 15,2%,
p < 0,001). Indywidualnie ezetymib dodany do rozuwastatyny w dawce 5 mg obniżył stężenie cholesterolu frakcji LDL w większym stopniu niż rozuwastatyna w dawce 10 mg (różnica 12,3%, p < 0,001), natomiast ezetymib dodany do rozuwastatyny w dawce 10 mg obniżył stężenie cholesterolu frakcji LDL w większym stopniu niż rozuwastatyna w dawce 20 mg (różnica 17,5%, p < 0,001).
Trwające 6 tygodni randomizowane badanie miało na celu ocenę skuteczności
i bezpieczeństwa stosowania rozuwastatyny w dawce 40 mg w monoterapii lub w terapii skojarzonej z ezetymibem w dawce 10 mg u pacjentów obarczonych wysokim ryzykiem choroby wieńcowej (n = 469). Docelowe stężenie cholesterolu LDL-C wg ATP III uzyskało znacząco więcej pacjentów otrzymujących rozuwastatynę w skojarzeniu z ezetymibem niż pacjentów otrzymujących rozuwastatynę w monoterapii (< 100 mg/dl, 94,0% w por. z 79,1%, p < 0,001). Rozuwastatyna w dawce 40 mg skutecznie poprawiała profil lipidów aterogennych w tej populacji wysokiego ryzyka.
W trwającym 12 tygodni randomizowanym badaniu prowadzonym metodą otwartej próby oceniono obniżenie stężenia cholesterolu frakcji LDL w różnych grupach terapeutycznych (rozuwastatyna 10 mg + ezetymib 10 mg, rozuwastatyna 20 mg + ezetymib 10 mg, symwastatyna 40 mg + ezetymib 10 mg, symwastatyna 80 mg + ezetymib 10 mg).
Zmniejszenie stężenia względem wartości wyjściowych podczas terapii skojarzonej
z użyciem niskiej dawki rozuwastatyny wynosiło 59,7% i było istotnie większe niż podczas terapii skojarzonej z wykorzystaniem niskiej dawki symwastatyny, kiedy to wynosiło 55,2% (p < 0,05). Terapia skojarzona z użyciem wysokiej dawki rozuwastatyny powodowała zmniejszenie stężenia cholesterolu LDL-C o 63,5%, a terapia skojarzona z wykorzystaniem wysokiej dawki symwastatyny — o 57,4% (p < 0,001).
Dzieci i młodzież
Europejska Agencja Leków uchyliła obowiązek dołączenia wyników badań produktu leczniczego Crosuvo Plus we wszystkich podgrupach populacji dzieci i młodzieży w leczeniu podwyższonego stężenia cholesterolu (stosowanie u dzieci i młodzieży, patrz punkt 4.2).
Leczenie skojarzone z użyciem rozuwastatyny i ezetymibu
Jednoczesne stosowanie 10 mg rozuwastatyny i 10 mg ezetymibu powodowało 1,2-krotne zwiększenie wartości AUC rozuwastatyny u pacjentów z hipercholesterolemią. W odniesieniu do działań niepożądanych nie można wykluczyć interakcji farmakodynamicznej między rozuwastatyną i ezetymibem.
Rozuwastatyna
Wchłanianie: po podaniu doustnym rozuwastatyna osiąga maksymalne stężenia w osoczu po około 5 godzinach. Bezwzględna biodostępność wynosi około 20%.
Dystrybucja: rozuwastatyna jest w znacznym stopniu wychwytywana przez wątrobę, będącą głównym miejscem syntezy cholesterolu i usuwania LDL-C. Objętość dystrybucji rozuwastatyny wynosi około 134 l. Rozuwastatyna wiąże się z białkami osocza, głównie
z albuminami, w około 90%.
Metabolizm: rozuwastatyna jest metabolizowana w niewielkim stopniu (około 10%).
W badaniach dotyczących metabolizmu prowadzonych w warunkach in vitro z użyciem ludzkich hepatocytów wykazano, że rozuwastatyna jest słabym substratem metabolizmu przy udziale cytochromu P450. Głównym izoenzymem biorącym udział w metabolizmie rozuwastatyny jest CYP2C9, a w mniejszym stopniu izoenzymy 2C19, 3A4 i 2D6. Głównymi wykrytymi metabolitami są pochodne N-demetylowane i laktonowe. Metabolity N- demetylowane wykazują aktywność niższą o około 50% od rozuwastatyny, natomiast metabolity laktonowe uważa się za nieaktywne klinicznie. Rozuwastatyna hamuje ponad 90% aktywności reduktazy HGM-CoA w krwiobiegu.
Eliminacja: około 90% dawki rozuwastatyny jest wydalane w postaci niezmienionej z kałem (zarówno wchłonięta, jak i niewchłonięta substancja czynna), a pozostała część jest wydalana z moczem.
Około 5% jest wydalane z moczem w postaci niezmienionej. Okres półtrwania w fazie eliminacji w osoczu wynosi około 19 godzin i nie zwiększa się przy podawaniu wyższych dawek. Średnia geometryczna klirensu osoczowego wynosi około 50 l/godz. (współczynnik zmienności 21,7%).
Tak jak w przypadku innych inhibitorów reduktazy HMG-CoA, wychwytywanie rozuwastatyny przez komórki wątroby odbywa się za pomocą transportera błonowego OATP-
C. Jest to ważny związek transportowy w procesie eliminacji rozuwastatyny w wątrobie.
Liniowość: ekspozycja ustrojowa na rozuwastatynę zwiększa się proporcjonalnie do dawki. Parametry farmakokinetyczne nie zmieniają się po wielokrotnym podaniu w ciągu doby.
Szczególne grupy pacjentów
Wiek i płeć: u dorosłych pacjentów nie stwierdzono klinicznie istotnego wpływu wieku i płci na właściwości farmakokinetyczne rozuwastatyny. Farmakokinetyka rozuwastatyny u dzieci i młodzieży z heterozygotyczną rodzinną hipercholesterolemią była zbliżona do farmakokinetyki u dorosłych ochotników (patrz punkt „Dzieci i młodzież” poniżej).
Rasa: badania farmakokinetyczne wykazały około 2-krotne zwiększenie mediany wartości AUC i Cmax u pacjentów pochodzenia azjatyckiego (Japończyków, Chińczyków, Filipińczyków, Wietnamczyków i Koreańczyków) w porównaniu z rasą kaukaską. U Azjatów pochodzenia hinduskiego występuje około 1,3-krotne zwiększenie mediany wartości AUC
i Cmax.
Badania farmakokinetyczne w populacji rasy kaukaskiej i czarnej nie wykazały istotnych klinicznie różnic w farmakokinetyce.
Niewydolność nerek: w badaniu z udziałem pacjentów z zaburzeniami czynności nerek
o różnym nasileniu stwierdzono, że zaburzenia czynności nerek o nasileniu od łagodnego do umiarkowanego nie wpływają na stężenie rozuwastatyny lub jej N-demetylowanych metabolitów w osoczu krwi. U pacjentów z ciężkimi zaburzeniami czynności nerek (CrCl
< 30 ml/min) stwierdzano 3-krotne zwiększenie stężenia rozuwastatyny w osoczu i 9-krotne zwiększenie stężenia jej N-demetylowanych metabolitów w porównaniu z wartościami
u zdrowych ochotników. U pacjentów dializowanych stężenie rozuwastatyny w osoczu
w stanie stacjonarnym było o około 50% większe niż u zdrowych ochotników.
Niewydolność wątroby: w badaniu z udziałem pacjentów z zaburzeniami czynności wątroby
o różnym nasileniu nie stwierdzono zwiększonej ekspozycji na rozuwastatynę u pacjentów
z wynikiem oceny w skali Childa-Pugha wynoszącym 7 punktów lub mniej. Jednak u dwóch pacjentów z wynikiem oceny w skali Childa-Pugha wynoszącym 8 i 9 punktów stwierdzono co najmniej 2-krotne zwiększenie ekspozycji w porównaniu z pacjentami z niższym wynikiem oceny w tej skali.
Nie ma danych dotyczących pacjentów z wynikiem oceny w skali Childa-Pugha powyżej 9 punktów.
Polimorfizmy genetyczne: w dystrybucji inhibitorów reduktazy HMG-CoA, w tym rozuwastatyny, rolę odgrywa czynność białek transportowych OATP1B1 i BCRP.
U pacjentów z polimorfizmami genetycznymi w genach kodujących SLCO1B1 (OATP1B1)
i (lub) ABCG2 (BCRP) istnieje ryzyko zwiększonej ekspozycji na rozuwastatynę. Pojedyncze polimorfizmy SLCO1B1 c.521CC i ABCG2 c.421AA są związane z większą ekspozycją na rozuwastatynę (AUC) w porównaniu z genotypami SLCO1B1 c.521TT lub ABCG2 c.421CC.
To swoiste genotypowanie nie jest rutynowo prowadzone w praktyce klinicznej, ale
u pacjentów z rozpoznanym polimorfizmem tego rodzaju zaleca się mniejszą dobową dawkę produktu leczniczego Crosuvo Plus.
Dzieci i młodzież: nie określono w pełni parametrów farmakokinetycznych rozuwastatyny
u dzieci i młodzieży w wieku 10–17 lat z heterozygotyczną hipercholesterolemią rodzinną. W niewielkim badaniu farmakokinetycznym prowadzonym z zastosowaniem rozuwastatyny (podawanej w tabletkach) w grupie 18 dzieci wykazano, że ekspozycja u dzieci i młodzieży wydaje się być porównywalna z ekspozycją u dorosłych pacjentów. Ponadto wyniki wskazują, że nie oczekuje się dużego odchylenia od proporcjonalności dawki.
Ezetymib
Wchłanianie: po podaniu doustnym ezetymib jest szybko wchłaniany i w znacznym stopniu sprzęgany w postaci czynnego farmakologicznie glukuronianu fenolowego (glukuronianu ezetymibu). Średnie maksymalne stężenia w osoczu (Cmax) obserwuje się w ciągu 1–
W badaniach dotyczących jednoczesnego stosowania ezetymibu i statyn stwierdzono, że działania toksyczne były zasadniczo takie, jak związane ze stosowaniem statyn. Niektóre z działań toksycznych były bardziej nasilone podczas stosowania produktu złożonego niż obserwowane podczas stosowania statyn w monoterapii. Można to przypisać interakcjom farmakokinetycznym i farmakodynamicznym podczas stosowania leczenia skojarzonego.
W badaniach klinicznych nie obserwowano takich interakcji. Miopatie występowały
u szczurów dopiero po dawkach wielokrotnie wyższych od dawek leczniczych stosowanych u ludzi (około 20-krotnie większa wartość AUC dla statyn i od 500- do 2000-krotnie większa wartość AUC dla czynnych metabolitów).
W szeregu testów dotyczących działania ezetymibu przeprowadzonych w warunkach in vivo
i in vitro nie stwierdzono genotoksycznego działania podczas podawania ezetymibu
w monoterapii lub w skojarzeniu ze statynami. Badania dotyczące rakotwórczego działania
ezetymibu w ujęciu długoterminowym dały wynik ujemny.
Równoczesne podawanie ezetymibu i statyn nie wiązało się z działaniem teratogennym u szczurów. U ciężarnych samic królika zaobserwowano niewielką liczbę deformacji kostnych (zrośnięcie kręgów piersiowych i ogonowych, zmniejszenie liczby kręgów ogonowych).
Rozuwastatyna: dane niekliniczne wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, genotoksyczności oraz potencjalnego działania rakotwórczego nie ujawniają żadnego szczególnego zagrożenia dla człowieka. Nie przeprowadzono szczegółowych badań nad wpływem leku na aktywność hERG. Działania niepożądane, których nie obserwowano w badaniach klinicznych, a które występowały u zwierząt po narażeniu podobnym do występującego w warunkach klinicznych, były następujące:
w badaniach toksyczności po podaniu dawek wielokrotnych zmiany histopatologiczne
w wątrobie, prawdopodobnie na skutek działania farmakologicznego rozuwastatyny, były
obserwowane u myszy, szczurów oraz, w mniejszym stopniu, wraz ze zmianami
w pęcherzyku żółciowym, u psów, lecz nie u małp. Ponadto po podaniu większych dawek obserwowano działanie uszkadzające jądra u małp i psów. U szczurów obserwowano toksyczny wpływ na rozrodczość, ze zmniejszeniem wielkości i masy miotów oraz przeżywalności nowonarodzonych szczurów po podaniu matce dawek toksycznych.
W badaniach tych ekspozycje układowe były kilkukrotnie większe od poziomu terapeutycznego.
Ezetymib: badania z udziałem zwierząt dotyczące przewlekłego działania toksycznego ezetymibu nie pozwoliły na zidentyfikowanie narządów szczególnie narażonych na działania toksyczne. U psów, którym podawano ezetymib przez cztery tygodnie
(≥ 0,03 mg/kg/mc./dobę) stwierdzono od 2,5- do 3,5-krotne zwiększenie stężenia cholesterolu
w żółci znajdującej się w pęcherzyku żółciowym. Jednak w badaniu, w którym przez rok
podawano psom dawki do 300 mg/kg mc./dobę, nie stwierdzono zwiększenia zapadalności na kamicę żółciową ani innego oddziaływania na wątrobę i drogi żółciowe. Nie wiadomo, czy wyniki tych badań mają znaczenie dla ludzi. Nie można wykluczyć ryzyka działania przyśpieszającego tworzenie złogów związanego z leczeniem ezetymibem.
Ezetymib nie wpływał na płodność samic lub samców szczurów ani też nie wykazywał działania teratogennego w badaniach na szczurach lub królikach. Nie wywierał również wpływu na rozwój w życiu płodowym i pourodzeniowy. Po podaniu wielokrotnych dawek po 1000 mg/kg mc./dobę ezetymib przechodził przez barierę łożyskową u ciężarnych samic szczurów i królików. Stosowanie ezetymibu w skojarzeniu z lowastatyną miało letalne działanie na zarodki.
Rdzeń tabletki (taki sam w przypadku wszystkich mocy) Celuloza mikrokrystaliczna (E460)
Krzemionka koloidalna bezwodna (E551) Magnezu stearynian (E572)
Powidon K30 (E1201) Kroskarmeloza sodowa (E468) Sodu laurylosiarczan (E487) Laktoza jednowodna Hypromeloza 2910 (E464)
Otoczka
Crosuvo Plus, 5 mg + 10 mg: Opadry Yellow 02F220026: Hypromeloza 2910 (E464) Tytanu dwutlenek (E171) Makrogol 4000 (E1521) Żelaza tlenek żółty (E172) Talk (E553b)
Żelaza tlenek czerwony (E171)
Crosuvo Plus, 10 mg + 10 mg: Opadry Beige 02F270003: Hypromeloza 2910 (E464) Tytanu dwutlenek (E171) Makrogol 4000 (E1521) Żelaza tlenek żółty (E172) Talk (E553b)
Crosuvo Plus, 20 mg + 10 mg: Vivacoat Yellow PC-2P-308: Hypromeloza 2910 (E464) Tytanu dwutlenek (E171) Makrogol 4000 (E1521) Żelaza tlenek żółty (E172) Talk (E553b)
Crosuvo Plus, 40 mg + 10 mg:
Opadry White OY-L-28900:
Laktoza jednowodna Hypromeloza 2910 (E464) Tytanu dwutlenek (E171) Makrogol 4000 (E1521)
Nie dotyczy.
Brak specjalnych zaleceń dotyczących temperatury przechowywania produktu leczniczego. Przechowywać w oryginalnym opakowaniu w celu ochrony przed światłem i wilgocią.
Opakowania po 30, 60 i 90 tabletek powlekanych w blistrze (OPA/Aluminium/PVC/Aluminium).
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Bausch Health Ireland Limited 3013 Lake Drive
Citywest Business Campus Dublin 24, D24PPT3 Irlandia
Crosuvo Plus, 5 mg + 10 mg:
Crosuvo Plus, 10 mg + 10 mg:
Crosuvo Plus, 20 mg + 10 mg:
Crosuvo Plus, 40 mg + 10 mg:
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











