Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA (NUMERY POZWOLEŃ) NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
analiza przyczyn niepowodzenia, tj. wstrzyknięcie w niewłaściwe mięśnie, zastosowanie nieodpowiedniej techniki wstrzykiwania, powstanie przeciwciał neutralizujących przeciwko toksynie botulinowej, niewystarczająca dawka;
ponowna ocena zasadności stosowania toksyny botulinowej typu A.
Nie przeprowadzono oceny skuteczności ani bezpieczeństwa stosowania wielokrotnych wstrzyknięć w okresie przekraczającym 12 miesięcy.
Specjalne grupy pacjentów
Pacjenci w podeszłym wieku
Brak danych klinicznych dotyczących stosowania produktu leczniczego Letybo u pacjentów w wieku powyżej 75 lat. U pacjentów w wieku powyżej 65 lat nie trzeba dostosowywać dawki (patrz punkt 5.1).
Dzieci i młodzież
Stosowanie produktu leczniczego Letybo u dzieci i młodzieży nie jest właściwe (patrz punkt 5.1). Sposób podawania
Podanie domięśniowe.
Po rekonstytucji produkt leczniczy Letybo można stosować tylko w ramach jednej serii wstrzyknięć u jednego pacjenta.
Instrukcje rozcieńczania, stosowania, informacje dotyczące przygotowania i usuwania fiolek, patrz punkt 6.6.
Wstrzyknięcia domięśniowe należy wykonywać sterylną strzykawką insulinową lub tuberkulinową o objętości 1 mL z podziałką co 0,01 mL oraz igłą w rozmiarze od 30 do 31 G.
Pobrać objętość 0,5 mL odpowiednio rekonstytuowanego roztworu do sterylnej strzykawki i usunąć wszelkie pęcherzyki powietrza z cylindra. Igłę użytą do rekonstytucji produktu leczniczego należy usunąć i zamienić na nową w celu podania produktu.
Uważać, aby nie wstrzyknąć produktu leczniczego Letybo do naczynia krwionośnego.
Aby zapobiec powikłaniom w postaci opadnięcia powieki (blefaroptozy), należy unikać wykonywania wstrzyknięć w pobliżu mięśnia dźwigacza powieki górnej, szczególnie u pacjentów z większą grupą mięśni obniżających brwi. W przypadku wstrzykiwania w każdy z mięśni marszczących brwi
pierwsze wstrzyknięcie należy wykonać bezpośrednio nad przyśrodkową krawędzią brwi. Drugie wstrzyknięcie należy wykonać mniej więcej 1 cm powyżej krawędzi nadoczodołowej (twarda krawędź kostna wyczuwalna powyżej górnej części górnej powieki), gdzie łączą się linie środkowe obu brwi.
Miejsce wstrzyknięcia w mięsień podłużny nosa znajduje się tuż powyżej linii środkowej grzbietu kostnego nosa, gdzie tworzą się zmarszczki poziome pomiędzy przyśrodkowymi końcami brwi.
W przypadku wykonywania wstrzyknięć w przyśrodkowe zakończenia mięśnia marszczącego brwi oraz linie środkowe brwi miejsca wstrzyknięć powinny znajdować się w odległości co najmniej 1 cm od krawędzi nadoczodołowej (twarda krawędź kostna wyczuwalna powyżej górnej części górnej powieki).
mięsień podłużny nosa
mięsień marszczący brwi
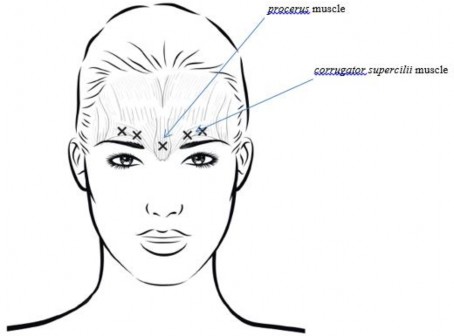
Wstrzyknięcia należy wykonywać ostrożnie, aby uniknąć wstrzyknięcia produktu w naczynia krwionośne. Przed wstrzyknięciem można umieścić kciuk lub palec wskazujący poniżej brzegu oczodołu i mocno ucisnąć, aby zapobiec wysiękowi produktu leczniczego w tym obszarze. Igła powinna być skierowana do góry i przyśrodkowo.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
Jakiekolwiek wycieki produktu należy usunąć: używając chłonnego materiału nasączonego roztworem sodu podchlorynu (w przypadku proszku) lub suchego materiału absorbującego w przypadku produktu po rekonstytucji.
Zanieczyszczone powierzchnie należy wytrzeć chłonnym materiałem nasączonym roztworem sodu podchlorynu, a następnie osuszyć.
Jeśli fiolka jest rozbita należy postępować według powyższych instrukcji. Ostrożnie zebrać kawałki rozbitego szkła oraz wytrzeć resztki produktu unikając skaleczeń.
Jeśli dojdzie do kontaktu produktu leczniczego ze skórą, umyć ją roztworem sodu podchlorynu, a następnie obficie spłukać wodą.
W razie dostania się produktu do oczu, należy dokładnie przemyć oczy dużą ilością wody lub roztworem do przemywania oczu.
Jeśli produkt dostanie się do rany, skaleczenia lub pęknięcia na skórze, należy dokładnie przemyć to miejsce dużą ilością wody, a następnie podjąć stosowne kroki medyczne w zależności od dawki, na której działanie była narażona osoba poszkodowana.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA (NUMERY POZWOLEŃ) NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Letybo, 50 jednostek, proszek do sporządzania roztworu do wstrzykiwań
Jedna fiolka zawiera 50 jednostek toksyny botulinowej typu A wytwarzanej przez Clostridium botulinum.
Po rekonstytucji w każdym 0,1 mL roztworu znajdują się 4 jednostki. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Proszek do sporządzania roztworu do wstrzykiwań. Biały proszek.
Produkt leczniczy Letybo jest wskazany do stosowania w celu uzyskania tymczasowej poprawy wyglądu umiarkowanych lub głębokich pionowych zmarszczek pomiędzy brwiami u osób dorosłych poniżej 75 roku życia, widocznych podczas maksymalnego zmarszczenia brwi (zmarszczki gładzizny czoła), w przypadku, gdy nasilenie zmarszczek na twarzy wywiera istotny wpływ na psychikę pacjenta.
Produkt leczniczy Letybo mogą podawać wyłącznie lekarze posiadający odpowiednie kwalifikacje i doświadczenie w zakresie tej metody leczenia oraz w stosowaniu wymaganego sprzętu.
Dawkowanie
Zalecana dawka to łącznie 20 jednostek podzielonych na pięć wstrzyknięć, każde po 4 jednostki (0,1 mL): 2 wstrzyknięcia w każdy mięsień marszczący brwi oraz 1 wstrzyknięcie w mięsień podłużny nosa.
Jednostki są swoiste dla produktu i nie mają zastosowania dla innych produktów zawierających toksynę botulinową typu A.
Zalecane dawki różnią się od dawek innych produktów zawierających toksynę botulinową.
Przerwa pomiędzy zabiegami powinna wynosić co najmniej trzy miesiące.
Jeśli w następstwie przeprowadzenia poprzedniej sesji leczniczej nie wystąpią żadne działania niepożądane, można przeprowadzić kolejną pod warunkiem zachowania między nimi odstępu wynoszącego co najmniej trzy miesiące.
Jeśli leczenie zakończy się niepowodzeniem po miesiącu od pierwszej serii zabiegów, tj. w przypadku stwierdzenia braku znaczącej poprawy względem stanu wyjściowego, można rozważyć następujące postępowanie:
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Uogólnione zaburzenia czynności mięśni (np. miastenia rzekomoporaźna, zespół Lamberta-Eatona, stwardnienie zanikowe boczne).
Obecność ostrej postaci zakażenia lub stanu zapalnego w miejscach planowanych wstrzyknięć.
Ogólne
Budowa anatomiczna mięśni i otaczających struktur naczyniowych i nerwowych w okolicy gładzizny czołowej oraz wszelkie zmiany w anatomii spowodowane wcześniejszymi zabiegami chirurgicznymi muszą zostać dokładnie rozpoznane przed podaniem produktu leczniczego Letybo. Należy unikać wstrzykiwania we wrażliwe na uszkodzenie struktury anatomiczne.
Należy zachować ostrożność podczas stosowania produktu leczniczego Letybo, jeśli docelowy mięsień wykazuje cechy wyraźnego osłabienia lub zaniku.
Istnieje ryzyko wystąpienia opadnięcia powieki po zabiegu – instrukcje podawania produktu pozwalające na zminimalizowanie tego ryzyka znajdują się w punkcie 4.2.
Zdarzenia związane z zabiegiem
Po podaniu innych toksyn botulinowych zdarzało się, że ból lub lęk związane z wkłuciem igły powodowały reakcje wazowagalne, w tym przejściową objawową hipotensję i omdlenie.
Wcześniej istniejące zaburzenia nerwowo-mięśniowe
U pacjentów z nierozpoznanymi zaburzeniami nerwowo-mięśniowymi może zwiększyć się ryzyko wystąpienia istotnych klinicznie działań ogólnoustrojowych, w tym ciężkich zaburzeń połykania i upośledzenia oddychania po podaniu standardowych dawek toksyny botulinowej typu A.
Reakcje nadwrażliwości
Bardzo rzadko po wstrzyknięciu toksyny botulinowej może wystąpić reakcja anafilaktyczna. Z tego względu powinna być dostępna epinefryna (adrenalina) lub jakiekolwiek inne środki przeciwanafilaktyczne.
Miejscowe i ogólne efekty rozprzestrzeniania się toksyny
Bardzo rzadko po podaniu toksyny botulinowej zgłaszano działania niepożądane mogące mieć
związek z rozprzestrzenianiem się toksyny do miejsc odległych od miejsca wstrzyknięcia toksyny botulinowej (patrz punkt 4.8). U pacjentów leczonych dawkami terapeutycznymi może wystąpić nadmierne osłabienie mięśni.
Zaburzenia przełykania i oddychania są ciężkie i mogą spowodować zgon. Nie zaleca się wstrzykiwania produktu leczniczego Letybo u pacjentów z zaburzeniami połykania i zachłyśnięciem w wywiadzie.
Należy pouczyć pacjentów lub ich opiekunów, aby natychmiast szukali pomocy medycznej w razie wystąpienia zaburzeń przełykania, mowy lub oddychania.
Powstawanie przeciwciał
Zbyt częste podawanie produktu lub podawanie go w zbyt dużych dawkach może zwiększać ryzyko powstania przeciwciał. Powstanie przeciwciał może być przyczyną niepowodzenia leczenia
z zastosowaniem toksyny botulinowej typu A, także w innych wskazaniach.
Zaburzenia krwawienia
Należy zachować ostrożność podczas stosowania produktu leczniczego Letybo u pacjentów z zaburzeniami krzepnięcia, ponieważ wstrzyknięcia mogą powodować siniaki.
Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na fiolkę, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
Identyfikowalność
W celu poprawienia identyfikowalności biologicznych produktów leczniczych należy czytelnie zapisać nazwę i numer serii podawanego produktu leczniczego.
Nie przeprowadzono badań dotyczących interakcji. Dla tego wskazania nie zgłoszono żadnych innych istotnych klinicznie interakcji.
Teoretycznie działanie toksyny botulinowej może zostać wzmocnione przez antybiotyki aminoglikozydowe, spektynomycynę oraz inne produkty lecznicze wpływające na przewodzenie nerwowo-mięśniowe (tj. produkty lecznicze blokujące przewodzenie nerwowo-mięśniowe).
Skutki podawania różnych serotypów neurotoksyny botulinowej w tym samym czasie lub w odstępie kilku miesięcy nie są znane. Podanie innej toksyny botulinowej przed ustąpieniem działania toksyny podanej wcześniej, może zaostrzyć nadmierne osłabienie nerwowo-mięśniowe.
Ciąża
Nie ma odpowiednich danych dotyczących stosowania toksyny botulinowej typu A u kobiet w okresie ciąży. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję przy podawaniu dużych dawek (patrz punkt 5.3). Potencjalne zagrożenie dla człowieka jest nieznane. Produkt leczniczy Letybo nie powinien być stosowany w okresie ciąży oraz u kobiet w wieku rozrodczym nie
stosujących skutecznej metody antykoncepcji.
Karmienie piersią
Nie wiadomo, czy produkt leczniczy Letybo przenika do mleka kobiecego. Nie należy stosować produktu leczniczego Letybo w okresie karmienia piersią.
Płodność
Nie ma wystarczającej ilości danych dotyczących wpływu stosowania toksyny botulinowej typu A na płodność kobiet w wieku rozrodczym. Badania na samcach i samicach szczurów wykazały obniżenie płodności (patrz punkt 5.3).
Nie przeprowadzono badań dotyczących wpływu produktu na zdolność do prowadzenia pojazdów i obsługiwania maszyn. Jednak stosowanie toksyny botulinowej typu A wiązało się z astenią,
osłabieniem mięśni, zawrotami głowy i zaburzeniami widzenia, co może mieć wpływ na zdolność prowadzenia pojazdów i obsługiwanie maszyn.
Podsumowanie profilu bezpieczeństwa
Bezpieczeństwo stosowania produktu leczniczego Letybo oceniano w trzech kluczowych badaniach klinicznych fazy III, z których wszystkie składały się z części z grupą kontrolną otrzymującą placebo (cykl 1) oraz części stanowiącej długoterminowe badanie przedłużone (cykle 2–4) i były prowadzone przez okres do jednego roku z udziałem 1 162 pacjentów otrzymujących Letybo. Ponadto dostępne są dane uzupełniające pochodzące z badania fazy III dotyczącego zmarszczek gładzizny czołowej przeprowadzonego w Korei, a także dane zgromadzone po dopuszczeniu produktu do obrotu.
Działania niepożądane mogą być związane z badanym produktem leczniczym (Letybo), procedurą wstrzyknięcia lub jednym i drugim. Działania niepożądane obserwowane są zazwyczaj w ciągu kilku pierwszych dni po wstrzyknięciu i mają przemijający charakter. Większość zgłoszonych działań
niepożądanych miało nasilenie od łagodnego do umiarkowanego. W trzech wyżej wymienionych badaniach kluczowych dotyczących stosowania Letybo w celu redukcji zmarszczek gładzizny
czołowej najczęściej zgłaszanymi działaniami niepożądanymi (u co najmniej 2 pacjentów leczonych Letybo w cyklu 1) były: ból głowy (1,7% pacjentów), ból w miejscu wstrzyknięcia (0,3% pacjentów) oraz opadanie powiek, kurcz powiek, uczucie dyskomfortu związane z głową, a także siniaki (każda u 0,2% pacjentów).
Z procedurą wstrzyknięcia związane były miejscowy ból, stan zapalny, parestezje, niedoczulica, tkliwość, opuchlizna, obrzęk, rumień, miejscowe zakażenie, krwawienie lub zasinienie skóry. Po wstrzyknięciach toksyny botulinowej zgłaszano również występowanie gorączki i objawów grypopodobnych (patrz punkt 4.4).
Tabelaryczny zestawienie działań niepożądanych
Poniżej podano dane dotyczące częstości występowania działań niepożądanych pochodzące z praktyki klinicznej. Kategorie częstotliwości zdefiniowano następująco: bardzo często (≥ 1/10); często
(≥ 1/100, < 1/10); niezbyt często (≥ 1/1 000, < 1/100); rzadko (≥ 1/10 000, < 1/1 000); bardzo rzadko (< 1/10 000).
Tabela 1: Działania niepożądane zgłaszane po podaniu Letybo w badaniach klinicznych i badaniach po wprowadzeniu produktu do obrotu
Klasyfikacja układów i narządów | Częstotliwość | Działanie niepożądane |
Zakażenia i zarażenia pasożytnicze | niezbyt często | zapalenie gardła i błon śluzowych nosa |
rzadko | opryszczka jamy ustnej, zapalenie mieszków włosowych* | |
Zaburzenia układu nerwowego | często | ból głowy |
niezbyt często | uczucie dyskomfortu związane z głową * |
rzadko | migrena, zawroty głowy, parestezje, ograniczenie pola widzenia, zaburzenia mowy | |
Zaburzenia oka | niezbyt często | opadanie powiek, kurcz powiek, obrzęk okołooczodołowy |
rzadko | wylew podspojówkowy*, suchość oka, niewyraźne widzenie, ból oka*, zaburzenie czucia powiek** | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | rzadko | niedoczulica gardła |
Zaburzenia żołądka i jelit | rzadko | zaparcia, nudności |
Zaburzenia skóry i tkanki podskórnej | rzadko | opadanie brwi, suchość skóry, pokrzywka |
Zaburzenia ogólne i stany w miejscu podania | często | reakcja w miejscu wstrzyknięcia |
niezbyt często | ból w miejscu wstrzyknięcia, siniaki w miejscu wstrzyknięcia, opuchlizna w miejscu wstrzyknięcia*, świąd w miejscu wstrzyknięcia, guz w miejscu wstrzyknięcia, ucisk w miejscu wstrzyknięcia** | |
rzadko | ból twarzy*, objawy grypopodobne, gorączka | |
Badania diagnostyczne | rzadko | wzrost stężenia potasu we krwi |
Urazy, zatrucia i powikłania po zabiegach | niezbyt często | siniaki, krwiak okołooczodołowy* |
Uwaga: spośród 1 162 pacjentów, którzy otrzymali Letybo, rzadkie działania niepożądane wystąpiły tylko u jednego uczestnika.
W odniesieniu do przypisywania częstości występowania zdarzeń w badaniach klinicznych
i badaniach po wprowadzeniu produktu do obrotu zastosowano metodę „najgorszego możliwego scenariusza”.
* działania niepożądane związane z procedurą wstrzykiwania. Uwaga: dane te nie były gromadzone w koreańskim badaniu po wprowadzeniu produktu do obrotu.
** tylko badanie po wprowadzeniu produktu do obrotu
Opis wybranych działań niepożądanych
Działania niepożądane związane z podawaniem produktu leczniczego
Działania niepożądane związane z podawaniem produktu leczniczego zgłaszane po podaniu Letybo występują pojedynczo niezbyt często, ale często gdy się je zsumuje. Niezbyt częste reakcje w miejscu wstrzyknięcia obejmują ból, siniaki, opuchliznę, świąd, nacieki i uczucie ucisku. Rzadko występujące zdarzenia w miejscu wstrzyknięcia obejmują ból i uczucie dyskomfortu.
Ryzyko związane z rozprzestrzenianiem się toksyny w do miejsc oddalonych od miejsca podania
Bardzo rzadko zgłaszano występowanie działań niepożądanych związanych z rozprzestrzenianiem się toksyny do miejsc odległych od miejsca wstrzyknięcia toksyny botulinowej (np. osłabienie mięśni, zaburzenia połykania, zaparcia lub zachłystowe zapalenie płuc ze skutkiem śmiertelnym w niektórych przypadkach) (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy przedawkowania
Objawy przedawkowania produktem leczniczym Letybo zależą od dawki, miejsca wstrzyknięcia i właściwości tkanek położonych niżej.
Nie odnotowano żadnych przypadków toksyczności ogólnoustrojowej w wyniku przypadkowego wstrzyknięcia toksyny botulinowej typu A. Zbyt duże dawki mogą powodować miejscowe, odległe lub uogólnione i głębokie porażenie nerwowo-mięśniowe. Nie zgłoszono przypadków połknięcia toksyny botulinowej typu A.
Objawy przedawkowania mogą nie uwidaczniać się bezpośrednio po wstrzyknięciu.
Postępowanie w przypadku przedawkowania
W razie przypadkowego wstrzyknięcia lub połknięcia pacjent powinien być natychmiast poddany obserwacji pod kątem wystąpienia objawów podmiotowych i przedmiotowych ogólnego osłabienia lub porażenia mięśni. U pacjentów z objawami zatrucia toksyną botulinową typu A (ogólne osłabienie, opadanie powiek, podwójne widzenie, trudności w połykaniu i zaburzenia mowy lub niedowład
mięśni oddechowych) należy rozważyć przyjęcie do szpitala.
Grupa farmakoterapeutyczna: Produkty zwiotczające mięśnie, inne produkty zwiotczające mięśnie działające obwodowo.
Kod ATC: M03AX01
Mechanizm działania
Neurotoksyna Clostridium botulinum typu A obwodowo hamuje uwalnianie neuroprzekaźnika,
acetylocholiny, na presynaptycznych cholinergicznych zakończeniach nerwowych w połączeniach nerwowo-mięśniowych poprzez rozszczepianie białka SNAP-25, tj. białka odgrywającego kluczową rolę w przyłączaniu i uwalnianiu acetylocholiny z pęcherzyków znajdujących się wewnątrz zakończeń nerwowych, co prowadzi do odnerwienia i porażenia wiotkiego mięśni.
Po wstrzyknięciu początkowo toksyna szybko wiąże się z wysokim powinowactwem ze swoistymi receptorami na powierzchni komórki. Następnie toksyna przenika przez błonę plazmatyczną w
mechanizmie endocytozy zależnej od receptorów. Ostatecznie toksyna jest uwalniania do cytozolu, przy czym dochodzi do postępującego zahamowania uwalniania acetylocholiny. Objawy kliniczne występują w ciągu 2–3 dni, a efekt maksymalny jest widoczny w ciągu czterech tygodni od wstrzyknięcia. Powrót pełnej funkcji mięśni następuję zwykle w ciągu 3–4 miesięcy od wstrzyknięcia, kiedy zakończenia nerwowe odrastają i ponownie łączą się z płytką nerwowo-mięśniową.
Dane kliniczne
Skuteczność i bezpieczeństwo stosowania produktu leczniczego Letybo oceniano w trzech głównych badaniach fazy III prowadzonych metodą podwójnie ślepej próby (BLESS I, BLESS II i BLESS III), w których łącznie 955 pacjentów poddano jednemu zabiegowi z zastosowaniem produktu leczniczego Letybo, a 317 pacjentów poddano jednemu zabiegowi z zastosowaniem placebo. Ponadto dostępne są dane dotyczące 854 pacjentów, którzy otrzymali produkt leczniczy Letybo w niezaślepionej części
stanowiącej przedłużenie badań BLESS I i II w ramach kolejnych od jednego do trzech zabiegów. Dane uzupełniające dotyczące zmarszczek gładzizny czołowej pochodzą z klinicznego programu opracowywania produktu obejmującego badanie fazy III (HG-11-01) z udziałem 137 pacjentów oraz badanie po wprowadzaniu produktu do obrotu (HG-13-02) z udziałem 815 pacjentów.
Skuteczność
W badaniach BLESS I, BLESS II i BLESS III u wszystkich pacjentów występowały w punkcie wyjściowym zmarszczki gładzizny czołowej widoczne przy pełnym zmarszczeniu brwi o nasileniu umiarkowanym (27% pacjentów) lub głębokie (73% pacjentów). Zastosowanie produktu leczniczego Letybo w dawce 20 jednostek przyczyniło się do znaczącej redukcji głębokości zmarszczek gładzizny czołowej widocznych przy pełnym zmarszczeniu brwi zgodnie z oceną głębokości zmarszczek
przeprowadzoną przez badacza i pacjenta według czteropunktowej skali oceny stopnia nasilenia zmarszczek na twarzy (ang. facial wrinkle scale, FWS). Istotny statystycznie odsetek odpowiedzi świadczących o skuteczności produktu leczniczego Letybo stwierdzono przy zastosowaniu punktu końcowego w postaci 2-punktowej poprawy w skali FWS. Wysoki odsetek odpowiedzi świadczący
o skuteczności produktu leczniczego Letybo stwierdzano również przy zastosowaniu definicji istotnej klinicznie odpowiedzi w postaci uzyskania wyniku w skali FWS wynoszącego 0 lub 1 (brak zmarszczek lub delikatne zmarszczki) w ocenie badacza w tygodniu 4 (patrz Tabela 2).
Tabela 2 Odsetek odpowiedzi w okresie od punktu wyjściowego do tygodnia 4 oceniany przy pełnym zmarszczeniu brwi według skali oceny stopnia nasilenia zmarszczek na twarzy (FWS) w badaniach BLESS I, BLESS II i BLESS III – Pełny zestaw danych
BLESS I | BLESS II | BLESS III | ||||
Oceniał: | Letybo (N = 529) | Placebo (N = 175) | Letybo (N = 160) | Placebo (N = 53) | Letybo (N = 266) | Placebo (N = 89) |
Odsetek odpowiedzi (n [%]): Obniżenie wyniku w skali FWS z umiarkowanych lub głębokich na brak lub delikatne (wymagana poprawa o ≥ 2 punkty)a | ||||||
Badacz ORAZ pacjent | 246 (46,5%)* | 0 (0 %) | 78 (48,8%)* | 1 (1,9%) | 172 (64,7%)* | 0 (0,0%) |
Badacz | 348 (65,8%)* | 1 (0,6%) | 120 (75,0%)* | 1 (1,9%) | 209 (78,6%)* | 1 (1,1%) |
Pacjent | 290 (54,8%)* | 0 (0 %) | 83 (51,9%)* | 1 (1,9%) | 183 (68,8%)* | 0 (0,0%) |
Odsetek odpowiedzi (%): Obniżenie wyniku w skali FWS z umiarkowanych lub głębokich na brak lub delikatneb | ||||||
Badacz | 393 (74,3%)* | 3 (1,7%) | 136 (85,0)* | 2 (3,8%) | 218 (82,0%)* | 1 (1,1%) |
*wartość p < 0,001 w teście Cochrana-Mantela-Haenszela mającym na celu ocenę różnic pomiędzy Letybo a placebo; N: liczba zrandomizowanych pacjentów, n: liczba pacjentów, u których stwierdzono odpowiedź
a Pierwszorzędowy punkt końcowy oceny skuteczności
b Analiza post-hoc
W ocenie badacza u łącznie 38,3% pacjentów, którzy otrzymali produkt leczniczy Letybo, uzyskano trzypunktową poprawę redukcji głębokości zmarszczek, od głębokich zmarszczek (stopień 3 wg FWS) w punkcie wyjściowym do braku zmarszczek (stopień 0 wg FWS) w tygodniu 4.
Poprawa redukcji głębokości zmarszczek gładzizny czołowej (w postaci obniżenia wyniku w skali FWS ≥ 2 punkty przy pełnym zmarszczeniu brwi w ocenie zarówno badacza, jak i pacjenta) zaczęła być widoczna po tygodniu od wstrzyknięcia, a efekt maksymalny osiągnięto w drugim tygodniu po wstrzyknięciu. Uważa się, że efekt utrzymuje się od 12 do 16 tygodni (patrz Rysunek 1).
BLESS I Letybo BLESS I Placebo BLESS II Letybo
BLESS II Placebo BLESS III Letybo BLESS III Placebo
TYDZIEŃ 2 TYDZIEŃ 4
TYDZIEŃ 8
Wizyta w trakcie Cyklu 1
TYDZIEŃ 12
TYDZIEŃ 16
WYJŚCIOWY
PUNKT
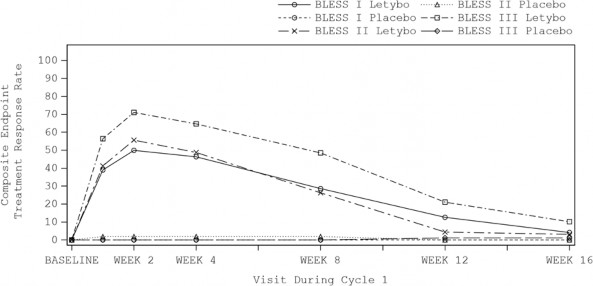

Złożony punkt końcowy
Odsetek odpowiedzi na leczenie
Rysunek 1 Rozkład odsetka pacjentów wykazujących odpowiedź (wymagana poprawa wyniku w skali FWS wynosząca ≥ 2 punkty w ocenie zarówno pacjenta, jak i badacza)
w trakcie cyklu 1 dla zabiegów z zastosowaniem substancji czynnej w porównaniu z zabiegami z zastosowaniem placebo w badaniach głównych BLESS
Wykazano, że odsetek pacjentów wykazujących odpowiedź w postaci ≥ 1-punktowego obniżenia wyniku w skali FWS w spoczynku był znacząco statystycznie większy w grupie otrzymującej produkt leczniczy Letybo w porównaniu z grupą otrzymującą placebo: cztery tygodnie po wstrzyknięciu badacze ocenili, że u 63,1%, 59,4% oraz 61,3% pacjentów, którzy otrzymali produkt leczniczy Letybo, oraz u 15,4%, 5,7% i 9,0% pacjentów, którzy otrzymali placebo, nastąpiła poprawa
wynosząca w spoczynku ≥ 1 punktu w skali FWS odpowiednio w badaniach BLESS I, BLESS II i BLESS III (wartość p dotycząca różnic pomiędzy grupą otrzymującą produkt leczniczy a grupą otrzymującą placebo wynosiła < 0,001 we wszystkich badaniach).
Dane pochodzące z długoterminowych badań z zastosowaniem wielokrotnej dawki potwierdzają, że odsetek odpowiedzi po drugim, trzecim i czwartym zabiegu z zastosowaniem produktu leczniczego Letybo utrzymywał się na wysokim poziomie w okresie badania wynoszącym jeden rok, pomimo że w zastosowanym schemacie badania kolejne cykle leczenia były obarczone pewnym błędem
mogącym wpływać na wyniki w sposób zmniejszający liczbę odpowiedzi.
Według nowo opracowanej skali Modified Skindex-16 Glabellar Line Quality of Life Scale (Zmodyfikowana skala Skindex-16 dotycząca jakości życia ze zmarszczkami gładzizny czołowej) zmarszczki gładzizny czołowej obecne w punkcie wyjściowym miały umiarkowany lub silny negatywny wpływ na psychikę ponad 85% pacjentów przystępujących do badania oraz łagodny negatywny wpływ na psychikę około 15% pacjentów przystępujących do badania.
W ocenie według skali Modified Skindex-16 Glabellar Line Quality of Life wyraźnie większą
poprawę samopoczucia psychicznego, zaobserwowano u pacjentów otrzymujących produkt leczniczy Letybo w porównaniu z pacjentami otrzymującymi placebo.
Stwierdzono korzystny efekt kosmetyczny zgłaszany przez pacjentów oraz wysoki poziom zadowolenia z uzyskanego efektu leczenia.
Bezpieczeństwo
W trakcie leczenia z zastosowaniem metody podwójnie ślepej próby w badaniach BLESS I, BLESS II i BLESS III u 33 (3,5%) pacjentów wystąpiły działania niepożądane w czasie leczenia, które oceniono jako co najmniej możliwie związane ze stosowaniem produktu leczniczego Letybo, a u 8 (2,5%) wystąpiły działania niepożądane w czasie leczenia, które oceniono jako co najmniej możliwie
związane z zastosowaniem placebo. W okresie leczenia z zastosowaniem metody otwartej próby u 46 (5,4%) pacjentów wystąpiły działania niepożądane w czasie leczenia, które oceniono jako co najmniej możliwie związane ze stosowaniem produktu leczniczego Letybo (w trakcie maksymalnie trzech cykli leczenia). Żadne z tych działań niepożądanych nie zostało uznane za ciężkie. Wyniki okazały się spójne z wynikami badania uzupełniającego fazy III HG-11-01 dotyczącego zmarszczek gładzizny
czołowej.
W badaniach BLESS I, BLESS II i BLESS III oceniano tworzenie się przeciwciał przed każdym zabiegiem, 4 tygodnie po każdym zabiegu oraz podczas ostatniej wizyty w ramach badania. Po podaniu Letybo u żadnego pacjenta nie wykryto przeciwciał neutralizujących.
Dane po wprowadzeniu produktu do obrotu
Dane uzyskane po wprowadzeniu produktu do obrotu, w tym dane z badania dotyczącego zmarszczek gładzizny czołowej prowadzonego po wprowadzeniu produktu do obrotu z udziałem 815 pacjentów (HG-13-02), są spójne z tymi zgromadzonymi w badaniach klinicznych.
Pacjenci w podeszłym wieku
W badaniach BLESS I, BLESS II i BLESS III łącznie 152/1 272 pacjentów (11,91%) było w wieku 65 lat lub starszych w momencie badań przesiewowych. Żaden z pacjentów nie był w wieku powyżej 75 lat. W rozpatrywanych zbiorczo badaniach BLESS I, BLESS II i BLESS III łączny odsetek
pacjentów wykazujących odpowiedź na leczenie w tygodniu 4 (główny punkt końcowy) wśród pacjentów otrzymujących Letybo był niższy u osób w wieku 65 lat lub starszych, u których wynosił 46/118 (39,0%), niż u pacjentów w wieku poniżej 65 lat, u których wynosił 450/839 (53,6%).
W trzech badaniach rozpatrywanych zbiorczo nie stwierdzono dużych różnic w łącznym odsetku pacjentów, u których wystąpiły działania niepożądane w czasie leczenia uznane za związane
z prowadzonym metodą podwójnie ślepej próby leczeniem Letybo (odpowiednio 3,7% oraz 1,7% u pacjentów w wieku poniżej 65 lat oraz w wieku 65 lat lub starszych, przy czym uwzględniano
zarówno działania niepożądane w czasie leczenia związane z lekiem, jak i te związane z procedurą wstrzykiwania).
Dzieci i młodzież
Europejska Agencja Leków uchyliła obowiązek przedstawiania wyników badań produktu leczniczego Letybo we wszystkich podgrupach populacji pediatrycznej w leczeniu zmarszczek indukowanych
przez ruch mięśni (patrz punkt 4.2 stosowanie u dzieci i młodzieży).
Po domięśniowym podaniu zalecanej dawki 20 jednostek nie oczekuje się obecności toksyny botulinowej typu A w wykrywalnym stężeniu w krwi obwodowej.
Badania toksyczności pojedynczej i wielokrotnej dawki po cotygodniowych lub comiesięcznych domięśniowych wstrzyknięciach BoNT/A–DP u szczurów wykazały zależne od dawki porażenie mięśni, w które wykonywano wstrzyknięcia, co doprowadziło do ograniczenia ruchomości,
ograniczenia spożycia pokarmu, spadku masy ciała i stężenia kreatyniny spowodowanych atrofią mięśni, którą uznano za wtórną wobec porażenia mięśni i obniżenia sprawności zwierząt. Przy stosowaniu dawek do 15 j./kg nie stwierdzono żadnych innych ciężkich miejscowych lub ogólnoustrojowych skutków mających znaczenie toksykologiczne.
W badaniu na szczurach w okresie organogenezy po codziennych domięśniowych wstrzyknięciach BoNT/A–DP w dawce do 8 j./kg wykonywanych począwszy od 5 do 16 dnia ciąży u samic
stwierdzono zależne od dawki porażenie mięśni prowadzące do atrofii mięśni, spadek masy ciała oraz zabrudzenia okolicy krocza. Stwierdzono opóźnione kostnienie i obniżenie masy ciała u płodów (≥ 20%), jednak nie wykryto żadnych wad, w związku z czym zjawiska te zinterpretowano jako wtórne wobec toksyczności dla matki, co jest zgodne z doświadczeniami dotyczącymi innych produktów
zawierających toksynę botulinową typu A. Nie oceniano wpływu na rozwój w okresie około- i poporodowym.
U szczurów podczas podawania dużych dawek innych produktów zawierających toksynę botulinową typu A obserwowano zaburzenia płodności u samców i samic.
Nie przeprowadzono badań dotyczących genotoksyczności, antygenowości, działania rakotwórczego ani wpływu na płodność dla BoNT/A-DP.
Albumina ludzka Sodu chlorek
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 6.6.
Nieotwarta fiolka 3 lata.
Roztwór po rekonstrukcji
Wykazano, że gotowy do użycia produkt zachowuje stabilność chemiczną i fizyczną przez 24 godziny w temperaturze 2°C.
Z mikrobiologicznego punktu widzenia zaleca się natychmiastowe użycie produktu. Jeżeli produkt nie zostanie natychmiast użyty, za czas i warunki przechowywania gotowego do użycia roztworu odpowiedzialność ponosi użytkownik, przy czym zwykle czas przechowywania wynosi maksymalnie 24 godziny w temperaturze 2ºC – 8°C, chyba że rekonstytucji/rozcieńczenia dokonano w kontrolowanych i zwalidowanych warunkach aseptycznych.
Przechowywać w lodówce (2°C - 8°C).
Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt 6.3.
Fiolka z przezroczystego szkła o pojemności 5 mL (szkło typu I) z korkiem z gumy chlorobutylowej, zabezpieczonym aluminiowym kapslem, w tekturowym pudełku.
Opakowania zawierające 1 fiolkę.
Opakowanie zbiorcze zawierające 2 fiolki (2 opakowania po 1 szt.) Opakowanie zbiorcze zawierające 6 fiolek (6 opakowań po 1 szt.)
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Należy ściśle przestrzegać instrukcji dotyczących stosowania, przygotowania i usuwania produktu leczniczego. Rekonstytucję należy wykonać zgodnie z zasadami dobrej praktyki szczególnie w odniesieniu do techniki aseptycznej.
W celu rekonstytucji do produktu leczniczego Letybo dodaje się 1,25 mL rozpuszczalnika – roztworu chlorku sodu do wstrzykiwań w stężeniu 9 mg/mL (0,9%).
Dobrą praktyką jest sporządzenie roztworu i przygotowanie strzykawki nad ręcznikiem papierowym powleczonym folią na wypadek rozlania produktu. 9 mg/mL (0,9%) roztwór chlorku sodu do wstrzykiwań należy pobrać do strzykawki i delikatnie wstrzyknąć do fiolki, aby uniknąć tworzenia się piany/pęcherzyków powietrza oraz energicznego mieszania roztworu, które mogłoby spowodować denaturację.
Należy wyrzucić fiolkę, jeżeli nie nastąpi wciągnięcie rozpuszczalnika do fiolki pod wpływem próżni.
Rekonstytuowany roztwór Letybo powinien być przezroczysty, bezbarwny i nie zawierać żadnych cząstek stałych. Przed użyciem fiolkę należy obejrzeć, aby upewnić się, że produkt nie zawiera
cząstek stałych.
Nie należy używać Letybo, jeśli rekonstytuowany roztwór nie jest przezroczysty lub zawiera cząstki stałe.
Roztwór do wstrzykiwań przechowywany dłużej niż 24 godziny powinien zostać wyrzucony.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Procedura bezpiecznego usuwania użytych fiolek, strzykawek i materiałów
W celu bezpiecznej utylizacji nierekonstytuowany produkt Letybo należy poddać rekonstytucji
w fiolce z użyciem niewielkiej ilości wody, a następnie należy poddać sterylizacji w autoklawie. Puste fiolki, fiolki zawierające resztki roztworu, strzykawki oraz przedmioty zabrudzone roztworem należy poddać sterylizacji w autoklawie. Alternatywą jest inaktywacja wszelkich pozostałości produktu Letybo poprzez dodanie rozcieńczonego roztworu wodorotlenku sodu (0,1 N NaOH) lub
rozcieńczonego roztworu sodu podchlorynu (0,5% lub 1% NaOCl).
Po inaktywacji, wykorzystane fiolki, strzykawki oraz materiały nie powinny być opróżniane lecz muszą zostać włożone do odpowiednich pojemników i wyrzucone zgodnie z lokalnymi przepisami.
Zalecenia dotyczące procedur na wypadek nieprzewidzianych incydentów podczas podawania toksyny botulinowej typu A
Croma-Pharma GmbH Industriezeile 6
2100 Leobendorf Austria
Tel.: (+43) 2262 684 68 - 0
Faks: (+43) 2262 684 68 - 165
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











