Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO, OZNAKOWANIE OPAKOWAŃ I ULOTKA DLA PACJENTA
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Wynzora, (50 mikrogramów + 0,5 mg)/g, krem
Jeden gram produktu leczniczego Wynzora zawiera 50 mikrogramów kalcypotriolu i betametazonu dipropionian, odpowiadający 0,5 mg betametazonu.
Substancje pomocnicze o znanym działaniu:
Butylohydroksyanizol: 1,0 mg/g kremu
Makrogologlicerolu hydroksystearynian (40): 3,4 mg/g kremu Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Krem
Biały krem.
Produkt leczniczy Wynzora jest wskazany do stosowania w leczeniu miejscowym łuszczycy pospolitej, w tym łuszczycy pospolitej owłosionej skóry glowy, o przebiegu łagodnym do umiarkowanego, u osób dorosłych.
Dawkowanie
Produkt leczniczy Wynzora należy nakładać na zmienione chorobowo obszary skóry raz na dobę. Dokładnie wetrzeć cienką warstwę kremu. Zalecany okres leczenia to maksymalnie osiem tygodni. Leczenie należy przerwać po osiągnięciu kontroli choroby. Jeżeli po tym okresie konieczna będzie kontynuacja leczenia albo ponowne rozpoczęcie leczenia, należy je prowadzić jedynie po dokonaniu oceny medycznej i pod regularnym nadzorem lekarza.
W przypadku stosowania produktów leczniczych zawierających kalcypotriol, maksymalna dawka dobowa nie powinna przekraczać 15 g. Powierzchnia ciała leczona produktami leczniczymi zawierającymi kalcypotriol nie powinna przekraczać 30% całkowitej powierzchni ciała (patrz punkt 4.4).
W przypadku stosowania na owłosionej skórze głowy
Produktem leczniczym Wynzora można leczyć wszystkie obszary na owłosionej skórze głowy objęte zmianami chorobowymi.
Szczególne grupy pacjentów
Zaburzenia czynności nerek i wątroby
Nie badano bezpieczeństwa i skuteczności stosowania produktu leczniczego Wynzora u pacjentów z ciężką niewydolnością nerek albo ciężkimi zaburzeniami czynności wątroby.
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Wynzora u dzieci w wieku poniżej 18 lat.
Sposób podawania
Produktu leczniczego Wynzora nie należy nakładać bezpośrednio na twarz ani oczy. W celu uzyskania optymalnego działania nie zaleca się brania prysznica czy kąpieli bezpośrednio po zastosowaniu produktu leczniczego Wynzora. Zaleca się odczekanie ośmiu godzin od zastosowania produktu leczniczego do wzięcia prysznica, aby uniknąć zmycia produktu leczniczego ze skóry.
Po zastosowaniu produktu leczniczego należy umyć ręce.
Nadwrażliwość na substancje czynne lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Produkt leczniczy Wynzora jest przeciwwskazany u pacjentów z erytrodermią łuszczycową, łuszczycą złuszczającą i łuszczycą krostkową.
Ze względu na zawartość kalcypotriolu produkt leczniczy Wynzora jest przeciwwskazany u pacjentów z zaburzeniami metabolizmu wapnia (patrz punkt 4.4).
Ze względu na zawartość kortykosteroidu produkt leczniczy Wynzora jest przeciwwskazany
w przypadku następujących chorób: wirusowe zmiany skórne (np. opryszczka albo ospa wietrzna), grzybicze albo bakteryjne zakażenia skóry, zakażenia pasożytnicze, zmiany skórne związane
z gruźlicą, okołoustne zapalenie skóry, zanik skóry, rozstępy skórne, kruchość żył skórnych, rybia łuska, trądzik pospolity, trądzik różowaty, owrzodzenia i rany (patrz punkt 4.4).
Wpływ na układ hormonalny
Z powodu wchłaniania ogólnoustrojowego, w trakcie stosowania kortykosteroidów podawanych miejscowo, mogą również wystąpić działania niepożądane typowe dla stosowania kortykosteroidów
o działaniu ogólnoustrojowym, takie jak hamowanie czynności kory nadnerczy lub wpływ na kontrolę metaboliczną cukrzycy.
Należy unikać stosowania produktu leczniczego pod opatrunkami okluzyjnymi, ponieważ zwiększa to wchłanianie ogólnoustrojowe kortykosteroidów. Należy unikać stosowania produktu leczniczego na dużych powierzchniach uszkodzonej skóry, na błonach śluzowych czy w fałdach skóry, ponieważ zwiększa to wchłanianie ogólnoustrojowe kortykosteroidów (patrz punkt 4.8).
Poddano ocenie hamowanie osi podwzgórze-przysadka-nadnercza u dorosłych uczestników (N=27) z bardzo rozległą łuszczycą (obejmującą owłosioną skórę głowy). Zahamowanie czynności kory nadnerczy zaobserwowano u jednego z 27 uczestników (3,7%) po czterech tygodniach leczenia oraz u jednego dodatkowego pacjenta po ośmiu tygodniach leczenia.
Zaburzenia widzenia
Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią takie objawy jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn, do których może należeć zaćma, jaskra lub rzadkie choroby, takie jak centralna chorioretinopatia surowicza (ang: central serous chorioretinopathy, CSCR), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów.
Wpływ na metabolizm wapnia
Ze względu na zawartość kalcypotriolu w produkcie leczniczym Wynzora, w przypadku jego stosowania może wystąpić hiperkalcemia. Po przerwaniu leczenia, stężenie wapnia w surowicy powraca do normy. Ryzyko wystąpienia hiperkalcemii jest minimalne w przypadku nieprzekraczania maksymalnej dawki dobowej (15 g) produktu leczniczego Wynzora (patrz punkt 4.2).
Miejscowe działania niepożądane
W przeprowadzonym, z udziałem zdrowych uczestników, badaniu dotyczącym obkurczania naczyń, odpowiedź na stosowanie produktu leczniczego Wynzora w zakresie zbielenia skóry pod wpływem ucisku odpowiadała kortykosteroidom o umiarkowanym działaniu (grupa II), w porównaniu z innymi kortykosteroidami podawanymi miejscowo. Należy unikać jednoczesnego stosowania z innymi steroidami na tych samych obszarach skóry.
Skóra twarzy i narządów płciowych jest bardzo wrażliwa na kortykosteroidy. Nie należy stosować tego produktu leczniczego w tych obszarach.
Pacjentowi należy udzielić informacji na temat prawidłowego sposobu stosowania produktu leczniczego, aby uniknąć stosowania i przypadkowego przeniesienia produktu leczniczego na twarz, usta i oczy. Po każdym zastosowaniu produktu leczniczego należy umyć ręce, żeby uniknąć przypadkowego przeniesienia produktu leczniczego w te miejsca.
Współistniejące zakażenia skóry
W przypadku wtórnego zakażenia zmian, należy zastosować leczenie przeciwdrobnoustrojowe.
W razie zaostrzenia zakażenia, należy jednak przerwać leczenie kortykosteroidami (patrz punkt 4.3). Zaprzestanie leczenia
W trakcie leczenia łuszczycy kortykosteroidami podawanymi miejscowo istnieje ryzyko wystąpienia uogólnionej łuszczycy krostkowej lub efektu ,,z odbicia" po przerwaniu leczenia. Z tego powodu,
w okresie po zakończeniu leczenia pacjent powinien być nadal pod nadzorem lekarza. Długotrwałe stosowanie
Podczas długotrwałego stosowania kortykosteroidów może zwiększyć się ryzyko wystąpienia miejscowych i ogólnoustrojowych działań niepożądanych. Należy przerwać leczenie, jeśli wystąpią działania niepożądane związane z długotrwałym stosowaniem kortykosteroidu (patrz punkt 4.8).
Stosowanie, które nie zostało ocenione
Brak doświadczenia w stosowaniu produktu leczniczego Wynzora w leczeniu łuszczycy kropelkowatej.
Jednoczesne leczenie i ekspozycja na promieniowanie UV
W trakcie leczenia z zastosowaniem produktu leczniczego Wynzora lekarz powinien zalecić pacjentowi ograniczenie bądź unikanie nadmiernej ekspozycji na światło słoneczne czy też sztuczne źródła promieniowania słonecznego. Kalcypotriol podawany miejscowo może być stosowany jednocześnie z promieniowaniem UV wyłącznie gdy lekarz i pacjent uznają, że potencjalne korzyści przewyższają ewentualne ryzyko (patrz punkt 5.3).
Produkt leczniczy Wynzora zawiera butylohydroksyanizol (E320) oraz olej rycynowy uwodorniony polioksylenowany
Produkt leczniczy Wynzora zawiera jako substancję pomocniczą butylohydroksyanizol (E320), który może powodować miejscową reakcję skórną (np. kontaktowe zapalenie skóry) lub podrażnienie oczu i błon śluzowych.
Produkt leczniczy Wynzora zawiera makrogologlicerolu hydroksystearynian (40) (olej rycynowy uwodorniony polioksylenowany), który może powodować reakcje skórne.
Nie przeprowadzono badań dotyczących interakcji z produktem leczniczym Wynzora.
Ciąża
Brak odpowiednich danych dotyczących stosowania produktów leczniczych zawierających kalcypotriol + betametazon u kobiet w okresie ciąży. Badania dotyczące kalcypotriolu obejmujące podawanie dawek doustnych zwierzętom nie wykazały działania teratogennego, ale wykazały toksyczność reprodukcyjną (patrz punkt 5.3). Badania na zwierzętach obejmujące podawanie glikokortykosteroidów wykazały toksyczność reprodukcyjną (patrz punkt 5.3), jednak badania epidemiologiczne (dotyczące mniej niż 300 zakończonych rozwiązaniem ciąż) nie wykazały wad wrodzonych u niemowląt urodzonych przez kobiety leczone kortykosteroidami w trakcie ciąży.
Potencjalne ryzyko u ludzi jest niejasne. Z tego powodu, w okresie ciąży produkt leczniczy Wynzora należy stosować wyłącznie wtedy, gdy potencjalne korzyści przewyższają ewentualne ryzyko.
Karmienie piersią
Betametazon przenika do mleka ludzkiego, ale ryzyko wystąpienia działania niepożądanego
u niemowlęcia wydaje się być mało prawdopodobne w przypadku stosowania dawek terapeutycznych. Brak danych dotyczących przenikania kalcypotriolu do mleka ludzkiego. Należy zachować ostrożność w przypadku przepisywania produktu leczniczego Wynzora kobietom karmiącym piersią. Pacjentkę należy poinformować, że nie wolno stosować produktu leczniczego Wynzora na piersi w okresie karmienia piersią.
Płodność
Badania na szczurach obejmujące podawanie doustnych dawek kalcypotriolu albo betametazonu dipropionianu nie wykazały żadnych zaburzeń płodności u osobników płci męskiej i żeńskiej (patrz punkt 5.3).
Produkt leczniczy Wynzora nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Częstość występowania działań niepożądanych oszacowano na podstawie analizy zbiorczej danych z badań klinicznych.
Częstość występowania wszystkich zgłoszonych działań niepożądanych wynosiła poniżej 1%. Najczęściej zgłaszane działania niepożądane stanowiły „Reakcje w miejscu zastosowania”, w tym podrażnienie, ból, świąd, wyprysk, łuszczenie, teleangiektazje i zapalenie mieszków włosowych w miejscu zastosowania.
Działania niepożądane przedstawiono w Tabeli 1 poniżej według klasyfikacji układów i narządów oraz częstości występowania. W obrębie każdej grupy o określonej częstości występowania działania niepożądane są wymienione zgodnie ze zmniejszającym się nasileniem.
Częstość występowania działań niepożądanych przedstawiono z podziałem na następujące kategorie: niezbyt często (≥1/1000 do <1/100); nieznana (częstość nie może być określona na podstawie dostępnych danych).
Tabela 1: Działania niepożądane zgłaszane w przypadku produktu leczniczego Wynzora
Klasyfikacja układów i narządów | Niezbyt często | Częstość nieznana |
Zakażenia i zarażenia pasożytnicze | Zapalenie mieszków włosowych w miejscu zastosowania | |
Zaburzenia układu nerwowego | Bezsenność | |
Zaburzenia oka | Nieostre widzenie* | |
Zaburzenia skóry i tkanki podskórnej | Świąd Wysypka Pokrzywka | |
Zaburzenia ogólne i stany w miejscu podania | Podrażnienie w miejscu zastosowania Ból w miejscu zastosowania Świąd w miejscu zastosowania Wyprysk w miejscu zastosowania Łuszczenie w miejscu zastosowania Teleangiektazje w miejscu zastosowania |
* Patrz punkt 4.4
Uważa się, że wymienione poniżej działania niepożądane są związane z grupą farmakologiczną odpowiednio kalcypotriolu i betametazonu:
Kalcypotriol
Działania niepożądane obejmują reakcje w miejscu zastosowania, świąd, podrażnienie skóry, uczucie pieczenia i kłucia, suchość skóry, rumień, wysypkę, zapalenie skóry, wyprysk, nasilenie łuszczycy, nadwrażliwość na światło oraz reakcje nadwrażliwości, w tym bardzo rzadkie przypadki obrzęku naczynioruchowego i obrzęku twarzy.
Działania ogólnoustrojowe po zastosowaniu miejscowym występują bardzo rzadko, powodując hiperkalcemię lub hiperkalciurię (patrz punkt 4.4).
Betametazon (w postaci dipropionianu)
Po stosowaniu miejscowym mogą wystąpić reakcje miejscowe, zwłaszcza podczas długotrwałego stosowania, obejmujące zanik skóry, teleangiektazje, rozstępy, zapalenie mieszków włosowych, nadmierne owłosienie, okołoustne zapalenie skóry, alergiczne kontaktowe zapalenie skóry, odbarwienia i prosaki koloidowe.
W trakcie leczenia łuszczycy kortykosteroidami podawanymi miejscowo istnieje ryzyko wystąpienia uogólnionej łuszczycy krostkowej.
Reakcje ogólnoustrojowe spowodowane miejscowym zastosowaniem kortykosteroidów występują u osób dorosłych rzadko, ale mogą mieć ciężkie nasilenie. Może wystąpić zahamowanie czynności kory nadnerczy, zaćma, zakażenia, wpływ na kontrolę metaboliczną cukrzycy i wzrost ciśnienia wewnątrzgałkowego, zwłaszcza po długotrwałym leczeniu. Reakcje ogólnoustrojowe występują częściej w przypadku stosowania substancji na zakrytą skórę (plastikiem, w fałdach skóry), na duże powierzchnie skóry i długotrwale (patrz punkt 4.4).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Stosowanie dawek większych niż zalecane może prowadzić do podwyższenia stężenia wapnia w surowicy, które powraca do normy po przerwaniu leczenia. Do objawów hiperkalcemii należą wielomocz, zaparcia, osłabienie mięśni, splątanie i śpiączka.
Nadmierne, długotrwałe stosowanie kortykosteroidów podawanych miejscowo może prowadzić do zahamowania czynności kory nadnerczy, które jest zazwyczaj odwracalne. Może być wskazane zastosowanie leczenia objawowego.
W przypadku przewlekłej toksyczności, kortykosteroidy należy odstawiać stopniowo.
Grupa farmakoterapeutyczna: leki przeciwłuszczycowe. Inne leki przeciwłuszczycowe do stosowania miejscowego, kalcypotriol, produkty złożone, kod ATC: D05AX52
Mechanizm działania
Produkt leczniczy Wynzora łączy w sobie działanie farmakologiczne kalcypotriolu wodzianu jako syntetycznego analogu witaminy D3 oraz betametazonu dipropionianu jako syntetycznego kortykosteroidu.
Działanie witaminy D i jej analogów w leczeniu łuszczycy polega głównie na hamowaniu proliferacji i indukowaniu różnicowania keratynocytów. Zasadniczy antyproliferacyjny mechanizm działania witaminy D na keratynocyty polega na indukowaniu czynnika hamowania wzrostu – transformującego czynnika wzrostu-β – i inhibitorów kinaz cyklinozależnych, z następczym zahamowaniem wzrostu
w fazie G1 cyklu komórkowego oraz obniżeniem aktywności dwóch czynników proliferacyjnych: czynnika odpowiedzi na wczesny wzrost 1 i kinazy polo-podobnej 2.
Ponadto witamina D ma działanie immunomodulujące – hamuje aktywację i różnicowanie limfocytów Th17/Th1, indukując jednocześnie odpowiedź Th2/Treg.
Kortykosteroidy stosowane w łuszczycy powodują supresję układu odpornościowego, w szczególności cytokin prozapalnych i chemokin, hamując w ten sposób aktywację limfocytów T. Na poziomie molekularnym kortykosteroidy działają za pośrednictwem wewnątrzkomórkowego receptora glukokortykoidowego, a ich działanie przeciwzapalne jest wynikiem transrepresji prozapalnych czynników transkrypcyjnych, takich jak jądrowy czynnik transkrypcyjny κB, białko aktywatorowe 1
i czynnik regulujący transkrypcję genu interferonu typu 3.
Kalcypotriol i betametazonu dipropionian w skojarzeniu wywierają silniejsze działanie przeciwzapalne i antyproliferacyjne niż każdy z tych składników osobno.
Działanie farmakodynamiczne
Oceniano supresję osi podwzgórze-przysadka-nadnercza u dorosłych uczestników (N=27) z rozległą łuszczycą, z zajęciem 20–30% powierzchni ciała (w tym owłosionej skóry głowy), w warunkach maksymalnego stosowania. Leczenie obejmowało stosowanie produktu leczniczego Wynzora raz na dobę, na powierzchni ciała i owłosionej skóry głowy (u 75% uczestników występowało zajęcie owłosionej skóry głowy), przez maksymalnie osiem tygodni. Po czterech tygodniach leczenia zaobserwowano zahamowanie czynności kory nadnerczy u jednego z 27 uczestników (3,7%), a po ośmiu tygodniach leczenia dodatkowo u jednego pacjenta (N=26).
Nie stwierdzono tendencji do obniżenia stężenia kortyzolu po stymulacji ACTH w przypadku zwiększenia stężenia ogólnoustrojowego B17P mierzonego w oparciu o wartość AUC0–7 albo Cmax ani w przypadku zwiększenia średniej ilości produktu leczniczego Wynzora stosowanej tygodniowo.
W trakcie leczenia z zastosowaniem produktu leczniczego Wynzora żaden uczestnik nie uzyskał wyników badań laboratoryjnych świadczących o zmianach w metabolizmie wapnia.
Skuteczność kliniczna i bezpieczeństwo stosowania
Skuteczność produktu leczniczego Wynzora stosowanego raz na dobę oceniano w ramach dwóch randomizowanych, ośmiotygodniowych, zaślepionych dla badacza badań klinicznych, obejmujących 738 uczestników stosujących produkt leczniczy Wynzora albo odpowiadające mu podłoże, u których występowała łuszczyca różnych części ciała i tułowia (w badaniu 1 również owłosionej skóry głowy), o nasileniu od łagodnego do umiarkowanego według wyniku ogólnej oceny nasilenia choroby dokonywanej przez lekarza (ang: Physician’s Global Assessment, PGA). Rozkład stopni nasilenia choroby wśród zrandomizowanych uczestników obu badań był podobny i był reprezentatywny dla praktyki klinicznej; u większości uczestników w punkcie początkowym występowała choroba
o nasileniu od łagodnego do umiarkowanego, u 24% występowała choroba o nasileniu ciężkim w oparciu o zajętą powierzchnię ciała (zajęcie więcej niż 10% powierzchni ciała), a u ponad 12% występowała choroba o nasileniu ciężkim w oparciu o wynik oceny według zmodyfikowanego
wskaźnika rozległości i nasilenia łuszczycy (ang: modified Psoriasis Area and Severity Index, mPASI; wynik oceny według wskaźnika mPASI >12). Produkt leczniczy Wynzora wykazywał skuteczność
w przypadku wszystkich stopni nasilenia choroby. Jako aktywny produkt porównawczy stosowano żel zawierający kalcypotriol + betametazonu dipropionian.
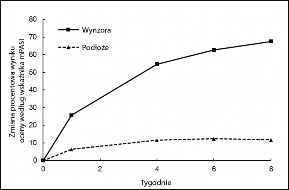
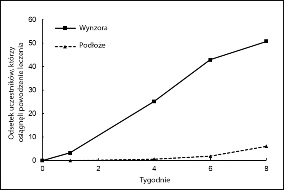
Zarówno w badaniu 1, jak i w badaniu 2 wyniki analiz głównych i drugorzędowych punktów końcowych oceny skuteczności wykazały, że produkt leczniczy Wynzora był bardziej skuteczny niż podłoże (p<0,0001) w leczeniu łuszczycy różnych części ciała i tułowia, w zakresie wszystkich potwierdzających punktów końcowych oceny skuteczności (Tabela 2). Powodzenie leczenia według wyniku oceny PGA definiowano jako „całkowite ustąpienie zmian” albo „prawie całkowite ustąpienie zmian” w przypadku pacjentów, u których w punkcie początkowym występowała choroba o nasileniu umiarkowanym, i „całkowite ustąpienie zmian” w przypadku pacjentów, u których
w punkcie początkowym występowała choroba o nasileniu łagodnym.
Tabela 2: Skuteczność produktu leczniczego Wynzora w badaniu 1 i badaniu 2
Badanie 1 | Badanie 2 | |||
Wynzora N = 213 | Podłoże kremu N = 68 | Wynzora N = 342 | Podłoże kremu N = 115 | |
Odsetek uczestników, którzy osiągnęli „powodzenie leczenia” według wyniku oceny | 50,7 (43,9; 57,5) | 6,1 (-0,2; 12,4) | 37,4 (32,1; 42,6) | 3,7 (0,1; 7,2) |
PGA w Tygodniu 8 (CI - confidence interval – przedział ufności 95%) | ||||
Średnie procentowe obniżenie wyniku oceny według wskaźnika mPASI w Tygodniu 8 | 67,5 | 11,7 | 62,9 | 22,9 |
Ocena PASI75 w Tygodniu 8 (CI - confidence interval – przedział ufności 95%) | 47,6 (40,8; 54,4) | 5,1 (-0,5; 10,7) | 41,6 (36,3; 47,0) | 8,1 (2,8; 13,5) |
Rycina 1: Wyniki dotyczące skuteczności w czasie w badaniu 1
|
|
Badanie 1: Zmiana procentowa wyniku oceny według wskaźnika mPASI względem wartości w punkcie początkowym. Począwszy od Tygodnia 1 obserwowano statystycznie istotne różnice pomiędzy lekiem a podłożem (p<0,0001). | Badanie 1: Powodzenie leczenia według wyniku oceny PGA. Począwszy od Tygodnia 4 obserwowano statystycznie istotne różnice pomiędzy lekiem a podłożem (p<0,0001). |
W przypadku produktu leczniczego Wynzora wykazano w sposób statystycznie istotny wyższy odsetek powodzenia leczenia według wyniku oceny PGA w Tygodniu 8 w porównaniu z żelem zawierającym kalcypotriol + betametazonu dipropionian.
W badaniu 1 skuteczność produktu leczniczego Wynzora w leczeniu łuszczycy owłosionej skóry głowy oceniano w oparciu o odsetek uczestników, którzy osiągnęli „powodzenie leczenia” według wyniku oceny PGA (Tabela 3). Skuteczność produktu leczniczego Wynzora w leczeniu łuszczycy owłosionej skóry głowy była w sposób statystycznie istotny wyższa niż skuteczność podłoża
w Tygodniu 4 (p = 0,0051) i Tygodniu 8 (p = 0,0002).
Tabela 3: Skuteczność produktu leczniczego Wynzora w leczeniu łuszczycy owłosionej skóry głowy, w badaniu 1
Badanie 1 | ||
Wynzora N = 112 | Podłoże kremu N = 38 | |
Odsetek uczestników, którzy osiągnęli „powodzenie leczenia” według wyniku oceny PGA w Tygodniu 8 (CI - confidence interval – przedział ufności 95%) | 50,8 (41,4; 60,1) | 9,3 (-0,5; 19,1) |
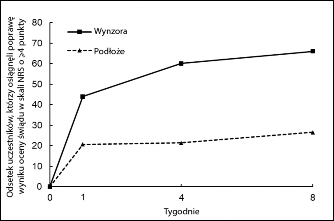
W badaniu 2 produkt leczniczy Wynzora wykazywał przewagę w porównaniu z podłożem, w zakresie obniżenia nasilenia świądu, definiowanego jako poprawa wyniku oceny świądu w skali numerycznej (ang: numeric rating scale, NRS) w Tygodniu 4, o co najmniej 4 punkty względem wartości
w punkcie początkowym. Począwszy od Tygodnia 1 obserwowano statystycznie istotne różnice w leczeniu (p<0,0001).
Rycina 2: Poprawa wyniku oceny świądu w skali NRS, w Tygodniu 4 względem wartości w punkcie początkowym, w badaniu 2, po zastosowaniu produktu leczniczego Wynzora
W obu badaniach oceniano wpływ produktu leczniczego Wynzora na jakość życia. Ocena według dermatologicznego kwestionariusza dotyczącego wskaźnika wpływu dolegliwości skórnych na jakość życia (ang: Dermatology Life Quality Index, DLQI), który odnosi się do stopnia wpływu choroby skóry występującej u uczestnika na wykonywanie przez niego codziennych czynności, wykazał
w sposób statystycznie istotny większą poprawę jakości życia w przypadku produktu leczniczego Wynzora w porównaniu z podłożem zarówno w Tygodniu 4 (p<0,0001), jak i w Tygodniu 8 (p<0,0001).
Pacjenci uczestniczący w badaniach zgłaszali wysoki stopień wygody stosowania produktu leczniczego Wynzora przy użyciu zwalidowanego narzędzia oceny (skala oceny wygody leczenia łuszczycy) służącego do oceny kluczowych aspektów uznawanych przez pacjentów za ważne
w przypadku miejscowego produktu leczniczego, takich jak łatwość stosowania, brak tłustości, nawilżenie oraz wpływ na codzienne czynności.
Po ekspozycji ogólnoustrojowej obie substancje czynne – kalcypotriol i betametazonu dipropionian – są szybko i w znacznym stopniu metabolizowane.
Główną drogą wydalania kalcypotriolu jest kał (szczury i świnki miniaturowe), a betametazonu dipropionianu – mocz (szczury i myszy). Badania dystrybucji tkankowej znakowanego radioaktywnie kalcypotriolu i betametazonu dipropionianu wykazały, że największa dawka radioaktywności gromadzi się odpowiednio w nerkach i wątrobie.
Stopień wchłaniania przezskórnego obu substancji czynnych po zastosowaniu miejscowym produktu leczniczego Wynzora określono w badaniu dotyczącym osi podwzgórze-przysadka-nadnercza,
z udziałem uczestników z rozległą łuszczycą pospolitą (patrz punkt 5.1).
Stężenia kalcypotriolu i betametazonu dipropionianu oraz ich głównych metabolitów w osoczu oznaczano po czterech i ośmiu tygodniach stosowania produktu leczniczego Wynzora raz na dobę.
Średnie stężenia wszystkich analitów w osoczu mieściły się w zakresie subnanomolowym,
a w większości próbek były one niższe niż dolna granica oznaczalności albo do niej zbliżone.
U jednego z 27 (3,7%) uczestników występowało możliwe do oznaczenia stężenie kalcypotriolu
w Tygodniu 4. W przypadku głównego metabolitu kalcypotriolu - MC1080, w Tygodniu 4, możliwe do oznaczenia stężenia występowały u trzech z 27 (11,1%) uczestników. W Tygodniu 8 u żadnego uczestnika nie występowało możliwe do oznaczenia stężenie kalcypotriolu ani MC1080.
W Tygodniu 4 u trzech uczestników (11,1%) występowało możliwe do oznaczenia stężenie betametazonu dipropionianu. Główny metabolit betametazonu dipropionianu – 17-propionian betametazonu (B17P) – był możliwy do oznaczenia u 13 uczestników (48,1%) w Tygodniu 4.
W Tygodniu 8 u żadnego uczestnika nie występowało możliwe do oznaczenia stężenie betametazonu dipropionianu, natomiast u siedmiu z 17 (41,2%) uczestników w Tygodniu 8 występowało możliwe do oznaczenia stężenie B17P.
Badania na zwierzętach z zastosowaniem kortykosteroidów wykazały ich szkodliwy wpływ na reprodukcję (rozszczep podniebienia, zniekształcenia kośćca). W badaniach toksycznego wpływu na reprodukcję obejmujących długotrwałe podawanie kortykosteroidów drogą doustną szczurom, stwierdzono przedłużenie czasu trwania ciąży oraz przedłużenie czasu trwania i trudności w trakcie porodu. Ponadto obserwowano zmniejszenie przeżywalności, masy ciała i przyrostu masy ciała potomstwa. Nie stwierdzono zaburzeń płodności. Znaczenie tych obserwacji dla ludzi nie jest znane.
Kalcypotriol podawany drogą doustną szczurom i królikom, w dawkach wynoszących odpowiednio 54 µg/kg/dobę i 12 µg/kg/dobę wykazywał toksyczny wpływ na matkę i płód. Do obserwowanych nieprawidłowości płodu, którym towarzyszył toksyczny wpływ na matkę, należały objawy świadczące
o niedojrzałości kośćca (niecałkowite kostnienie kości łonowych i paliczków kończyn przednich oraz powiększone ciemiączka) oraz zwiększona częstość występowania nadmiarowych żeber.
Szacunkowa ekspozycja ogólnoustrojowa po zastosowaniu miejscowym produktu leczniczego Wynzora u pacjentów z łuszczycą jest pomijalna w porównaniu ze stężeniami kalcypotriolu ocenianymi w badaniach in vivo po podaniu doustnym i nie stwierdza się istotnego zagrożenia związanego z rozrodczością dla osób poddawanych ekspozycji leczniczej na produkt leczniczy Wynzora.
Dane niekliniczne, wynikające z konwencjonalnych badań farmakologicznych dotyczących bezpieczeństwa, badań toksyczności po podaniu dawek wielokrotnych oraz genotoksyczności nie ujawniają szczególnego zagrożenia dla człowieka.
W badaniu na myszach dotyczącym rakotwórczego działania kalcypotriolu na skórę i badaniu na szczurach dotyczącym działania rakotwórczego po podaniu doustnym nie wykazano żadnych szczególnych zagrożeń dla ludzi.
Badania dotyczące kancerogenności prowadzone na myszach wskazują, że kalcypotriol może wzmacniać działanie promieniowania UV w zakresie wywoływania nowotworów skóry.
W badaniu na myszach dotyczącym działania rakotwórczego na skórę i badaniu na szczurach dotyczącym działania rakotwórczego po podaniu doustnym nie wykazano żadnych szczególnych zagrożeń dla ludzi związanych ze stosowaniem betametazonu dipropionianu.
W badaniu tolerancji miejscowej na świnkach miniaturowych produkt leczniczy Wynzora powodował podrażnienie skóry o nasileniu od łagodnego do umiarkowanego.
Izopropylu mirystynian Parafina ciekła
Triglicerydy kwasów tłuszczowych o średniej długości łańcucha Alkohol izopropylowy
Makrogolu eter laurylowy (4) Poloksamer (407)
Makrogologlicerolu hydroksystearynian (40) Karbomer (interpolimer Typ A) Butylohydroksyanizol
Trolamina
Disodu wodorofosforan siedmiowodny Sodu diwodorofosforan jednowodny All-rac-α-tokoferol
Woda oczyszczona
Nie dotyczy.
2 lata
Okres ważności po pierwszym otwarciu tuby: 6 miesięcy.
Nie przechowywać w temperaturze powyżej 25°C. Nie zamrażać.
Aluminiowa tuba powlekana od wewnątrz lakierem epoksydowo-fenolowym, z zakrętką z HDPE, w tekturowym pudełku.
Wielkość opakowania: 1 tuba zawierająca 60 g lub opakowanie zbiorcze 120 g (2 tuby w tekturowym pudełku, każda zawierająca 60 g).
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Almirall, S.A.
Ronda General Mitre 151 08022 Barcelona Hiszpania
Pozwolenie nr:
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: