Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
zespołami mielodysplastycznymi (ang. myelodysplastic syndromes, MDS) o pośrednim2
i wysokim ryzyku, zgodnie z Międzynarodowym Punktowym Systemem Rokowniczym (ang. International Prognostic Scoring System, IPSS),
przewlekłą białaczką mielomonocytową (ang. chronic myelomonocytic leukaemia, CMML)
z 1029% blastów w szpiku, bez choroby mieloproliferacyjnej,
ostrą białaczką szpikową (ang. acute myeloid leukaemia, AML) z 2030% blastów
Dawkowanie i sposób podawania
Przeciwwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Zaawansowane nowotwory złośliwe wątroby (patrz punkt 4.4).
Karmienie piersią (patrz punkt 4.6).
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
Azacitidine Zentiva, 25 mg/ml, proszek do sporządzania zawiesiny do wstrzykiwań
Każda fiolka zawiera 100 mg azacytydyny. Po przygotowaniu każdy ml zawiesiny zawiera 25 mg azacytydyny.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Proszek do sporządzania zawiesiny do wstrzykiwań. Biały, liofilizowany proszek.
Produkt leczniczy Azacitidine Zentiva jest wskazana w leczeniu dorosłych pacjentów, którzy nie kwalifikują się do przeszczepienia krwiotwórczych komórek macierzystych (ang. haematopoietic stem cell transplantation, HSCT), z:
i wieloliniową dysplazją, zgodnie z klasyfikacją Światowej Organizacji Zdrowia (WHO),
AML z >30% blastów w szpiku, zgodnie z klasyfikacją WHO.
Leczenie produktem leczniczym Azacitidine Zentiva powinno być rozpoczęte, a następnie kontrolowane przez lekarza posiadającego doświadczenie w stosowaniu chemioterapeutyków. Pacjentom należy podać premedykację w postaci leków przeciwwymiotnych, aby zapobiec nudnościom i wymiotom.
Dawkowanie
Zalecana dawka początkowa w pierwszym cyklu leczenia dla wszystkich pacjentów, bez względu na początkowe hematologiczne wartości laboratoryjne, wynosi 75 mg/m2 powierzchni ciała, podawana jako wstrzyknięcie podskórne, codziennie przez 7 dni, po czym następuje okres przerwy trwający 21 dni (28dniowy cykl leczenia).
Zalecane jest leczenie pacjentów przez co najmniej 6 cykli. Leczenie należy kontynuować tak długo, jak pacjent odnosi z niego korzyści lub do progresji choroby.
Należy obserwować pacjentów w celu wykrycia odpowiedzi i (lub) toksyczności hematologicznej oraz toksyczności dla nerek (patrz punkt 4.4); może być konieczne opóźnienie rozpoczęcia następnego cyklu lub zmniejszenie dawki w sposób opisany poniżej.
Produktu leczniczego Azacitidine Zentiva nie należy podawać zamiennie z azacytydyną podawaną doustnie. Ze względu na różnice w ekspozycji, zalecenia dotyczące dawki i schematu dawkowania azacytydyny podawanej doustnie różnią się od zaleceń dla azacytydyny do wstrzykiwań. Pracownikom opieki zdrowotnej zaleca się sprawdzenie nazwy produktu leczniczego, dawki i drogi podania.
Badania laboratoryjne
Przed każdym rozpoczęciem leczenia i każdym cyklem leczenia należy wykonać testy czynnościowe wątroby, oznaczyć stężenie kreatyniny oraz dwuwęglanów w surowicy. Pełną morfologię krwi należy wykonać przed rozpoczęciem terapii oraz odpowiednio do potrzeb, w celu kontrolowania odpowiedzi i toksyczności, ale nie rzadziej, niż przed każdym cyklem leczenia.
Dostosowanie dawki z powodu toksyczności hematologicznej
Toksyczność hematologiczna jest definiowana jako najniższa wartość osiągnięta w danym cyklu (nadir), jeśli liczba płytek wynosi ≤ 50,0 x 109/l i (lub) liczba bezwzględna neutrofili (ang. absolute neutrophil count, ANC) wynosi ≤ 1 x 109/l.
Regeneracja jest definiowana jako zwiększenie linii komórkowej(ych), dla której(ych) zaobserwowano toksyczność hematologiczną, przynajmniej o połowę bezwzględnej różnicy między wartością nadiru i liczbą początkową plus wartość nadiru (tj. liczba krwinek w momencie regeneracji
≥ wartość nadiru + (0,5 x [liczba początkowa – wartość nadiru]).
Pacjenci bez zmniejszonej początkowej liczby krwinek (tj. liczba krwinek białych [ang. white blood cells, WBC] ≥ 3,0 x 109/l i ANC ≥ 1,5 x 109/l oraz płytki krwi ≥ 75,0 x 109/l) przed pierwszym leczeniem.
W przypadku zaobserwowania toksyczności hematologicznej po leczeniu produktem leczniczym Azacitidine Zentiva, należy opóźnić następny cykl leczenia, aż do osiągnięcia regeneracji liczby płytek krwi i ANC. Jeśli regeneracja nastąpiła w ciągu 14 dni, dostosowanie dawki nie jest konieczne. Jednak, jeśli regeneracja nie nastąpiła w ciągu 14 dni, należy zmniejszyć dawkę zgodnie z poniższą tabelą. Po zmodyfikowaniu dawki, czas trwania cyklu powinien powrócić do 28 dni.
Wartość nadiru w cyklu | Dawka w następnym cyklu, jeśli regeneracja* nie nastąpiła w ciągu 14 dni | |
ANC (x 109/l) | Płytki krwi (x 109/l) | |
≤1,0 | ≤50,0 | 50% |
>1,0 | >50,0 | 100% |
*Regeneracja = wartości ≥ wartość nadiru + (0,5 x [liczba początkowa – wartość nadiru])
Pacjenci ze zmniejszoną początkową liczbą krwinek (tj. WBC < 3,0 x 109/l lub ANC < 1,5 x 109/l lub
płytki krwi < 75,0 x 109/l) przed pierwszym leczeniem.
Jeśli po leczeniu produktem leczniczym Azacitidine Zentiva zmniejszenie liczby WBC lub ANC lub płytek krwi w porównaniu z wartościami przed leczeniem wynosi ≤ 50% lub więcej niż 50%, ale z poprawą w różnicowaniu którejkolwiek z linii komórkowej, nie należy opóźniać następnego cyklu, ani dostosowywać dawki.
Jeśli zmniejszenie liczby WBC lub ANC lub płytek krwi w porównaniu z wartościami przed leczeniem jest większe niż 50% bez poprawy w różnicowaniu linii komórkowej, należy opóźnić następny cykl leczenia produktem leczniczym Azacitidine Zentiva do osiągnięcia regeneracji liczby płytek krwi i ANC. Jeśli regeneracja nastąpiła w ciągu 14 dni, dostosowanie dawki nie jest konieczne. Jednak, jeśli regeneracja nie nastąpiła w ciągu 14 dni, należy ocenić komórkowość szpiku kostnego. Jeśli komórkowość szpiku kostnego wynosi > 50%, nie należy dostosowywać dawki. Jeśli
komórkowość szpiku wynosi ≤ 50%, należy opóźnić leczenie i zmniejszyć dawkę zgodnie z poniższą tabelą:
Komórkowość szpiku kostnego | Dawka w następnym cyklu, jeśli regeneracja nie jest osiągnięta w ciągu 14 dni | |
Regeneracja* ≤21 dni | Regeneracja * > 21 dni | |
1550% | 100% | 50% |
< 15% | 100% | 33% |
*Regeneracja = wartości ≥ wartość nadiru + (0,5 x [liczba początkowa – wartość nadiru]) Po modyfikacji dawki czas trwania następnego cyklu powinien powrócić do 28 dni.
Szczególne grupy pacjentów
Pacjenci w podeszłym wieku
Brak szczególnych zaleceń dotyczących dostosowania dawki. U pacjentów w podeszłym wieku występuje większe prawdopodobieństwo zmniejszonej czynności nerek, dlatego u tych pacjentów może być użyteczne kontrolowanie czynności nerek.
Zaburzenia czynności nerek
Azacytydyna może być podawana pacjentom z zaburzeniami czynności nerek bez dostosowywania dawki początkowej (patrz punkt 5.2). Jeśli wystąpi niewyjaśnione zmniejszenie stężenia dwuwęglanów w surowicy poniżej 20 mmol/l, należy zmniejszyć dawkę o 50% w następnym cyklu. Jeśli wystąpi niewyjaśnione zwiększenie stężenia kreatyniny w surowicy lub azotu mocznikowego we krwi (ang. blood urea nitrogen, BUN) do wartości ≥ 2krotności wartości początkowych i powyżej górnej granicy normy (GGN), należy opóźnić następny cykl do czasu, gdy wartości powrócą do normy lub do wartości początkowych, oraz zmniejszyć dawkę o 50% w następnym cyklu leczenia (patrz punkt 4.4).
Zaburzenia czynności wątroby
Nie przeprowadzono formalnych badań u pacjentów z zaburzeniami czynności wątroby (patrz punkt 4.4). Należy uważnie obserwować pacjentów z ciężką niewydolnością wątroby w celu wykrycia wystąpienia działań niepożądanych. U pacjentów z zaburzeniami czynności wątroby występującymi przed rozpoczęciem leczenia nie zaleca się szczególnej modyfikacji dawki początkowej; późniejsze modyfikacje dawek powinny być oparte na hematologicznych wartościach laboratoryjnych. Produkt leczniczy Azacitidine Zentiva jest przeciwwskazany u pacjentów z zaawansowanymi nowotworami złośliwymi wątroby (patrz punkty 4.3 i 4.4).
Dzieci i młodzież
Nie ustalono dotychczas bezpieczeństwa stosowania i skuteczności azacytydyny u dzieci i młodzieży w wieku od 0 do 17 lat. Aktualne dane przedstawiono w punktach 4.8, 5.1 i 5.2, ale brak zaleceń dotyczących dawkowania.
Sposób podawania
Przygotowany produkt leczniczy Azacitidine Zentiva należy wstrzykiwać podskórnie w ramię, udo lub brzuch. Należy zmieniać miejsca wstrzyknięcia. Nowe wstrzyknięcie należy podawać przynajmniej 2,5 cm od poprzedniego miejsca i nigdy nie wstrzykiwać w miejsca drażliwe, zasiniaczone, zaczerwienione lub stwardniałe.
Po sporządzaniu, zawiesina nie powinna być filtrowana. Instrukcja dotycząca przygotowania produktu leczniczego przed podaniem, patrz punkt 6.6.
Toksyczność hematologiczna
Leczenie azacytydyną jest związane z występowaniem niedokrwistości, neutropenii
i małopłytkowości, szczególnie podczas dwóch pierwszych cykli (patrz punkt 4.8). Należy wykonywać pełną morfologię krwi odpowiednio do potrzeb, w celu kontrolowania odpowiedzi
i toksyczności, jednak nie rzadziej niż przed każdym cyklem leczenia. Po podaniu zalecanej dawki dla pierwszego cyklu, należy zmniejszyć dawkę dla następnych cykli lub opóźnić jej podanie w oparciu
o wartości nadiru i odpowiedź hematologiczną (patrz punkt 4.2). Należy poinformować pacjentów, aby niezwłocznie zgłaszali epizody gorączki. Pacjenci oraz lekarze powinni także zwracać uwagę na objawy przedmiotowe i podmiotowe krwawienia.
Zaburzenia czynności wątroby
Nie przeprowadzono formalnych badań z udziałem pacjentów z zaburzeniami czynności wątroby. U pacjentów z rozległym obciążeniem nowotworem z powodu przerzutów zgłaszano występowanie postępującej śpiączki wątrobowej i zgonów podczas leczenia azacytydyną, w szczególności u tych, u których początkowe stężenie albuminy w surowicy wynosiło < 30 g/l. Azacytydyna jest przeciwwskazana u pacjentów z zaawansowanymi nowotworami złośliwymi wątroby (patrz punkt 4.3).
Zaburzenia czynności nerek
Zaburzenia dotyczące nerek, począwszy od zwiększonego stężenia kreatyniny w surowicy do niewydolności nerek i zgonu, zgłaszano u pacjentów leczonych stosowaną dożylnie azacytydyną w skojarzeniu z innymi chemioterapeutykami. Dodatkowo, u 5 pacjentów z przewlekłą białaczką szpikową leczonych azacytydyną i etopozydem, rozwinęła się nerkowa kwasica cewkowa, definiowana jako zmniejszenie stężenia dwuwęglanów w surowicy < 20 mmol/l związane z zasadowym odczynem moczu i hipokaliemią (stężenie potasu w surowicy < 3 mmol/l). Jeśli wystąpi niewyjaśnione zmniejszenie stężenia dwuwęglanów (<20 mmol/l) lub zwiększenie stężenia kreatyniny lub BUN w surowicy, należy zmniejszyć dawkę lub opóźnić podanie (patrz punkt 4.2).
Należy poinformować pacjentów, aby natychmiast zgłaszali lekarzowi wystąpienie skąpomoczu i bezmoczu.
Pomimo, że nie odnotowano istotnych klinicznie różnic w częstości występowania działań niepożądanych pomiędzy pacjentami z prawidłową czynnością nerek i pacjentami z zaburzeniami czynności nerek, należy ściśle obserwować pacjentów z zaburzeniami czynności nerek w celu wykrycia toksyczności, gdyż azacytydyna i (lub) jej metabolity są wydalane głównie przez nerki (patrz punkt 4.2).
Badania laboratoryjne
Przed rozpoczęciem leczenia i przed każdym cyklem należy wykonać testy czynnościowe wątroby, oznaczyć stężenie kreatyniny i dwuwęglanów w surowicy. Pełną morfologię krwi należy wykonać przed rozpoczęciem leczenia i odpowiednio do potrzeb w celu kontrolowania odpowiedzi i toksyczności, jednak nie rzadziej, niż przed każdym cyklem leczenia, patrz także punkt 4.8.
Choroby serca i płuc
Pacjenci z ciężką zastoinową niewydolnością serca, klinicznie niestabilną chorobą serca lub chorobą płuc w wywiadzie, byli wykluczeni z głównych badań rejestracyjnych (AZA PH GL 2003 CL 001 i AZAAML001), dlatego nie ustalono bezpieczeństwa stosowania oraz skuteczności azacytydyny w tej grupie pacjentów. Najnowsze dane z badań klinicznych u pacjentów z chorobami układu sercowo naczyniowego lub płuc w wywiadzie wykazały istotnie zwiększoną częstość zdarzeń dotyczących serca w związku ze stosowaniem azacytydyny (patrz punkt 4.8). Dlatego zaleca się zachowanie ostrożności przy przepisywaniu azacytydyny tym pacjentom. Należy rozważyć przeprowadzenie oceny wydolności krążeniowooddechowej przed leczeniem i w jego trakcie.
Martwicze zapalenie powięzi
U pacjentów leczonych azacytydyną zgłaszano przypadki martwiczego zapalenia powięzi, w tym przypadki zakończone zgonem. Jeśli u pacjentów rozwinie się martwicze zapalenie powięzi, należy przerwać leczenie azacytydyną i bezzwłocznie wdrożyć odpowiednie leczenie.
Zespół rozpadu guza
Ryzyko zespołu rozpadu guza dotyczy pacjentów z dużym rozmiarem guza przed zastosowaniem leczenia. Należy ściśle obserwować tych pacjentów i podjąć u nich odpowiednie środki ostrożności.
Zespół różnicowania
U pacjentów otrzymujących azacytydyny do wstrzykiwań zgłaszano przypadki zespołu różnicowania (znanego także jako zespół kwasu retinowego). Zespół różnicowania może skutkować zgonem, a objawy kliniczne mogą obejmować niewydolność oddechową, nacieki w płucach, gorączkę, wysypkę, obrzęk płuc, obrzęk obwodowy, szybki przyrost masy ciała, wysięk do opłucnej, wysięk do osierdzia, niedociśnienie i zaburzenia czynności nerek (patrz punkt 4.8). Należy rozważyć leczenie dużymi dawkami dożylnych kortykosteroidów i monitorowanie parametrów hemodynamicznych w razie pierwszego wystąpienia objawów przedmiotowych i podmiotowych, wskazujących na zespół różnicowania. Należy rozważyć czasowe przerwanie stosowania produktu azacytydyny do wstrzykiwań do czasu ustąpienia objawów i w razie ponownego ich wystąpienia należy zachować ostrożność.
W oparciu o dane z badań in vitro nie wydaje się, aby w metabolizmie azacytydyny uczestniczyły izoenzymy cytochromu P450 (CYP), UDPglukuronozylotransferazy (UGT), sulfotransferazy (SULT), ani transferazy glutationowe. Z tego powodu uznaje się, że interakcje związane z tymi enzymami metabolizującymi in vivo są mało prawdopodobne.
Istotne klinicznie działanie azacytydyny, hamujące lub indukujące izoenzymy cytochromu P450 są mało prawdopodobne (patrz punkt 5.2).
Nie przeprowadzono formalnych badań klinicznych dotyczących interakcji lekowych z azacytydyną.
Kobiety w wieku rozrodczym/antykoncepcja kobiet i mężczyzn
Kobiety w wieku rozrodczym muszą stosować skuteczną metodę antykoncepcji w trakcie leczenia i przez co najmniej 6 miesięcy po okresie leczenia. Należy poinstruować mężczyzn, aby podczas leczenia nie spłodzili dziecka oraz by stosowali skuteczną antykoncepcję w trakcie leczenia i przez co najmniej 3 miesiące po okresie leczenia.
Ciąża
Nie ma wystarczających danych dotyczących stosowania azacytydyny u kobiet w ciąży. Badania na myszach wykazały toksyczny wpływ na reprodukcję (patrz punkt 5.3). Potencjalne ryzyko u ludzi nie jest znane. W oparciu o wyniki badań na zwierzętach oraz mechanizm działania azacytydyny, nie należy jej stosować w czasie ciąży, szczególnie w pierwszym trymestrze, chyba że jest to wyraźnie koniecznie. W każdym indywidualnym przypadku należy rozważyć stosunek korzyści z leczenia do możliwego ryzyka dla płodu.
Karmienie piersią
Nie wiadomo, czy azacytydyna i (lub) jej metabolity przenikają do mleka ludzkiego. Karmienie piersią jest przeciwwskazane podczas leczenia azacytydyną, ze względu na możliwe ciężkie działania niepożądane u karmionego dziecka.
Płodność
Nie ma danych dotyczących wpływu azacytydyny na płodność u ludzi. U zwierząt udokumentowano działania niepożądane związane ze stosowaniem azacytydyny, wpływające na płodność u samców (patrz punkt 5.3). Przed rozpoczęciem leczenia należy doradzić pacjentom płci męskiej, aby zasięgnęli porady na temat przechowywania nasienia.
Azacytydyna ma niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Zgłaszano zmęczenie podczas stosowania azacytydyny. Z tego względu zalecane jest zachowanie ostrożności podczas prowadzenia pojazdów lub obsługiwania maszyn.
Podsumowanie profilu bezpieczeństwa
Dorośli pacjenci z MDS, CMML oraz AML (20-30% blastów w szpiku)
Działania niepożądane uznawane za możliwie lub prawdopodobnie związane z podawaniem azacytydyny, wystąpiły u 97% pacjentów.
Do najczęściej występujących ciężkich działań niepożądanych, zaobserwowanych w kluczowym badaniu (AZA PH GL 2003 CL 001) należały gorączka neutropeniczna (8,0%) oraz niedokrwistość (2,3%), działania te zgłaszano również w badaniach wspomagających (CALGB 9221 oraz CALGB 8921). Inne ciężkie działania niepożądane obserwowane w tych 3 badaniach to zakażenia, takie jak posocznica neutropeniczna (0,8%) i zapalenie płuc (2,5%) (w niektórych przypadkach zakończone zgonem), małopłytkowość (3,5%), reakcje nadwrażliwości (0,25%) i zdarzenia krwotoczne (np. krwotok mózgowy [0,5%], krwotok żołądkowojelitowy [0,8%] oraz krwotok śródczaszkowy [0,5%]).
Najczęściej zgłaszanymi działaniami niepożądanymi w czasie leczenia azacytydyną były reakcje hematologiczne (71,4%), w tym małopłytkowość, neutropenia i leukopenia (zazwyczaj stopnia 3. 4.), zdarzenia żołądkowojelitowe (60,6%), w tym nudności, wymioty (zazwyczaj stopnia 1.2.) lub reakcje w miejscu podania (77,1%, zazwyczaj stopnia 1.2.).
Dorośli pacjenci w wieku 65 lat lub starsi z AML z >30% blastów w szpiku
Najczęściej występujące ciężkie działania niepożądane (≥ 10%), zaobserwowane w badaniu AZA AML001 w grupie leczonej azacytydyną to gorączka neutropeniczna (25,0%), zapalenie płuc (20,3%) oraz gorączka (10,6%). Inne, rzadziej zgłaszane, ciężkie działania niepożądane w grupie leczonej azacytydyną to posocznica (5,1%), niedokrwistość (4,2%), posocznica neutropeniczna (3,0%), zakażenie dróg moczowych (3,0%), małopłytkowość (2,5%), neutropenia (2,1%), zapalenie tkanki łącznej (2,1%), zawroty głowy (2,1%) oraz duszność (2,1%).
Najczęściej zgłaszanymi (≥ 30%) działaniami niepożądanymi w czasie leczenia azacytydyną były zdarzenia żołądkowojelitowe, w tym zaparcia (41,9%), nudności (39,8%) oraz biegunka (36,9%), (zazwyczaj stopnia 1.2.), zaburzenia ogólne i stany w miejscu podania, w tym gorączka (37,7%, zazwyczaj stopnia 1.2.), oraz zdarzenia hematologiczne, w tym gorączka neutropeniczna (32,2%) oraz neutropenia (30,1%), zazwyczaj stopnia 3.4.
Tabelaryczne zestawienie działań niepożądanych
Poniższa Tabela 1 przedstawia działania niepożądane związane z leczeniem azacytydyną, pochodzące z głównych badań klinicznych dotyczących MDS i AML oraz z obserwacji po wprowadzeniu produktu zawierającego azacytydynę do obrotu.
Częstości zdefiniowano następująco: bardzo często (≥1/10); często (≥1/100 do <1/10); niezbyt często (≥1/1 000 do <1/100); rzadko (≥1/10 000 do <1/1 000); bardzo rzadko (<1/10 000); częstość nieznana (nie może być określona na podstawie dostępnych danych). W obrębie każdej grupy o określonej częstości działania niepożądane wymieniono zgodnie ze zmniejszającym się nasileniem. Działania niepożądane przedstawiono w poniższej tabeli zgodnie z największą częstością występowania obserwowaną w którymkolwiek spośród głównych badań klinicznych.
Tabela 1 Działania niepożądane zgłaszane u pacjentów z MDS lub AML leczonych azacytydyną (pochodzące z badań klinicznych i po wprowadzeniu do obrotu)
Klasyfikacja układów i narządów | Bardzo często | Często | Niezbyt często | Rzadko | Częstość nieznana |
Zakażenia i | zapalenie płuc* | posocznica* (w | martwicze | ||
zarażenia | (w tym | tym bakteryjna, | zapalenie | ||
pasożytnicze | bakteryjne, | wirusowa i | powięzi* | ||
wirusowe i | grzybicza), | ||||
grzybicze), | posocznica | ||||
zapalenie jamy | neutropeniczna*, | ||||
nosowo | zakażenie dróg | ||||
gardłowej | oddechowych (w | ||||
tym górnych | |||||
dróg | |||||
oddechowych i | |||||
oskrzeli), | |||||
zakażenie dróg | |||||
moczowych, | |||||
zapalenie tkanki | |||||
łącznej, | |||||
zapalenie | |||||
uchyłków, | |||||
grzybica jamy | |||||
ustnej, | |||||
zapalenie zatok, | |||||
zapalenie gardła, | |||||
zapalenie błony | |||||
śluzowej nosa, | |||||
opryszczka | |||||
pospolita, | |||||
zakażenie skóry | |||||
Nowotwory | zezpół | ||||
łagodne, złośliwe i | różnicowania*, | ||||
nieokreślone (w | a | ||||
tym torbiele i | |||||
polipy) |
Zaburzenia krwi i układu chłonnego | gorączka neutropeniczna*, neutropenia, leukopenia, małopłytkowość, niedokrwistość | pancytopenia*, niewydolność szpiku kostnego | |||
Zaburzenia układu immunologicznego | reakcje nadwrażliwości | ||||
Zaburzenia metabolizmu i odżywiania | anoreksja, zmniejszone łaknienie, hipokaliemia | odwodnienie | zespół rozpadu guza | ||
Zaburzenia psychiczne | bezsenność | stan splątania, lęk | |||
Zaburzenia układu nerwowego | zawroty głowy, ból głowy | krwotok śródczaszkowy*, omdlenie, senność, letarg | |||
Zaburzenia oka | krwotok oczny, krwotok spojówkowy | ||||
Zaburzenia serca | wysięk osierdziowy | zapalenie osierdzia | |||
Zaburzenia naczyniowe | niedociśnienie tętnicze*, nadciśnienie tętnicze, niedociśnienie ortostatyczne, krwiaki | ||||
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | duszność, krwawienie z nosa | wysięk opłucnowy, duszność wysiłkowa, ból gardła i krtani | choroba śródmiąższowa płuc | ||
Zaburzenia żołądka i jelit | biegunka, wymioty, zaparcia, nudności, ból brzucha (w tym dyskomfort brzucha i nadbrzusza) | krwotok żołądkowo jelitowy* (w tym krwotok z jamy ustnej), krwotok hemoroidalny, zapalenie jamy ustnej, krwawienie dziąseł, niestrawność | |||
Zaburzenia wątroby i dróg żółciowych | niewydolność wątroby*, postępująca śpiączka wątrobowa |
Zaburzenia skóry i tkanki podskórnej | wybroczyny, świąd (w tym uogólniony), wysypka, podskórne wylewy krwawe | plamica, łysienie, pokrzywka, rumień, wysypka plamista | ostra gorączkowa dermatoza neutrofilowa, ropne zgorzelinowe zapalenie skóry (łac. pyoderma gangrenosum) | ||
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | bóle stawów, bóle mięśniowo szkieletowe (w tym pleców, kości i ból w kończynie) | skurcze mięśni, bóle mięśniowe | |||
Zaburzenia nerek i dróg moczowych | niewydolność nerek*, krwiomocz, podwyższone stężenie kreatyniny w surowicy | nerkowa kwasica kanalikowa | |||
Zaburzenia ogólne i stany w miejscu podania | gorączka*, zmęczenie, osłabienie, bóle w klatce piersiowej, rumień w miejscu podania, ból w miejscu podania, odczyn w miejscu podania (nieokreślony) | siniaki, krwiaki, stwardnienie, wysypka, świąd, stan zapalny, odbarwienie, guzki i krwotok (w miejscu podania), złe samopoczucie, dreszcze, krwawienie w miejscu wkłucia cewnika | martwica miejsca wstrzyknięcia (w miejscu wstrzyknięcia) | ||
Badania diagnostyczne | zmniejszenie masy ciała |
*zgłaszano rzadko przypadki zgonów
a patrz punkt 4.4
Opis wybranych działań niepożądanych
Hematologiczne działania niepożądane
Najczęściej zgłaszane (≥ 10%) hematologiczne działania niepożądane związane z leczeniem azacytydyną to niedokrwistość, małopłytkowość, neutropenia, gorączka neutropeniczna i leukopenia, które były zazwyczaj stopnia 3. lub 4. Ryzyko wystąpienia tych zdarzeń jest większe podczas pierwszych 2 cykli, po czym u pacjentów z przywróconą czynnością układu krwiotwórczego występują one z mniejszą częstością. W przypadku większości hematologicznych działań niepożądanych, zastosowano rutynowe kontrole pełnej morfologii krwi i opóźnienie podawania azacytydyny w następnym cyklu, profilaktyczną antybiotykoterapię i (lub) w razie konieczności podawanie czynników wzrostu (np. GCSF) w neutropenii, oraz przetoczenia krwi w niedokrwistości lub małopłytkowości.
Zakażenia
Zahamowanie czynności szpiku może prowadzić do neutropenii i zwiększonego ryzyka wystąpienia zakażeń. U pacjentów otrzymujących azacytydynę były zgłaszane ciężkie działania niepożądane, takie jak posocznica, w tym posocznica neutropeniczna i zapalenie płuc, w niektórych przypadkach zakończone zgonem. Zakażenia można leczyć stosując leki przeciwzakaźne oraz wspomaganie czynnikami wzrostu (np. GCSF) w przypadku neutropenii.
Krwawienia
U pacjentów otrzymujących azacytydynę może wystąpić krwawienie. Zgłaszano ciężkie działania niepożądane, takie jak krwotok żołądkowojelitowy i krwotok śródczaszkowy. Należy obserwować pacjentów pod kątem objawów przedmiotowych i podmiotowych krwawienia, w szczególności pacjentów z istniejącą uprzednio lub związaną z leczeniem małopłytkowością.
Nadwrażliwość
U pacjentów otrzymujących azacytydynę zgłaszano ciężkie reakcje nadwrażliwości. W przypadku reakcji rzekomoanafilaktycznych, leczenie azacytydyną należy niezwłocznie przerwać i rozpocząć odpowiednie leczenie objawowe.
Działania niepożądane dotyczące skóry i tkanki podskórnej
Większość działań niepożądanych dotyczących skóry i tkanki podskórnej była związana z miejscem podania. Żadne z tych działań niepożądanych nie prowadziło do przerwania podawania azacytydyny, ani do obniżenia dawki azacytydyny w głównych badaniach. Większość działań niepożądanych występowała podczas pierwszych 2 cykli leczenia i zwykle zmniejszała się w następnych cyklach.
Działania niepożądane dotyczące tkanki podskórnej, takie jak wysypka/stan zapalny/świąd w miejscu podania, wysypka, rumień i uszkodzenie skóry, mogą wymagać równoczesnego zastosowania produktów leczniczych, takich jak leki przeciwhistaminowe, kortykosteroidy i niesteroidowe leki przeciwzapalne (NLPZ). Tego typu reakcje skórne należy odróżniać od zakażeń tkanek miękkich, występujących niekiedy w miejscu wstrzyknięcia. Po wprowadzeniu azacytydyny do obrotu zgłaszano występowanie zakażeń tkanek miękkich, w tym zapalenia tkanki łącznej i martwiczego zapalenia powięzi, w rzadkich przypadkach prowadzących do zgonu. Leczenie zakaźnych działań niepożądanych, patrz punkt 4.8 Zakażenia.
Działania niepożądane żołądkowo-jelitowe
Najczęściej zgłaszane działania niepożądane dotyczące żołądka i jelit, związane z leczeniem azacytydyną, obejmowały zaparcia, biegunkę, nudności i wymioty. Te działania niepożądane leczono objawowo lekami przeciwwymiotnymi na nudności i wymioty, lekami przeciwbiegunkowymi na biegunkę oraz lekami przeczyszczającymi i (lub) środkami zmiękczającymi stolec na zaparcia.
Działania niepożądane dotyczące nerek
U pacjentów leczonych azacytydyną zgłaszano zaburzenia czynności nerek, począwszy od zwiększonego stężenia kreatyniny w surowicy oraz krwiomoczu, po nerkową kwasicę kanalikową, niewydolność nerek i zgon (patrz punkt 4.4).
Działania niepożądane dotyczące wątroby
U pacjentów z rozległym obciążeniem nowotworem z powodu choroby przerzutowej, zgłaszano występowanie niewydolności wątroby, postępującej śpiączki wątrobowej i zgonu podczas leczenia azacytydyną (patrz punkt 4.4).
Zdarzenia dotyczące serca
Dane z badania klinicznego, do którego możliwe było włączenie pacjentów z chorobą układu sercowonaczyniowego lub chorobą płuc w wywiadzie, wykazały zwiększenie częstości zdarzeń dotyczących serca u pacjentów z nowo rozpoznaną ostrą białaczką szpikową (AML), leczonych azacytydyną (patrz punkt 4.4).
Pacjenci w podeszłym wieku
Informacje dotyczące bezpieczeństwa stosowania azacytydyny u pacjentów w wieku ≥ 85 lat są ograniczone (w badaniu AZAAML001 wzięło udział 14 [5,9%] pacjentów w wieku ≥ 85 lat).
Dzieci i młodzież
W badaniu AZAJMML001 leczono azacytydyną 28 pacjentów pediatrycznych (w wieku od jednego miesiąca do mniej niż 18 lat) z MDS (n = 10) albo młodzieńczą białaczką mielomonocytową (ang. juvenile myelomonocytic leukaemia, JMML; n = 18; patrz punkt 5.1).
U wszystkich 28 pacjentów wystąpiło co najmniej jedno zdarzenie niepożądane, a u 17 (60,7%) wystąpiło co najmniej jedno zdarzenie związane z leczeniem. Najczęściej zgłaszanymi zdarzeniami niepożądanymi w ogólnej populacji dzieci i młodzieży były gorączka, zdarzenia hematologiczne, w tym niedokrwistość, trombocytopenia i gorączka neutropeniczna, a także zdarzenia dotyczące przewodu pokarmowego, w tym zaparcia i wymioty.
U 3 (trzech) uczestników wystąpiło zdarzenie zaobserwowane w czasie leczenia, prowadzące do przerwania przyjmowania leku (gorączka, progresja choroby i ból brzucha).
W badaniu AZAAML004 siedmiu pacjentów pediatrycznych (w wieku od dwóch do 12 lat) otrzymało azacytydynę w celu leczenia nawrotu molekularnego AML po pierwszej remisji całkowitej (complete remission, CR1; patrz punkt 5.1).
U wszystkich siedmiu pacjentów wystąpiło przynajmniej jedno zdarzenie niepożądane związane z leczeniem. Najczęściej zgłaszanymi zdarzeniami niepożądanymi były neutropenia, nudności, leukopenia, trombocytopenia, biegunka i zwiększenie aktywności aminotransferazy alaninowej (AlAT). U dwóch pacjentów wystąpiło zdarzenie związane z leczeniem prowadzące do przerwania przyjmowania dawek (gorączka neutropeniczna, neutropenia).
Wśród ograniczonej liczby pacjentów pediatrycznych leczonych azacytydyną w trakcie badania klinicznego nie zidentyfikowano żadnych nowych sygnałów dotyczących bezpieczeństwa.
Ogólny profil bezpieczeństwa był zgodny z profilem bezpieczeństwa w populacji osób dorosłych.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań produktów Leczniczych Urzędu Rejestracji produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02222 Warszawa
Tel. +48 22 49 29 301
Faks: +48 22 49 29 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu lub przedstawicielowi podmiotu odpowiedzialnego.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat bezpieczeństwa stosowania leku.
Podczas badań klinicznych zgłoszono jeden przypadek przedawkowania azacytydyny. U pacjenta wystąpiła biegunka, nudności i wymioty po otrzymaniu pojedynczej dawki dożylnej około
290 mg/m2 pc., co stanowi prawie 4krotność zalecanej dawki początkowej.
W przypadku przedawkowania, pacjenta należy obserwować wykonując odpowiednie badania krwi, oraz w razie konieczności podać mu leczenie wspomagające. Nie jest znane antidotum na przedawkowanie azacytydyny.
Grupa farmakoterapeutyczna: leki przeciwnowotworowe, analogi pirymidyn Kod ATC: L01BC07
Mechanizm działania
Uważa się, że azacytydyna działa przeciwnowotworowo poprzez wiele mechanizmów, w tym cytotoksyczność wobec nieprawidłowych komórek krwiotwórczych w szpiku kostnym i hipometylację DNA. Działania cytotoksyczne azacytydyny mogą wynikać z wielu mechanizmów, w tym zahamowania syntezy DNA, RNA i białek, włączania jej do RNA i DNA oraz aktywacji szlaków odpowiedzi na uszkodzenie DNA. Komórki nieproliferujące są względnie niewrażliwe na azacytydynę. Włączenie azacytydyny do DNA powoduje dezaktywację metylotransferaz DNA, co prowadzi do hipometylacji DNA. Hipometylacja DNA nieprawidłowo metylowanych genów zaangażowanych w normalną regulację cyklu komórkowego, różnicowanie i szlaki śmierci komórkowej, może prowadzić do ponownej ekspresji genów oraz przywrócenia komórkom nowotworowym zdolności do supresji nowotworu. Względne znaczenie hipometylacji DNA dla wyników klinicznych, w porównaniu z cytotoksycznością lub innymi działaniami azacytydyny, nie zostało ustalone.
Skuteczność kliniczna i bezpieczeństwo stosowania
Dorośli pacjenci (MDS, CMML oraz AML [20-30% blastów w szpiku])
Skuteczność i bezpieczeństwo stosowania azacytydyny badano w międzynarodowym, wieloośrodkowym, kontrolowanym, prowadzonym metodą otwartej próby, randomizowanym badaniu porównawczym fazy 3. w grupach równoległych (AZA PH GL 2003 CL 001) z udziałem dorosłych pacjentów z: MDS o pośrednim2 i wysokim ryzyku zgodnie z Międzynarodowym Punktowym Systemem Rokowniczym (IPSS), niedokrwistością oporną na leczenie z nadmiarem blastów (ang. refractory anaemia with excess blasts, RAEB), niedokrwistością oporną na leczenie z nadmiarem blastów w okresie transformacji (ang. refractory anaemia with excess blasts in transformation, RAEB T) oraz zmodyfikowaną przewlekłą białaczką mielomonocytową (ang. modified chronic myelomonocytic leukaemia, mCMML) zgodnie z systemem klasyfikacji French American British (FAB). Pacjenci z RAEBT (2130% blastów) są obecnie uznawani według aktualnej klasyfikacji WHO za pacjentów z ostrą białaczką szpikową (AML). Azacytydynę i najlepsze leczenie wspomagające (ang. best supportive care, BSC) (n = 179) porównywano z konwencjonalnymi metodami leczenia (ang. conventional care regimens, CCR). CCR składało się z samego BSC (n = 105), cytarabiny w małych dawkach i BSC (n = 49), lub standardowej chemioterapii indukcyjnej i BSC (n = 25). Przed randomizacją pacjenci byli wstępnie przydzielani przez lekarza prowadzącego do jednej z 3 metod CCR. Leczenie wstępnie wybrane przez lekarza prowadzącego otrzymywali pacjenci, którzy nie zostali przydzieleni losowo do otrzymywania azacytydyny. Jednym z kryteriów włączenia był stan pacjentów wg Eastern Cooperative Oncology Group (ECOG) w zakresie 02. Pacjenci z wtórnym MDS byli wykluczeni z badania. Pierwszorzędowym parametrem końcowym badania była całkowita przeżywalność. Azacytydyna była podawana podskórnie w dawce 75 mg/m2 pc. na dobę
przez 7 dni, po czym następował okres przerwy trwający 21 dni (28dniowy cykl leczenia), przez medianę 9 cykli (zakres = 139) i przez średnio 10,2 cyklu. W populacji włączonej do badania (ang. Intent to Treat, ITT) mediana wieku wynosiła 69 lat (zakres od 38 do 88 lat). W analizie ITT 358 pacjentów (179 otrzymujących azacytydynę i 179 otrzymujących CCR), leczenie azacytydyną było związane z medianą czasu przeżycia wynoszącą 24,46 miesiąca w porównaniu z 15,02 miesiąca w przypadku pacjentów otrzymujących leczenie CCR, czyli różnica wynosiła 9,4 miesiąca, z wartością p wynoszącą 0,0001 w stratyfikowanym teście logrank. Współczynnik ryzyka (HR) dla efektu leczenia wynosił 0,58 (95% CI: 0,43; 0,77). Współczynnik dwuletniego czasu przeżycia wynosił 50,8% dla pacjentów otrzymujących azacytydynę vs. 26,2% dla pacjentów otrzymujących CCR (p < 0,0001).
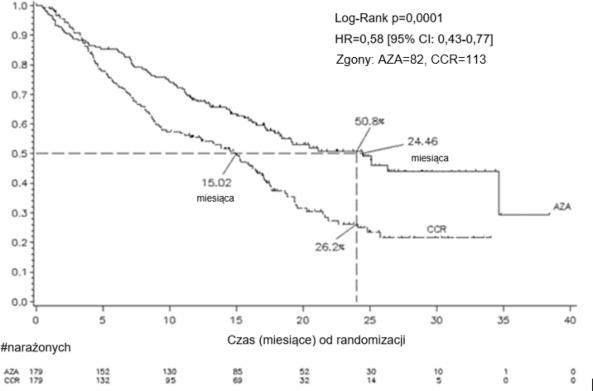
AZA = azacytydyna; CCR = konwencjonalne metody leczenia; CI (ang. confidence interval) przedział ufności; HR (ang. hazard ratio) = współczynnik ryzyka
Korzyści odnośnie czasu przeżycia po podawaniu azacytydyny były zgodne, niezależnie od opcji leczenia CCR (samo BSC, cytarabina w małej dawce i BSC lub standardowa chemioterapia indukcyjna i BSC) zastosowanej w grupie kontrolnej.
Podczas analizy podgrup cytogenetycznych IPSS zaobserwowano podobne wyniki w odniesieniu do mediany całkowitego czasu przeżycia we wszystkich grupach (dobra, pośrednia, zła cytogenetyka, w tym monosomia 7). W analizach podgrup wiekowych zaobserwowano zwiększenie mediany całkowitego czasu przeżycia dla wszystkich grup (< 65 lat, ≥ 65 lat i ≥ 75 lat).
Leczenie azacytydyną było związane z medianą czasu do zgonu lub transformacji w AML wynoszącą 13,0 miesięcy, vs, 7,6 miesiąca w przypadku pacjentów otrzymujących leczenie CCR; poprawa wynosiła 5,4 miesiąca z wartością p=0,0025 w stratyfikowanym teście logrank.
Leczenie azacytydyną było również związane ze zmniejszeniem częstości występowania cytopenii i powiązanych z nimi objawów. Leczenie azacytydyną prowadziło do zmniejszenia zapotrzebowania na przetoczenia czerwonych krwinek i płytek krwi. W grupie otrzymującej azacytydynę, spośród pacjentów zależnych od przetoczeń czerwonych krwinek na początku badania, 45,0% pacjentów stało
się niezależnych od przetoczeń czerwonych krwinek podczas okresu leczenia, w porównaniu z 11,4% pacjentów w złożonej grupie leczonej CCR (statystycznie istotna (p < 0,0001) różnica wynosząca 33,6% [95% CI: 22,4; 44,6]). U pacjentów, którzy na początku byli zależni od przetoczeń czerwonych krwinek i stali się niezależni od nich, mediana czasu trwania niezależności od przetoczeń czerwonych krwinek, w grupie otrzymującej azacytydynę wynosiła 13 miesięcy.
Odpowiedź była oceniana przez badacza lub niezależną komisję rewizyjną (ang. Independent Review Committee, IRC). Odpowiedź ogółem (remisja całkowita [ang. complete remission, CR] + remisja częściowa [ang. partial remission, PR]) według ustaleń badacza wynosiła 29% w grupie otrzymującej azacytydynę i 12% w złożonej grupie leczonej CCR (p = 0,0001). Odpowiedź ogółem (CR + PR) według ustaleń IRC w badaniu AZA PH GL 2003 CL 001 wynosiła 7% (12/179) w grupie otrzymującej azacytydynę, w porównaniu z 1% (2/179) w złożonej grupie leczonej CCR (p = 0,0113). Różnice między oceną odpowiedzi przez IRC i badacza wynikały z kryteriów Międzynarodowej Grupy Roboczej (ang. International Working Group, IWG), według których wymagana jest poprawa morfologii krwi obwodowej i utrzymanie poprawy przez co najmniej 56 dni. Korzyści odnośnie czasu przeżycia wykazano również u pacjentów, którzy nie uzyskali całkowitej/częściowej odpowiedzi po leczeniu azacytydyną. Poprawa hematologiczna (większa lub mniejsza) według ustaleń IRC była uzyskana u 49% pacjentów otrzymujących azacytydynę w porównaniu z 29% pacjentów w złożonej grupie leczonej CCR (p < 0,0001).
U pacjentów z jedną lub kilkoma nieprawidłowościami cytogenetycznymi na początku badania, procent pacjentów z większą odpowiedzią cytogenetyczną był podobny w grupie otrzymującej azacytydynę i w złożonej grupie leczonej CCR. Mniejsza odpowiedź cytogenetyczna była statystycznie istotnie (p = 0,0015) wyższa w grupie otrzymującej azacytydynę (34%) w porównaniu ze złożoną grupą leczoną CCR (10%).
Dorośli pacjenci w wieku 65 lat lub starsi z AML z >30% blastów w szpiku
Przedstawione poniżej wyniki dotyczą populacji ITT badania AZAAML001 (zatwierdzone wskazania, patrz punkt 4.1).
Skuteczność oraz bezpieczeństwo stosowania azacytydyny oceniono w międzynarodowym, wieloośrodkowym, kontrolowanym, otwartym badaniu klinicznym fazy 3. z grupami równoległymi, w grupie pacjentów w wieku 65 lat i starszych z nowo rozpoznaną pierwotną lub wtórną AML z >30% blastów w szpiku zgodnie z klasyfikacją WHO, niekwalifikujących się do przeszczepienia krwiotwórczych komórek macierzystych. Azacytydynę z BSC (n=241) porównywano z CCR. CCR składało się z samego BSC (n=45), cytarabiny w małych dawkach z BSC (n=158) lub standardowej intensywnej chemioterapii złożonej z cytarabiny i antracykliny oraz BSC (n=44). Przed randomizacją pacjenci byli wstępnie przydzielani przez lekarza prowadzącego do jednej z 3 metod CCR. Leczenie wstępnie wybrane przez lekarza prowadzącego otrzymywali pacjenci, którzy nie zostali przydzieleni losowo do otrzymywania azacytydyny. Wśród kryteriów włączenia był stan pacjentów wg ECOG w zakresie 02 oraz umiarkowane lub duże ryzyko wynikające z nieprawidłowości cytogenetycznych.
Pierwszorzędowym parametrem końcowym badania była przeżywalność ogółem.
Azacytydyna była podawana podskórnie w dawce 75 mg/m2 pc. na dobę przez 7 dni, po czym następował okres przerwy trwający 21 dni (28dniowy cykl leczenia), przez medianę 6 cykli (zakres 1 28), u pacjentów z grupy wyłącznie otrzymującej BSC przez medianę 3 cykli (zakres 120), u pacjentów otrzymujących cytarabinę w małych dawkach medianę 4 cykli (zakres 125) oraz u pacjentów otrzymujących standardową intensywną chemioterapię medianę 2 cykli (zakres 13, cykl indukcyjny plus 1 lub 2 cykle konsolidacyjne).
Indywidualne parametry początkowe były porównywalne między grupą otrzymującą azacytydynę, a grupami otrzymującymi CCR. Mediana wieku pacjentów wynosiła 75,0 lat (zakres 64 do 91 lat), 75,2% było rasy kaukaskiej, 59,0% stanowili mężczyźni. Na początku badania, u 60,7% pacjentów stwierdzono bliżej nieokreśloną AML, u 32,4% AML ze zmianami mielodysplastycznymi, u 4,1% nowotwory szpiku związane z leczeniem, natomiast u 2,9% AML z nawracającymi nieprawidłowościami genetycznymi, zgodnie z klasyfikacją WHO.
W analizie ITT 488 pacjentów (241 otrzymujących azacytydynę oraz 247 otrzymujących CCR), leczenie azacytydyną było związane z medianą przeżywalności wynoszącą 10,4 miesiąca w porównaniu z 6,5 miesiąca w przypadku pacjentów otrzymujących CCR, czyli różnica wynosiła 3,8 miesiąca, z wartością p wynoszącą 0,1009 w stratyfikowanym teście logrank (dwustronnie).
Współczynnik ryzyka dla efektu leczenia wynosił 0,85 (95% CI: 0,69; 1,03). Wskaźnik rocznego przeżycia wynosił 46,5% u pacjentów otrzymujących azacytydynę vs.34,3% u pacjentów otrzymujących CCR.
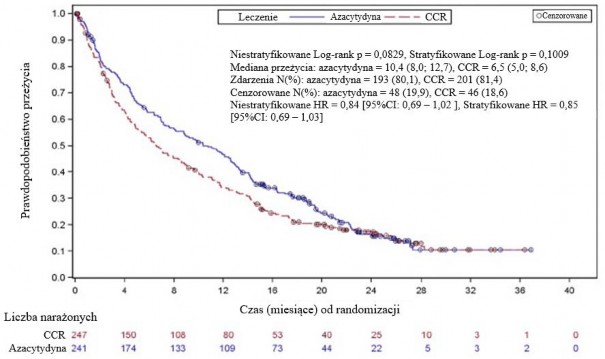
Model hazardu proporcjonalnego Cox’a dopasowany dla predefiniowanych na początku badania czynników prognostycznych określił wskaźnik ryzyka dla azacytydyny vs. CCR na poziomie 0,80 (95% CI: 0,66; 0,99; p=0,0355).
Ponadto, pomimo tego, że badanie nie dawało możliwości wykazania statystycznie istotnej różnicy pomiędzy grupą azacytydyny a wybranymi wstępnie grupami CCR, czas przeżycia pacjentów leczonych azacytydyną był dłuższy w porównaniu do wariantów CCR: wyłącznie BSC, cytarabiny w małych dawkach z BSC oraz porównywalny w przypadku zastosowania standardowej, intensywnej chemioterapii z BSC.
We wszystkich określonych przed rozpoczęciem badania podgrupach [wiek (<75 lat oraz ≥75 lat), płeć, rasa, wynik w skali ECOG (0, 1 lub 2), wyjściowe ryzyko cytogenetyczne (umiarkowane lub duże), region geograficzny, klasyfikacja AML wg WHO (w tym AML ze zmianami mielodysplastycznymi, początkowa liczba białych krwinek (≤5 x 109/l lub >5 x 109/l), początkowy odsetek blastów w szpiku (≤50% lub >50%) i MDS w wywiadzie] obserwowano tendencję do większej korzyści w odniesieniu do przeżywalności ogółem w grupie otrzymującej azacytydynę. W kilku określonych przed rozpoczęciem badania podgrupach współczynnik ryzyka przeżywalności ogółem osiągnął wartość istotną statystycznie, w tym u pacjentów z dużym ryzykiem cytogenetycznym, pacjentów z AML ze zmianami mielodysplastycznymi, pacjentów w wieku < 75 lat, u kobiet oraz u pacjentów rasy białej.
Odpowiedzi hematologiczna oraz cytogenetyczna zostały podobnie ocenione przez badacza oraz IRC. Współczynnik odpowiedzi ogółem (remisja całkowita [CR] i remisja całkowita z niepełną regeneracją
morfologii krwi [CRi]) określony przez IRC wynosił 27,8% w grupie otrzymującej azacytydynę oraz 25,1% w złożonej grupie CCR (p = 0,5384). U pacjentów, którzy osiągnęli CR lub CRi, mediana czasu trwania remisji wynosiła 10,4 miesiąca (95% CI = 7,2; 15,2) u pacjentów otrzymujących azacytydynę oraz 12,3 miesiąca (95% CI = 9,0; 17,0) u pacjentów otrzymujących CCR.
Korzyści odnośnie czasu przeżycia wykazano również u pacjentów, którzy nie uzyskali całkowitej odpowiedzi po leczeniu azacytydyną w porównaniu do CCR.
Leczenie azacytydyną wpływało na poprawę wyników morfologii krwi obwodowej oraz prowadziło do zmniejszenia potrzeby przetoczeń czerwonych krwinek i płytek krwi. Pacjenta określano jako zależnego od przetoczeń czerwonych krwinek lub płytek krwi na początku badania, jeśli miał jedno lub więcej przetoczeń czerwonych krwinek lub płytek krwi w ciągu 56 dni (8 tygodni) przed randomizacją. Pacjenta określano jako niezależnego od przetoczeń czerwonych krwinek lub płytek krwi w okresie leczenia, jeśli u pacjenta nie przeprowadzono żadnego przetoczenia czerwonych krwinek lub płytek krwi w ciągu kolejnych 56 dni podczas okresu obserwacji.
Spośród pacjentów w grupie otrzymującej azacytydynę, zależnych od przetoczeń czerwonych krwinek na początku badania, 38,5% (95% CI = 31,1; 46,2) pacjentów stało się niezależnych od przetoczeń czerwonych krwinek podczas okresu leczenia, w porównaniu z 27,6% (95% CI = 20,9; 35,1) pacjentów w złożonej grupie CCR. U pacjentów, którzy na początku badania byli zależni od przetoczeń czerwonych krwinek i stali się niezależni od nich podczas leczenia, mediana czasu trwania niezależności od przetoczeń czerwonych krwinek w grupie otrzymującej azacytydynę wynosiła 13,9 miesiąca, a nie została osiągnięta w grupie CCR.
Spośród pacjentów w grupie otrzymującej azacytydynę, zależnych od przetoczeń płytek krwi na początku badania, 40,6% (95% CI = 30,9; 50,8) stało się niezależnych od przetoczeń płytek krwi podczas okresu leczenia, w porównaniu z 29,3% (95% CI = 19,7; 40,4) pacjentów w złożonej grupie leczonej CCR. U pacjentów, którzy na początku badania byli zależni od przetoczeń płytek krwi i stali się niezależni od nich podczas leczenia, mediana czasu trwania niezależności od przetoczeń płytek krwi wynosiła 10,8 miesiąca w grupie otrzymującej azacytydynę oraz 19,2 miesiąca w grupie CCR.
Zależna od zdrowia jakość życia (ang. Health- Related Quality of Life, HRQoL) została oceniona za pomocą kwestionariusza European Organization for Research and Treatment of Cancer Core Quality of Life Questionnaire (EORTC QLQC30). Dane dotyczące HRQoL mogą być analizowane dla części populacji objętej badaniem. Pomimo ograniczeń analizy, z dostępnych danych wynika, że pacjenci nie doświadczają znaczącego pogorszenia jakości życia podczas leczenia azacytydyną.
Dzieci i młodzież
Badanie AZAJMML001 było międzynarodowym, wieloośrodkowym badaniem fazy II prowadzonym metodą otwartej próby, mającym na celu ocenę farmakokinetyki, farmakodynamiki, bezpieczeństwa stosowania oraz aktywności azacytydyny przed przeszczepieniem krwiotwórczych komórek macierzystych u pacjentów pediatrycznych z nowo rozpoznanym zaawansowanym MDS albo JMML. Głównym celem badania klinicznego była ocena wpływu azacytydyny na wskaźnik odpowiedzi w Dniu 28. Cyklu 3.
Pacjentów (z MDS, n = 10; z JMML, n = 18; wiek od trzech miesięcy do 15 lat; 71% płci męskiej)
leczono azacytydyną podawaną dożylnie w dawce 75 mg/m² pc. codziennie w Dniach 1.–
7. w cyklach 28dniowych przez co najmniej trzy cykle, a maksymalnie sześć cykli.
Włączanie pacjentów do grupy badanej z MDS przerwano po włączeniu 10 pacjentów z powodu braku skuteczności; u tych 10 pacjentów nie odnotowano żadnych potwierdzonych odpowiedzi.
Do grupy badanej z JMML włączono 18 pacjentów (13 z mutacjami somatycznymi w genie PTPN11, trzech w genie NRAS i jednego w genie KRAS oraz jednego z rozpoznaniem klinicznym nerwiakowłókniakowatości typu 1 [ang. neurofibromatosis type 1, NF1]). Szesnastu pacjentów ukończyło trzy cykle leczenia, a pięciu z nich ukończyło sześć cykli leczenia. Łącznie 11 pacjentów
z JMML wykazywało odpowiedź kliniczną w Dniu 28. Cyklu 3, a spośród tych 11 uczestników
u dziewięciu (50%) potwierdzono odpowiedź kliniczną (trzech uczestników z potwierdzoną remisją
całkowitą [ang. confirmed complete remission, cCR] i sześciu uczestników z potwierdzoną remisją częściową [ang. confirmed partial remission, cPR]). W kohorcie pacjentów z JMML leczonych azacytydyną u siedmiu (43,8%) pacjentów wystąpiła utrzymująca się odpowiedź w zakresie liczby płytek krwi (liczba ≥100 × 109/l), a siedmiu (43,8%) wymagało przetoczenia krwi podczas przeszczepienia krwiotwórczych komórek macierzystych. U 17 z 18 pacjentów przeprowadzono następnie przeszczepienie krwiotwórczych komórek macierzystych.
Ze względu na schemat badania klinicznego (niewielka liczba pacjentów i różne czynniki zakłócające) na jego podstawie nie można wnioskować o tym, czy stosowanie azacytydyny przed przeszczepieniem krwiotwórczych komórek macierzystych powoduje poprawę wyników w zakresie przeżycia pacjentów z JMML.
Badanie AZAAML004 było wieloośrodkowym, prowadzonym metodą otwartej próby badaniemfazy
2 oceniającym bezpieczeństwo stosowania, farmakodynamikę i skuteczność azacytydyny w porównaniu z brakiem leczenia przeciwnowotworowego u dzieci i młodych osób dorosłych
z nawrotem molekularnym AML po CR1.
Siedmiu pacjentom (mediana wieku 6,7 lat [zakres 2–12 lat]; 71,4% płci męskiej) podawano azacytydynę dożylnie w dawce 100 mg/m2 raz na dobę w Dniach 1–7 każdego 28dniowego cyklu przez maksymalnie trzy cykle.
U pięciu pacjentów przeprowadzono ocenę w celu wykrycia minimalnej choroby resztkowej w dniu 84.; u czterech pacjentów wystąpiła stabilizacja molekularna (n = 3) albo poprawa
molekularna(n = 1), a u jednego pacjenta wystąpił nawrót kliniczny. Sześciu z siedmiu pacjentów (90% [95% CI = 0,4, 1,0]) leczonych azacytydyną poddano przeszczepieniu krwiotwórczych komórek macierzystych (haematopoietic stem cell transplantation, HSCT).
Z powodu małej liczebności próby nie można określić skuteczności azacytydyny w leczeniu AML u pacjentów pediatrycznych.
Informacje dotyczące bezpieczeństwa znajdują się w punkcie 4.8.
Wchłanianie
Po podskórnym podaniu pojedynczej dawki 75 mg/m2 pc. azacytydyna była szybko wchłaniana z uzyskaniem maksymalnych stężeń w osoczu wynoszących 750 ± 403 ng/ml po 0,5 godz. od podania dawki (pierwszy punkt pobierania próbek). Całkowita dostępność biologiczna azacytydyny po podaniu podskórnym względem podania dożylnego (pojedyncze dawki 75 mg/m2 pc.) wynosiła około 89% w oparciu o pole powierzchni pod krzywą (AUC).
Pole powierzchni pod krzywą oraz maksymalne stężenie w osoczu (Cmax) po podaniu podskórnym azacytydyny były w przybliżeniu proporcjonalne w zakresie dawek od 25 do 100 mg/m2 pc.
Dystrybucja
Po dożylnym podaniu średnia objętość dystrybucji wynosiła 76 ± 26 l, a klirens układowy wynosił 147
± 47 l/godz.
Metabolizm
W oparciu o dane z badań in vitro, nie wydaje się, by w metabolizmie azacytydyny uczestniczyły izoenzymy cytochromu P450 (CYP), UDPglukuronozylotransferazy (UGT), sulfotransferazy (SULT) ani transferazy glutationowe (GST).
Azacytydyna ulega spontanicznej hydrolizie oraz deaminacji z udziałem deaminazy cytydynowej. W ludzkich frakcjach wątrobowych S9, tworzenie metabolitów było niezależne od NADPH, co wskazuje, że w metabolizmie azacytydyny nie uczestniczą izoenzymy cytochromu P450. Badanie in vitro azacytydyny z hodowlami ludzkich hepatocytów wskazało, że przy stężeniach od 1,0 μM do 100 μM (tzn. do około 30krotnie większych niż stężenia osiągane klinicznie), azacytydyna nie indukuje CYP 1A2, 2C19, ani 3A4 lub 3A5. W badaniach mających na celu ocenę hamowania szeregu izoenzymów P450 (CYP 1A2, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 i 3A4) azacytydyna w stężeniu do 100 μM nie powodowała ich hamowania. Dlatego indukcja lub hamowanie enzymu CYP przez azacytydynę w stężeniach klinicznie osiągalnych w osoczu jest mało prawdopodobne.
Wydalanie
Azacytydyna jest szybko usuwana z osocza ze średnim okresem półtrwania w fazie eliminacji (t½) po podaniu podskórnym wynoszącym 41 ± 8 minut. Przy podskórnym podawaniu azacytydyny w dawce 75 mg/m2 pc. raz na dobę przez 7 dni nie występuje kumulacja. Azacytydyna i (lub) jej metabolity są wydalane głównie z moczem. Po dożylnym i podskórnym podaniu 14Cazacytydyny, odpowiednio 85% i 50% podanej radioaktywności było wykrywane w moczu, podczas gdy < 1% było wykrywane w kale.
Szczególne grupy pacjentów
Nie badano formalnie wpływu niewydolności wątroby (patrz punkt 4.2), płci, wieku ani rasy na farmakokinetykę azacytydyny.
Dzieci i młodzież
W badaniu AZAJMML001 przeprowadzono analizę farmakokinetyczną u 10 pacjentów pediatrycznych z MDS i 18 z JMML w Dniu 7. Cyklu 1 (patrz punkt 5.1). Mediana (przedział) wieku pacjentów z MDS wynosiła 13,3 (1,9–15) roku, a pacjentów z JMML – 2,1 (0,2–6,9) roku.
Po podaniu dożylnym w dawce 75 mg/m2 pc. azacytydyna osiągała wartość Cmax szybko, w ciągu 0,083 godziny, zarówno w populacji z MDS, jak i w populacji z JMML. Średnia geometryczna Cmax u pacjentów z MDS i JMML wynosiła odpowiednio 1797,5 i 1066,3 ng/ml, a średnia geometryczna AUC0∞ wynosiła odpowiednio 606,9 i 240,2 ng∙h/ml. Średnia geometryczna objętości dystrybucji u uczestników z MDS i JMML wynosiła odpowiednio 103,9 i 61,1 l. Wydaje się, że całkowita ekspozycja osocza na azacytydynę była wyższa u uczestników z MDS, jednak w przypadku zarówno wartości AUC, jak i Cmax stwierdzono umiarkowaną do wysokiej zmienność między pacjentami.
Średnia geometryczna t½ w przypadku MDS i JMML wynosiła odpowiednio 0,4 i 0,3 godziny,
a średnia geometryczna klirensu wynosiła odpowiednio 166,4 i 148,3 l/h.
Dane farmakokinetyczne pochodzące z badania AZAJMML001 połączono i porównano z danymi farmakokinetycznymi pochodzącymi od sześciu uczestników dorosłych z MDS, którym podawano azacytydynę dożylnie w dawce 75 mg/m2 pc. w ramach badania AZA2002BA002. Średnie wartości Cmax i AUC0t azacytydyny u pacjentów dorosłych i pacjentów pediatrycznych po podaniu dożylnym były podobne (odpowiednio 2750 ng/ml wobec 2841 ng/ml oraz 1025 ng∙h/ml
wobec 882,1 ng∙h/ml).
W badaniu AZAAML004 przeprowadzono analizę farmakokinetyczną u sześciu z siedmiu pacjentów pediatrycznych, w przypadku których uzyskano przynajmniej jedną mierzalną wartość stężenia leku po podaniu dawki na potrzeby badań farmakokinetycznych (patrz punkt 5.1). Mediana wieku (zakres) pacjentów z AML wynosiła 6,7 (2–12) lat.
Po podaniu dawek wielokrotnych 100 mg/m2 średnie geometryczne dla wartości Cmax i AUC0tauw dniu
7. Cyklu 1. wyniosły odpowiednio 1557 ng/ml i 899,6 ng h/ml, z obserwowaną dużą
zmiennością międzyosobniczą (CV% odpowiednio 201,6% i 87,8%). Azacytydyna szybko osiągnęła wartość Cmax, z medianą czasu wynoszącą 0,090 godzin po podaniu dożylnym, a wartość spadała przy
średniej geometrycznej t1/2 wynoszącej 0,380 godzin. Średnia geometryczna klirensu i objętości dystrybucji wyniosła odpowiednio 127,2 l/h i 70,2 l.
Ekspozycja farmakokinetyczna (na azacytydynę) obserwowana u dzieci z nawrotem molekularnym
AML po CR1 była porównywalna z ekspozycją na podstawie danych zbiorczych uzyskanych od10 dzieci z MDS i 18 dzieci z JMML oraz porównywalna z ekspozycją na azacytydynę u osób dorosłych z MDS.
Niewydolność nerek
Niewydolność nerek nie ma istotnego wpływu na ekspozycję na azacytydynę po pojedynczym ani wielokrotnym podaniu podskórnym. Po podaniu podskórnym pojedynczej dawki 75 mg/m2 pc., średnie wartości ekspozycji (AUC oraz Cmax) u pacjentów z łagodną, umiarkowaną oraz ciężką niewydolnością nerek zwiększyły się o odpowiednio 1121%, 1527% oraz 4166%, w porównaniu do pacjentów z prawidłową czynnością nerek. Jednakże ekspozycja mieściła się w zakresie wartości obserwowanych u pacjentów z prawidłową czynnością nerek. Azacytydyna może być podawana pacjentom z niewydolnością nerek bez początkowego dostosowania dawki, pod warunkiem obserwacji pacjentów pod kątem wystąpienia toksyczności, ponieważ azacytydyna i (lub) jej metabolity są wydalane głównie przez nerki.
Farmakogenomika
Nie badano formalnie wpływu znanych polimorfizmów deaminazy cytydynowej na metabolizm azacytydyny.
Azacytydyna indukuje zarówno mutacje genowe, jak i aberracje chromosomowe w układach komórkowych bakterii i ssaków in vitro. Potencjalne działanie rakotwórcze azacytydyny było oceniane na myszach i szczurach. Azacytydyna wywoływała nowotwory układu krwiotwórczego u samic myszy po podawaniu dootrzewnowym 3 razy na tydzień przez 52 tygodnie. U myszy, którym podawano azacytydynę dootrzewnowo przez 50 tygodni, obserwowano zwiększoną częstość występowania guzów w układzie chłonnosiateczkowym, płucach, sutkach i skórze. Badanie na szczurach dotyczące rakotwórczości wykazało zwiększoną częstość występowania nowotworów jądra.
Badania na myszach dotyczące wczesnej embriotoksyczności wykazały częstość występowania wewnątrzmacicznego obumarcia zarodka (zwiększona resorpcja) wynoszącą 44% po pojedynczym wstrzyknięciu dootrzewnowym azacytydyny w czasie organogenezy. U myszy, którym podano azacytydynę podczas zamykania lub przed zamknięciem podniebienia twardego, wykryto nieprawidłowości rozwojowe w mózgu. U szczurów azacytydyna podawana przed implantacją nie powodowała działań niepożądanych, ale podawana podczas organogenezy, była wyraźnie toksyczna dla zarodka. Zaburzenia u płodu podczas organogenezy u szczurów obejmowały: nieprawidłowości OUN (egzencefalia lub przepuklina mózgowa), nieprawidłowości kończyn (mikromelia, stopa zdeformowana, syndaktylia, oligodaktylia) i inne (małoocze, mikrognacja, wytrzewienie, obrzęk i nieprawidłowości żeber).
Podanie azacytydyny samcom myszy przed kopulacją z nieleczonymi azacytydyną samicami myszy skutkowało zmniejszeniem płodności i utratą potomstwa podczas późniejszego rozwoju płodowego i pourodzeniowego. Podanie azacytydyny samcom szczurów prowadziło do utraty masy jąder i najądrzy, obniżonej liczby plemników, obniżonej częstości ciąż, zwiększonej liczby płodów nieprawidłowych i zwiększonej liczby straconych płodów przez pokryte samice (patrz punkt 4.4).
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
Mannitol (E 421)
Nie wolno mieszać tego produktu leczniczego z innymi produktami leczniczymi, z wyjątkiem wymienionych w punkcie 6.6.
Nieotwarta fiolka z proszkiem: 2 lata
Produkt po rekonstytucji:
Dla produktu leczniczego Azacitidine Zentiva przygotowany z użyciem nieschłodzonej wody do wstrzykiwań wykazano chemiczną i fizyczną stabilność użytkową przygotowanego produktu leczniczego przez 60 minut w temperaturze 25°C i przez 8 godzin w temperaturze 2°C 8°C.
Okres ważności przygotowanego produktu leczniczego może zostać wydłużony poprzez przygotowanie produktu z użyciem schłodzonej (2°C 8°C) wody do wstrzykiwań. Dla produktu leczniczego Azacitidine Zentiva przygotowanego z użyciem schłodzonej (2°C 8°C) wody do wstrzykiwań, wykazano chemiczną i fizyczną stabilność użytkową przygotowanego produktu leczniczego w temperaturze 2°C 8°C przez 22 godziny.
Z mikrobiologicznego punktu widzenia sporządzony produkt należy zużyć natychmiast. Jeżeli nie został użyty natychmiast, za czas i warunki przechowywania przed zastosowaniem leku odpowiada użytkownik. Nie wolno go jednak przechowywać dłużej niż 8 godzin w temperaturze 2°C 8°C jeśli produkt został przygotowany z użyciem nieschłodzonej wody do wstrzykiwań i nie dłużej niż 22 godziny jeśli produkt został przygotowany z użyciem schłodzonej wody do wstrzykiwań.
Nieotwarte fiolki
Brak specjalnych zaleceń dotyczących przechowywania produktu leczniczego.
Przygotowana zawiesina
Warunki przechowywania produktu leczniczego po rekonstytucji, patrz punkt 6.3.
Fiolka z bezbarwnego szkła typu I zamknięta 20 mm ciemnoszarym korkiem z gumy chlorobutylowej z pojedynczą szczeliną i 20 mm aluminiowym uszczelnieniem z zamknięciem typu flip off.
Wielkość opakowania: 1 fiolka.
stosowania
Zalecenia dotyczące bezpiecznego postępowania
Azacytydyna jest cytotoksycznym produktem leczniczym i, jak w przypadku innych potencjalnie toksycznych związków, należy zachować ostrożność podczas sporządzania i postępowania z zawiesiną azacytydyny. Należy stosować się do procedur właściwego postępowania z przeciwnowotworowymi produktami leczniczymi i ich usuwania.
W przypadku styczności przygotowanego produktu leczniczego Azacitidine Zentiva ze skórą, należy ją natychmiast dokładnie przemyć wodą z mydłem. W przypadku kontaktu z błonami śluzowymi, należy je dokładnie przepłukać wodą.
Procedura przygotowania
Produkt leczniczy Azacitidine Zentiva powinien zostać przygotowany z użyciem wody do wstrzykiwań. Okres ważności przygotowanego produktu leczniczego może zostać wydłużony poprzez przygotowanie produktu z użyciem schłodzonej (2°C8°C) wody do wstrzykiwań. Szczegóły dotyczące przechowywania przygotowanego produktu zostały przedstawione powyżej.
DOPUSZCZENIE DO OBROTU
Zentiva k.s.
U kabelovny 130 Dolní Měcholupy 102 37 Praga 10 Republika Czeska
Pozwolenie nr 26975
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 24.03.2022
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
11/2022











