Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Submena, 100 mikrogramów, tabletki podjęzykowe Submena, 200 mikrogramów, tabletki podjęzykowe Submena, 400 mikrogramów, tabletki podjęzykowe Submena, 800 mikrogramów, tabletki podjęzykowe
Każda tabletka podjęzykowa zawiera:
157 mikrogramów fentanylu cytrynianu mikronizowanego co odpowiada 100 mikrogramom fentanylu
(Fentanylum).
314 mikrogramów fentanylu cytrynianu mikronizowanego co odpowiada 200 mikrogramom fentanylu
(Fentanylum).
628 mikrogramów fentanylu cytrynianu mikronizowanego co odpowiada 400 mikrogramom fentanylu
(Fentanylum).
1257 mikrogramów fentanylu cytrynianu mikronizowanego co odpowiada 800 mikrogramom fentanylu (Fentanylum).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Tabletka podjęzykowa
Submena, 100 mikrogramów, tabletka podjęzykowa to biała okrągła tabletka o średnicy 6 mm Submena, 200 mikrogramów, tabletka podjęzykowa to owalna biała tabletka o wymiarach 7 x 5 mm Submena, 400 mikrogramów, tabletka podjęzykowa to biała tabletka w kształcie rombu o wymiarach 9 x 7 mm
Submena, 800 mikrogramów, tabletka podjęzykowa to biała tabletka w kształcie kapsułki o wymiarach 10 x 6 mm
Leczenie bólu przebijającego u dorosłych pacjentów, u których stosuje się terapię opioidową w przewlekłych bólach nowotworowych.
Ból przebijający to przemijające nasilenie dolegliwości bólowych nakładających się na kontrolowany w inny sposób przewlekły ból podstawowy.
Produkt leczniczy Submena należy podawać wyłącznie pacjentom, u których stwierdzono tolerancję na leczenie opioidami uporczywego bólu nowotworowego.
Pacjenci, których można uznać za tolerujących leczenie opioidami, to pacjenci otrzymujący doustnie co najmniej 60 mg morfiny na dobę, przezskórnie co najmniej 25 mikrogramów fentanylu na godzinę,
co najmniej 30 mg oksykodonu na dobę, doustnie co najmniej 8 mg hydromorfonu na dobę lub równoważną analgetycznie dawkę innego leku opioidowego stosowanego przez tydzień lub dłużej.
Sposób podawania
Produkt leczniczy Submena, tabletki podjęzykowe powinny być wkładane głęboko pod język. Tabletek nie należy połykać, żuć, ani ssać, ale poczekać do całkowitego ich rozpuszczenia. Pacjentom należy zalecić, aby nic nie jedli ani nie pili aż do czasu całkowitego rozpuszczenia tabletki podjęzykowej.
U pacjentów, u których występuje suchość jamy ustnej można użyć wody do zwilżenia jamy ustnej przed podaniem tabletki produktu leczniczego Submena.
Dostosowanie dawki
Celem dostosowania dawki jest ustalenie optymalnej dawki podtrzymującej stosowanej w leczeniu ciągłym bólu przebijającego. Dawka optymalna powinna zapewnić odpowiednie działanie przeciwbólowe przy akceptowalnym nasileniu działań niepożądanych.
Optymalna dawka produktu Submena zostanie określona poprzez stopniowe zwiększanie dawki, indywidualnie dla każdego pacjenta. Dostępnych jest kilka mocy produktu do stosowania w fazie dostosowywania dawki. Dawka początkowa produktu Submena powinna wynosić 100 mikrogramów i w miarę potrzeby powinna być zwiększana w zakresie dostępnych mocy.
Należy ściśle monitorować pacjentów aż do czasu ustalenia optymalnej dawki.
Ze względu na różny profil wchłaniania nie można zamienić w stosunku 1:1 dawki innych produktów zawierających fentanyl na dawkę produktu Submena. U pacjentów, u których dotychczas stosowano inny produkt zawierający fentanyl, należy przeprowadzić od początku proces dostosowania dawki produktu Submena.
Zaleca się dostosowywanie dawki według poniższego schematu, jednak w każdym przypadku lekarz powinien wziąć pod uwagę stan kliniczny pacjenta, wiek oraz współistniejące choroby.
U wszystkich pacjentów leczenie należy rozpoczynać od podania jednej tabletki podjęzykowej 100 mikrogramów. Jeśli w ciągu 15-30 minut od podania jednej tabletki nie uzyskano odpowiedniego działania przeciwbólowego, można podać dodatkową (drugą) tabletkę podjęzykową 100 mikrogramów. Jeśli nie zostanie osiągnięte działanie przeciwbólowe w ciągu 15-30 minut od podania pierwszej dawki, w przypadku kolejnego epizodu bólu przebijającego należy rozważyć zwiększenie dawki do kolejnej dostępnej mocy (patrz rysunek poniżej).
Zwiększanie dawki należy kontynuować w sposób stopniowy aż do uzyskania odpowiedniego działania przeciwbólowego z tolerowanymi działaniami niepożądanymi. Moc dodatkowej (drugiej) tabletki podjęzykowej należy zwiększyć ze 100 do 200 mikrogramów dla dawek 400 mikrogramów i większych. Przedstawiono to w poniższym schemacie. W fazie dostosowania dawki nie należy podawać więcej niż dwie (2) dawki na pojedynczy epizod bólu przebijającego.
SCHEMAT DOSTOSOWANIA DAWKI PRODUKTU LECZNICZEGO SUBMENA
Dawka początkowa 100 µg
Pożądane działanie przeciwbólowe osiągnięte w ciągu 15-30 minut?
TAK NIE
Należy przyjąć drugą tabletkę (patrz tabela w celu ustalenia mocy drugiej tabletki)
Należy stosować tę dawkę podczas kolejnych epizodów bólu przebijającego
W następnym epizodzie bólu przebijającego należy zwiększyć moc pierwszej tabletki do kolejnej mocy
Moc (w mikrogramach) pierwszej tabletki w epizodzie bólu przebijającego | Moc (w mikrogramach) dodatkowej (drugiej) tabletki, którą w razie potrzeby należy przyjąć po 15-30 minutach od podania pierwszej tabletki |
100 | 100 |
200 | 100 |
300 | 100 |
400 | 200 |
600 | 200 |
800 | - |
Jeżeli przy zastosowaniu większej dawki uzyskuje się odpowiednie działanie przeciwbólowe, ale działania niepożądane są nie do zaakceptowania, można podać dawkę pośrednią (stosując dawkę o mocy 100 mikrogramów).
Podczas dostosowania dawki należy poinstruować pacjentów, aby stosowali wielokrotność tabletek o mocy 100 mikrogramów i (lub) mocy 200 mikrogramów dla każdej pojedynczej dawki. Jednorazowo nie należy stosować więcej niż cztery (4) tabletki.
W klinicznych badaniach z udziałem pacjentów nie oceniano skuteczności i bezpieczeństwa dawek większych niż 800 mikrogramów.
Aby zminimalizować ryzyko wystąpienia działań niepożądanych związanych z opioidami i określić odpowiednią dawkę, konieczne jest ścisłe monitorowanie pacjentów przez pracowników służby zdrowia podczas procesu dostosowania dawki.
W okresie dostosowania dawki, pacjenci powinni odczekać co najmniej 2 godziny przed rozpoczęciem leczenia kolejnego epizodu bólu przebijającego z zastosowaniem produktu leczniczego Submena.
Leczenie podtrzymujące
Po ustaleniu odpowiedniej dawki, która może być większa niż jedna tabletka, pacjenci powinni stosować tę dawkę i ograniczyć stosowanie do maksymalnie czterech dawek produktu leczniczego Submena na dobę.
W okresie leczenia podtrzymującego, pacjenci powinni odczekać co najmniej 2 godziny przed rozpoczęciem leczenia kolejnego epizodu bólu przebijającego z zastosowaniem produktu leczniczego Submena.
Ponowne dostosowanie dawki
Jeśli odpowiedź (działanie przeciwbólowe lub działania niepożądane) na leczenie ustaloną dawką produktu leczniczego Submena ulegnie wyraźnej zmianie, może być konieczne ponowne dostosowanie dawki, aby osiągnąć dawkę optymalną.
Jeśli występują więcej niż cztery epizody bólu przebijającego na dobę przez okres dłuższy niż cztery kolejne dni, należy ponownie dostosować dawkę długo działających opioidów, stosowanych w bólu przewlekłym. Jeśli dokonano zmiany opioidu o długotrwałym działaniu lub zmieniono jego dawkę, dawka produktu Submena powinna być ponownie oceniona i zmiareczkowana, aby zapewnić pacjentowi przyjmowanie optymalnej dawki.
W przypadku braku odpowiedniej kontroli bólu, należy brać pod uwagę możliwość wystąpienia hiperalgezji, tolerancji i postępu choroby podstawowej (patrz punkt 4.4).
Ponowne dostosowanie dawki każdego leku przeciwbólowego musi odbywać się pod kontrolą lekarza. Przerwanie leczenia
Stosowanie produktu Submena należy przerwać natychmiast, jeśli u pacjenta nie występują już
epizody bólu przebijającego. Leczenie utrzymującego się przewlekłego bólu podstawowego powinno odbywać się zgodnie z zaleceniami lekarza.
Jeśli konieczne jest przerwanie stosowania opioidów, pacjent musi być ściśle monitorowany przez lekarza w celu uniknięcia ryzyka wystąpienia nagłych objawów odstawiennych.
Stosowanie u dzieci i młodzieży
Produktu leczniczego Submena nie należy stosować u pacjentów w wieku poniżej 18 lat z uwagi na brak danych dotyczących bezpieczeństwa i skuteczności.
Stosowanie u osób w podeszłym wieku
Dostosowanie dawki u pacjentów w podeszłym wieku powinno być przeprowadzone z zachowaniem szczególnej ostrożności, a pacjentów należy obserwować pod kątem występowania objawów zatrucia fentanylem (patrz punkt 4.4).
Stosowanie u pacjentów z zaburzeniami czynności nerek i wątroby
W czasie dostosowania dawki, pacjenci z zaburzeniami czynności nerek lub wątroby powinni być ściśle obserwowani pod kątem objawów zatrucia fentanylem (patrz punkt 4.4).
Nadwrażliwość na substancję czynną lub którąkolwiek z substancji pomocniczych wymienionych w punkcie 6.1.
Stosowanie u pacjentów, którzy nie otrzymują podtrzymującego leczenia opioidami z uwagi na podwyższone ryzyko wystąpienia depresji oddechowej.
Ciężka depresja oddechowa lub ciężka choroba obturacyjna płuc. Leczenie ostrego bólu innego niż ból przebijający.
Stosowanie u pacjentów przyjmujących produkty lecznicze zawierające hydroksymaślan sodu.
Należy uprzedzić pacjentów i ich opiekunów, że produkt leczniczy Submena zawiera substancję czynną w ilości zagrażającej życiu dziecka i dlatego tabletki należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Z uwagi na możliwość wystąpienia ciężkich działań niepożądanych podczas stosowania opioidów, takich jak produkt leczniczy Submena, należy uprzedzić pacjentów i ich opiekunów o konieczności przyjmowania produktu Submena dokładnie według wskazań lekarza oraz jakie przedsięwziąć kroki, jeśli wystąpią objawy przedawkowania.
Przed rozpoczęciem leczenia produktem Submena ważne jest, aby ustabilizować długotrwała terapię opioidami mającą na celu kontrolę bólu przewlekłego.
Zaburzenia związane ze stosowaniem opioidów (nadużywanie i uzależnienie)
Tolerancja oraz fizyczne i (lub) psychiczne uzależnienie mogą rozwinąć się w czasie długotrwałego stosowania opioidów takich jak fentanyl. Wiadomo, że po terapeutycznym zastosowaniu opioidów występuje uzależnienie jatrogenne.
Powtarzające się stosowanie produktu Submena może prowadzić do zaburzeń związanych ze stosowaniem opioidów (ang. OUD – Opioid Use Disorder). Nadużywanie lub celowe niewłaściwe zastosowanie produktu leczniczego Submena może spowodować przedawkowanie i (lub) zgon.
Ryzyko wystąpienia OUD jest większe u pacjentów, u których w wywiadzie osobistym lub rodzinnym (rodzice lub rodzeństwo) występują zaburzenia wiązane z używaniem substancji psychoaktywnych (w tym zaburzeń związanych z używaniem alkoholu), u pacjentów, którzy obecnie są palaczami tytoniu lub u pacjentów, u których w wywiadzie stwierdzono inne zaburzenia psychiczne (np. duże epizody depresji, zaburzenia lękowe, zaburzenia osobowości).
Pacjenci będą wymagali monitorowani pod kątem oznak zachowania związanego z poszukiwaniem leku (np. zbyt wczesne prośby o uzupełnienie dawki). Obejmuje to przegląd stosowanych jednocześnie opioidów i leków psychoaktywnych (takich jak benzodiazepiny). W przypadku pacjentów z oznakami i objawami OUD należy rozważyć konsultację ze specjalistą od uzależnień.
Depresja oddechowa
Podobnie jak w przypadku wszystkich opioidów, istnieje ryzyko wystąpienia klinicznie istotnej depresji oddechowej związanej ze stosowaniem produktu Submena. Należy zachować szczególną ostrożność podczas dostosowania dawki produktu Submena u pacjentów z przewlekłą obturacyjną
chorobą płuc lub innymi chorobami predysponującymi do depresji oddechowej (np. miastenia gravis) ze względu na ryzyko dalszej depresji oddechowej, która może prowadzić do niewydolności oddechowej.
Zwiększone ciśnienie wewnątrzczaszkowe
Produkt leczniczy Submena należy podawać z zachowaniem szczególnej ostrożności pacjentom, którzy mogą być szczególnie podatni na wewnątrzczaszkowe działanie hiperkapnii, takich jak pacjenci wykazujący oznaki podwyższonego ciśnienia wewnątrzczaszkowego, ograniczenia świadomości, śpiączki lub guza mózgu. U pacjentów z urazami głowy przebieg kliniczny może być maskowany przez stosowanie opioidów. W takim przypadku opioidy powinny być stosowane tylko w przypadku zdecydowanej konieczności.
Hiperalgezja
Podobnie jak w przypadku innych opioidów, w przypadku niewystarczającej kontroli bólu w odpowiedzi na zwiększoną dawkę fentanylu, należy rozważyć możliwość wystąpienia hiperalgezji wywołanej opioidami. Może być wskazane zmniejszenie dawki fentanylu lub przerwanie leczenia fentanylem lub ponowne rozpatrzenie schematu leczenia.
Choroby serca
Fentanyl może wywoływać bradykardię. Fentanyl należy stosować ostrożnie u pacjentów z przebytą lub zdiagnozowaną wcześnie bradyarytmią.
Osoby w podeszłym wieku, wyniszczone i osłabione
Dane z badań z fentanylem podawanym dożylnie sugerują, że u pacjentów w podeszłym wieku może występować zmniejszony klirens, wydłużony okres półtrwania i mogą być oni bardziej wrażliwi na działanie substancji czynnej niż młodsi pacjenci. Pacjentów w podeszłym wieku, wyniszczonych lub osłabionych należy uważnie obserwować pod kątem objawów toksyczności fentanylu i w razie konieczności zmniejszyć dawkę.
Zaburzenia czynności wątroby lub nerek
Produkt Submena należy podawać z zachowaniem ostrożności pacjentom z zaburzeniami czynności wątroby lub nerek, zwłaszcza w fazie dostosowania dawki. Stosowanie produktu Submena u pacjentów z zaburzeniami czynności wątroby lub nerek może zwiększyć biodostępność fentanylu i zmniejszyć jego klirens ogólnoustrojowy, co może prowadzić do kumulacji oraz nasilenia i wydłużenia działania opioidów.
Hipowolemia i niedociśnienie tętnicze
Należy zachować ostrożność podczas leczenia pacjentów z hipowolemią i niedociśnieniem.
Stosowanie u pacjentów z ranami jamy ustnej lub zapaleniem błony śluzowej
Produkt Submena nie był badany u pacjentów z ranami jamy ustnej lub zapaleniem błony śluzowej. U takich pacjentów może istnieć ryzyko zwiększonej ogólnoustrojowej ekspozycji na lek, dlatego zaleca się szczególną ostrożność podczas dostosowania dawki.
Odstawianie produktu leczniczego Submena
Nie powinny występować zauważalne skutki zaprzestania stosowania produktu Submena, ale możliwe objawy odstawienia to niepokój, drżenie, pocenie się, bladość, nudności i wymioty.
Zespół serotoninowy
Należy zachować ostrożność podczas jednoczesnego stosowania produktu Submena z lekami wpływającymi na serotoninergiczne układy neuroprzekaźnikowe.
Potencjalnie zagrażający życiu zespół serotoninowy może wystąpić podczas jednoczesnego stosowania z lekami serotoninergicznymi, takimi jak selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI) i inhibitory zwrotnego wychwytu serotoniny i noradrenaliny (SNRI), i z lekami,
które zaburzają metabolizm serotoniny (w tym inhibitorami monoaminooksydazy [IMAO]). Może to wystąpić przy zalecanych dawkach.
Zespół serotoninowy może obejmować zmiany stanu psychicznego (np. pobudzenie, omamy, śpiączkę), niestabilność układu autonomicznego (np. tachykardię, wahania ciśnienia tętniczego, hipertermię), zaburzenia nerwowo-mięśniowe (np. hiperrefleksję, zaburzenia koordynacji, sztywność), i (lub) objawy żołądkowo-jelitowe (np. nudności, wymioty, biegunkę).
W razie podejrzenia zespołu serotoninowego należy przerwać leczenie produktem Submena.
Zaburzenia oddychania podczas snu
Opioidy mogą powodować zaburzenia oddychania podczas snu, w tym ośrodkowy bezdech senny (ang. CSA – central sleep apnoea) i hipoksemię podczas snu. Stosowanie opioidów zwiększa ryzyko wystąpienia CSA w sposób zależny od dawki. U pacjentów, u których występuje CSA, należy rozważyć zmniejszenie całkowitej dawki opioidów.
Ryzyko związane z równoczesnym stosowaniem leków uspokajających, takich jak benzodiazepiny lub leki pokrewne
Jednoczesne stosowanie produktu leczniczego Submena i leków uspokajających, takich jak benzodiazepiny lub pokrewne leki, może powodować uspokojenie, depresję oddechową, śpiączkę i zgon. Z tego względu jednoczesne przepisywanie tych leków uspokajających powinno być zarezerwowane dla pacjentów, u których alternatywne opcje leczenia nie są możliwe. Jeśli zostanie podjęta decyzja o przepisaniu produktu leczniczego Submena jednocześnie z lekami uspokajającymi, należy zastosować najniższą skuteczną dawkę, a czas leczenia powinien być jak najkrótszy.
Pacjentów należy ściśle obserwować w celu wykrycia objawów przedmiotowych i podmiotowych depresji oddechowej i uspokojenia. W związku z tym zdecydowanie zaleca się poinformowanie pacjentów i ich opiekunów o tych objawach (patrz punkt 4.5).
Produkt leczniczy Submena zawiera sód
Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) w jednej tabletce, co oznacza, że uznaje się go za „wolny od sodu”.
Jednoczesne stosowanie produktów leczniczych zawierających hydroksymaślan sodu i fentanyl jest przeciwwskazane (patrz punkt 4.3). Leczenie hydroksymaślanem sodu należy przerwać przed rozpoczęciem leczenia produktem Submena.
Fentanyl jest metabolizowany przez CYP3A4. Substancje czynne, które hamują aktywność CYP3A4 takiej , jak antybiotyki makrolidowe (np. erytromycyna), przeciwgrzybicze pochodne azolu (np. ketokonazol, itrakonazol) lub niektóre inhibitory proteazy ( np. rytonawir) mogą zwiększać biodostępność fentanylu poprzez zmniejszenie jego ogólnoustrojowego klirensu, co może prowadzić do nasilenia lub przedłużenia działania opioidów. Sok grapefruitowy jest również znanym inhibitorem CYP3A4. Jednoczesne podawanie z substancjami, które indukują aktywność CYP3A4, takimi jak leki przeciwgruźlicze (np. ryfampina, ryfabutyna), leki przeciwdrgawkowe (np. karbamazepina, fenytoina, fenobarbital), lekami roślinnymi (np. ziele dziurawca zwyczajnego) może zmniejszać skuteczność fentanylu. Induktory CYP3A4 wywierają swoje działanie w sposób zależny od czasu, a osiągnięcie maksymalnego działania po ich wprowadzeniu może trwać co najmniej 2 tygodnie. I odwrotnie, po zaprzestaniu stosowania fentanylu indukcja CYP3A4 może zmniejszyć się po co najmniej 2 tygodniach. Pacjenci otrzymujący fentanyl, którzy przerywają leczenie induktorami CYP3A4 lub zmniejszają ich dawkę, mogą być narażeni na zwiększoną aktywność lub toksyczność fentanylu. Dlatego fentanyl należy podawać pacjentom z zachowaniem ostrożności, jeśli jest podawany jednocześnie z inhibitorami i (lub) induktorami CYP3A4.
Jednoczesne stosowanie innych leków działających depresyjnie na OUN, takich jak inne pochodne morfiny (leki przeciwbólowe i przeciwkaszlowe), leki stosowane do znieczulenia ogólnego, leki
zwiotczające mięśnie szkieletowe, leki przeciwdepresyjne o działaniu uspokajającym, leki przeciwhistaminowe H1 o działaniu uspokajającym, barbiturany, leki anksjolityczne (np. benzodiazepiny), leki nasenne, gabapentynoidy (gabapentyna i pregabalina), leki przeciwpsychotyczne, klonidyna i substancje pokrewne mogą powodować nasilenie działania depresyjnego na OUN, zwiększone ryzyko sedacji, depresji oddechowej, niedociśnienia, śpiączki i zgonu z powodu addytywnego działania depresyjnego na OUN. Dawka i czas trwania jednoczesnego stosowania powinny być ograniczone (patrz punkt 4.4).
Alkohol nasila działanie uspokajające leków przeciwbólowych na bazie morfiny, dlatego nie zaleca się równoczesnego podawania napojów alkoholowych lub produktów leczniczych zawierających alkohol z produktem Submena.
Produkt Submena nie jest zalecany do stosowania u pacjentów, którzy w ciągu 14 dni otrzymywali inhibitory monoaminooksydazy (MAO), ponieważ zgłaszano ciężkie i nieprzewidywalne nasilenie działania opioidowych leków przeciwbólowych podczas stosowania i inhibitorami MAO.
Jednoczesne stosowanie częściowych agonistów/antagonistów opioidowych (np. buprenorfina, nalbufina, pentazocyna) nie jest zalecane. Mają one duże powinowactwo do receptorów opioidowych o stosunkowo małej aktywności wewnętrznej i dlatego częściowo antagonizują przeciwbólowe działanie fentanylu oraz mogą wywoływać objawy odstawienne u pacjentów uzależnionych od opioidów.
Leki serotoninergiczne
Jednoczesne podawanie fentanylu z lekiem serotoninergicznym, takim jak selektywny inhibitor wychwytu zwrotnego serotoniny (SSRI) lub inhibitor zwrotnego wychwytu serotoniny i noradrenaliny (SNRI) lub inhibitor monoaminooksydazy (IMAO), może zwiększać ryzyko wystąpienia zespołu serotoninowego, który potencjalnie zagraża życiu.
Nie ustalono bezpieczeństwa stosowania fentanylu w okresie ciąży. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3). Potencjalne zagrożenie dla człowieka nie jest znane. Fentanyl powinien być stosowany w okresie ciąży wyłącznie, jeśli jest to bezwzględnie konieczne.
Długotrwałe stosowanie w okresie ciąży może powodować zespół odstawienny u noworodka.
Nie należy stosować fentanylu w trakcie porodu (w tym również w trakcie cięcia cesarskiego), ponieważ fentanyl przenika przez łożysko i może powodować depresję oddechową u płodu lub noworodka.
Karmienie piersią
Fentanyl przenika do mleka matki i może powodować uspokojenie polekowe i depresję oddechową u dziecka karmionego piersią. Fentanyl nie powinien być stosowany u kobiet karmiących i nie należy zaczynać ponownego karmienia piersią przynajmniej przez 5 dni po ostatnim podaniu fentanylu.
Nie przeprowadzono badań nad wpływem produktu leczniczego Submena na zdolność prowadzenia pojazdów mechanicznych i obsługiwania maszyn.
Jednak opioidowe leki przeciwbólowe znane są z upośledzania psychicznej i fizycznej sprawności do wykonywania potencjalnie niebezpiecznych czynności takich, jak prowadzenie pojazdów czy obsługiwanie maszyn. Należy pouczyć pacjentów, aby nie prowadzili pojazdów, ani nie obsługiwali maszyn, jeśli podczas stosowania produktu Submena wystąpią u nich zawroty głowy, senność lub zaburzenia widzenia.
Podczas stosowania produktu leczniczego Submena należy się spodziewać działań niepożądanych typowych dla opioidów. Objawy niepożądane mają tendencję do zmniejszania intensywności w miarę wydłużonego stosowania. Najcięższe potencjalne działania niepożądane związane ze stosowaniem opioidów to depresja oddechowa (która może prowadzić do zatrzymania oddychania), niedociśnienie oraz wstrząs.
Badania kliniczne nad produktem Submena zostały zaprojektowane w celu oceny bezpieczeństwa i skuteczności w leczeniu pacjentów z przebijającym nowotworowym; wszyscy pacjenci przyjmowali jednocześnie opioidy, takie jak morfina o przedłużonym uwalnianiu, oksykodon o przedłużonym uwalnianiu lub fentanyl w postaci transdermalnej, w związku z utrzymującym się bólem. Dlatego niemożliwe jest definitywne oddzielenie efektów działania samego produktu leczniczego Submena.
Najczęściej obserwowane działania niepożądane produktu Submena obejmują działania niepożądane typowe dla opioidów takie, jak nudności, zaparcie, senność i ból głowy.
Tabelaryczne zestawienie działań niepożądanych związanych z produktem leczniczym Submena i (lub) innymi związkami zawierającymi fentanyl: W trakcie badań klinicznych oraz na podstawie doświadczeń po wprowadzeniu do obrotu zgłaszano następujące działania niepożądane związane z produktem leczniczym Submena i (lub) innymi związkami zawierającymi fentanyl. Są one wymienione poniżej, według klasyfikacji układów i narządów i częstości występowania (bardzo często (≥ 1/10), często (≥ 1/100 do < 1/10), niezbyt często (≥ 1/1 000 do < 1/100), rzadko (≥ 1/10 000 do < 1/1 000), bardzo rzadko (< 1/10 000) i częstość nieznana (nie może być określona na podstawie dostępnych danych)). W obrębie każdej grupy częstości działania niepożądane są przedstawione w kolejności zmniejszającej się ciężkości.
Klasyfikacja układów i narządów | Działania niepożądane według częstości występowania | |||
Bardzo często (≥ 1/10) | Często (≥ 1/100 to <1/10) | Niezbyt często (≥ 1/1,000 to < 1/100) | Częstość nieznana (nie może być określona na podstawie dostępnych danych) | |
Zaburzenia układu immunologicznego | Nadwrażliwość | |||
Zaburzenia metabolizmu i odżywiania | Jadłowstręt Zmniejszenie apetytu | |||
Zaburzenia psychiczne | Depresja Paranoja Stan splątania Dezorientacja | Omamy Uzależnienie od leku Nadużywanie | ||
Zmiany stanu | leku | |||
psychicznego Lęk | Majaczenie | |||
Nastrój | ||||
euforyczny | ||||
Dysforia Niestabilność | ||||
emocjonalna | ||||
Zaburzenia uwagi Bezsenność | ||||
Zaburzenia układu nerwowego | Zawroty głowy Ból głowy Senność | Amnezja Zaburzenia węchu Zaburzenia smaku Drżenie Letarg Niedoczulica Zaburzenia snu | Drgawki Obniżony poziom świadomości Utrata przytomności | |
Zaburzenia oka | Zamglone widzenie | |||
Zaburzenia serca | Tachykardia Bradykardia | |||
Zaburzenia układu naczyniowego | Niedociśnienie | |||
Zaburzenia oddychania, klatki piersiowej i śródpiersia | Duszność | Ból jamy ustnej i gardła Ucisk w gardle | Depresja oddechowa | |
Zaburzenia żołądka i jelit | Nudności | Zapalenie jamy ustnej Wymioty Zaparcie Suchość w ustach | Owrzodzenie jamy ustnej Owrzodzenie dziąseł Owrzodzenie warg Zaburzenia opróżniania żołądka Ból brzucha Niestrawność Uczucie dyskomfortu w żołądku Zaburzenia języka Aftowe zapalenie jamy ustnej | Obrzęk języka Biegunka |
Zaburzenia skóry i tkanki podskórnej | Nadmierne pocenie się | Zmiany skórne Wysypka Świąd alergiczny Świąd Nocne poty Zwiększona skłonność do powstawania siniaków | Pokrzywka | |
Zaburzenia mięśniowo- szkieletowe i tkanki łącznej | Ból stawów Sztywność mięśniowo- szkieletowa Sztywność |
stawów | ||||
Zaburzenia układu rozrodczego i piersi | Zaburzenia erekcji | |||
Zaburzenia ogólne i stany w miejscu podania | Zmęczenie | Zespół odstawienny* Astenia Złe samopoczucie | Zaczerwienienie twarzy Uderzenia gorąca Obrzęk obwodowy Pyreksja Noworodkowy zespół odstawienny | |
Urazy, zatrucia i powikłania po zabiegach | Przypadkowe przedawkowanie | Upadki |
* w przypadku fentanylu podawanego przezśluzówkowo obserwowano objawy odstawienne związane ze stosowaniem opioidów, takie jak nudności, wymioty, biegunka, niepokój, dreszcze, drżenie i pocenie się
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
tel.: + 48 22 49 21 301
faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy przedawkowania fentanylu są przedłużeniem jego działania farmakologicznego, a najpoważniejszym skutkiem jest depresja oddechowa, która może prowadzić do zatrzymania oddechu. Znane jest również występowanie śpiączki.
Postępowanie w przypadku przedawkowania opioidów w trybie natychmiastowym obejmuje usunięcie z jamy ustnej wszelkich pozostałości tabletek podjęzykowych produktu Submena, fizyczną i słowną stymulację pacjenta oraz ocenę poziomu świadomości. Należy zapewnić i utrzymać drożność dróg oddechowych. W razie konieczności należy założyć rurkę ustno- gardłową lub wewnątrztchawiczną, podać tlen oraz rozpocząć mechaniczną wentylację. Należy utrzymać odpowiednią temperaturę ciała i pozajelitowo podawać płyny.
W leczeniu przypadkowego przedawkowania u osób nieleczonych wcześniej opioidami należy stosować nalokson lub innych antagonistów opioidów, zgodnie ze wskazaniami klinicznymi i Charakterystyką Produktu Leczniczego. Powtórne podanie antagonisty opioidowego może być konieczne, jeśli czas trwania depresji oddechowej wydłuża się.
Należy zachować ostrożność podczas stosowania naloksonu lub innych antagonistów opioidów w leczeniu przedawkowania u pacjentów leczonych opioidami, ze względu na ryzyko wystąpienia ostrego zespołu odstawiennego.
W przypadku wystąpienia ciężkiego lub utrzymującego się niedociśnienia tętniczego należy rozważyć hipowolemię, a stan ten należy opanować za pomocą odpowiedniej płynoterapii pozajelitowej.
Podczas stosowania fentanylu i innych opioidów zgłaszano występowanie sztywności mięśni utrudniającej oddychanie. W takim przypadku może być konieczne wykonanie intubacji dotchawiczej, wspomaganej wentylacji i podanie antagonistów opioidów oraz leków zwiotczających mięśnie.
W przypadku przedawkowania fentanylu, szczególnie u pacjentów z niewydolnością serca w wywiadzie, obserwowano przypadki wystąpienia oddechu Cheyne'a Stokesa.
Grupa farmakoterapeutyczna: leki przeciwbólowe; opioidy; pochodne fenylopiperydyny kod ATC: N02AB03
Fentanyl jest silnym μ-opioidowym lekiem przeciwbólowym o szybkim początku analgezji i krótkim czasie działania. Fentanyl jest około 100-krotnie silniejszym analgetykiem niż morfina. Drugorzędne działanie fentanylu na ośrodkowy układ nerwowy (OUN), czynność układu oddechowego i żołądkowo-jelitowego jest typowe dla opioidowych leków przeciwbólowych i jest uważane za działanie klasyczne. Działania te obejmować depresję oddechową, bradykardię, hipotermię, zaparcia, zwężenie źrenic, uzależnienie fizyczne i euforię.
Przeciwbólowe działanie fentanylu związane jest z jego stężeniem we krwi; u pacjentów nie przyjmujących opioidów minimalne skuteczne przeciwbólowe stężenie fentanylu w surowicy wynosi 0,3-1,2 ng/ml, natomiast stężenie we krwi wynoszące 10-20 ng/ml powoduje znieczulenie chirurgiczne i głęboką depresję oddechową.
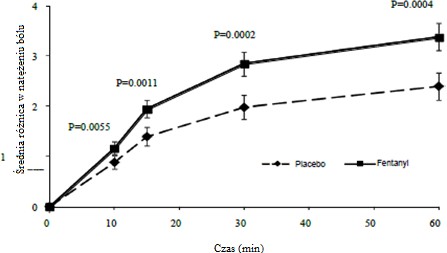
U pacjentów z przewlekłym bólem nowotworowym, przyjmujących stabilne dawki podtrzymujące opioidów, zaobserwowano statystycznie istotną poprawę różnicy w natężeniu bólu w przypadku stosowania produktu leczniczego Submena w porównaniu z placebo, począwszy od 10 minuty po podaniu (patrz ryc. 1 poniżej), z istotnie mniejszym zapotrzebowaniem na ratunkowe leczenie przeciwbólowe.
Ryc.1 Średnia różnica w natężeniu bólu od wartości wyjściowej (±SE) dla produktu Submena w porównaniu z placebo (mierzona w skali Lickerta 0-10)
Bezpieczeństwo i skuteczność produktu Submena oceniano u pacjentów przyjmujących lek na początku epizodu bólu przebijającego. W badaniach klinicznych nie badano prewencyjnego stosowania produktu Submena w przypadku przewidywalnych epizodów bólowych.
Fentanyl, podobnie jak wszyscy agoniści receptorów μ-opioidowych, wywołuje zależną od dawki depresję oddechową. Ryzyko to jest większe u osób nie przyjmujących opioidów niż u pacjentów odczuwających silny ból lub przewlekle leczonych opioidami. Długotrwałe leczenie opioidami prowadzi zwykle do rozwoju tolerancji na ich wtórne działanie.
Chociaż opioidy ogólnie zwiększają napięcie mięśni gładkich dróg moczowych, efekt netto jest zmienny, w niektórych przypadkach powodując parcie na mocz, a w innych trudności w oddawaniu moczu.
Opioidy zwiększają napięcie i zmniejszają skurcze propulsywne mięśni gładkich przewodu pokarmowego, prowadząc do wydłużenia czasu pasażu żołądkowo-jelitowego, co może być powodem zapierającego działania fentanylu.
Opioidy mogą wpływać na oś podwzgórze-przysadka-nadnercza lub oś podwzgórze-przysadka - gonada. Niektóre zmiany, które można zaobserwować, obejmują zwiększenie stężenia prolaktyny w surowicy oraz zmniejszenie stężenia kortyzolu i testosteronu w osoczu. Kliniczne objawy przedmiotowe i podmiotowe mogą wynikać z tych zmian hormonalnych.
Wchła nianie Fentan yl ma silne właści wości lipofil ne i jest bardzo szybk o wchła niany przez
błony śluzowe jamy ustnej oraz wolniej z przewodu pokarmowego. Po podaniu doustnym jest w znaczącym stopniu metabolizowany podczas pierwszego przejścia przez wątrobę i jelita.
Dystrybucja
Produkt leczniczy Submena jest szybko rozpuszczającą się postacią tabletki podjęzykowej. Szybkie wchłanianie fentanylu następuje w ciągu około 30 minut po podaniu produkt Submena. Bezwzględna biodostępność produktu Submena została wynosi 54%. Średnie maksymalne stężenia fentanylu w osoczu wynoszą od 0,2 do 1,3 ng/ml (po podaniu od 100 do 800 μg produktu Submena) i są osiągane w ciągu 22,5 do 240 minut.
Około 80-85% fentanylu jest wiązane z białkami osocza, głównie z α1-glikoproteiną i w mniejszym stopniu z albuminami i lipoproteinami. Objętość dystrybucji fentanylu w stanie stacjonarnym wynosi około 3-6 l/kg.
Metabolizm
Fentanyl jest metabolizowany głównie przez CYP3A4 do szeregu farmakologicznie nieaktywnych metabolitów, w tym norfentanylu. W ciągu 72 godzin po dożylnym podaniu fentanylu, około 75% dawki jest wydalane z moczem, głównie w postaci metabolitów, a mniej niż 10% w postaci niezmienionego leku. Około 9% dawki jest odzyskiwane z kałem, głównie w postaci metabolitów. Całkowity klirens osoczowy fentanylu wynosi około 0,5 l/h/kg.
Eliminacja
Po podaniu produktu Submena, główny okres półtrwania eliminacji fentanylu wynosi około 7 godzin (zakres 3-12,5 godziny), a końcowy okres półtrwania wynosi około 20 godzin (zakres 11,5-25 godzin).
Wykazano, że farmakokinetyka produktu Submena jest proporcjonalna do dawki w zakresie dawek od 100 do 800 μg. Badania farmakokinetyczne wykazały, że wielokrotne podanie tabletki jest biorównoważne w stosunku do pojedynczych tabletek o takiej samej mocy.
Zaburzenia czynności wątroby i (lub) nerek
Zaburzona czynność wątroby lub nerek może powodować zwiększenie stężenia w surowicy. Pacjenci w podeszłym wieku, wyniszczeni lub ogólnie osłabieni mogą mieć mniejszy klirens fentanylu, co może powodować wydłużenie końcowego okresu półtrwania związku (patrz punkty 4.2 i 4.4).
Dane dotyczące farmakologii bezpieczeństwa i toksyczności po podaniu wielokrotnym nie ujawniają żadnego szczególnego zagrożenia dla ludzi, które nie byłoby już ujęte w innych sekcjach niniejszej Charakterystyki Produktu Leczniczego. Badania na zwierzętach wykazały zmniejszoną płodność i zwiększoną śmiertelność płodów szczurów. Nie wykazano jednak działania teratogennego.
Badania mutagenności u bakterii i gryzoni dały wyniki negatywne. Podobnie jak inne opioidy, fentanyl wykazywał działanie mutagenne in vitro w komórkach ssaków. Ryzyko mutagenne przy stosowaniu terapeutycznym wydaje się mało prawdopodobne, ponieważ działanie to było wywoływane tylko w bardzo dużych stężeniach.
Badania dotyczące rakotwórczości (26-tygodniowy alternatywny skórny test biologiczny na transgenicznych myszach Tg.AC; dwuletnie badanie podskórnej rakotwórczości u szczurów) fentanylu nie ujawniły żadnych wyników wskazujących na onkogenny potencjał. Ocena preparatów histologicznych mózgu z badania rakotwórczości u szczurów wykazała zmiany w mózgu u zwierząt, którym podawano duże dawki cytrynianu fentanylu. Znaczenie tych obserwacji dla ludzi jest nieznane.
Mannitol
Celuloza mikrokrystaliczna Krzemionka koloidalna bezwodna Kroskarmeloza sodowa
Magnezu stearynian
Nie dotyczy.
3 lata
Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią.
Brak specjalnych zaleceń dotyczących temperatury przechowywania produktu leczniczego.
Produkt Submena, tabletki podjęzykowe jest pakowany w blistry jednodawkowe z folii PA/Aluminium/PVC/Aluminium/PET z zabezpieczeniem przed dostępem dzieci, umieszczone w tekturowym pudełku.
Produkt Submena, 100 mikrogramów, tabletki podjęzykowe jest dostępny w opakowaniach zawierających blistry jednodawkowe: 5 x 1 tabletka, 10 x 1 tabletka i 30 x 1 tabletka.
Produkt Submena, 200 mikrogramów, tabletki podjęzykowe jest dostępny w opakowaniach zawierających blistry jednodawkowe: 5 x 1 tabletka, 10 x 1 tabletka i 30 x 1 tabletka.
Produkt Submena, 400 mikrogramów, tabletki podjęzykowe jest dostępny w opakowaniach zawierających blistry jednodawkowe: 5 x 1 tabletka, 10 x 1 tabletka i 30 x 1 tabletka.
Produkt Submena, 800 mikrogramów, tabletki podjęzykowe jest dostępny w opakowaniach zawierających blistry jednodawkowe: 5 x 1 tabletka, 10 x 1 tabletka i 30 x 1 tabletka.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
G.L. Pharma GmbH Schlossplatz 1
8502 Lannach Austria
Submena, 100 mikrogramów, tabletki podjęzykowe: 27021
Submena, 200 mikrogramów, tabletki podjęzykowe: 27022
Submena, 400 mikrogramów, tabletki podjęzykowe: 27023
Submena, 800 mikrogramów, tabletki podjęzykowe: 27024
11.04.2022
17.08.2022











