Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przed zakropleniem produktu leczniczego należy dokładnie umyć/oczyścić ręce.
Otworzyć aluminiową saszetkę zawierającą pojemniki jednodawkowe.
Sprawdzić, czy pojemnik jednodawkowy jest nienaruszony.
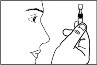
Oderwać jeden pojemnik jednodawkowy z paska i włożyć nieotwarte pojemniki z powrotem do saszetki.
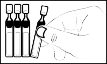
Pojemnik jednodawkowy otworzyć, przekręcając górną część, bez pociągania. Nie dotykać końcówki pojemnika po otwarciu.
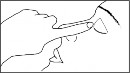
Delikatnie ścisnąć pojemnik jednodawkowy, tak aby wycisnąć jedną kroplę do chorego oka. Nie dotykać końcówką pojemnika jednodawkowego oka, powieki ani żadnej innej powierzchni, aby uniknąć zanieczyszczenia.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
podrażnienie oka
przekrwienie spojówki
wysypka na powiece
obrzęk powieki
świąd oka
Zaburzenia układu immunologicznego:
nadwrażliwość
pokrzywka
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Netenax, 3 mg/ml, krople do oczu, roztwór w pojemniku jednodawkowym
1 ml roztworu zawiera 3 mg netylmycyny (w postaci netylmycyny siarczanu). Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Krople do oczu, roztwór w pojemniku jednodawkowym.
Przezroczysty, bezbarwny lub jasnożółty roztwór, praktycznie wolny od cząstek stałych. pH: 6,5 – 7,5
Osmolalność: 0,274 – 0,306 osmol/kg
Produkt leczniczy Netenax jest wskazany w leczeniu zewnętrznych zakażeń oka i jego przydatków, wywołanych przez bakterie wrażliwe na netylmycynę.
Należy brać pod uwagę oficjalne zalecenia dotyczące właściwego stosowania środków przeciwbakteryjnych.
Dawkowanie
Jedna dawka to jedna lub dwie krople podawane do worka spojówkowego chorego oka trzy razy dziennie lub wedle zaleceń lekarza.
Dzieci i młodzież
Nie określono bezpieczeństwa stosowania ani skuteczności produktu leczniczego Netenax 3 mg/ml krople do oczu, roztwór u dzieci (poniżej 12 lat) ani u młodzieży (do 18 lat).
Sposób podawania

W zmniejszeniu ogólnoustrojowego wchłaniania leku może pomóc uciśnięcie woreczka łzowego przy przyśrodkowym kącie oka przez jedną minutę w trakcie podawania leku i po jego zakropleniu. (Uniemożliwia to przedostawanie się kropli przez przewód nosowo-łzowy do odznaczającego się dużą chłonnością rozległego obszaru śluzówki nosa i gardła).
Czas trwania leczenia
Czas trwania leczenia wynosi zazwyczaj 5 dni. Lekarz może zalecić dłuższe leczenie w przypadku opornych lub powikłanych zakażeń.
Nadwrażliwość na substancję czynną, antybiotyki aminoglikozydowe lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
U pacjentów otrzymujących ogólnoustrojowe leczenie antybiotykami aminoglikozydowymi obserwowano ciężkie działania niepożądane, obejmujące neurotoksyczność, ototoksyczność i nefrotoksyczność. Należy zachować ostrożność podczas jednoczesnego stosowania produktu leczniczego z ogólnoustrojowymi antybiotykami aminoglikozydowymi (patrz punkt 4.5).
Długotrwałe stosowanie miejscowych antybiotyków może powodować nadmierne namnażanie się drobnoustrojów opornych. W przypadku braku klinicznej poprawy w ciągu stosunkowo krótkiego czasu lub w razie wystąpienia podrażnienia lub nadwrażliwości, należy przerwać stosowanie produktu leczniczego i wdrożyć odpowiednie leczenie.
Produkt leczniczy Netenax nie jest przeznaczony do wstrzykiwań, a zatem nie należy go wstrzykiwać podspojówkowo ani wprowadzać do komory przedniej oka.
Podczas powierzchniowego zakażenia oka nie zaleca się noszenia soczewek kontaktowych.
Dzieci i młodzież
Nie zaleca się stosowania produktu leczniczego Netenax u dzieci i młodzieży (patrz punkt 4.2).
Nie zgłaszano istotnych interakcji farmakologicznych w przypadku stosowania produktu leczniczego Netenax.
Jednoczesne podawanie innych potencjalnie nefrotoksycznych i ototoksycznych antybiotyków, nawet miejscowe, a w szczególności dojamowe, może zwiększać ryzyko wystąpienia takich działań.
Jednoczesne lub następcze stosowanie następujących leków nefrotoksycznych i antybiotyków aminoglikozydowych może zwiększać ryzyko nefrotoksyczności, w związku z czym należy go unikać: cisplatyna, polimyksyna B, kolistyna, wiomycyna, streptomycyna, wankomycyna, inne antybiotyki aminoglikozydowe i niektóre cefalosporyny (cefaloridyna) lub silnie działające leki moczopędne, takie jak kwas etakrynowy i furosemid ze względu na ich działanie na nerki.
W warunkach in vitro skojarzenie aminoglikozydu z antybiotykiem beta-laktamowym (z grupy penicylin lub cefalosporyn) może powodować wzajemną i istotną inaktywację. U pacjentów z niewydolnością nerek oraz u niektórych pacjentów z prawidłową czynnością nerek dochodziło do zmniejszenia okresu półtrwania lub stężenia aminoglikozydu w osoczu, nawet w przypadku podania antybiotyku aminoglikozydowego i penicylinowego dwoma różnymi drogami.
Pacjentów należy poinformować, że w przypadku stosowania więcej niż jednego okulistycznego produktu leczniczego należy zachować co najmniej 5-minutową przerwę pomiędzy poszczególnymi lekami. Maści do oczu należy stosować w ostatniej kolejności.
Ciąża
Mimo że badania przedkliniczne nie wykazały toksycznego działania na płód w przypadku miejscowego stosowania netylmycyny ze względu na niskie ogólnoustrojowe wchłanianie produktu, w okresie ciąży produkt należy stosować wyłącznie po starannym rozważeniu korzyści i ryzyka i pod ścisłą kontrolą lekarza.
Karmienie piersią
Stosowanie produktu leczniczego Netenax nie jest zalecane w okresie karmienia piersią, ponieważ antybiotyki aminoglikozydowe przenikają do mleka ludzkiego w niewielkich ilościach.
Płodność
Brak danych dotyczących wpływu produktu leczniczego Netenax na płodność człowieka.
Stosowanie kropli do oczu może powodować przemijające niewyraźne widzenie. W przypadku wystąpienia niewyraźnego widzenia, pacjenci nie powinni prowadzić pojazdów ani obsługiwać maszyn, dopóki nie wróci ostrość widzenia.
Zgłaszane działania niepożądane przedstawiono poniżej zgodnie z klasyfikacją układów i narządów MedDRA. Brak wystarczających danych umożliwiających określenie częstości występowania poszczególnych działań wymienionych poniżej (częstość nieznana).
Zaburzenia oka:
Epizody podrażnienia i nadwrażliwości oka spowodowane przez produkt leczniczy Netenax są łagodne i przemijające.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, PL-02-222 Warszawa, Tel.:+ 48 22 49 21 301, Faks: +
48 22 49 21 309 , strona internetowa: https://smz.ezdrowie.gov.plDziałania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie zgłaszano przypadków przedawkowania.
Grupa farmakoterapeutyczna: leki przeciwzakaźne, antybiotyki, kod ATC: S01AA23
Netylmycyna jest półsyntetycznym antybiotykiem aminoglikozydowym o szerokim spektrum działania. Wykazano, że jest skuteczna, w niskim stężeniu, przeciwko różnym bakteriom chorobotwórczym, Gram- dodatnim i Gram-ujemnym, w tym przeciwko szczepom opornym na gentamycynę. Ten antybiotyk, w przeciwieństwie do gentamycyny, nie jest podatny na działanie inaktywujące enzymów bakteryjnych odpowiadających za fosforylację i adenylację.
Netylmycyna odznacza się szybkim działaniem bakteriobójczym poprzez indukowanie mistranslacji w kodzie genetycznym mRNA, wprowadzając w ten sposób nieprawidłowe aminokwasy do wydłużającego się łańcucha polipeptydowego.
Występowanie oporności może różnić się w zależności od obszaru geograficznego oraz od czasu w odniesieniu do wybranych gatunków drobnoustrojów, dlatego wskazane jest uzyskanie lokalnych informacji na temat oporności, szczególnie w przypadku leczenia ciężkich zakażeń. Poniższe informacje stanowią jedynie ogólne dane na temat prawdopodobnej wrażliwości drobnoustrojów na netylmycynę w produkcie leczniczym Netenax.
Definicje wartości granicznych, na podstawie których poszczególne izolowane szczepy określa się jako wrażliwe lub oporne, są przydatne przy przewidywaniu skuteczności klinicznej antybiotyków podawanych ogólnoustrojowo. Kiedy antybiotyk jest podawany w bardzo dużym stężeniu miejscowo, bezpośrednio w miejscu zakażenia, definicje te mogą nie mieć zastosowania. W przypadku większości izolowanych szczepów, które należałoby zaklasyfikować jako oporne wg wartości granicznych przy stosowaniu ogólnoustrojowym leczenie miejscowe jest skuteczne.
Oporność na antybiotyki aminoglikozydowe może dotyczyć do 50% bakterii z rodzaju Staphylococcus w niektórych krajach europejskich.
Tabela 1 Kliniczne wartości graniczne MIC związane z określonym gatunkiem drobnoustrojów dla netylmycyny (EUCAST 2017)
Drobnoustrój | Kliniczne wartości graniczne MIC (mg/l) | ||
S () | R () | ECOFF | |
Enterobacteriaceae | 2 | 4 | 2 |
Pseudomonas | 4 | 4 | 4 |
Acinetobacter | 4 | 4 | NR |
Staphylococcus | 1 | 1 | 1 |
Staphylococcus, koagulazo-ujemne | 1 | 1 | NR |
Enterococcus | IE | IE | NR |
Streptococcus A, B, C i G | NR | NR | NR |
Streptococcus pneumoniae | NR | NR | NR |
Streptococcus spp. grupa viridans | NR | NR | NR |
Haemophilus influenzae | IE | IE | NR |
Moraxella catarrhalis | IE | IE | NR |
Neisseria gonorrhea | NR | NR | NR |
Neisseria meningitidis | NR | NR | NR |
Beztlenowe bakterie Gram-dodatnie z wyjątkiem Clostridium difficile | NR | NR | NR |
Beztlenowe bakterie Gram-ujemne | NR | NR | NR |
Wartość graniczna niezwiązana z określonym gatunkiem drobnoustrojów | 2 | 4 | NR |
Uwaga: S = wrażliwy, R = oporny, ECOFF = epidemiologiczna wartość graniczna do oceny oporności, IE = istnieje zbyt mało dowodów potwierdzających, że lek wykazuje aktywność wobec tej grupy drobnoustrojów NR = niezgłaszane | |||
Badania in vitro wykazały aktywność netylmycyny przeciwko większości szczepów powszechnie występujących drobnoustrojów chorobotwórczych wywołujących zakażenie oka oraz bakterii flory skórnej. W Tabeli 2 przedstawiono poziomy oporności na netylmycynę dotyczące 767 bakterii izolowanych z próbek materiału klinicznego z oka, pobranych we Francji (FR), Niemczech (DE), Włoszech (IT) Polsce (PL), Słowacji (SK), Hiszpanii (ES) i Wielkiej Brytanii (UK). Przedstawiono w ten sposób ogólny poziom oporności bakterii powszechnie występujących w oku na ten antybiotyk.
Tabela 2 Dane dot. oporności na netylmycynę na podstawie badań in vitro bakterii izolowanych w UE
Wrażliwy | Średniowrażliw y | Oporny | MIC50 (µg/ml) | MIC90 (µg/ml) | ||||
Drobnoustrój | [n] | [%] | [n] | [%] | [n] | [%] | ||
S. aureus | 252 | 100 | 0 | 0 | 0 | 0 | 0,25 | 0,5 |
S. aureus (koagulazo- ujemny) | 302 | 96,5 | 10 | 3,2 | 1 | 0,3 | 0,06 | 4 |
S. epidermidis | 216 | 95,6 | 9 | 4 | 1 | 0,4 | 0,05 | 4 |
S. pneumoniae | 4 | 8 | ||||||
H. influenzae | 0,25 | 0,5 | ||||||
Ps. aeruginosa | 39 | 100 | 0 | 0 | 0 | 0 | 4 | 4 |
Inne informacje:
Oporność krzyżowa pomiędzy antybiotykami aminoglikozydowymi (takimi jak gentamycyna, tobramycyna i netylmycyna) jest związana ze swoistością enzymów modyfikujących, adenylotransferazy (ANT) oraz acetylotransferazy (ACC). Oporność krzyżowa różni się jednak pomiędzy antybiotykami aminoglikozydowymi w zależności od swoistości poszczególnych enzymów modyfikujących.
Najczęstszy mechanizm nabytej oporności na aminoglikozydy stanowi inaktywacja antybiotyku przez plazmid i enzymy modyfikujące kodowane przez transpozony.
Po podaniu produktu leczniczego Netenax do worka spojówkowego spodziewane jest niskie wchłanianie miejscowe i ogólnoustrojowe.
Największe stężenie netylmycyny w osoczu wynoszące 5 g/ml osiąga się w ciągu 30-60 minut po wstrzyknięciu domięśniowym dawki 2 mg/ml. Po podaniu w drodze infuzji dożylnej w ciągu 60 minut stężenie w osoczu wynosi około 11 g/ml. Okres półtrwania wynosi zwykle od 2 do 2,5 godziny u osób dorosłych i ulega wydłużeniu w przypadku osób z niewydolnością nerek.
W badaniach nieklinicznych nie stwierdzono szczególnego zagrożenia dla człowieka w oparciu o badania przeprowadzone na szczurach, psach, świnkach morskich, świniach, kotach, królikach i małpach.
Dawka śmiertelna LD50 w podaniu domięśniowym i dootrzewnowym wynosi odpowiednio 142 i 186 mg/kg u myszy, 166 i 266 mg/kg u szczurów oraz 160 < LD50 < 200 domięśniowo i
40 < LD50 < 72 dożylnie u psów.
Sodu chlorek
Sodu wodorotlenek (do ustalenia pH) Woda oczyszczona
Nie dotyczy.
Nieotwarte opakowanie: 2 lata.
Pojemnik jednodawkowy należy zużyć niezwłocznie po otwarciu; resztę produktu należy wyrzucić.
Nie przechowywać w temperaturze powyżej 25°C.
Pojemniki jednodawkowe przechowywać w oryginalnej saszetce aluminiowej w celu ochrony przed światłem.
15 pojemników jednodawkowych z LDPE zawierających 0,3 ml kropli do oczu, roztworu, w tekturowym pudełku..
20 pojemników jednodawkowych z LDPE zawierających 0,3 ml kropli do oczu, roztworu, w tekturowym pudełku..
Każdy z zestawów 5 pojemników jednodawkowych umieszczony jest w saszetce aluminiowej. Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wszelkie niewykorzystane resztki antybiotyku lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
SIFI S.p.A.
Via Ercole Patti 36
95025 Aci S. Antonio (CT) Włochy
26411
2021-05-17
2022-08-17











