Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwskazania
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Układowe zakażenia grzybicze; układowe zakażeniai, chyba że zastosowano swoistą terapię przeciwzakażeniową.
Wstrzyknięcie dostawowe jest przeciwwskazane w przypadkach:
zakażenia w obrębie lub w bezpośrednim sąsiedztwie stawu wymagającego leczenia;
bakteryjnego zapalenia stawów;
niestabilności stawu wymagającego leczenia;
skłonności do krwawień (samoistnej lub spowodowanej przez leki przeciwzakrzepowe);
zwapnienia okołostawowego;
pozanaczyniowej martwicy kości;
zerwania ścięgna;
stawu Charcota.
Podanie nasiękowe bez dodatkowego leczenia przyczynowego jest przeciwwskazane w przypadku występowania zakażeń w miejscu podania.
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Od około 8 tygodni przed i do 2 tygodni po profilaktycznych szczepieniach z użyciem żywych szczepionek: Przebieg chorób wirusowych może być szczególnie ciężki u pacjentów leczonych deksametazonem. Szczególnie zagrożone są dzieci z upośledzoną odpornością (z obniżoną odpornością), a także osoby, które jeszcze nie chorowały na odrę lub ospę wietrzną.
W przypadku kontaktu takich osób z osobami chorymi na odrę lub ospę wietrzną podczas
leczenia deksametazonem należy natychmiast skonsultować się z lekarzem prowadzącym, który w razie potrzeby może zastosować leczenie zapobiegawcze. Zobacz także „Szczepienia” poniżej.
Osteoporoza: W zależności od dawkowania i czasu trwania leczenia należy spodziewać się
negatywnego wpływu na metabolizm wapnia; stąd konieczne jest dodatkowe podawanie wapnia i zaleca się witaminę D. Należy rozważyć dodatkowe leczenie u pacjentów z istniejącą
wcześniej osteoporozą. U pacjentów z ciężką osteoporozą stosować tylko w sytuacjach zagrażających życiu lub przez krótkie okresy. U pacjentów w podeszłym wieku należy
przeprowadzić szczegółową analizę korzyści/ryzyka oraz trzeba zachować czujność pod kątem działań niepożądanych, takich jak osteoporoza.
Cukrzyca: Nadzór kliniczny i dostosowanie leczenia przeciwcukrzycowego.
Wywiad psychiatryczny, w tym ryzyko samobójstwa (zarówno w przeszłości lub obecnie): Proponowany jest nadzór neurologiczny lub psychiatryczny.
Zaburzenia czynności nerek: Jednoczesne skuteczne leczenie choroby podstawowej i ciągłe monitorowanie.
Myasthenia gravis: możliwe jest początkowe nasilenie objawów po podaniu kortykosteroidów; stąd staranny i ostrożny dobór dawki początkowej.
Zaburzenia żołądka i jelit
U pacjentów z wrzodami przewodu pokarmowego, wskazane jest jednoczesne leczenie lekami przeciwwrzodowymi, a także uważna obserwacja (w tym monitorowanie rentgenowskie lub gastroskopia).
Ze względu na ryzyko perforacji jelita, fosforan deksametazonu może być stosowany wyłącznie w ścisłych wskazaniach i pod odpowiednią kontrolą, u pacjentów z:
ciężkim wrzodziejącym zapaleniem jelita grubego z ryzykiem perforacji,
powstawanie ropni lub zakażenia ropne,
zapaleniem uchyłków,
zespoleniem jelitowo-jelitowym (bezpośrednio po operacji).
możliwa miejscowa nietolerancja i wyniszczenie tkanek (zanik tkanki tłuszczowej i mięśni);
niedokładność w dawkowaniu: początkowo zbyt duża dawka, później niewystarczające działanie.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Dexamethasone Kalceks, 4 mg/mL, roztwór do wstrzykiwań/do infuzji
Każda 1 mL ampułka zawiera deksametazonu sodu fosforan, w ilości odpowiadającej 4 mg deksametazonu fosforanu.
Każda 2 mL ampułka zawiera deksametazonu sodu fosforan, w ilości odpowiadającej 8 mg deksametazonu fosforanu.
Substancja pomocnicza o znanym działaniu Każdy mL roztworu zawiera około 3 mg sodu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań/do infuzji.
Przezroczysty, bezbarwny roztwór, wolny od widocznych cząstek. pH roztworu wynosi od 7,0 do 8,5
Osmolalność 270 do 310 mOsmol/kg.
Dawkowanie
Dawkowanie zależy od nasilenia objawów patologicznych, indywidualnej odpowiedzi pacjenta oraz od wielkości stawu podczas stosowania dostawowego.
Glikokortykosteroidy należy stosować tylko tak długo – i tylko w tak małych dawkach – jak jest to absolutnie konieczne do osiągnięcia i utrzymania pożądanego działania.
W przypadku, gdy wymagane jest podawanie dużych dawek jednorazowo, należy rozważyć
zastosowanie produktu leczniczego zawierającego deksametazon o większej mocy na jednostkę objętości.
Ostra niewydolność kory nadnerczy
Nagłe przerwanie leczenia, które trwało dłużej niż 10 dni, może spowodować rozwój ostrej
niewydolności kory nadnerczy. W związku z tym dawkę należy powoli zmniejszać, jeśli planowane
jest przerwanie leczenia. W zależności od dawki i czasu trwania leczenia, niewydolność kory nadnerczy spowodowana terapią glikokortykosteroidami może utrzymywać się przez kilka miesięcy, a w indywidualnych przypadkach nawet przez ponad rok po zakończeniu leczenia.
Jeśli w trakcie leczenia wystąpią szczególne sytuacje stresu fizycznego (np. wypadek, zabieg chirurgiczny, poród) może być konieczne tymczasowe zwiększenie dobowej dawki fosforanu deksametazonu. Podawanie glikokortykosteroidów może być również wymagane w sytuacjach stresu fizycznego, jeśli niewydolność kory nadnerczy utrzymuje się po zakończeniu leczenia.
Ryzyko zakażeń bakteryjnych, wirusowych, grzybiczych, pasożytniczych i oportunistycznych
Leczenie fosforanem deksametazonu, ze względu na działanie immunosupresyjne może prowadzić do wzrostu ryzyka zakażeń bakteryjnych, wirusowych, grzybiczych, pasożytniczych i oportunistycznych. Objawy istniejącego lub rozwijającego się zakażenia mogą być maskowane, co utrudnia diagnozę.
Szczególna ostrożność jest wymagana w ostrych zakażeniach wirusowych (wirusowe zapalenie wątroby typu B, Herpes zoster, Herpes simplex, Varicella, opryszczkowe zapalenie rogówki).
W przypadku ostrych i przewlekłych zakażeń bakteryjnych należy zastosować celowaną antybiotykoterapię.
Utajone zakażenia, takie jak gruźlica lub wirusowe zapalenie wątroby typu B, mogą ulec reaktywacji. U pacjentów z gruźlicą w wywiadzie, deksametazon należy stosować wyłącznie z profilaktyką gruźlicy.
W przypadku grzybic układowych należy jednocześnie zastosować leczenie przeciwgrzybicze. W przypadku niektórych chorób pasożytniczych (zakażenie amebą, nicieniami) należy stosować jednocześnie terapię przeciwpasożytniczą. U pacjentów z rozpoznaną lub podejrzewaną infekcją owsików glikokortykosteroidy mogą prowadzić do jej aktywacji i proliferacji.
Jednoczesne stosowanie kortykosteroidów
Nie należy odstawiać kortykosteroidów ogólnoustrojowych u pacjentów, którzy są już leczeni kortykosteroidami ogólnoustrojowymi (doustnymi) z innych powodów (np. pacjenci z przewlekłą obturacyjną chorobą płuc), ale nie wymagają suplementacji tlenem.
Przełom w postaci guza chromochłonnego
Po podaniu ogólnoustrojowych kortykosteroidów zgłaszano przełom w postaci guza
chromochłonnego, który może być śmiertelny. Kortykosteroidy powinny być podawane wyłącznie pacjentom z podejrzeniem lub rozpoznaniem guza chromochłonnego nadnerczy po przeprowadzeniu odpowiedniej oceny stosunku ryzyka do korzyści.
Szczególna ostrożność jest wskazana w następujących sytuacjach:
Oznaki podrażnienia otrzewnej po perforacji przewodu pokarmowego mogą nie wystąpić u pacjentów otrzymujących duże dawki glikokortykosteroidów.
Ryzyko zaburzeń ścięgien
Ryzyko zaburzeń ścięgien, zapalenia ścięgna i zerwania ścięgna wzrasta po jednoczesnym stosowaniu doustnych fluorochinolonów i kortykosteroidów.
Szczepienia
Zasadniczo, szczepienia z użyciem szczepionek inaktywowanych są możliwe. Jednakże należy pamiętać, że w przypadku podawania dużych dawek kortykosteroidów odpowiedź immunologiczna i w konsekwencji skuteczność szczepienia może być osłabiona.
Ryzyko reakcji anafilaktycznych
Mogą wystąpić ciężkie reakcje anafilaktyczne.
Terapia długotrwała
W terapii długotrwałej, wskazane są regularne kontrole lekarskie (w tym kontrole okulistyczne
w odstępach trzymiesięcznych); po stosunkowo dużych dawkach należy zachować ostrożność, aby zapewnić odpowiednią podaż potasu i ograniczenie sodu, a także monitorować stężenie potasu
w surowicy.
Ciąża
Kobiety powinny powiadomić lekarza prowadzącego, jeśli są w ciąży lub zajdą w ciążę.
Zaburzenia serca i naczyniowe
Wskazana jest uważna obserwacja pacjentów z ciężką niewydolnością serca.
W przypadku trudnego do kontrolowania nadciśnienia tętniczego, konieczne jest skojarzone leczenie hipotensyjne i regularna kontrola. Bradykardia może wystąpić po dużych dawkach deksametazonu.
U pacjentów z niewydolnością serca konieczne jest jednoczesne skuteczne leczenie choroby podstawowej oraz stała kontrola.
Kardiomiopatia przerostowa
Występowanie kardiomiopatii przerostowej notowano po ogólnoustrojowym podaniu niemowlętom przedwcześnie urodzonym kortykosteroidów, w tym deksametazonu. W większości zgłoszonych przypadków było to działanie przemijające po odstawieniu leku. U niemowląt przedwcześnie urodzonych leczonych ogólnoustrojowo deksametazonem, należy wykonać ocenę diagnostyczną i monitorować czynność i strukturę serca (patrz punkt 4.8).
Obrzęk mózgu lub zwiększone ciśnienie śródczaszkowe
Kortykosteroidów nie należy stosować u pacjentów z urazem głowy lub udarem, ponieważ prawdopodobnie nie przyniosą korzyści lub mogą nawet zaszkodzić.
Zespół rozpadu guza (TLS, ang. tumor lysis syndrome)
Po wprowadzeniu produktu leczniczego do obrotu obserwowano zespół rozpadu guza (TLS) u pacjentów z nowotworami układu krwiotwórczego, leczonych deksametazonem w monoterapii lub w skojarzeniu z innymi chemioterapeutykami. Pacjenci z wysokim ryzykiem TLS, tacy jak pacjenci
z wysokim wskaźnikiem proliferacji, dużą masą guza i dużą wrażliwością na cytostatyki, powinni być ściśle kontrolowani i leczeni z zachowaniem odpowiednich środków ostrożności.
Zaburzenia widzenia
Zaburzenia widzenia mogą wystąpić w wyniku ogólnoustrojowego i miejscowego stosowania kortykosteroidów. Jeżeli u pacjenta wystąpią objawy takie jak nieostre widzenie lub inne zaburzenia widzenia, należy rozważyć skierowanie go do okulisty w celu ustalenia możliwych przyczyn; może do nich należeć zaćma, jaskra lub rzadkie choroby, np. centralna chorioretinopatia surowicza (CSC, ang. central serous chorioretinopathy), którą notowano po ogólnoustrojowym i miejscowym stosowaniu kortykosteroidów.
Należy zachować szczególną ostrożność u pacjentów z jaskrą zamkniętego i otwartego kąta.
W przypadku owrzodzenia i urazu rogówki konieczna jest ścisła kontrola i leczenie okulistyczne.
Pacjenci w podeszłym wieku
U pacjentów w podeszłym wieku, wymagana jest dokładna ocena stosunku korzyści do ryzyka oraz zachowanie ostrożności ze względu na działania niepożądane takie jak osteoporoza.
Dzieci i młodzież
Wcześniaki: Dostępne dane wskazują na występowanie długotrwałych zdarzeń niepożądanych na rozwój neurologiczny wcześniaków z przewlekłą chorobą płuc po rozpoczęciu wczesnego leczenia (<96 godzin) w dawce początkowej 0,25 mg/kg dwa razy na dobę.
Dzieci i młodzież w fazie wzrostu, nie powinny być leczone, chyba że jest to ściśle wskazane.
Informacje związane z określonymi sposobami podawania Podanie domięśniowe
Dexamethasone Kalceks należy podawać domięśniowo tylko w wyjątkowych przypadkach, z następujących powodów:
Podanie dożylne
Podczas podawania dożylnego, fosforan deksametazonu należy wstrzykiwać powoli (2–3 minuty), ponieważ zbyt szybkie podanie może skutkować krótkotrwałymi skutkami ubocznymi w postaci nieprzyjemnego mrowienia lub parestezji, które same w sobie są nieszkodliwe i trwają do 3 minut.
Podanie dostawowe
Dostawowe podawanie glikokortykosteroidów zwiększa ryzyko zakażenia stawów. Przedłużone
i powtarzane stosowanie glikokortykosteroidów w obrębie obciążonych stawów może prowadzić do pogorszenia zmian degeneracyjnych stawów. Jedną z możliwych przyczyn jest przeciążenie objętego chorobą stawu po ustąpieniu bólu lub innych objawów.
Podanie miejscowe
W przypadku stosowania miejscowego, wymagana jest czujność pod kątem możliwych ogólnoustrojowych działań niepożądanych i interakcji.
Substancje pomocnicze
Produkt leczniczy zawiera około 3 mg sodu na mL roztworu, co odpowiada 0,15% zalecanej przez WHO maksymalnej 2 g dobowej dawki sodu u osób dorosłych.
Ponieważ ten produkt leczniczy może być rozcieńczany roztworami zawierającymi sód (patrz
punkt 6.6), należy to rozpatrywać w odniesieniu do całkowitej zawartości sodu ze wszystkich źródeł, które zostaną podane pacjentowi.
Glikozydy naparstnicy: | Nasilenie działania glikozydów ze względu na niedobór potasu |
Saluretyki: | Nasilenie wydalania potasu |
Leki przeciwcukrzycowe: | Zmniejszona redukcja glikemii |
Pochodne kumaryny: | Działanie przeciwzakrzepowe może być osłabione lub nasilone. Podczas jednoczesnego stosowania konieczne jest dostosowanie dawki |
Efedryna: | Osłabienie działania kortykosteroidów |
Ryfampicyna, fenytoina, karbamazepina, barbiturany, prymidon i inne produkty lecznicze indukujące CYP3A4: | Osłabienie działania kortykosteroidów |
Ketokonazol, itrakonazol, rytonawir, kobicystat, antybiotyki makrolidowe i inne produkty lecznicze, które hamują CYP3A4: | Podczas jednoczesnego leczenia inhibitorami CYP3A, w tym produktami zawierającymi kobicystat, można spodziewać się zwiększonego ryzyka ogólnoustrojowych działań niepożądanych. Należy unikać takich połączeń, chyba że korzyści przewyższają zwiększone ryzyko ogólnoustrojowych działań niepożądanych kortykosteroidów; w takim przypadku pacjenci powinni być monitorowani pod kątem ogólnoustrojowego działań kortykosteroidów |
Niesteroidowe leki przeciwzapalne/leki przeciwreumatyczne (np. salicylany i indometacyna): | Zwiększenie ryzyka owrzodzenia i krwawienia z przewodu pokarmowego |
Leki antykoncepcyjne zawierające estrogen: | Nasilenie działania kortykosteroidów |
Prazykwantel: | Możliwe zmniejszenie stężenia prazykwantelu we krwi |
Inhibitory ACE: | Zwiększone ryzyko zmian w morfologii krwi |
Chlorochina, hydroksychlorochina, meflochina: | Zwiększone ryzyko wystąpienia miopatii i kardiomiopatii. |
Somatropina: | Osłabienie działania somatropiny po długotrwałym podawaniu |
Leki przeczyszczające: | Nasilona utrata potasu |
Atropina, inne leki przeciwcholinergiczne: | Niewykluczony dodatkowy wzrost ciśnienia wewnątrzgałkowego |
Niedepolaryzujące leki zwiotczające mięśnie: | Rozluźnienie mięśni może utrzymywać się dłużej |
Leki immunosupresyjne (cyklosporyna): | Zwiększona podatność na infekcje i zaostrzenie lub ujawnienie się nieaktywnych infekcji. W przypadku cyklosporyny dodatkowo zwiększa się ryzyko wystąpienia drgawek mózgowych |
Bupropion: | Jednoczesne podawanie z ogólnoustrojowymi glikokortykosteroidami może zwiększać ryzyko drgawek |
Fluorochinolony: | Zwiększone ryzyko zaburzeń ścięgien, zapalenia i zerwania ścięgien |
Wpływ na badania diagnostyczne:
Reakcje skórne na testy alergiczne mogą być hamowane.
Protyrelina: Możliwe jest osłabione zwiększanie aktywności TSH po podaniu protyreliny.
Jeśli leczenie glikokortykosteroidami jest podawane 8 tygodni przed lub do 2 tygodni po szczepieniu z użyciem żywej szczepionki, można spodziewać się osłabienia lub braku immunizacji.
Ciąża
Deksametazon przenika przez łożysko. W czasie ciąży, szczególnie w pierwszych trzech miesiącach, produkt leczniczy należy stosować wyłącznie po dokładnej ocenie stosunku korzyści do ryzyka.
Dexamethasone Kalceks należy stosować w okresie ciąży wyłącznie w sytuacjach zagrożenia życia.
W przypadku długotrwałego leczenia glikokortykosteroidami w czasie ciąży, nie można wykluczyć
zaburzeń wzrostu płodu. Podawanie kortykosteroidów ciężarnym zwierzętom może powodować wady rozwojowe płodu, w tym rozszczep podniebienia, opóźnienie wzrostu wewnątrzmacicznego oraz może wpływać na wzrost i rozwój mózgu. Nic nie wskazuje na to, by kortykosteroidy prowadziły do
zwiększonej częstości występowania wad wrodzonych, takich jak rozszczep podniebienia/rozszczep warg u ludzi. Patrz także punkt 5.3. Jeśli glikokortykosteroidy podaje się pod koniec ciąży, istnieje ryzyko wystąpienia atrofii kory nadnerczy u płodu, co może wymagać zastosowania leczenia substytucyjnego u noworodka, które należy stopniowo odstawiać. W badaniach wykazano zwiększone ryzyko hipoglikemii u noworodka, występujące po krótkim cyklu leczenia przed porodem
kortykosteroidami, w tym deksametazonem, kobiet narażonych na wystąpienie późnego przedwczesnego porodu.
Karmienie piersią
Glikokortykosteroidy przenikają do mleka ludzkiego. Dotychczas nie zgłaszano szkodliwego działania na niemowlę. Niemniej jednak, powinny być one stosowane jedynie wtedy, gdy jest to ściśle wskazane w okresie karmienia piersią. Jeżeli konieczne jest zastosowanie większych dawek, należy przerwać
karmienie piersią.
Płodność
Nie przeprowadzono badań dotyczących płodności.
Nie przeprowadzono badań dotyczących wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
Podczas krótkotrwałego leczenia deksametazonem ryzyko wystąpienia działań niepożądanych jest małe. Należy jednak zwracać uwagę na wrzody żołądka i dwunastnicy (często związane ze stresem), które w wyniku leczenia kortykosteroidami mogą dawać nieliczne objawy, jak również objawiać się zmniejszoną tolerancją glukozy i odporności na zakażenia.
Szczególnie podczas długotrwałego leczenia (dłuższym niż około 2 tygodnie), mogą wystąpić reakcje niepożądane na glikokortykosteroidy, które jako nasilone oddziaływania hormonalne, są podobne do zespołu Cushinga.
Zakażenia i zarażenia pasożytnicze
Maskowanie zakażenia, wystąpienie, proliferacja lub reaktywacja zakażeń (bakteryjnych, wirusowych, grzybiczych oraz pasożytniczych i oportunistycznych), aktywacja owsików (patrz punkt 4.4).
Zaburzenia krwi i układu chłonnego
Zmiany w morfologii krwi (umiarkowana leukocytoza, limfopenia, eozynopenia, policytemia).
Zaburzenia układu immunologicznego
Reakcje nadwrażliwości (np. wysypka), ciężkie reakcje anafilaktyczne, takie jak arytmie, skurcz oskrzeli, obniżenie lub podwyższenie ciśnienia tętniczego, zapaść krążeniowa, zatrzymanie akcji serca, osłabienie układu odpornościowego.
Zaburzenia endokrynologiczne
Zespół Cushinga (np. księżycowa twarz, otyłość tułowia), inaktywacja lub atrofia kory nadnerczy.
Zaburzenia metabolizmu i odżywiania
Zatrzymanie sodu z powstawaniem obrzęków, zwiększone wydalanie potasu (uwaga: arytmie), przyrost masy ciała, zmniejszona tolerancja glukozy, cukrzyca, zwiększony apetyt, hipercholesterolemia i hipertriglicerydemia.
Zaburzenia psychiczne
Psychoza, depresja, drażliwość, euforia, zaburzenia snu, labilność, lęk, mania, halucynacje, myśli samobójcze.
Zaburzenia układu nerwowego
Guz rzekomy mózgu, manifestacja padaczki utajonej i zwiększona podatność na drgawki w przypadkach rozpoznanej padaczki.
Zaburzenia oka
Zwiększone ciśnienie wewnątrzgałkowe (jaskra), zmętnienie soczewki (zaćma). Nasilenie objawów owrzodzenia rogówki, nasilenie wirusowego, grzybiczego i bakteryjnego zapalenia oka, nasilenie bakteryjnego zapalenia rogówki, opadanie powiek, rozszerzenie źrenic, chemoza, jatrogenna perforacja twardówki, chorioretinopatia. W bardzo rzadkich przypadkach odwracalny wytrzeszcz (patrz również punkt 4.4).
Zaburzenia serca
Kardiomiopatia przerostowa u niemowląt przedwcześnie urodzonych (patrz punkt 4.4).
Zaburzenia naczyniowe
Nadciśnienie tętnicze, zwiększone ryzyko miażdżycy i zakrzepicy, zapalenie naczyń (łac. vasculitis, także jako zespół odstawienia po długotrwałym leczeniu), zwiększona łamliwość naczyń włosowatych.
Zaburzenia żołądka i jelit
Niestrawność, aktywacja i rozwój wrzodów żołądka lub dwunastnicy, zapalenie trzustki (u pacjentów predysponowanych, np. z powodu alkoholizmu), krwawienie z przewodu pokarmowego, ryzyko perforacji we wrzodziejącym zapaleniu jelita grubego.
Zaburzenia skóry i tkanki podskórnej
Rozstępy (łac. striae rubra), ścieńczenie skóry (atrofia), punktowe krwawienia pod skórą (wybroczyny), siniaki (ang. ecchymosis), trądzik steroidowy, okołoustne zapalenie skóry, teleangiektazje, nadmierne owłosienie, zmiany pigmentacji skóry.
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej
Osłabienie mięśni, zanik mięśni (atrofia), miopatia, zaburzenia ścięgien, zapalenie ścięgna, zerwanie ścięgna, osteoporoza, aseptyczna martwica kości, opóźnienie wzrostu u dzieci, tłuszczakowatość nadtwardówkowa.
Zaburzenia układu rozrodczego i piersi
Zaburzenia wydzielania hormonów płciowych (brak miesiączki, hirsutyzm, impotencja).
Zaburzenia ogólne i stany w miejscu podania Wolniejsze gojenie się ran.
Podanie miejscowe: Możliwe miejscowe podrażnienie i oznaki nadwrażliwości (uczucie pieczenia, uporczywy ból), szczególnie po podaniu do oka. Nie można wykluczyć wystąpienia zaniku skóry
i tkanki podskórnej, jeśli kortykosteroidy nie są ostrożnie wstrzykiwane do jamy stawowej.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzane działania niepożądane za pośrednictwem Departamentu Monitorowania
Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Nie są znane przypadki ostrego zatrucia deksametazonem. W przypadku przedawkowania można oczekiwać nasilenia działań niepożądanych (patrz punkt 4.8), zwłaszcza zaburzeń
endokrynologicznych, metabolizmu i równowagi elektrolitowej. Nie jest znane antidotum.
Grupa farmakoterapeutyczna: Kortykosteroidy do stosowania ogólnoustrojowego; kortykosteroidy do stosowania ogólnoustrojowego, zwykłe, glikokortykosteroidy, kod ATC: H02AB02
Deksametazon jest monofluorowanym glikokortykosteroidem o znacznych właściwościach przeciwalergicznych, przeciwzapalnych i stabilizujących błony komórkowe, jak również wpływa również na metabolizm węglowodanów, białek i tłuszczów.
Z powodu długiego biologicznego okresu półtrwania, wynoszącego ponad 36 godzin, deksametazon należy do bardzo długo działających glikokortykoidów. W związku z jego długim czasem działania, codzienne stosowanie deksametazonu może prowadzić do kumulacji i przedawkowania.
Deksametazon wykazuje działanie glikokortykosteroidowe 7,5 razy silniejsze niż prednizolon i prednizon; w porównaniu do hydrokortyzonu jest 30 razy silniejszy; nie wykazuje działania mineralokortykosteroidowego.
Glikokortykosteroidy, takie jak deksametazon wywierają biologiczne działanie przez aktywację transkrypcji genów zależnych od kortykosteroidów. Działanie przeciwzapalne, immunosupresyjne
i antyproliferacyjne jest spowodowane przez czynniki takie jak zmniejszone powstawanie, uwalnianie i aktywność mediatorów zapalnych oraz przez hamowanie czynności i migracji specyficznych komórek zapalnych. Dodatkowo, kortykosteroidy mogą zapobiegać oddziaływaniu aktywowanych limfocytów T i makrofagów na komórki docelowe.
Leczenie COVID 19
Badanie RECOVERY (ang. Randomised Evaluation of COVid-19 thERapY)1 to inicjowane przez badacza, indywidualnie randomizowane, kontrolowane, otwarte adaptacyjne badanie platformowe, prowadzonym w celu oceny wpływu potencjalnych metod leczenia u pacjentów hospitalizowanych z powodu COVID-19.
Badanie zostało przeprowadzone w 176 szpitalach w Wielkiej Brytanii.
6425 pacjentów przydzielono losowo do: grupy otrzymującej deksametazon (2104 pacjentów) lub grupy otrzymującej tylko standardową opiekę medyczną (4321 pacjentów). 89% pacjentów miało potwierdzone laboratoryjnie zakażenie wirusem SARS-CoV-2.
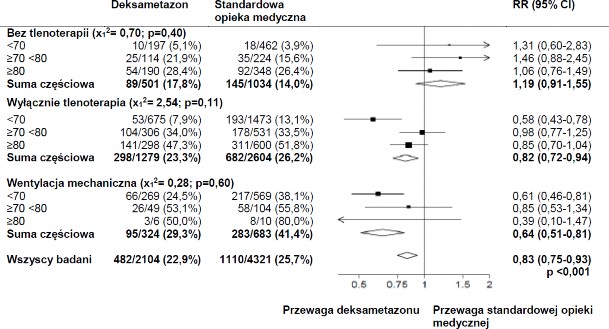
W trakcie randomizacji, 16% pacjentów poddawanych było inwazyjnej wentylacji mechanicznej lub pozaustrojowemu utlenowaniu krwi, 60% otrzymywało tylko tlen (z lub bez wentylacji nieinwazyjnej), a 24% w żaden sposób nie wspomagano oddychania.
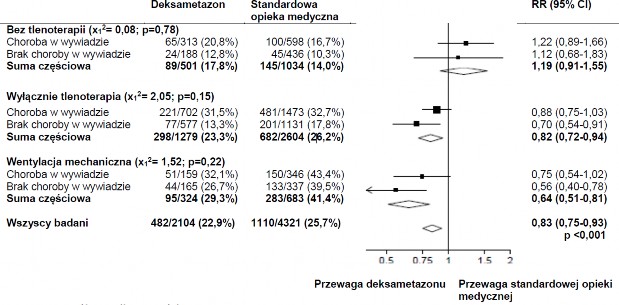
Średni wiek pacjentów wynosił 66,1 +/- 15,7 lat. Kobiety stanowiły 36% badanych pacjentów. U 24% pacjentów stwierdzono występowanie cukrzycy, u 27% choroby serca, a u 21% przewlekłej choroby płuc, w wywiadzie.
Pierwszorzędowy punkt końcowy
Śmiertelność po 28 dniach była istotnie niższa w grupie leczonej deksametazonem niż w grupie podlegającej standardowej opiece medycznej, odnotowano odpowiednio 482 zgony w grupie 2104 pacjentów (22,9%) i 1110 zgonów w grupie 4321 pacjentów (25,7%) (współczynnik częstości, 0,83;
95% przedział ufności [CI], 0,75 do 0,93; P<0,001).
W grupie otrzymującej deksametazon częstość zgonów była niższa w porównaniu do grupy otrzymującej standardową opiekę medyczną wśród pacjentów poddawanych inwazyjnej wentylacji mechanicznej (29,3% vs. 41,4%; współczynnik częstości, 0,64; 95% CI, 0,51 do 0,81) oraz otrzymujących tlen bez inwazyjnej wentylacji mechanicznej (23,3% vs. 26,2%; współczynnik
częstości, 0,82; 95% CI, 0,72 do 0,94).
Brak wyraźnego wpływu deksametazonu u pacjentów, u których nie stosowano wsparcia oddechowego w czasie randomizacji (17,8% vs. 14,0%; współczynnik częstości, 1,19; 95% CI, 0,91
do 1,55).
Drugorzędowe punkty końcowe
Pacjenci w grupie otrzymującej deksametazon byli hospitalizowani krócej w porównaniu do
pacjentów z grupy otrzymującej standardową opiekę medyczną (mediana, 12 dni vs. 13 dni) i mieli większe prawdopodobieństwo wypisu ze szpitala przy życiu w ciągu 28 dni (współczynnik częstości, 1,10; 95% CI, 1,03 do 1,17).
Zgodnie z pierwszorzędowym punktem końcowym, największy wpływ stosowania deksametazonu na wypisanie ze szpitala w ciągu 28 dni zaobserwowano u pacjentów, których poddawano inwazyjnej
wentylacji mechanicznej w czasie randomizacji (współczynnik częstości, 1,48; 95% CI, 1,16 do 1,90), a następnie wśród pacjentów otrzymujących tylko tlen (współczynnik częstości, 1,15; 95% CI,
1,06-1,24), nie obserwowano korzyści ze stosowania u pacjentów, których nie poddawano tlenoterapii (współczynnik częstości, 0,96; 95% CI, 0,85-1,08).
Wynik | Deksametazon (N=2104) | Standardowa opieka medyczna (N=4321) | Współczynnik częstości lub ryzyka (95% CI) * |
liczba/całkowita liczba pacjentów (%) | |||
Pierwszorzędowy wynik | |||
Śmiertelność po 28 dniach | 482/2104 (22,9) | 1110/4321 (25,7) | 0,83 (0,75-0,93) |
Drugorzędowe wyniki | |||
Wypisanie ze szpitala w ciągu 28 dni | 1413/2104 (67,2) | 2745/4321 (63,5) | 1,10 (1,03-1,17) |
Inwazyjna wentylacja mechaniczna lub zgon † | 456/1780 (25,6) | 994/3638 (27,3) | 0,92 (0,84-1,01) |
Inwazyjna wentylacja mechaniczna | 102/1780 (5,7) | 285/3638 (7,8) | 0,77 (0,62-0,95) |
Zgon | 387/1780 (21,7) | 827/3638 (22,7) | 0,93 (0,84-1,03) |
* Wskaźniki częstości zostały dostosowane do wieku w odniesieniu do wyników śmiertelności
w ciągu 28 dni i wypisu ze szpitala. Współczynniki ryzyka zostały dostosowane do wieku w odniesieniu do wyniku zastosowania inwazyjnej wentylacji mechanicznej lub zgonu i jej
elementów składowych.
† Z tej kategorii wykluczeni są pacjenci, którzy byli poddawani inwazyjnej wentylacji mechanicznej w trakcie randomizacji.
Bezpieczeństwo
Wystąpiły cztery ciężkie zdarzenia niepożądane (ang, serious adverse events, SAE) związane z badanym leczeniem: dwa związane z hiperglikemią, jedno związane z psychozą wywołaną steroidami oraz jedno ciężkie zdarzenie niepożądane związane z krwawieniem z górnego odcinka przewodu pokarmowego. Wszystkie zdarzenia ustąpiły.
Analizy podgrup
Wpływ alokacji do grupy otrzymującej DEKSAMETAZON na śmiertelność w ciągu 28 dni, w zależności od wieku i wsparcia oddechowego w czasie randomizacji2
Wpływ alokacji do grupy otrzymującej DEKSAMETAZON na śmiertelność w ciągu 28 dni, w zależności od wsparcia oddechowego w czasie randomizacji i występowania jakiejkolwiek choroby przewlekłej w wywiadzie3
Dystrybucja
Deksametazon jest wiązany z albuminami w osoczu w zależności od dawki. Po bardzo dużych Dawkach, większość krąży niezwiązana we krwi, tj. niezwiązana z białkami. Frakcja niezwiązana (aktywna) kortykosteroidów wzrasta w przypadku hipoalbuminemii.
Przenikanie płynu mózgowo-rdzeniowego (CSF)
U ludzi, w cztery godziny po podaniu dożylnym deksametazonu znakowanego radioaktywnie maksymalne stężenie w płynie mózgowo-rdzeniowym odpowiada około 1/6 stężenia w surowicy.
Transfer łożyskowy
Jak wszystkie glikokortykosteroidy, deksametazon może przenikać przez barierę łożyskową, ale w przeciwieństwie do większości innych kortykosteroidów nie jest metabolizowany.
Przenikanie do mleka ludzkiego
Brak danych dotyczących deksametazonu. Niewielkie ilości glikokortykosteroidów przenikają do mleka ludzkiego, przy zasadniczym narażeniu niemowląt na poniżej 1/100 dawki dostępnej ogólnoustrojowo u matki karmiącej piersią. Niemniej jednak w przypadku stosowania większych dawek lub podczas długotrwałego leczenia należy przerwać karmienie piersią.
Biotransformacja
Po dożylnym wstrzyknięciu fosforanu deksametazonu rozszczepienie estru jest bardzo szybkie. Wartości szczytowe wolnego alkoholu deksametazonowego są mierzone po 10 minutach.
Deksametazon jest częściowo metabolizowany przez sprzęganie z kwasem glukuronowym lub siarkowym w wątrobie, a następnie wydalany głównie przez nerki.
Eliminacja
Średni okres półtrwania deksametazonu w osoczu w fazie eliminacji u osób dorosłych wynosi 4,1±1,3 godziny. Deksametazon jest w dużej mierze wydalany przez nerki z moczem w postaci
wolnego alkoholu deksametazonowego. Uszkodzenie czynności nerek nie wpływa znacząco na
eliminację deksametazonu. W ciężkich chorobach wątroby, np. zapaleniu wątroby, marskości wątroby, a także w czasie ciąży i podawania estrogenów wydłuża się okres półtrwania glikokortykosteroidów
w fazie eliminacji.
U ludzi, fosforan deksametazonu jest wydalany głównie w postaci deksametazonu. W niewielkim stopniu cząsteczki ulegają uwodornieniu lub hydroksylacji, w wyniku czego powstają główne metabolity 6-hydroksydeksametazon i 20-dihydrodeksametazon. U ludzi, 30-40% ilości wydalanej z moczem wiąże się z kwasem glukuronowym lub siarkowym.
Toksyczność po podaniu jednorazowym
Po podaniu pojedynczej dawki doustnej, LD50 dla deksametazonu w ciągu pierwszych 7 dni wynosi
16 g/kg mc. u myszy oraz ponad 3 g/kg mc. u szczurów. Po jednorazowym podaniu podskórnym, LD50 u myszy wynosi więcej niż 700 mg/kg mc. oraz około 120 mg/kg mc. u szczurów, w ciągu pierwszych 7 dni. W ciągu 21 dniowego okresu obserwacji, wartości te uległy zmniejszeniu, co interpretuje się jako konsekwencję ciężkich schorzeń infekcyjnych spowodowanych immunosupresją hormonalną.
Toksyczność po podaniu wielokrotnym
Brak danych dotyczących przewlekłej toksyczności u ludzi i zwierząt. Zatrucia wywołane
kortykosteroidami nie są znane. W przypadku długotrwałego leczenia dawkami powyżej 1,5 mg/dobę, można spodziewać się wyraźnych działań niepożądanych (patrz punkt 4.8).
Potencjalna genotoksyczność i rakotwórczość
Dostępne wyniki badań z zastosowaniem glikokortykosteroidów nie wykazują jakichkolwiek klinicznie znaczących właściwości genotoksycznych.
Toksyczny wpływ na reprodukcję
W badaniach na zwierzętach, obserwowano rozszczepienie podniebienia u szczurów, myszy,
chomików, królików, psów i naczelnych; nie u koni i owiec. W niektórych przypadkach te wady łączyły się z wadami ośrodkowego układu nerwowego i serca. U naczelnych, efekty w mózgu
obserwowano po ekspozycji. Ponadto wzrost wewnątrzmaciczny może być opóźniony. Wszystkie te efekty były widoczne przy wysokich dawkach.
Kreatynina
Sodu cytrynian (do ustalenia pH) Disodu edetynian
Sodu wodorotlenek (do ustalenia pH) Woda do wstrzykiwań
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 6.6.
2 lata
Po otwarciu ampułki: Po otwarciu produkt leczniczy powinien być zużyty natychmiast.
Okres ważności po rozcieńczeniu
Stabilność chemiczna i fizyczna podczas użycia została wykazana przez 48 godzin w temperaturze 25 °C (w warunkach ochrony przed światłem) i 2 do 8 °C.
Z mikrobiologicznego punktu widzenia, rozcieńczony roztwór należy zużyć natychmiast. Jeśli roztwór nie zostanie zużyty natychmiast, za czas i warunki przechowywania przed użyciem odpowiada użytkownik i zwykle nie powinien być on dłuższy niż 24 godziny w temperaturze 2 do 8 °C, chyba że rozcieńczenie miało miejsce w kontrolowanych i zwalidowanych warunkach aseptycznych.
Nie przechowywać w temperaturze powyżej 30 °C.
Przechowywać ampułki w opakowaniu zewnętrznym w celu ochrony przed światłem. Warunki przechowywania produktu leczniczego po otwarciu ampułki, patrz punkt 6.3.
Roztwór do wstrzykiwań jest zawarty w 1 mL lub 2 mL ampułkach z przezroczystego, bezbarwnego szkła typu I z jednym punktem przełamania. Ampułki oznaczone są kolorową obwódką.
Ampułki zapakowane są w osłonkę. Osłonki zapakowane są w tekturowe pudełka.
Wielkości opakowań:
3, 10, 25, 50 lub 100 ampułek po 1 mL
5, 10, 25, 50 lub 100 ampułek po 2 mL
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Wyłącznie do jednorazowego użytku.
Po otwarciu produkt leczniczy powinien być zużyty natychmiast. Należy wyrzucić wszystkie niewykorzystane pozostałości.
Ten produkt leczniczy powinien być sprawdzony wizualnie przed użyciem. Można podać tylko przezroczysty i wolny od cząsteczek roztwór.
Dexamethasone Kalceks roztwór do wstrzykiwań/do infuzji najlepiej podawać w postaci
bezpośredniego wstrzyknięcia dożylnego lub wstrzyknięcia do rurki infuzyjnej. Jednakże, roztwory do wstrzykiwań są zgodne z następującymi roztworami do infuzji (250 mL i 500 mL):
− 9 mg/mL (0,9%) roztwór chlorku sodu
− 50 mg/mL (5%) roztwór glukozy
− płyn Ringera.
Podczas łączenia z roztworami do infuzji należy wziąć pod uwagę informacje od odpowiednich wytwórców dotyczące ich roztworów do infuzji, w tym dane dotyczące zgodności, przeciwwskazań, działań niepożądanych i interakcji.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
AS KALCEKS
Krustpils iela 71E
LV-1057 Rīga
Łotwa
Tel.: +371 67083320
Pozwolenie nr: 26779
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 10 grudzień 2021 r.
01/03/2023











