Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Paliperidone Teva, 75 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu Paliperidone Teva, 100 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu Paliperidone Teva, 150 mg, zawiesina do wstrzykiwań o przedłużonym uwalnianiu
Paliperidone Teva 75 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu
Każda ampułkostrzykawka zawiera paliperidonu palmitynian, równoważny75 mg paliperydonu.
Paliperidone Teva 100 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu
Każda ampułkostrzykawka zawiera paliperidonu palmitynian, równoważny 100 mg paliperydonu.
Paliperidone Teva 150 mg zawiesina do wstrzykiwań o przedłużonym uwalnianiu
Każda ampułkostrzykawka zawiera paliperidonu palmitynian, równoważny 150 mg paliperydonu. Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Zawiesina do wstrzykiwań o przedłużonym uwalnianiu (iniekcje o przedłużonym uwalnianiu). Zawiesina ma kolor biały do białawego. Odczyn pH zawiesiny jest obojętny (około 7,0).
Paliperidone Teva jest wskazany w leczeniu podtrzymującym schizofrenii u stabilnych dorosłych pacjentów leczonych paliperydonem lub rysperydonem.
U wybranych dorosłych pacjentów ze schizofrenią, którzy reagowali wcześniej na doustny paliperydon lub rysperydon, paliperydon może być stosowany bez uprzedniej stabilizacji za pomocą terapii doustnej, jeśli objawy psychotyczne są łagodne do umiarkowanych i wskazana jest terapia w postaci długodziałających iniekcji.
Dawkowanie
Zaleca się rozpoczęcie stosowania produktu leczniczego Paliperidone Teva od dawki 150 mg w
1. dniu leczenia i 100 mg tydzień później (8. dzień). W obu przypadkach produkt leczniczy należy podawać do mięśnia naramiennego, aby szybko uzyskać stężenie terapeutyczne (patrz punkt 5.2). Trzecią dawkę należy podać miesiąc po podaniu drugiej dawki inicjującej. Zalecana dawka podtrzymująca wynosi 75 mg, podawane co miesiąc; u niektórych pacjentów korzystne może być stosowanie mniejszej lub większej dawki w zalecanym zakresie od 25 do 150 mg, zależnie od indywidualnej tolerancji leku i (lub) skuteczności. Pacjenci z nadwagą lub otyli mogą wymagać dawek z górnego zakresu (patrz punkt 5.2). Po podaniu drugiej dawki inicjującej comiesięczne dawki podtrzymujące można wstrzykiwać do mięśnia naramiennego lub pośladkowego.
1
Dostosowanie dawki podtrzymującej można przeprowadzać co miesiąc. Podczas dostosowywania dawki należy uwzględnić charakterystykę przedłużonego uwalniania produktu leczniczego Paliperidone Teva (patrz punkt 5.2), ponieważ całkowity efekt leczniczy podawania dawek podtrzymujących może nie być widoczny przez kilka miesięcy.
Zamiana z doustnego paliperydonu o przedłużonym uwalnianiu lub doustnego rysperydonu na produkt leczniczy Paliperidone Teva
Stosowanie produktu leczniczego Paliperidone Teva należy rozpocząć, jak opisano na początku punktu 4.2, powyżej. U pacjentów uprzednio ustabilizowanych przy użyciu różnych dawek paliperydonu w postaci tabletek o przedłużonym uwalnianiu, można uzyskać podobną ekspozycję na paliperydon w stanie stacjonarnym stosując terapię podtrzymującą produktem leczniczym Paliperidone Teva podawanym co miesiąc w postaci wstrzyknięć. Dawki podtrzymujące produktu leczniczego Paliperidone Teva konieczne do uzyskania podobnych ekspozycji w stanie stacjonarnym przedstawiono poniżej:
Dawki paliperydonu w postaci tabletek o przedłużonym uwalnianiu i produktu leczniczego Paliperidone Teva konieczne do uzyskania podobnych ekspozycji w stanie stacjonarnym na paliperydon w czasie terapii podtrzymującej | |
Poprzednia dawka paliperydonu w postaci tabletek o przedłużonym uwalnianiu | Wstrzyknięcie produktu leczniczego Paliperidone Teva |
3 mg na dobę | 25-50 mg co miesiąc |
6 mg na dobę | 75 mg co miesiąc |
9 mg na dobę | 100 mg co miesiąc |
12 mg na dobę | 150 mg co miesiąc |
W momencie rozpoczęcia leczenia produktem leczniczym Paliperidone Teva, można przerwać podawanie stosowanego wcześniej doustnego paliperydonu lub doustnego rysperydonu. U niektórych pacjentów korzystne może być stopniowe wycofywanie wcześniej stosowanego leku. Niektórzy pacjenci przestawieni z większych doustnych dawek paliperydonu (np. 9-12 mg na dobę) na produkt leczniczy Paliperidone Teva wstrzykiwany do mięśnia pośladkowego, mogą przez pierwsze 6 miesięcy po zmianie wykazywać mniejszą ekspozycję na paliperydon w osoczu. Dlatego przez pierwsze 6 miesięcy można, alternatywnie, rozważyć wstrzyknięcia do mięśnia naramiennego.
Zamiana z rysperydonu w postaci iniekcji o przedłużonym działaniu na produkt leczniczy Paliperidone Teva
Przestawiając pacjenta z leczenia rysperydonem w postaci iniekcji o przedłużonym działaniu na leczenie produktem leczniczym Paliperidone Teva, należy zastąpić nim następne zaplanowane wstrzyknięcie. Następnie należy kontynuować stosowanie produktu leczniczego Paliperidone Teva w odstępach miesięcznych. Nie jest wymagany tygodniowy rozpoczynający schemat dawkowania, obejmujący wstrzyknięcia domięśniowe (odpowiednio w 1. dniu i 8. dniu), opisany w punkcie 4.2, powyżej. Pacjenci, których stan ustabilizowano wcześniej za pomocą różnych dawek rysperydonu w postaci iniekcji o przedłużonym działaniu, mogą osiągnąć podobną ekspozycję na paliperydon w stanie stacjonarnym podczas leczenia podtrzymującego comiesięcznymi dawkami produktu leczniczego Paliperidone Teva, zgodnie z poniższym schematem:
Dawki rysperydonu w postaci iniekcji o przedłużonym działaniu i dawki produktu Paliperidone Teva, wymagane do osiągnięcia podobnej ekspozycji na paliperydon w stanie stacjonarnym | |
Poprzednia dawka rysperydonu w postaci iniekcji o przedłużonym działaniu | Wstrzyknięcie produktu leczniczegoPaliperidone Teva |
25 mg co 2 tygodnie | 50 mg co miesiąc |
37,5 mg co 2 tygodnie | 75 mg co miesiąc |
50 mg co 2 tygodnie | 100 mg co miesiąc |
Leki przeciwpsychotyczne należy odstawiać zgodnie z odpowiednimi informacjami dotyczącymi przepisywania produktu. Przerywając stosowanie Paliperidone Teva, należy wziąć pod uwagę przedłużony charakter jego uwalniania. Należy okresowo oceniać potrzebę kontynuacji stosowania leku zwalczającego objawy pozapiramidowe (EPS).
Pominięte dawki
Unikanie pominiętych dawek
Zaleca się podanie drugiej dawki początkowej produktu leczniczego Paliperidone Teva tydzień po podaniu pierwszej dawki. Aby uniknąć pominięcia dawki, pacjentom można podać drugą dawkę 4 dni przed lub po wyznaczonym terminie jednego tygodnia (8. dnia). Podobnie, trzecią i kolejne dawki po schemacie dawkowania wstępnego, zaleca się podawać w odstępach comiesięcznych. Aby uniknąć pominięcia comiesięcznej dawki, pacjentom można podać wstrzyknięcie do 7 dni przed lub po upłynięciu miesięcznego terminu.
Jeśli opuszczono ustalony termin drugiego wstrzyknięcia produktu leczniczego Paliperidone Teva (8. dzień ± 4 dni), zalecane ponowne rozpoczęcie dawkowania zależy od tego, ile czasu upłynęło od pierwszego wstrzyknięcia.
Pominięcie drugiej dawki początkowej (< 4 tygodnie od pierwszego wstrzyknięcia)
Jeśli od pierwszego wstrzyknięcia upłynęło mniej niż 4 tygodnie, pacjentowi należy jak najszybciej podać drugą dawkę wynoszącą 100 mg do mięśnia naramiennego. Po 5 tygodniach od pierwszego wstrzyknięcia (niezależnie od terminu drugiego wstrzyknięcia) pacjentowi należy podać trzecią dawkę produktu leczniczego Paliperidone Teva, wynoszącą 75 mg, do mięśnia naramiennego lub pośladkowego. Następnie należy przestrzegać zwykłego comiesięcznego cyklu wstrzyknięć do mięśnia naramiennego lub pośladkowego dawki od 25 mg do 150 mg ustalonej na podstawie indywidualnej tolerancji pacjenta i (lub) skuteczności.
Pominięcie drugiej dawki początkowej (4-7 tygodni od pierwszego wstrzyknięcia)
Jeśli od pierwszego wstrzyknięcia produktu leczniczego Paliperidone Teva upłynęło od 4 do 7 tygodni, należy wznowić dawkowanie, rozpoczynając od dwóch wstrzyknięć po 100 mg w następujący sposób:
Nadwrażliwość na substancję czynną, rysperydon lub na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1.
Zastosowanie u pacjentów w stanie silnego pobudzenia lub w ostrym stanie psychotycznym
Produktu leczniczego Paliperidone Teva nie należy stosować do leczenia silnego pobudzenia ani ostrych stanów psychotycznych, gdy wymagane jest natychmiastowe złagodzenie objawów.
Odstęp QT
Należy zachować ostrożność, gdy paliperydon przepisywany jest pacjentom z rozpoznaną chorobą układu sercowo-naczyniowego lub z wydłużeniem odstępu QT w wywiadzie rodzinnym, a także podczas jednoczesnego stosowania innych produktów leczniczych, które wydłużają odstęp QT.
Złośliwy zespół neuroleptyczny
Podczas przyjmowania paliperydonu zgłaszano występowanie złośliwego zespołu neuroleptycznego
(ang. Neuroleptic Malignant Syndrome, NMS), charakteryzującego się: podwyższeniem temperatury ciała, sztywnością mięśni, niestabilnością układu autonomicznego, zaburzeniami świadomości i zwiększeniem aktywności fosfokinazy kreatynowej w surowicy. Ponadto może wystąpić mioglobinuria (rabdomioliza) i ostra niewydolność nerek. Jeśli u pacjenta rozwiną się objawy przedmiotowe lub podmiotowe wskazujące na zespół NMS, należy przerwać stosowanie paliperydonu.
Późne dyskinezy/ objawy pozapiramidowe
Produkty lecznicze o właściwościach antagonistycznych w stosunku do receptorów dopaminy były kojarzone z pojawianiem się późnych dyskinez, charakteryzujących się rytmicznymi ruchami mimowolnymi, głównie języka i (lub) twarzy. Jeśli wystąpią przedmiotowe lub podmiotowe objawy późnych dyskinez, należy rozważyć przerwanie stosowania wszystkich leków przeciwpsychotycznych, w tym paliperydonu.
Należy zachować ostrożność u pacjentów otrzymujących jednocześnie leki psychostymulujące (np. metylofenidat) i paliperydon, gdyż mogą wystąpić objawy pozapiramidowe podczas dostosowywania dawki jednego lub obu leków. Zaleca się stopniowe wycofywanie terapii stymulantem (patrz punkt 4.5).
Leukopenia, neutropenia i agranulocytoza
Podczas stosowania paliperydonu stwierdzano wystąpienie leukopenii, neutropenii i agranulocytozy. Agranulocytozę po wprowadzeniu produktu do obrotu zgłaszano bardzo rzadko (< 1/10 000 pacjentów). Pacjentów z istotną klinicznie małą liczbą leukocytów lub polekową leukopenią/neutropenią w wywiadzie należy obserwować przez pierwsze kilka miesięcy leczenia. Należy rozważyć odstawienie produktu leczniczego Paliperidone Teva przy pierwszym objawie istotnego klinicznie zmniejszenia liczby leukocytów, wobec braku innych czynników przyczynowych. Pacjentów ze znaczącą klinicznie neutropenią należy uważnie obserwować, czy nie występuje u nich gorączka lub inne objawy przedmiotowe lub podmiotowe infekcji, oraz podjąć natychmiastowe leczenie w razie wystąpienia takich objawów. U pacjentów z ciężką neutropenią (bezwzględna liczba neutrofilów < 1 x 109/l) należy przerwać stosowanie produktu leczniczego Paliperidone Teva i badać liczbę leukocytów do momentu powrotu wyniku do normy.
Reakcje nadwrażliwości
Po wprowadzeniu produktu do obrotu rzadko stwierdzano reakcje anafilaktyczne u pacjentów, którzy wcześniej tolerowali doustny rysperydon lub doustny paliperydon (patrz punkty 4.1 i 4.8).
Jeśli wystąpią reakcje nadwrażliwości należy przerwać stosowanie produktu leczniczego Paliperidone Teva, wdrożyć w razie konieczności odpowiednie środki wspomagające i obserwować pacjenta do czasu ustąpienia objawów przedmiotowych i podmiotowych (patrz punkty 4.3 i 4.8).
Hiperglikemia i cukrzyca
Podczas leczenia paliperydonem stwierdzano wystąpienie hiperglikemii, cukrzycy i zaostrzenia przebiegu wcześniej występującej cukrzycy, w tym śpiączkę cukrzycową i kwasicę ketonową. Zaleca się prowadzenie odpowiedniej obserwacji klinicznej zgodnie z wytycznymi terapii przeciwpsychotycznej. U pacjentów leczonych produktem leczniczym Paliperidone Teva, należy obserwować objawy hiperglikemii (takie jak: polidypsja, poliuria, nadmierne łaknienie i osłabienie), a pacjentów z cukrzycą należy regularnie badać, czy nie pogarsza się u nich kontrola glikemii.
Zwiększenie masy ciała
Podczas stosowania produktu Paliperidone Teva zgłaszano znaczne zwiększenie masy ciała. Należy regularnie kontrolować masę ciała.
Stosowanie u pacjentów z nowotworami zależnymi od prolaktyny
Badania hodowli tkankowych wskazują, że prolaktyna może stymulować wzrost komórek nowotworów piersi u ludzi. Chociaż w badaniach klinicznych i epidemiologicznych nie wykazano dotychczas wyraźnego związku ze stosowaniem leków przeciwpsychotycznych, zaleca się zachowanie ostrożności u pacjentek z wywiadem medycznym w tym kierunku. Paliperydon należy stosować ostrożnie u pacjentów z wcześniej występującym nowotworem, który może być zależny od prolaktyny.
Niedociśnienie ortostatyczne
Ze względu na działanie blokujące receptory alfa-adrenergiczne paliperydon może wywoływać u niektórych pacjentów hipotonię ortostatyczną. Na podstawie zebranych danych pochodzących z trzech sześciotygodniowych, kontrolowanych placebo badań z użyciem podawanych doustnie tabletek paliperydonu o przedłużonym uwalnianiu w ustalonej dawce (3, 6, 9 i 12 mg) stwierdzono niedociśnienie ortostatyczne u 2,5% badanych przyjmujących doustnie paliperydon i 0,8% badanych przyjmujących placebo. Paliperydon należy stosować ostrożnie u pacjentów z rozpoznaną chorobą układu sercowo-naczyniowego (np. niewydolnością serca, zawałem lub niedokrwieniem serca albo zaburzeniami przewodnictwa), chorobą naczyń mózgowych lub stanami predysponującymi pacjenta do niedociśnienia (np. odwodnienie i hipowolemia).
Drgawki
Należy zachować ostrożność podczas stosowania paliperydonu u pacjentów, u których występowały wcześniej drgawki lub stany mogące obniżać próg drgawkowy.
Zaburzenia czynności nerek
Stężenia paliperydonu w osoczu są zwiększone u pacjentów z zaburzeniami czynności nerek
i dlatego u pacjentów z łagodnymi zaburzeniami czynności nerek zaleca się dostosowanie dawki. Nie zaleca się stosowania paliperydonu u pacjentów z umiarkowanymi lub ciężkimi zaburzeniami czynności nerek (klirens kreatyniny < 50 ml/min) (patrz punkty 4.2 i 5.2).
Zaburzenia czynności wątroby
Brak dostępnych danych dotyczących pacjentów z ciężkimi zaburzeniami czynności wątroby (klasa C wg Childa-Pugh). Zaleca się ostrożność podczas stosowania paliperydonu u takich pacjentów.
Pacjenci w podeszłym wieku z otępieniem
Nie badano stosowania paliperydonu u pacjentów w podeszłym wieku z otępieniem. Należy zachować ostrożność podczas stosowania paliperydonu u pacjentów w podeszłym wieku z otępieniem, u których występuje ryzyko udaru mózgu.
Prezentowane poniżej informacje uzyskano dla rysperydonu, ale przyjmuje się je jako wiążące również dla paliperydonu.Śmiertelność ogólna
W metaanalizie 17 badań klinicznych z grupą kontrolną, w grupie pacjentów w podeszłym wieku z otępieniem leczonych innymi atypowymi lekami przeciwpsychotycznymi, w tym rysperydonem, arypiprazolem, olanzapiną i kwetiapiną, stwierdzono większe ryzyko zgonu niż w grupie placebo. Wśród pacjentów leczonych rysperydonem śmiertelność wyniosła 4% w porównaniu do 3,1% u pacjentów przyjmujących placebo.
Zdarzenia niepożądane naczyniowo-mózgowe
W randomizowanych badaniach klinicznych z grupą kontrolną placebo przeprowadzonych u pacjentów z otępieniem stosujących niektóre atypowe leki przeciwpsychotyczne, w tym rysperydon, arypiprazol i olanzapinę, wystąpiło około 3-krotne zwiększenie ryzyka zdarzeń niepożądanych naczyniowo-mózgowych. Mechanizm tego zwiększonego ryzyka nie jest znany.
Choroba Parkinsona i otępienie z obecnością ciał Lewy'ego
Lekarz przepisujący paliperydon pacjentowi z chorobą Parkinsona lub otępieniem z obecnością ciał Lewy'ego (ang. Dementia with Lewy Bodies, DLB) powinien rozważyć stosunek ryzyka do korzyści, ze względu na podwyższone w tych grupach pacjentów ryzyko wystąpienia złośliwego zespołu neuroleptycznego, jak również zwiększoną wrażliwość na leki przeciwpsychotyczne.
Zwiększona wrażliwość na leki przeciwpsychotyczne może objawiać się splątaniem, zaburzeniem świadomości, niestabilnością postawy z częstymi upadkami, co towarzyszy objawom pozapiramidowym.
Priapizm
Donoszono o przypadkach priapizmu wywołanych przez leki przeciwpsychotyczne (w tym rysperydon) o działaniu blokującym receptory alfa-adrenergiczne. Podczas obserwacji po wprowadzeniu produktu leczniczego do obrotu odnotowano również przypadki priapizmu wywołane przez paliperydon podawany doustnie, będący aktywnym metabolitem rysperydonu. Należy poinformować pacjentów, aby zgłosili się pilnie do lekarza, jeśli objawy priapizmu nie ustąpią w ciągu 4 godzin.
Regulacja temperatury ciała
Lekom przeciwpsychotycznym przypisywano właściwość zakłócania zdolności organizmu do obniżania temperatury podstawowej ciała. Zaleca się zachowanie odpowiedniej ostrożności w przypadku przypisywania paliperydonu pacjentom, którzy mogą znaleźć się w sytuacjach sprzyjających podwyższeniu podstawowej temperatury ciała, np.: podejmujących intensywny wysiłek fizyczny, narażonych na działanie skrajnie wysokich temperatur, przyjmujących jednocześnie leki o działaniu przeciwcholinergicznym lub odwodnionych.
Żylna choroba zakrzepowo-zatorowa
Podczas stosowania leków przeciwpsychotycznych zgłaszano przypadki żylnej choroby zakrzepowo-zatorowej (ang. venous thromboembolism, VTE). U pacjentów leczonych lekami przeciwpsychotycznymi często występują nabyte czynniki ryzyka zakrzepicy z zatorami w układzie żylnym, z tego względu przed rozpoczęciem oraz w trakcie leczenia paliperydonem należy rozpoznać wszystkie potencjalne czynniki zwiększające ryzyko wystąpienia żylnej choroby zakrzepowo-zatorowej oraz podjąć odpowiednie środki zapobiegawcze.
Działanie przeciwwymiotne
W badaniach przedklinicznych z użyciem paliperydonu obserwowano działanie przeciwwymiotne. W przypadku stosowania leku u ludzi działanie to może maskować objawy przedmiotowe i podmiotowe przedawkowania niektórych leków lub stany, takie jak niedrożność jelit, zespół Reye’a i nowotwór mózgu.
Sposób podawania
Należy uważać, aby uniknąć nieumyślnego podania produktu leczniczego Paliperidone Teva do naczynia krwionośnego.
Śródoperacyjny zespół wiotkiej tęczówki
U pacjentów przyjmujących produkty lecznicze o działaniu antagonistycznym na receptory alfa1a- adrenergiczne, takie jak paliperydon, stwierdzano podczas operacji usunięcia zaćmy śródoperacyjny zespół wiotkiej tęczówki (ang. intraoperative floppy iris syndrome, IFIS) (patrz punkt 4.8).
Zespół IFIS może zwiększać ryzyko powikłań ocznych w trakcie i po zabiegu. Przed zabiegiem trzeba poinformować wykonującego go okulistę o aktualnym lub wcześniejszym przyjmowaniu produktów leczniczych o działaniu antagonistycznym na receptory alfa1a-adrenergiczne. Nie ustalono możliwych korzyści z odstawienia leków blokujących receptory alfa1 przed zabiegiem usunięcia zaćmy i należy to rozważyć wobec ryzyka przerwania leczenia przeciwpsychotycznego.
Substancje pomocnicze
Produkt leczniczy zawiera mniej niż 1 mmol (23 mg) sodu na dawkę, to znaczy lek uznaje się za
„wolny od sodu”.
Zaleca się zachowanie ostrożności w przypadku przepisywania paliperydonu wraz z innymi produktami leczniczymi wydłużającymi ostęp QT, np. lekami przeciwarytmicznymi klasy IA (np. chinidyna, dyzopyramid) oraz lekami przeciwarytmicznymi klasy III (np. amiodaron, sotalol), niektórymi lekami przeciwhistaminowymi, niektórymi innymi lekami przeciwpsychotycznymi, a także niektórymi lekami przeciwmalarycznymi (np. meflochina). Powyższa lista ma charakter informacyjny i nie jest listą wyczerpującą.
Możliwość wpływu produktu leczniczego Paliperidone Teva na inne leki
Nie przewiduje się istotnych klinicznie interakcji farmakokinetycznych paliperydonu z produktami leczniczymi, które są metabolizowane przez izoenzymy cytochromu P-450.
Biorąc pod uwagę zasadniczy wpływ paliperydonu na ośrodkowy układ nerwowy (OUN) (patrz punkt 4.8), należy zachować ostrożność, stosując paliperydon w połączeniu z innymi produktami leczniczymi działającymi ośrodkowo, np. anksjolitykami, większością leków przeciwpsychotycznych, lekami nasennymi, opioidami, itp. lub alkoholem.
Paliperydon może antagonizować działanie lewodopy i innych agonistów dopaminergicznych. Jeśli to skojarzenie leków wydaje się konieczne, szczególnie w schyłkowej fazie choroby Parkinsona, należy zastosować najmniejsze skuteczne dawki obu leków.
Z powodu możliwości wywoływania niedociśnienia ortostatycznego (patrz punkt 4.4), można zaobserwować efekt addytywny w przypadku stosowania produktu leczniczego Paliperidone Teva wraz z innymi produktami leczniczymi o takim samym potencjale, np. innymi lekami przeciwpsychotycznymi, lekami trójpierścieniowymi.
Zaleca się ostrożność, jeśli paliperydon podawany jest z innymi produktami leczniczymi, które obniżają próg drgawkowy (tj.: fenotiazyny lub butyrofenony, leki trójpierścieniowe lub selektywne inhibitory wychwytu zwrotnego serotoniny (SSRI), tramadol, meflochina, itd.).
Jednoczesne doustne podawanie tabletek paliperydonu o przedłużonym uwalnianiu w stanie stacjonarnym (12 mg raz na dobę) wraz z tabletkami diwalproinianu sodu o przedłużonym uwalnianiu (od 500 mg do 2000 mg raz na dobę) nie wpływało na farmakokinetykę walproinianu w stanie stacjonarnym.
Nie przeprowadzono badań dotyczących interakcji farmakokinetycznej paliperydonu i litu, jednak jest ona mało prawdopodobna.
Możliwość wpływu innych leków na produkt leczniczy Paliperidone Teva
Badania in vitro wykazały, że w metabolizmie paliperydonu w minimalnym stopniu mogą uczestniczyć enzymy CYP2D6 i CYP3A4, nie ma jednak wyników badań in vitro ani in vivo wskazujących, że te izoenzymy odgrywają znaczącą rolę w metabolizmie paliperydonu.
Jednoczesne podawanie doustne paliperydonu z paroksetyną, silnym inhibitorem enzymu CYP2D6, nie miało istotnego klinicznie wpływu na farmakokinetykę paliperydonu.
Jednoczesne podawanie doustnego paliperydonu o przedłużonym uwalnianiu raz na dobę wraz z karbamazepiną w dawce 200 mg dwa razy na dobę spowodowało zmniejszenie średniej wartości Cmax w stanie stacjonarnym oraz wartości AUC paliperydonu o około 37%. Jest to w znacznym stopniu spowodowane zwiększeniem o 35% klirensu nerkowego paliperydonu, prawdopodobnie w wyniku pobudzenia przez karbamazepinę aktywności glikoproteiny P (P-gp) znajdującej się w nerkach. Niewielkie zmniejszenie ilości substancji czynnej wydalonej z moczem w postaci niezmienionej wskazuje na niewielki wpływ na metabolizm zależny od enzymów CYP lub dostępność biologiczną paliperydonu w przypadku skojarzonego stosowania z karbamazepiną.
Większe spadki stężenia paliperydonu w osoczu mogą nastąpić po większych dawkach karbamazepiny.
Rozpoczynając stosowanie karbamazepiny, dawkę produktu leczniczego Paliperidone Teva należy ponownie ocenić i, w razie konieczności, zwiększyć. I odwrotnie, w przypadku przerwania stosowania karbamazepiny, dawkę produktu leczniczego Paliperidone Teva należy ponownie ocenić i, w razie konieczności, zmniejszyć.
Jednoczesne doustne podawanie pojedynczej dawki paliperydonu w postaci tabletek o przedłużonym uwalnianiu (12 mg) wraz z diwalproinianem sodu w postaci tabletek o przedłużonym uwalnianiu (dwie tabletki 500 mg raz na dobę) spowodowało zwiększenie o ok. 50% wartości Cmax
i AUC paliperydonu, prawdopodobnie w wyniku zwiększonego wchłaniania po podaniu doustnym. Ponieważ nie zaobserwowano wpływu na klirens ogólnoustrojowy, nie oczekuje się istotnej klinicznie interakcji między diwalproinianem sodu w postaci tabletek o przedłużonym uwalnianiu i paliperydonu podawanego domięśniowo. Nie zbadano tej interakcji w przypadku stosowania produktu leczniczego Paliperidone Teva.
Jednoczesne stosowanie produktu leczniczego Paliperidone Teva z rysperydonem lub paliperydonem podawanym doustnie
Ponieważ paliperydon jest głównym aktywnym metabolitem rysperydonu, należy zachować ostrożność w razie jednoczesnego stosowania przez dłuższy czas rysperydonu lub doustnego paliperydonu. Dane dotyczące bezpieczeństwa stosowania paliperydonu jednocześnie z innymi lekami przeciwpsychotycznymi są ograniczone.
Jednoczesne stosowanie produktu Paliperidone Teva z lekami psychostymulującymi
Jednoczesne stosowanie leków psychostymulujących (np. metylofenidatu) z paliperydonem może prowadzić do wystąpienia objawów pozapiramidowych po zmianie jednego lub obu leków (patrz punkt 4.4).
Ciąża
Brak wystarczających danych dotyczących stosowania paliperydonu podczas ciąży. Podawany domięśniowo palmitynian paliperydonu i podawany doustnie paliperydon nie wywoływały wad rozwojowych w badaniach przeprowadzonych na zwierzętach, jednak zaobserwowano inne rodzaje szkodliwego wpływu na rozród (patrz punkt 5.3). Noworodki narażone na działanie paliperydonu w
czasie trzeciego trymestru ciąży są w grupie ryzyka, w której mogą wystąpić działania niepożądane, w tym zaburzenia pozapiramidowe i (lub) objawy odstawienne o różnym nasileniu i czasie trwania po porodzie. Obserwowano pobudzenie, wzmożone napięcie, obniżone napięcie, drżenie, senność, zespół zaburzeń oddechowych lub zaburzenia związane z karmieniem. W związku z powyższym noworodki powinny być uważnie monitorowane. Produktu leczniczego Paliperidone Teva nie należy stosować w czasie ciąży, jeśli nie jest to bezwzględnie konieczne.
Karmienie piersią
Paliperydon przenika do mleka ludzkiego w takiej ilości, że może wpływać na organizm dziecka karmionego piersią, jeśli kobieta karmiąca przyjmuje dawki terapeutyczne leku. Produkt leczniczy Paliperidone Teva nie powinien być stosowany podczas karmienia piersią.
Płodność
W badaniach nieklinicznych nie zaobserwowano istotnego wpływu na płodność.
Paliperydon może wywierać niewielki lub umiarkowany wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn ze względu na potencjalne działanie na układ nerwowy i wzrok, wiążące się z objawami, takimi jak sedacja, senność, omdlenia, niewyraźne widzenie (patrz punkt 4.8). Dlatego należy poinformować pacjentów, aby nie prowadzili pojazdów mechanicznych ani nie obsługiwali maszyn, aż do ustalenia indywidualnej podatności na działanie produktu leczniczego Paliperidone Teva.
Podsumowanie profilu bezpieczeństwa
W badaniach klinicznych najczęściej zgłaszano następujące działania niepożądane leku: bezsenność, ból głowy, lęk, infekcję górnych dróg oddechowych, reakcje w miejscu wstrzyknięć, parkinsonizm, zwiększenie masy ciała, akatyzję, pobudzenie, sedację/senność, nudności, zaparcia, zawroty głowy, ból mięśniowo-szkieletowy, częstoskurcz, drżenie, ból w jamie brzusznej, wymioty, biegunkę, zmęczenie i dystonię. Akatyzja i sedacja/senność były zależne od wielkości dawki.
Tabelaryczna lista działań niepożądanych
Poniżej wymieniono wszystkie działania niepożądane leku zgłoszone podczas stosowania paliperydonu zgodnie z kategoriami częstości występowania w badaniach klinicznych palmitynianu paliperydonu. Przyjęto następujące określenia odnoszące się do częstości występowania działań niepożądanych: bardzo często (≥ 1/10); często (≥ 1/100 do < 1/10); niezbyt często (≥ 1/1 000 do < 1/100); rzadko (≥ 1/10 000 do < 1/1 000); bardzo rzadko (< 1/10 000) oraz częstość nieznana (częstość nie może być określona na podstawie dostępnych danych).
Klasyfikacja układów i narządów | Działania niepożądane leku | ||||
Częstość | |||||
Bardzo często | Często | Niezbyt często | Rzadko | Nieznanaa | |
Zakażenia i zarażenia pasożytnicze | zakażenie górnych dróg oddechowych, zakażenie dróg moczowych, grypa | zapalenie płuc, zapalenie oskrzeli, zakażenie dróg oddechowych, zapalenie zatok, zapalenie pęcherza | zakażenie oka, zapalenie skóry wywołane przez roztocza, ropień podskórny | ||
Klasyfikacja układów i narządów | Działania niepożądane leku | ||||
Częstość | |||||
Bardzo często | Często | Niezbyt często | Rzadko | Nieznanaa | |
moczowego, zakażenie ucha, zapalenie migdałków, grzybica paznokci, zapalenie tkanki łącznej | |||||
Zaburzenia krwi i układu chłonnego | zmniejszenie liczby leukocytów, trombocytopenia, niedokrwistość | neutropenia, zwiększenie liczby eozynofilów | agranulocytoza | ||
Zaburzenia układu immunologicz nego | nadwrażliwość | reakcja anafilaktyczna | |||
Zaburzenia endokrynolog iczne | hiperprolaktynemia b | nieprawidłowe wydzielanie hormonu antydiuretycznego obecność glukozy w moczu | |||
Zaburzenia metabolizmu i odżywiania | hiperglikemia, zwiększenie masy ciała, zmniejszenie masy ciała, zmniejszenie apetytu | cukrzycad, hiperinsulinemia, zwiększenie apetytu, jadłowstręt, zwiększenie stężenia triglicerydów we krwi, zwiększone stężenie cholesterolu we krwi | cukrzycowa kwasica ketonowa, hipoglikemia, polidypsja | zatrucie wodne | |
Zaburzenia psychiczne | bezsennośće | pobudzenie, depresja, lęk | zaburzenia snu, mania, zmniejszone libido, nerwowość, koszmary senne | katatonia, stan splątania, somnambulizm, przytępiony afekt, anorgazmia | zaburzenia odżywiania związane ze snem |
Zaburzenia układu nerwowego | parkinsonizmc, akatyzjac, sedacja/senność, dystoniac, zawroty głowy, dyskinezac, drżenie, ból głowy | późne dyskinezy, omdlenia, hiperaktywność psychomotoryczna, zawroty głowy związane z pozycją ciała, zaburzenia koncentracji, dyzartria, zaburzenia smaku, niedoczulica, parestezje | złośliwy zespół neuroleptyczny, niedokrwienie mózgu, brak reakcji na bodźce, utrata świadomości, zmniejszony poziom świadomości, napady drgawkowee, zaburzenia równowagi, nieprawidłowa koordynacja | śpiączka cukrzycowa, kiwanie głową | |
Zaburzenia oka | niewyraźne widzenie, zapalenie spojówek, suche oko | jaskra, zaburzenia ruchów gałki ocznej, rotacyjne ruchy gałek | zespół wiotkiej tęczówki (śródoperacyjny) | ||
Klasyfikacja układów i narządów | Działania niepożądane leku | ||||
Częstość | |||||
Bardzo często | Często | Niezbyt często | Rzadko | Nieznanaa | |
ocznych, światłowstręt, zwiększone łzawienie, przekrwienie oczu | |||||
Zaburzenia ucha i błędnika | zawroty głowy, szum w uszach, ból ucha | ||||
Zaburzenia serca | tachykardia | blok przedsionkowo- komorowy, zaburzenia przewodnictwa, wydłużenie odstępu QT w EKG, zespół tachykardii postawno- ortostatycznej, bradykardia, nieprawidłowy zapis EKG, kołatanie serca | migotanie przedsionków, niemiarowość zatokowa | ||
Zaburzenia naczyniowe | Nadciśnienie tętnicze | niedociśnienie, niedociśnienie ortostatyczne | zakrzepica żył głębokich, napady zaczerwienienia | zatorowość płucna, niedokrwienie | |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | kaszel, przekrwienie błony śluzowej nosa | duszność, przekrwienie dróg oddechowych, sapanie, ból gardła i krtani, krwawienie z nosa | zespół bezdechu śródsennego, zastój krwi w płucach, rzężenie | hiperwen- tylacja, zachłystowe zapalenie płuc, dysfonia | |
Zaburzenia żołądka i jelit | ból w jamie brzusznej, wymioty, nudności, zaparcia, biegunka, niestrawność, ból zęba | dyskomfort w jamie brzusznej, zapalenie żołądka i jelit, dysfagia, suchość błony śluzowej jamy ustnej, wzdęcia | zapalenie trzustki, obrzęk języka, nietrzymanie stolca, kamienie kałowe, zapalenie warg | niedrożność jelit, ileus | |
Zaburzenia wątroby i dróg żółciowych | zwiększenie aktywności aminotransferaz | zwiększenie aktywności gamma- glutamylo- transferazy, zwiększenie aktywności enzymów wątrobowych | żółtaczka | ||
Zaburzenia skóry i tkanki podskórnej | pokrzywka, świąd, wysypka, łysienie, wyprysk, sucha skóra, rumień, trądzik | wysypka polekowa, hiperkeratoza, łupież | Zespół Stevensa- Johnsona/martwica toksyczno- rozpływna naskórka, obrzęk naczyniowy, odbarwienie skóry, łojotokowe zapalenie skóry | ||
Zaburzenia | ból mięśniowo- | zwiększone | rabdomioliza, | nieprawidłowa | |
Klasyfikacja układów i narządów | Działania niepożądane leku | ||||
Częstość | |||||
Bardzo często | Często | Niezbyt często | Rzadko | Nieznanaa | |
mięśniowo- szkieletowe i tkanki łącznej | szkieletowy, bóle pleców, ból stawów | stężenie kinazy fosfokreatynowej we krwi, skurcze mięśni, sztywność stawów, osłabienie mięśni, ból szyi | obrzęk stawów | postawa ciała | |
Zaburzenia nerek i dróg moczowych | nietrzymanie moczu, częstomocz, dysuria | zastój moczu | |||
Ciąża, połóg i okres okołoporodo wy | noworodkowy zespół odstawienny (patrz punkt 4.6) | ||||
Zaburzenia układu rozrodczego i piersi | brak miesiączki, mlekotok | zaburzenia erekcji, zaburzenia ejakulacji, zaburzenia miesiączkowaniae ginekomastia, zaburzenia seksualne, ból piersi | dyskomfort piersi, obrzmienie piersi, powiększenie piersi, wydzielina z pochwy | priapizm | |
Zaburzenia ogólne i stany w miejscu podania | gorączka, astenia, zmęczenie, reakcja w miejscu wstrzyknięcia | obrzęk twarzy, obrzęke, zwiększenie temperatury ciała, nieprawidłowy sposób chodzenia, ból w klatce piersiowej, dyskomfort w klatce piersiowej, złe samopoczucie, stwardnienie | hipotermia, dreszcze, pragnienie, zespół odstawienia leku, ropień w miejscu wstrzyknięcia, zapalenie tkanki łącznej w miejscu wstrzyknięcia, torbiel w miejscu wstrzyknięcia, krwiak w miejscu wstrzyknięcia | zmniejszenie tempera- tury ciała, martwica w miejscu wstrzyknięcia, wrzód w miejscu wstrzyknięcia | |
Urazy, zatrucia i powikłania po zabiegach | upadek | ||||
a Częstość występowania tych działań niepożądanych została zakwalifikowana jako „nieznana”, gdyż nie stwierdzano ich w badaniach klinicznych palmitynianu paliperydonu. Pochodziły one albo ze zgłoszeń spontanicznych po wprowadzeniu produktu do obrotu, których częstości nie da się określić, albo z danych z badań klinicznych lub zgłoszeń po wprowadzeniu do obrotu dotyczących rysperydonu (jakiejkolwiek postaci) lub doustnego paliperydonu.
b Patrz poniżej „Hiperprolaktynemia”
c Patrz poniżej „Objawy pozapiramidowe”.
d W badaniach z kontrolą placebo cukrzycę zgłaszano u 0,32% osób leczonych paliperydonem w porównaniu do 0,39% w grupie placebo. Całkowita częstość występowania cukrzycy we wszystkich badaniach klinicznych wyniosła 0,65% u wszystkich osób leczonych palmitynianem paliperydonu.
e Bezsenność obejmuje: trudności z zasypianiem, bezsenność śródnocną; Napady drgawkowe obejmują: uogólniony napad toniczno- kloniczny; Obrzęk obejmuje: obrzęk uogólniony, obrzęk obwodowy, obrzęk ciastowaty. Zaburzenia miesiączkowania obejmują: opóźnienia miesiączki, nieregularne miesiączkowanie, skąpe miesiączkowanie.
Działania niepożądane stwierdzone podczas stosowania postaci farmaceutycznych rysperydonu
Paliperydon jest czynnym metabolitem rysperydonu, dlatego profile działań niepożądanych tych substancji (w tym zarówno postaci doustnych, jak i postaci we wstrzyknięciach) odpowiadają sobie wzajemnie.
Opis wybranych działań niepożądanych
Reakcja anafilaktyczna
Po wprowadzeniu produktu do obrotu zgłaszano rzadkie przypadki reakcji anafilaktycznej po wstrzyknięciu paliperydonu u pacjentów, którzy wcześniej tolerowali doustne postacie rysperydonu lub paliperydonu (patrz punkt 4.4).
Reakcje w miejscu wstrzyknięcia
Najczęściej zgłaszanym działaniem niepożądanym związanym z miejscem wstrzyknięcia był ból. Nasilenie większości zgłaszanych reakcji określano jako łagodne do umiarkowanego. We wszystkich badaniach fazy 2 i 3 paliperydonu, w ocenie bólu w miejscu wstrzyknięcia przez badanych opartej na skali wzrokowo-analogowej wykazano tendencję do zmniejszania częstości występowania i natężenia odczucia z czasem. Wstrzyknięcia do mięśnia naramiennego były postrzegane jako nieznacznie bardziej bolesne od analogicznego wstrzyknięcia do mięśnia pośladkowego. Pozostałe reakcje w miejscu wstrzyknięcia charakteryzowały się przeważnie łagodnym nasileniem i obejmowały stwardnienie (często), świąd (niezbyt często) i guzki (rzadko).
Objawy pozapiramidowe (EPS)
Objawy pozapiramidowe uwzględniały łącznie następujące zespoły objawów: parkinsonizm (w tym zwiększone wydzielanie śliny, sztywność mięśni szkieletowych, parkinsonizm, ślinienie się, sztywność typu koła zębatego, bradykinezja, hipokinezja, maskowata twarz, napięcie mięśni, akinezja, sztywność karku, sztywność mięśni, chód parkinsonowski, nieprawidłowy odruch gładziznowy oraz drżenie spoczynkowe w parkinsonizmie), akatyzja (w tym akatyzja, niepokój psychoruchowy, hiperkinezja, zespół niespokojnych nóg), dyskineza (dyskineza, drganie mięśni, choreoatetoza, atetoza i mioklonia), dystonia (w tym dystonia, wzmożone napięcie mięśni, kręcz szyi, mimowolne skurcze mięśni, przykurcze mięśni, kurcz powiek, rotacja gałek ocznych, porażenie języka, skurcz mięśni twarzy, skurcz mięśni krtani, miotonia, opistotonus, skurcz części ustnej gardła, pleurototonus, skurcz języka i szczękościsk) oraz drżenie. Należy zauważyć, że uwzględniono szersze spektrum objawów, które niekoniecznie mają pochodzenie pozapiramidowe.
Zwiększenie masy ciała
W trwającym 13 tygodni badaniu u pacjentów przyjmujących dawkę początkową 150 mg, częstość występowania nieprawidłowego zwiększenia masy ciała ≥7% była zależna od dawki i wynosiła 5% u badanych z grupy przyjmującej placebo oraz 6%, 8% i 13% w grupach stosujących paliperydon w dawkach odpowiednio 25 mg, 100 mg i 150 mg.
W trwającej 33 tygodnie otwartej fazie przejściowej/podtrzymującej długoterminowego badania dotyczącego zapobiegania nawrotom, 12% badanych przyjmujących produkt leczniczy Paliperidone Teva spełniło to kryterium (zwiększenie masy ciała ≥7% od fazy podwójnie ślepej próby aż do punktu końcowego badania); średnia (SD) zmiana masy ciała od punktu wyjścia fazy otwartej wyniosła +0,7 (4,79) kg.
Hiperprolaktynemia
W badaniach klinicznych zaobserwowano wzrost mediany stężenia prolaktyny w surowicy u badanych obu płci przyjmujących produkt leczniczy paliperydon. Działania niepożądane, które mogą wskazywać na zwiększone stężenie prolaktyny (np. brak miesiączki, mlekotok, zaburzenia menstruacji, ginekomastia) wystąpiły ogółem u <1% badanych.
Efekt klasy
W związku z przyjmowaniem leków przeciwpsychotycznych mogą wystąpić następujące działania niepożądane: wydłużenie odstępu QT, niemiarowości komorowe (migotanie komór, tachykardia komorowa), nagły zgon z niewyjaśnionych przyczyn, zatrzymanie krążenia oraz częstoskurcz komorowy typu torsade de pointes.
Zgłaszano przypadki żylnej choroby zakrzepowo-zatorowej, w tym zatorowości płucnej oraz zakrzepicy żył głębokich, związane ze stosowaniem leków przeciwpsychotycznych (częstość występowania nieznana).
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa
Tel: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Objawy
Na ogół spodziewane objawy przedmiotowe i podmiotowe są takie same jak znane skutki farmakologiczne związane z przedawkowaniem paliperydonu, tj. senność i sedacja, częstoskurcz i niedociśnienie, wydłużenie odstępu QT oraz objawy pozapiramidowe. U pacjentów, którzy przedawkowali przyjmowany doustnie paliperydon zgłaszano przypadki częstoskurczu komorowego typu torsade de pointes oraz migotanie komór. W razie ostrego stanu związanego z przedawkowaniem należy rozważyć możliwość jednoczesnego wpływu różnych leków.
Postępowanie
Oceniając potrzeby terapeutyczne oraz powrót do zdrowia należy uwzględnić przedłużone uwalnianie produktu leczniczego i długi okres półtrwania paliperydonu. Nie ma określonego antidotum na paliperydon. Należy zastosować doraźne środki zaradcze. Należy zapewnić i podtrzymywać drożność dróg oddechowych oraz zapewnić właściwe natlenienie i wentylację.
Należy natychmiast rozpocząć obserwację układu sercowo-naczyniowego, w tym stałe monitorowanie EKG pod kątem potencjalnych niemiarowości. W razie niedociśnienia i zapaści krążeniowej należy podjąć odpowiednie środki zaradcze, takie jak dożylne podawanie płynu i (lub) środków sympatykomimetycznych. W przypadku ciężkich objawów pozapiramidowych należy podać środki przeciwcholinergiczne. Należy kontynuować ścisły nadzór i obserwację, aż do wyzdrowienia pacjenta.
Grupa farmakoterapeutyczna: Leki psycholeptyczne, inne leki przeciwpsychotyczne, kod ATC: N05AX13
Paliperidone Teva zawiera mieszaninę racemiczną (+)- i (-)-paliperydonu. Mechanizm działania
Paliperydon jest selektywnym czynnikiem blokującym działanie monoamin, którego właściwości farmakologiczne różnią się od właściwości neuroleptyków klasycznych. Paliperydon silnie wiąże
się z receptorami serotoninergicznymi 5-HT2 i dopaminergicznymi D2. Blokuje także receptory alfa 1-adrenergiczne i nieznacznie słabiej receptory H1-histaminergiczne i alfa 2-adrenergiczne.
Aktywność farmakologiczna enancjomerów (+)- i (-)-paliperydonu jest podobna pod względem jakościowym i ilościowym.
Paliperydon nie wiąże się z receptorami cholinergicznymi. Chociaż paliperydon jest silnym antagonistą receptorów D2, co, jak się uważa, łagodzi objawy wytwórcze schizofrenii, powoduje rzadziej stany kataleptyczne i w mniejszym stopniu hamuje funkcje motoryczne niż klasyczne neuroleptyki. Dominujący ośrodkowy antagonizm serotoniny może zmniejszać tendencję paliperydonu do powodowania pozapiramidowych działań niepożądanych.
Skuteczność kliniczna
Leczenie nawrotu schizofrenii
Skuteczność paliperydonu w leczeniu nawrotu schizofrenii oceniono w czterech podwójnie zaślepionych, randomizowanych, kontrolowanych placebo krótkoterminowych badaniach (jedno trwające 9 tygodni i trzy trwające 13 tygodni), polegających na podawaniu stałej dawki dorosłym, hospitalizowanym pacjentom z nawrotem, spełniających kryteria klasyfikacji schizofrenii DSM-IV. W badaniach tych stałą dawkę produktu leczniczego paliperydonu podawano w dniach 1., 8. i 36. badania trwającego 9 tygodni oraz dodatkowo w 64. dniu badania trwającego 13 tygodni. Podczas leczenia nawrotu schizofrenii paliperydonem nie było potrzebne doustne podawanie dodatkowych leków przeciwpsychotycznych. Pierwszorzędowym punktem końcowym było zmniejszenie całkowitej punktacji skali objawów pozytywnych i negatywnych (ang. Positive and Negative Syndrome Scale, PANSS), co przedstawiono w poniższej tabeli. Skala PANSS jest uznanym zestawem wielu pozycji, złożonym z pięciu czynników służących ocenie objawów pozytywnych, negatywnych, dezorganizacji myślenia, niekontrolowanej wrogości/podniecenia oraz lęku/depresji. Funkcjonowanie oceniono za pomocą skali funkcjonowania indywidualnego i społecznego (ang.
Personal and Social Performance, PSP). Skala PSP jest uznaną skalą, używaną przez lekarzy klinicystów, służącą do określania funkcjonowania indywidualnego i społecznego w czterech obszarach: aktywności użytecznych społecznie (praca i nauka), związków osobistych i społecznych, dbałości o higienę osobistą oraz zachowań agresywnych i zakłócających porządek.
W badaniu trwającym 13 tygodni (n = 636), porównującym działanie trzech ustalonych dawek paliperydonu (początkowe wstrzyknięcie do mięśnia naramiennego 150 mg, a następnie 3 dawki podane do mięśnia pośladkowego lub naramiennego: 25 mg/4 tygodnie, 100 mg/4 tygodnie lub 150 mg/4 tygodnie) do placebo, wszystkie trzy dawki paliperydonu wykazały działanie lepsze od placebo pod względem poprawy całkowitej punktacji w skali PANSS. W tym badaniu w grupach leczonych dawkami 100 mg/4 tygodnie oraz 150 mg/4 tygodnie wykazano statystyczną przewagę nad placebo pod względem punktacji w skali PSP. Nie dotyczyło to dawki 25 mg/4 tygodnie.
Wyniki te potwierdzają skuteczność produktu w ciągu całego okresu leczenia i poprawę punktacji w skali PANSS. Zaobserwowano je już w 4. dniu, natomiast do 8. dnia nastąpiło wyraźne rozróżnienie wyników w grupach przyjmujących paliperydon w dawkach 25 mg i 150 mg w porównaniu do grupy przyjmującej placebo.
Inne badania dostarczyły statystycznie istotnych wyników przemawiających na korzyść paliperydonu, oprócz dawki 50 mg w jednym badaniu (patrz tabela poniżej).
Całkowita punktacja skali objawów pozytywnych i negatywnych w schizofrenii (PANSS) — zmiana z punktu wyjścia do punktu końcowego — ekstrapolacja ostatniej obserwacji (ang. Last Observation Carried Forward, LOCF) dla badań R092670-SCH-201, R092670-PSY-3003, R092670-PSY-3004 i R092670- PSY-3007: Zestaw analiz skuteczności podstawowej | |||||
Placebo | 25 mg | 50 mg | 100 mg | 150 mg | |
R092670-PSY-3007* | n = 160 | n = 155 | n = 161 | n = 160 | |
Średnia wyjściowa (SD) | 86,8 (10,31) | 86,9 (11,99) | 86,2 (10,77) | 88,4 (11,70) | |
Średnia zmiana (SD) Wartość p (vs. placebo) | -2,9 (19,26) -- | -8,0 (19,90) 0,034 | -- | -11,6 (17,63) < 0,001 | -13,2 (18,48) < 0,001 |
R092670-PSY-3003 Średnia wyjściowa (SD) Średnia zmiana (SD) Wartość p (vs. placebo) | n = 132 92,4 (12,55) -4,1 (21,01) -- | -- | n = 93 89,9 (10,78) -7,9 (18,71) 0,193 | n = 94 90,1 (11,66) -11,0 (19,06) 0,019 | n = 30 92,2 (11,72) -5,5 (19,78) |
R092670-PSY-3004 Średnia wyjściowa (SD) Średnia zmiana (SD) Wartość p (vs. placebo) | n = 125 90,7 (12,22) -7,0 (20,07) -- | n = 129 90,7 (12,25) -13,6 (21,45) 0,015 | n = 128 91,2 (12,02) -13,2 (20,14) 0,017 | n = 131 90,8 (11,70) -16,1 (20,36) < 0,001 | -- |
R092670-SCH-201 Średnia wyjściowa (SD) Średnia zmiana (SD) Wartość p (vs. placebo) | n=66 87,8 (13,90) 6,2 (18,25) -- | -- | n=63 88,0 (12,39) -5,2 (21,52) 0,001 | n=68 85,2 (11,09) -7,8 (19,40) < 0,0001 | -- |
* W przypadku badania R092670-PSY-3007 dawkę początkową wynoszącą 150 mg podano wszystkim pacjentom przyjmującym paliperydon w 1. dniu, a następnie podawano im później przydzieloną dawkę.
Uwaga: ujemna zmiana punktacji oznacza poprawę.
Utrzymywanie kontroli objawów i opóźnianie nawrotu schizofrenii
Skuteczność paliperydonu w utrzymywaniu kontroli objawów i opóźnianiu nawrotu schizofrenii ustalono w długoterminowym, podwójnie zaślepionym, kontrolowanym placebo badaniu przy użyciu zmiennych dawek, przeprowadzonym z udziałem 849 osób dorosłych, niebędących w podeszłym wieku i spełniających kryteria klasyfikacji schizofrenii DSM-IV. Badanie to składało się z otwartego trwającego 33 tygodnie etapu leczenia fazy ostrej i stabilizacji, randomizowanego podwójnie zaślepionego kontrolowanego placebo etapu obserwacji pod kątem nawrotu choroby oraz trwającego 52 tygodnie otwartego okresu dodatkowego. W tym badaniu dawki paliperydonu wynosiły 25, 50, 75 i 100 mg i były podawane co miesiąc; dawka 75 mg była dozwolona wyłącznie w trwającym 52 tygodnie otwartym okresie dodatkowym. Badane osoby początkowo otrzymywały elastycznie dobierane dawki (25-100 mg) paliperydonu w 9-tygodniowym okresie przejściowym, po czym nastąpił trwający 24 tygodnie okres podtrzymujący, w którym wymagano, aby punktacja w skali PANSS wyniosła dla badanych ≤ 75. Dostosowanie dawki było dozwolone jedynie w ciągu pierwszych 12 tygodni okresu podtrzymującego. Łącznie 410 stabilnych pacjentów przydzielono losowo do grupy przyjmującej paliperydon [mediana czasu trwania wynosiła 171 dni (zakres: od 1 do 407 dni)] lub grupy przyjmującej placebo [mediana czasu trwania wynosiła 105 dni (zakres: od 8 do 441 dni)] aż do nawrotu objawów schizofrenii w trakcie podwójnie zaślepionego etapu badania o różnym czasie trwania. Badanie przerwano wcześniej ze względu na skuteczność, gdyż zaobserwowano znacznie dłuższy czas do nawrotu choroby (p < 0,0001, Rys. 1) u pacjentów przyjmujących paliperydon w porównaniu do placebo (współczynnik ryzyka = 4,32; 95% przedział ufności (CI): 2,4-7,7).
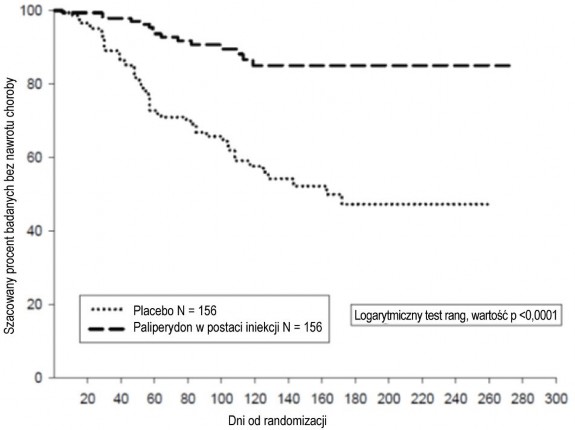
Rysunek 1: Wykres Kaplan-Meiera przedstawiający czas do nawrotu — analiza pośrednia (zestaw analiz pośrednich dla populacji z zamiarem leczenia ITT (ang. Intent-to-Treat Interim Analysis Set).
Dzieci i młodzież
Europejska Agencja Leków uchyliła obowiązek dołączania wyników badań dla referencyjnego produktu leczniczego zawierającego paliperydon we wszystkich podgrupach populacji dzieci i młodzieży ze schizofrenią. Stosowanie u dzieci i młodzieży, patrz punkt 4.2.
Wchłanianie i dystrybucja
Palmitynian paliperydonu jest estrem palmitynowym, prolekiem paliperydonu. Z powodu bardzo małej rozpuszczalności w wodzie, palmitynian paliperydonu po wstrzyknięciu domięśniowo rozpuszcza się powoli, zanim zostanie zhydrolizowany do paliperydonu i wchłonięty do krążenia ustrojowego. Po podaniu domięśniowym pojedynczej dawki stężenie paliperydonu w osoczu stopniowo wzrasta, osiągając wartość maksymalną przy medianie czasu Tmax wynoszącej 13 dni. Uwalnianie substancji czynnej rozpoczyna się już w 1. dniu i trwa przez co najmniej 4 miesiące.
Po wstrzyknięciu domięśniowo pojedynczych dawek (25-150 mg) do mięśnia naramiennego zaobserwowano stężenie Cmax większe o ok. 28% w porównaniu do wstrzyknięcia do mięśnia pośladkowego. Dwa początkowe wstrzyknięcia do mięśnia naramiennego dawki 150 mg w 1. dniu i dawki 100 mg w 8. dniu ułatwiają szybkie uzyskanie stężeń terapeutycznych. Profil uwalniania i schemat dawkowania produktu leczniczego paliperydonu umożliwia utrzymanie tych stężeń.
Całkowita ekspozycja na paliperydon po podaniu paliperydonu w postaci zawiesiny do wstrzykiwań o przedłużonym uwalnianiu była proporcjonalna do dawki w zakresie 25-150 mg i
mniejsza niż proporcjonalna do dawki pod względem Cmax dla dawek większych niż 50 mg. Średnia proporcja stężenia maksymalnego do stężenia minimalnego w stanie stacjonarnym w przypadku dawki 100 mg paliperydonu wyniosła 1,8 po podaniu do mięśnia pośladkowego i 2,2 po podaniu do mięśnia naramiennego. Mediana pozornego okresu półtrwania paliperydonu po podaniu paliperydonu w postaci zawiesiny do wstrzykiwań o przedłużonym uwalnianiu w dawce z zakresu 25-150 mg wynosiła od 25 do 49 dni.
Całkowita dostępność biologiczna palmitynianu paliperydonu po podaniu paliperydonu w postaci zawiesiny do wstrzykiwań o przedłużonym uwalnianiu wynosi 100%.
Po podaniu palmitynianu paliperydonu enancjomery (+) i (-) paliperydonu przechodzą przemianę wzajemną, osiągając stosunek (+) do (-) wartości AUC wynoszący około 1,6-1,8.
Wiązanie mieszaniny racemicznej paliperydonu przez białka osocza wynosi 74%. Metabolizm i eliminacja
Tydzień po podaniu doustnym pojedynczej dawki 1 mg natychmiast uwalnianego
14C-paliperydonu 59% dawki było wydalane w postaci niezmienionej z moczem, co oznacza, że paliperydon nie jest w znacznym stopniu metabolizowany przez wątrobę. Około 80% podanej dawki znakowanej radioaktywnie wykryto w moczu, a 11% w kale. Zidentyfikowano in vivo cztery szlaki metaboliczne, z których żaden nie odpowiadał za metabolizm więcej niż 6,5% dawki: dealkilację, hydroksylację, odwodornienie i odłączenie benzizoksazolu. Chociaż wyniki badań in vitro wskazywały, że w metabolizmie paliperydonu mogą uczestniczyć izoenzymy CYP2D6 i CYP3A4, w badaniach in vivo nie uzyskano dowodów na to, że odgrywają one istotną rolę w metabolizmie paliperydonu. Analizy farmakokinetyki przeprowadzone w populacji wskazują na brak dostrzegalnej różnicy klirensu paliperydonu po podaniu doustnym tego leku między osobami metabolizującymi substraty CYP2D6 w stopniu znacznym i niewielkim. Badania in vitro na ludzkich mikrosomach wątrobowych wykazały, że paliperydon nie hamuje w znaczącym stopniu metabolizmu produktów leczniczych metabolizowanych przez izoenzymy cytochromu P450, w tym CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 i CYP3A5.
Badania in vitro wykazały, że paliperydon jest substratem P-gp i w dużych stężeniach hamuje w nieznacznym stopniu P-gp. Znaczenie kliniczne tego faktu nie jest znane; brak danych in vivo.
Porównanie iniekcji długodziałającego palmitynianu paliperydonu do doustnego paliperydonu o przedłużonym uwalnianiu
Produkt leczniczy Paliperidone Teva opracowano w taki sposób, że dostarcza paliperydon przez miesiąc, podczas gdy paliperydon doustny o przedłużonym uwalnianiu jest podawany codziennie. Początkowy schemat dawkowania produktu leczniczego Paliperidone Teva (150 mg/100 mg do mięśnia naramiennego w 1. dniu/ 8. dniu) ma na celu szybkie osiągnięcie stanu stacjonarnego stężenia paliperydonu podczas rozpoczynania terapii bez dodatkowego stosowania leku doustnie.
Ogólnie, całkowite stężenia początkowe paliperydonu znajdują się w zakresie ekspozycji obserwowanym po podaniu doustnym dawki 6-12 mg paliperydonu o przedłużonym uwalnianiu. Zastosowanie schematu początkowego dawkowania paliperydonu umożliwiło pacjentom zachowanie zakresu ekspozycji odpowiadającego doustnej dawce 6-12 mg paliperydonu o przedłużonym uwalnianiu, nawet w dniach przed podaniem dawki (8. dzień i 36. dzień). Z powodu różnic między średnimi profilami farmakokinetycznymi tych dwóch produktów leczniczych, należy zachować ostrożność podczas bezpośredniego porównywania ich właściwości farmakokinetycznych.
Zaburzenia czynności wątroby
Paliperydon nie jest w znacznym stopniu metabolizowany przez wątrobę. Chociaż nie zbadano skutków stosowania paliperydonu u pacjentów z zaburzeniami czynności wątroby, dostosowanie dawki nie jest wymagane u pacjentów z łagodnymi lub umiarkowanymi zaburzeniami czynności wątroby. W badaniu pacjentów z umiarkowanymi zaburzeniami czynności wątroby (klasa B wg Child-Pugh), którym podawano doustnie paliperydon, stężenia wolnego paliperydonu w osoczu były podobne do stężeń u osób z prawidłową czynnością wątroby. Nie przeprowadzono badań dotyczących podawania paliperydonu pacjentom z ciężkimi zaburzeniami czynności wątroby.
Zaburzenia czynności nerek
Zbadano skutki podawania doustnego pojedynczej dawki paliperydonu wynoszącej 3 mg w postaci tabletek o przedłużonym uwalnianiu pacjentom z różną czynnością nerek. Eliminacja paliperydonu zmniejszała się wraz ze zmniejszaniem szacunkowego klirensu kreatyniny. Całkowity klirens paliperydonu był zmniejszony o średnio 32% u osób z łagodnymi zaburzeniami czynności nerek (CrCl = 50 do < 80 ml/min), o 64% w przypadku umiarkowanych zaburzeń czynności nerek
(CrCl = 30 do < 50 ml/min) i 71% w przypadku ciężkich zaburzeń czynności nerek (CrCl = 10 do
< 30 ml/min), co odpowiada odpowiednio 1,5; 2,6 i 4,8-krotnemu średniemu wzrostowi ekspozycji (AUCinf) w porównaniu do osób z prawidłową czynnością nerek. Na podstawie ograniczonej liczby obserwacji pacjentów z łagodnym zaburzeniem czynności nerek, u których stosowano paliperydon, oraz symulacji farmakokinetycznych, zaleca się zmniejszenie dawki (patrz punkt 4.2).
Pacjenci w podeszłym wieku
Analiza farmakokinetyki w populacji nie wykazała różnic farmakokinetyki związanych z wiekiem. Wskaźnik masy ciała (ang. Body Mass Index, BMI)/masa ciała
Badania farmakokinetyki palmitynianu paliperydonu wykazały nieznacznie niższe stężenia
paliperydonu w osoczu (10-20%) u pacjentów z nadwagą lub otyłych w porównaniu z pacjentami o prawidłowej masie ciała (patrz punkt 4.2).
Rasa
Analiza farmakokinetyki w populacji danych z badań dotyczących doustnego przyjmowania paliperydonu nie ujawniła zależnej od rasy różnicy w farmakokinetyce paliperydonu po podaniu paliperydonu.
Płeć
Nie zaobserwowano istotnych klinicznie różnic pomiędzy mężczyznami i kobietami. Palenie tytoniu
Na podstawie wyników badań in vitro przeprowadzonych z wykorzystaniem ludzkich enzymów wątrobowych stwierdzono, że paliperydon nie jest substratem dla izoenzymu CYP1A2; palenie tytoniu nie powinno mieć zatem wpływu na farmakokinetykę paliperydonu. Nie badano wpływu palenia tytoniu na farmakokinetykę paliperydonu w postaci zawiesiny do wstrzykiwań o przedłużonym uwalnianiu. Analiza farmakokinetyki w populacji na podstawie danych z badań dotyczących doustnego przyjmowania paliperydonu w postaci tabletek o przedłużonym uwalnianiu ujawniła nieznacznie mniejszą ekspozycję na paliperydon u osób palących w porównaniu do osób niepalących. Jednak jest mało prawdopodobne, aby ta różnica miała znaczenie kliniczne.
Badania toksyczności po wielokrotnym podaniu domięśniowym palmitynianu paliperydonu (postać podawana co miesiąc) oraz doustnym paliperydonu u szczurów i psów wykazały skutki głównie farmakologiczne, takie jak sedacja i efekty związane z działaniem prolaktyny na gruczoły sutkowe i narządy płciowe. U zwierząt, którym podawano palmitynian paliperydonu, zaobserwowano reakcję zapalną w miejscu wstrzyknięcia domięśniowego. Sporadycznie tworzył się ropień.
W badaniach reprodukcji u szczurów z zastosowaniem rysperydonu podawanego doustnie, który jest w znacznym stopniu przekształcany do paliperydonu u szczurów i ludzi, obserwowano niepożądane działania na masę urodzeniową i przeżywalność potomstwa. Po domięśniowym podaniu palmitynianu paliperydonu ciężarnym samicom szczurów aż do osiągnięcia najwyższej dawki 160 mg/kg/dobę, co odpowiada 4,1-krotności poziomu ekspozycji u ludzi przy maksymalnej zalecanej dawce wynoszącej 150 mg, nie zaobserwowano embriotoksyczności ani wad rozwojowych. Po podaniu ciężarnym zwierzętom innych antagonistów dopaminy wystąpił negatywny wpływ na zdolność uczenia się i rozwój motoryczny potomstwa.
Palmitynian paliperydonu oraz paliperydon nie wykazują działania genotoksycznego. W badaniach działania rakotwórczego doustnie podanego rysperydonu u szczurów i myszy obserwowano zwiększenie częstości występowania gruczolaków przysadki mózgowej (myszy), hormonalnie czynnych gruczolaków trzustki (szczury) i gruczolaków gruczołu sutkowego (u obu gatunków).
Potencjał rakotwórczy podawanego domięśniowo palmitynianu paliperydonu oceniono u szczurów. Badania wykazały statystycznie istotne zwiększenie częstości występowania gruczolakoraka gruczołu sutkowego u samic szczurów po dawkach 10, 30 i 60 mg/kg/miesiąc. U samców szczurów wykazano statystycznie istotne zwiększenie częstości występowania gruczolaków i nowotworów złośliwych gruczołu sutkowego po dawkach 30 i 60 mg/kg/miesiąc, co odpowiada 1,2- oraz 2,2- krotności poziomu ekspozycji po najwyższej zalecanej u ludzi dawce, wynoszącej 150 mg. Guzy te mogą być związane z przedłużonym antagonizmem receptorów D2 oraz hiperprolaktynemią.
Znaczenie tych wyników badań dotyczących guzów u gryzoni w odniesieniu do ryzyka u ludzi jest nieznane.
Polisorbat 20
Makrogol 4000
Kwas cytrynowy jednowodny Disodu fosforan
Sodu diwodorofosforan jednowodny Sodu wodorotlenek (do ustalenia pH) Woda do wstrzykiwań
Nie mieszać produktu leczniczego z innymi produktami leczniczymi.
2 lata
Ten produkt leczniczy nie wymaga specjalnych warunków przechowywania.
Ampułkostrzykawka (z kopolimeru cykloolefinowego) z tłokiem z PP i końcówką tłoka (z gumy bromobutylowej) oraz igły 22G x 1,5 cala (38,1 mm x 0,72 mm) i 23G x 1 cal (25,4 mm x 0,64 mm) ze stali nierdzewnej z zabezpieczeniem.
Każde opakowanie zawiera 1 ampułkostrzykawkę i 2 igły w tekturowym pudełku..
Wszelkie niewykorzystane resztki produktu lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Teva Pharmaceuticals Polska Sp. z o.o. ul. Emilii Plater 53
00-113 Warszawa











