Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- Właściwości farmakokinetyczne
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
u pacjentów z ciężką i długotrwałą limfopenią, (liczba limfocytów <0,5 × 109/l), która
utrzymuje się przez ponad 6 miesięcy, należy zaprzestać stosowania fumaranu dimetylu ze względu na
zwiększone ryzyko wystąpienia PML.
u pacjentów z długotrwałym umiarkowanym zmniejszeniem liczby limfocytów ≥0,5 × 109/l do
<0,8 × 109/l, które utrzymuje się przez ponad sześć miesięcy, należy ponownie ocenić stosunek korzyści do ryzyka w związku z leczeniem fumaranem dimetylu.
u pacjentów z liczbą limfocytów poniżej dolnej granicy normy (DGN), zgodnie z zakresem
czas trwania terapii fumaranem dimetylu; przypadki PML wystąpiły po upływie od około 1 roku do 5 lat leczenia, choć dokładna zależność pomiędzy wystąpieniem PML a czasem trwania leczenia nie jest znana,
istotne zmniejszenie liczby limfocytów T CD4+, w szczególności limfocytów T CD8+, które są ważnym elementem obrony immunologicznej (patrz punkt 4.8) oraz
wcześniejsze leczenie immunosupresyjne lub immunomodulacyjne (patrz poniżej).
Lekarze powinni ocenić stan pacjentów w celu określenia czy objawy podmiotowe wskazują na zaburzenia neurologiczne. Jeśli tak, należy ustalić, czy są one typowe dla SM, czy też mogą wskazywać na PML.
W momencie wystąpienia pierwszych objawów przedmiotowych lub podmiotowych wskazujących na
PML należy wstrzymać stosowanie fumaranu dimetylu oraz przeprowadzić odpowiednie badania
diagnostyczne, w tym oznaczenie DNA wirusa JCV w płynie mózgowo-rdzeniowym (PMR) metodą ilościowej reakcji łańcuchowej polimerazy (PCR). Objawy PML mogą przypominać nawrotowy rzut stwardnienia rozsianego. Typowe objawy PML są różnorodne, rozwijają się w ciągu dni lub tygodni i obejmują: postępujące osłabienie po jednej stronie ciała lub niezborność ruchową kończyn, zaburzenia widzenia, zmiany w toku myślenia, pamięci oraz orientacji, prowadzące do splątania
i zmian osobowości. Lekarze powinni zwracać szczególną uwagę na objawy podmiotowe wskazujące
na PML, których pacjent może nie zauważyć. Należy też poradzić pacjentom, aby poinformowali partnera lub opiekunów o stosowanym leczeniu, ponieważ mogą oni zauważyć objawy podmiotowe, których pacjent nie jest świadomy.
PML może występować tylko przy jednoczesnym zakażeniu wirusem Johna-Cunninghama (JCV). Należy wziąć pod uwagę, że nie zbadano wpływu limfopenii na dokładność testu na oznaczenie miana przeciwciał anty-JCV w surowicy u pacjentów leczonych fumaranem dimetylu. Należy również przypomnieć, że ujemny wynik tego testu (w przypadku prawidłowej liczby limfocytów) nie wyklucza możliwości późniejszego zakażenia wirusem JCV.
Jeśli u pacjenta wystąpi PML, należy całkowicie odstąpić od stosowania fumaranu dimetylu.
Wcześniejsze leczenie immunosupresyjne lub immunomodulacyjne
Nie przeprowadzono badań oceniających skuteczność i bezpieczeństwo fumaranu dimetylu
w przypadku zmiany z leczenia innymi lekami modyfikującymi na leczenie fumaranem dimetylu. Wcześniejsze leczenie immunosupresyjne może przyczynić się do wystąpienia PML u pacjentów leczonych fumaranem dimetylu.
Przypadki PML zdarzały się u pacjentów leczonych wcześniej natalizumabem, przy czym PML stanowi znane ryzyko związane z jego stosowaniem. Lekarze powinni mieć świadomość, że przypadki PML występujące po niedawnym zaprzestaniu stosowania natalizumabu mogą nie wiązać się
z limfopenią.
Ponadto większość potwierdzonych przypadków PML podczas stosowania fumaranu dimetylu
wystąpiła u pacjentów poddawanych wcześniej leczeniu immunomodulacyjnemu.
Zmieniając inny lek modyfikujący przebieg choroby na fumaran dimetylu, należy uwzględnić okres półtrwania i mechanizm działania odstawianego leku, aby uniknąć addytywnego wpływu na układ odpornościowy i jednocześnie zmniejszyć ryzyko nawrotu stwardnienia rozsianego.
Zaleca się wykonanie pełnej morfologii krwi przed wdrożeniem leczenia fumaranem dimetylu oraz regularnie przeprowadzać to badanie w trakcie leczenia (patrz powyżej: Badania krwi/analizy laboratoryjne).
Ciężkie zaburzenia czynności nerek i wątroby
Fumaranu dimetylu nie badano u pacjentów z ciężkimi zaburzeniami czynności nerek lub wątroby, a
zatem produkt należy stosować ostrożnie w tej grupie pacjentów (patrz punkt 4.2).
Ciężka czynna choroba układu pokarmowego
Fumaranu dimetylu nie badano u pacjentów z ciężką czynną chorobą układu pokarmowego, a zatem
produkt należy stosować ostrożnie w tej grupie pacjentów.
Nagłe zaczerwienienie skóry
Nagłe zaczerwienie skóry stwierdzano u 34% uczestników badań klinicznych leczonych fumaranem dimetylu. U większości pacjentów, u których ono wystąpiło, objaw ten miał nasilenie łagodne lub umiarkowane. Z danych pochodzących z badań z udziałem zdrowych ochotników wynika, że mediatorem nagłego zaczerwienienia skóry związanego ze stosowaniem fumaranu dimetylu jest prawdopodobnie prostaglandyna. W przypadku pacjentów z nieznośnym zaczerwienieniem korzystne może być krótkotrwałe leczenie 75 mg kwasu acetylosalicylowego bez otoczki dojelitowej (patrz punkt 4.5). W dwóch badaniach z udziałem zdrowych ochotników częstość i nasilenie nagłego zaczerwienienia skóry zmniejszyły się w okresie podawania kwasu acetylosalicylowego.
U 3 pacjentów spośród 2560 uczestników badań klinicznych leczonych fumaranem dimetylu wystąpiły silne objawy zaczerwienienia skóry, które były prawdopodobnie spowodowane reakcją nadwrażliwości lub rzekomoanafilaktyczną. Zdarzenia te nie zagrażały życiu, ale doprowadziły do hospitalizowania pacjenta. Lekarzy i pacjentów należy ostrzec o takim ryzyku w przypadku wystąpienia ciężkiej reakcji zaczerwienienia skóry (patrz punkty 4.2, 4.5 i 4.8).
Reakcje anafilaktyczne
Po wprowadzeniu do obrotu zgłaszano przypadki reakcji anafilaktycznej/anafilaktoidalnej po podaniu fumaranu dimetylu. Objawami mogą być duszność, hipoksja, niedociśnienie tętnicze, obrzęk naczynioworuchowy, wysypka lub pokrzywka. Nie jest znany mechanizm wywoływania reakcji anafilaktycznej przez fumaran dimetylu. Reakcja ta występuje zwykle po podaniu pierwszej dawki, może jednak wystąpić w dowolnym momencie leczenia i może być ciężka oraz stanowić zagrożenie dla życia. Należy poinformować pacjenta, że jeśli wystąpią objawy przedmiotowe lub podmiotowe anafilaksji, należy przerwać stosowanie fumaranu dimetylu i natychmiast skontaktować się
z lekarzem. Nie należy wznawiać leczenia (patrz punkt 4.8).
Zakażenia
W badaniach fazy III prowadzonych z kontrolą placebo u pacjentów leczonych fumaranem dimetylu i u pacjentów otrzymujących placebo częstość występowania zakażeń (60% w porównaniu do 58%) oraz ciężkich zakażeń (2% w porównaniu do 2%) była podobna. Jednakże, ze względu na właściwości immunomodulacyjne fumaranu dimetylu (patrz punkt 5.1), jeśli u pacjenta rozwinie się ciężkie zakażenie, należy rozważyć czasowe wstrzymanie leczenia fumaranem dimetylu, a przed jego wznowieniem przeprowadzić ponowną ocenę korzyści i ryzyka. Pacjentom przyjmującym fumaran dimetylu należy zalecić, aby zgłaszali lekarzowi wystąpienie objawów zakażenia. Nie należy rozpoczynać leczenia fumaranem dimetylu u pacjentów z ciężkimi zakażeniami, dopóki zakażenie nie ustąpi.
Nie obserwowano większej częstości ciężkich zakażeń u pacjentów z liczbą limfocytów <0,8 x 109/l lub <0,5 x 109/l (patrz punkt 4.8). Jeżeli leczenie jest kontynuowane w obecności umiarkowanej do ciężkiej i długotrwałej limfopenii, nie można wykluczyć ryzyka oportunistycznych zakażeń, w tym PML (patrz podpunkt dotyczący PML w punkcie 4.4).
Zakażenia półpaścem
Stosowanie fumaranu dimetylu wiązało się z przypadkami półpaśca. Większości z nich nie uznano za ciężkie, ale zgłaszano też ciężkie przypadki, w tym półpasiec rozsiany, półpasiec oczny, półpasiec uszny, półpasiec z powikłaniami neurologicznymi, zapalenie opon mózgowych i mózgu w półpaścu oraz zapalenie opon mózgowych i rdzenia w półpaścu. Zdarzenia te mogą wystąpić w dowolnym czasie leczenia. Pacjentów przyjmujących fumaran dimetylu należy monitorować pod kątem przedmiotowych i podmiotowych objawów półpaśca, zwłaszcza gdy zgłaszana jest współistniejąca limfocytopenia. W razie wystąpienia półpaśca należy wdrożyć odpowiednie leczenie. U pacjentów z ciężkimi zakażeniami należy rozważyć zaprzestanie leczenia fumaranem dimetylu do czasu ustąpienia zakażenia (patrz punkt 4.8).
Rozpoczęcie leczenia
Leczenie fumaranem dimetylu należy włączać stopniowo, aby ograniczyć występowanie nagłego
zaczerwienienia skóry oraz żołądkowo-jelitowych działań niepożądanych (patrz punkt 4.2).
Zespół Fanconiego
Podczas stosowania produktów leczniczych zawierających fumaran dimetylu w połączeniu z innymi estrami kwasu fumarowego zgłaszano przypadki zespołu Fanconiego. Zespół Fanconiego jest zwykle przemijający, dlatego ważne jest jego wczesne rozpoznanie i przerwanie leczenia fumaranem dimetylu, aby zapobiec wystąpieniu zaburzeń czynności nerek i osteomalacji. Najważniejsze objawy to białkomocz, cukromocz (przy prawidłowym stężeniu glukozy we krwi), hiperaminoacyduria
i fosfaturia (może występować jednocześnie z hipofosfatemią). Progresja może obejmować takie objawy, jak wielomocz, nadmierne pragnienie i osłabienie mięśni proksymalnych. W rzadkich przypadkach może rozwinąć się osteomalacja hipofosfatemiczna z niezlokalizowanym bólem kości, podwyższona aktywność fosfatazy zasadowej w surowicy oraz złamania zmiażdżeniowe. Co istotne,
zespół Fanconiego może wystąpić bez podwyższonego stężenia kreatyniny ani niskiego współczynnika filtracji kłębuszkowej. W razie wystąpienia niejednoznacznych objawów, należy rozważyć rozwój zespołu Fanconiego i wykonać odpowiednie badania.
Dzieci i młodzież
Profil bezpieczeństwa u dzieci i młodzieży w zakresie oceny jakościowej jest podobny do profilu u dorosłych, dlatego ostrzeżenia i środki ostrożności dotyczą również tej populacji. Różnice w profilu bezpieczeństwa w zakresie oceny ilościowej, patrz punkt 4.8.
Nie określono dotychczas bezpieczeństwa długotrwałego stosowania produktu Dimtruzic u dzieci i młodzieży.
Sód
Produkt zawiera mniej niż 1 mmol (23 mg) sodu na kapsułkę, to znaczy produkt uznaje się za „wolny
od sodu”.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
bardzo często (≥1/10)
- często (≥1/100 do <1/10)
niezbyt często (≥1/1000 do <1/100)
- rzadko (≥1/10 000 do <1/1000)
bardzo rzadko (<1/10 000)
nieznana (częstość nie może być określona na podstawie dostępnych danych).
Ból głowy zgłoszono u 28% pacjentów leczonych fumaranem dimetylu wobec 36% u pacjentów leczonych
interferonem beta-1a.
Zaburzenia żołądka i jelit zgłoszono u 74% pacjentów leczonych fumaranem dimetylu wobec 31% u pacjentów leczonych interferonem beta-1a. Wśród nich ból brzucha i wymioty najczęściej zgłaszano po zastosowaniu fumaranu dimetylu.
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia zgłoszono u 32% pacjentów leczonych fumaranem dimetylu wobec 11% u pacjentów leczonych interferonem beta-1a. Wśród nich ból jamy ustnej i gardła oraz kaszel były najczęściej zgłaszanymi działaniami niepożądanymi występującymi podczas stosowania fumaranu dimetylu.
Bolesne miesiączki zgłoszono u 17% pacjentek leczonych fumaranem dimetylu wobec 7% u pacjentek
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
Dimtruzic, 120 mg, kapsułki dojelitowe, twarde Dimtruzic, 240 mg, kapsułki dojelitowe, twarde
Dimtruzic 120 mg, kapsułki dojelitowe twarde
Każda kapsułka dojelitowa twarda zawiera 120 mg fumaranu dimetylu (Dimethylis fumaras).
Dimtruzic 240 mg, kapsułki dojelitowe twarde
Każda kapsułka dojelitowa twarda zawiera 240 mg fumaranu dimetylu (Dimethylis fumaras).
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Kapsułka dojelitowa twarda (kapsułka dojelitowa). Dimtruzic 120 mg kapsułki dojelitowe, żelatynowe, twarde.
Kapsułki żelatynowe twarde, długości ok. 19.4 mm i szerokości ok. 8,53 mm, korpus barwy białej,
wieczko barwy jasnozielonej, z nadrukiem na korpusie „120 mg”.
Dimtruzic 120 mg kapsułki dojelitowe, żelatynowe, twarde.
Kapsułki żelatynowe twarde, długości ok. 23.3 mm i szerokości ok. 8,53 mm, barwy jasnozielonej, z nadrukiem na korpusie „240 mg”.
Dimtruzic jest wskazany do stosowania u pacjentów dorosłych oraz dzieci w wieku 13 lat i starszych z rzutowo-remisyjną postacią stwardnienia rozsianego. (ang. relapsing-remitting multiple sclerosis, RRMS).
Leczenie powinno być rozpoczęte przez lekarza mającego doświadczenie w leczeniu stwardnienia
rozsianego.
Dawkowanie
Dawka początkowa wynosi 120 mg dwa razy na dobę. Po 7 dniach dawkę należy zwiększyć do
zalecanej dawki podtrzymującej, czyli 240 mg dwa razy na dobę (patrz punkt 4.4).
Jeżeli pacjent pominie dawkę, nie powinien przyjmować podwójnej dawki. Pacjent może przyjąć pominiętą dawkę, tylko jeśli zostanie zachowany odstęp 4 godzin pomiędzy dawkami. W przeciwnym razie pacjent powinien poczekać do planowanego czasu przyjęcia kolejnej dawki.
Tymczasowe zmniejszenie dawki do 120 mg dwa razy na dobę może ograniczyć występowanie działań niepożądanych, takich jak nagłe zaczerwienienie skóry oraz reakcje ze strony układu pokarmowego. Po upływie miesiąca należy wznowić stosowanie zalecanej dawki podtrzymującej, czyli 240 mg dwa razy na dobę.
Fumaran dimetylu należy przyjmować z posiłkiem (patrz punkt 5.2).
U pacjentów, u których występują działania niepożądane ze strony układu pokarmowego lub nagłe
zaczerwienienie skóry, przyjmowanie fumaranu dimetylu z posiłkiem może poprawić tolerancję leku (patrz punkty 4.4, 4.5 i 4.8).
Szczególne grupy pacjentów
Pacjenci w podeszłym wieku
W badaniach klinicznych fumaran dimetylu stosowano u zbyt ograniczonej liczby pacjentów w wieku 55 lat i starszych, a także u niewystarczającej liczby pacjentów w wieku 65 lat i starszych, aby ustalić, czy reagują oni na fumaran dimetylu inaczej niż młodsi dorośli (patrz punkt 5.2). Biorąc pod uwagę mechanizm działania substancji czynnej, teoretycznie nie ma powodów, dla których konieczne byłoby dostosowanie dawki u pacjentów w podeszłym wieku.
Zaburzenia czynności nerek i wątroby
Fumaranu dimetylu nie badano u pacjentów z zaburzeniami czynności nerek lub wątroby. Kliniczne badania farmakologiczne nie wskazują na konieczność dostosowania dawki (patrz punkt 5.2). Produkt należy jednak stosować ostrożnie u pacjentów z ciężkimi zaburzeniami czynności nerek lub wątroby (patrz punkt 4.4).
Dzieci i młodzież
Dawkowanie u dzieci i młodzieży w wieku 13 lat i starszych jest takie samo, jak u dorosłych. Aktualnie dostępne dane przedstawiono w punktach 4.4, 4.8, 5.1 oraz 5.2. Dane dotyczące stosowania u dzieci w wieku od 10 do 12 lat są ograniczone. Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu leczniczego Dimtruzic u dzieci w wieku poniżej 10 lat.
Sposób podawania Podanie doustne.
Kapsułkę należy połykać w całości. Kapsułki ani jej zawartości nie należy kruszyć, dzielić, rozpuszczać, ssać ani rozgryzać, ponieważ otoczka dojelitowa granulek zapobiega wystąpieniu podrażnienia jelit.
Nadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą wymienioną
w punkcie 6.1.
Podejrzenie lub rozpoznanie postępującej wieloogniskowej leukoencefalopatii (ang. Progressive Multifocal Leukoencephalopathy, PML).
Badania krwi/analizy laboratoryjne
W badaniach klinicznych u pacjentów leczonych fumaranem dimetylu obserwowano zmiany
w wynikach badań laboratoryjnych czynności nerek (patrz punkt 4.8). Kliniczne znaczenie takich zmian nie jest znane. Zaleca się przeprowadzanie oceny czynności nerek (np. oznaczanie kreatyniny i azotu mocznikowego we krwi oraz ogólne badanie moczu) przed rozpoczęciem leczenia, po
3 i 6 miesiącach leczenia, następnie co 6 do 12 miesięcy oraz zgodnie ze wskazaniami klinicznymi. W wyniku leczenia fumaranem dimetylu może dojść do polekowego uszkodzenia wątroby, w tym zwiększenia aktywności enzymów wątrobowych (≥3-krotnie przekroczona górna granica normy - GGN) i bilirubiny całkowitej (≥2-krotnie przekroczona GGN). Działania niepożądane mogą wystąpić bezpośrednio, po kilku tygodniach lub po dłuższym okresie od rozpoczęcia stosowania. Po przerwaniu leczenia obserwowano ustąpienie działań niepożądanych. Zaleca się przeprowadzenie badania aktywności aminotransferaz (np. aminotransferazy alaninowej [AlAT], aminotransferazy asparaginianowej [AspAT]) i stężenia bilirubiny całkowitej w surowicy przed rozpoczęciem
i w trakcie leczenia, zgodnie ze wskazaniami klinicznymi.
U pacjentów leczonych fumaranem dimetylu może wystąpić limfopenia (patrz punkt 4.8).
Bezpośrednio przed rozpoczęciem leczenia fumaranem dimetylu musi być wykonane badanie pełnej morfologii krwi, łącznie z oznaczeniem liczby limfocytów. Jeżeli liczba limfocytów okaże się być poniżej prawidłowego zakresu, należy przed wdrożeniem leczenia fumaranem dimetylu dokładnie zbadać możliwe tego przyczyny. Fumaranu dimetylu nie badano u pacjentów, u których już wcześniej występowała mała liczba limfocytów, a zatem u takich pacjentów produkt leczniczy należy stosować ostrożnie. Leczenia fumaranem dimetylu nie należy rozpoczynać u pacjentów z ciężką limfopenią (liczbą limfocytów <0,5 × 109/l). Po rozpoczęciu leczenia co 3 miesiące trzeba wykonywać pełną morfologię krwi łącznie z oznaczeniem liczby limfocytów.
Ze względu na zwiększone ryzyko wystąpienia postępującej wieloogniskowej leukoencefalopatii
(PML) u pacjentów z limfopenią zaleca się wzmożony nadzór i postępowanie, jak następuje:
referencyjnym określonym przez lokalne laboratorium, zaleca się regularne kontrolowanie bezwzględnej liczby limfocytów. Należy uwzględnić też inne czynniki, które mogą dodatkowo zwiększać indywidualne ryzyko wystąpienia PML (patrz podpunkt dotyczący PML niżej).
Liczbę limfocytów należy kontrolować do czasu ich powrotu do prawidłowych wartości (patrz
punkt 5.1). Gdy to nastąpi i gdy brak innych metod leczenia, decyzja dotycząca ponownego wdrożenia
leczenia fumaranem dimetylu po jego przerwaniu powinna opierać się na ocenie klinicznej.
Badanie obrazowe metodą rezonansu magnetycznego (MRI)
Przed rozpoczęciem leczenia fumaranem dimetylu powinien być dostępny wyjściowy wynik badania MRI (zazwyczaj z badania wykonanego w ciągu poprzednich 3 miesięcy) do celów porównawczych. Należy rozważyć konieczność wykonania kolejnych badań MRI, zgodnie z zaleceniami obowiązującymi w danym kraju lub rejonie. Badanie takie może być przeprowadzane w ramach ściślejszego monitorowania pacjentów, u których stwierdzono zwiększone ryzyko wystąpienia PML. W przypadkuklinicznego podejrzenia PML, należy niezwłocznie wykonać badanie MRI w celach diagnostycznych.
Postępująca wieloogniskowa leukoencefalopatia (PML)
U pacjentów leczonych fumaranem dimetylu zgłaszano przypadki PML (patrz punkt 4.8). PML jest oportunistycznym zakażeniem wywołanym wirusem Johna-Cunninghama (JCV), które może prowadzić do zgonu lub ciężkiej niepełnosprawności.
Stosowanie fumaranu dimetylu i innych produktów leczniczych zawierających fumarany wiązało się z przypadkami PML w przebiegu limfopenii (liczba limfocytów poniżej DGN). Długotrwała umiarkowana lub ciężka limfopenia zwiększa ryzyko wystąpienia PML w związku ze stosowaniem fumaranu dimetylu. Ryzyka tego nie można jednak wykluczyć u pacjentów z łagodną limfopenią.
Dodatkowe czynniki, które mogą przyczynić się do zwiększonego ryzyka PML w przebiegu
limfopenii, są następujące:
Nie badano stosowania fumaranu dimetylu w skojarzeniu z lekami przeciwnowotworowymi ani immunosupresyjnymi, a zatem należy zachować ostrożność podczas ich równoczesnego stosowania. W badaniach klinicznych nad stwardnieniem rozsianym leczenie nawrotowych rzutów choroby krótkimi seriami dożylnych kortykosteroidów nie wiązało się z klinicznie istotnym zwiększeniem częstości infekcji.
Podczas leczenia fumaranem dimetylu można rozważyć jednoczesne stosowanie szczepionek inaktywowanych zgodnie z krajowym kalendarzem szczepień. W badaniu klinicznym z udziałem ogółem 71 pacjentów z rzutowo-remisyjną postacią stwardnienia rozsianego, u pacjentów otrzymujących fumaran dimetylu 240 mg dwa razy na dobę przez co najmniej 6 miesięcy (n=38) lub niepegylowany interferon przez co najmniej 3 miesiące (n=33) wystąpiła porównywalna odpowiedź immunologiczna (definiowana jako >2-krotne zwiększenie miana przeciwciał w stosunku do stanu przed podaniem szczepionki) na toksoid tężcowy i skoniugowaną polisacharydową szczepionkę przeciwko meningokokom grupy C (neoantygen), podczas gdy odpowiedź immunologiczna na różne serotypy nieskoniugowanej 23-walentnej polisacharydowej szczepionki przeciwko pneumokokom (antygen T-zależny) różniła się w obu grupach. Pozytywną odpowiedź immunologiczną (definiowaną jako ≥4-krotne zwiększenie miana przeciwciał) na trzy szczepionki uzyskano u mniejszej liczby pacjentów w obu grupach. Stwierdzono niewielkie liczbowe różnice w odpowiedzi na toksoid tężcowy i polisacharyd pneumokokowy serotypu 3 na korzyść pacjentów przyjmujących niepegylowany interferon.
Brak danych klinicznych dotyczących skuteczności i bezpieczeństwa szczepionek zawierających żywe atenuowane drobnoustroje u pacjentów przyjmujących fumaran dimetylu. Stosowanie szczepionek zawierających żywe drobnoustroje może nieść za sobą zwiększone ryzyko zakażeń klinicznych, a zatem nie należy podawać ich pacjentom leczonym fumaranem dimetylu, chyba że zostanie uznane, iż ryzyko wynikające z braku szczepienia przewyższa ryzyko związane ze szczepionką.
Podczas leczenia fumaranem dimetylu należy unikać jednoczesnego stosowania innych pochodnych
kwasu fumarowego (zarówno miejscowo, jak i układowo).
U ludzi fumaran dimetylu jest w znacznym stopniu metabolizowany przez esterazy zanim przedostanie się do krążenia ogólnego, a jego dalszy metabolizm odbywa się za pośrednictwem cyklu kwasów trikarboksylowych, bez udziału układu cytochromu P450 (CYP). Badania in vitro blokowania i indukcji enzymu CYP, badanie p-glikoproteiny ani też badania wiązania fumaranu dimetylu
i fumaranu monometylu (głównego metabolitu fumaranu dimetylu) z białkami, nie wykazały ryzyka interakcji lekowych.
W badaniach klinicznych potencjalnych interakcji z fumaranem dimetylu interferonu beta-1a podawanego domięśniowo oraz octanu glatirameru, produktów leczniczych powszechnie stosowanych u pacjentów ze stwardnieniem rozsianym, nie stwierdzono, aby zmieniały one profil farmakokinetyczny fumaranu dimetylu.
Z danych pochodzących z badań z udziałem zdrowych ochotników wynika, że mediatorem nagłego zaczerwienienia skóry związanego ze stosowaniem fumaranu dimetylu jest prawdopodobnie prostaglandyna. W dwóch badaniach z udziałem zdrowych ochotników podawanie 325 mg (lub równowartości) kwasu acetylosalicylowego bez otoczki dojelitowej 30 minut przed zastosowaniem fumaranu dimetylu przez odpowiednio, 4 dni i 4 tygodnie leczenia nie zmieniało farmakokinetycznego profilu fumaranu dimetylu. Należy rozważyć ryzyko związane z leczeniem kwasem acetylosalicylowym przed podaniem go pacjentom z rzutowo-remisyjną postacią stwardnienia rozsianego, stosującym fumaranu dimetylu. Nie badano jednak dłuższego (>4 tygodnie) stosowania kwasu acetylosalicylowego (patrz punkty 4.4 i 4.8).
Równoczesne leczenie produktami nefrotoksycznymi (takimi jak aminoglikozydy, leki moczopędne, niesteroidowe leki przeciwzapalne i sole litu) może zwiększać ryzyko działań niepożądanych ze strony nerek (takich jak białkomocz, patrz punkt 4.8) u pacjentów leczonych fumaranem dimetylu (patrz punkt 4.4 - Badania krwi/analizy laboratoryjne).
Spożywanie umiarkowanych ilości alkoholu nie zmieniało ekspozycji na fumaran dimetylu i nie wiązało się z nasileniem działań niepożądanych. Należy unikać spożywania dużych ilości wysokoprocentowych napojów alkoholowych (ponad 30% alkoholu objętościowo) w ciągu godziny od przyjęcia fumaranu dimetylu, ponieważ alkohol może prowadzić do zwiększenia częstości żołądkowo-jelitowych działań niepożądanych.
Badania indukcji enzymu CYP in vitro nie wykazały interakcji pomiędzy fumaranem dimetylu
a doustnymi środkami antykoncepcyjnymi. W badaniu in vivo, jednoczesne stosowanie fumaranu dimetylu oraz złożonych, doustnych środków antykoncepcyjnych (norgestymat i etynyloestradiol) nie prowadziło do istotnych zmian w ekspozycji na doustne środki antykoncepcyjne. Nie przeprowadzono badań interakcji z doustnymi środkami antykoncepcyjnymi zawierającymi inne progestageny, jednak nie wydaje się, by fumaran dimetylu wpływał na ich ekspozycję.
Dzieci i młodzież
Badania dotyczące interakcji przeprowadzono wyłącznie u dorosłych.
Ciąża
Brak danych lub istnieją tylko ograniczone dane dotyczące stosowania fumaranu dimetylu u kobiet
w okresie ciąży. Badania na zwierzętach wykazały szkodliwy wpływ na reprodukcję (patrz punkt 5.3). Fumaran dimetylu nie jest zalecany do stosowania w okresie ciąży oraz u kobiet w wieku rozrodczym niestosujących skutecznej antykoncepcji (patrz punkt 4.5). Fumaran dimetylu można stosować
u kobiet w ciąży, wyłącznie gdy jest to wyraźnie konieczne i gdy spodziewane korzyści dla matki przewyższają ryzyko dla płodu.
Karmienie piersią
Nie wiadomo, czy fumaran dimetylu lub jego metabolity przenikają do mleka ludzkiego. Nie można wykluczyć zagrożenia dla noworodków/dzieci. Należy podjąć decyzję, czy przerwać karmienie piersią, czy przerwać podawanie fumaranu dimetylu, biorąc pod uwagę korzyści z karmienia piersią dla dziecka i korzyść z leczenia dla matki.
Płodność
Brak danych dotyczących wpływu fumaranu dimetylu na płodność u ludzi. Dane pochodzące z badań przedklinicznych nie wskazują na to, aby stosowanie fumaranu dimetylu zwiększało ryzyko obniżenia płodności (patrz punkt 5.3).
Fumaran dimetylu nie ma wpływu lub wywiera nieistotny wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn. Nie przeprowadzono badań dotyczących wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn, jednak w badaniach klinicznych nie wykrytozwiązanych z fumaranem dimetylu działań potencjalnie wpływających na wykonywanie tych czynności.
Podsumowanie profilu bezpieczeństwa
Najczęstszymi działaniami niepożądanymi (częstość występowania ≥10%) u pacjentów leczonych fumaranem dimetylu były nagłe zaczerwienienia skóry oraz zdarzenia ze strony układu pokarmowego (tj. biegunka, nudności, ból brzucha, bóle w nadbrzuszu). Objawy te pojawiały się zwykle
w początkowej fazie leczenia (głównie w ciągu pierwszego miesiąca). U pacjentów, u których wystąpiło nagłe zaczerwienienie skóry i zaburzenia żołądkowo-jelitowe, objawy te mogą pojawiać się okresowo w trakcie leczenia fumaranem dimetylu. Najczęściej zgłaszanymi działaniami niepożądanymi prowadzącymi do przerwania leczenia (częstość występowania >1%) u pacjentów leczonych fumaranem dimetylu były nagłe zaczerwienienia skóry (3%) i zaburzenia żołądka i jelit (4%).
W badaniach klinicznych kontrolowanych placebo, jak i bez grupy kontrolnej, fumaran dimetylu otrzymywało łącznie 2513 pacjentów przez maksymalnie 12 lat (łączna ekspozycja równoważna 11318 pacjentolat). Łącznie 1169 pacjentów było leczonych fumaranem dimetylu przez co najmniej 5 lat, a 426 pacjentów było leczonych fumaranem dimetylu przez co najmniej 10 lat. Obserwacje wynikające z badań bez grupy kontrolnej i z grupą kontrolną są zgodne.
Tabelaryczne zestawienie działań niepożądanych
Działania niepożądane pochodzące z badań klinicznych, badań dotyczących bezpieczeństwa
stosowania po wprowadzeniu do obrotu oraz zgłoszeń spontanicznych przedstawiono w tabeli poniżej.
Działania niepożądane przedstawiono zgodnie z terminologią MedDRA oraz klasyfikacją układów i narządów. Częstość występowania działań niepożądanych określono zgodnie z poniższą klasyfikacją:
Klasyfikacja układów i narządów MedDRA | Działanie niepożądane | Kategoria częstości |
Zakażenia i zarażenia pasożytnicze | Zapalenie żołądka i jelit | Często |
Postępująca leukoencefalopatia wieloogniskowa | Nieznana | |
Półpasiec | Nieznana | |
Zaburzenia krwi i układu chłonnego | Limfopenia | Często |
Leukopenia | Często | |
Trombocytopenia | Niezbyt często | |
Zaburzenia układu immunologicznego | Nadwrażliwość | Niezbyt często |
Anafilaksja | Nieznana | |
Duszność | Nieznana | |
Hipoksja | Nieznana | |
Niedociśnienie tętnicze | Nieznana | |
Obrzęk naczyniowo-ruchowy | Nieznana | |
Zaburzenia układu nerwowego | Uczucie pieczenia | Często |
Zaburzenia naczyniowe | Nagłe zaczerwienienie skóry | Bardzo często |
Uderzenia gorąca | Często |
Zaburzenia układu oddechowego, klatki piersiowej i śródpiersia | Nieżyt nosa | Nieznana |
Zaburzenia żołądka i jelit | Biegunka | Bardzo często |
Nudności | Bardzo często | |
Bóle w nadbrzuszu | Bardzo często | |
Ból brzucha | Bardzo często | |
Wymioty | Często | |
Niestrawność | Często | |
Zapalenie żołądka | Często | |
Zaburzenia żołądka i jelit | Często | |
Zaburzenia wątroby i dróg żółciowych | Zwiększona aktywność aminotransferazy asparaginowej | Często |
Zwiększona aktywność aminotransferazy alaninowej | Często | |
Polekowe uszkodzenie wątroby | Nieznana | |
Zaburzenia skóry i tkanki podskórnej | Świąd | Często |
Wysypka | Często | |
Rumień | Często | |
Łysienie | Często | |
Zaburzenia nerek i dróg moczowych | Białkomocz | Często |
Zaburzenia ogólne i stany w miejscu podania | Uczucie gorąca | Często |
Badania diagnostyczne | Obecność ciał ketonowych w moczu | Bardzo często |
Obecność albuminy w moczu | Często | |
Zmniejszenie liczby białych krwinek | Często |
Opis wybranych działań niepożądanych
Nagłe zaczerwienienie skóry
W badaniach kontrolowanych placebo częstość nagłego zaczerwienienia skóry (34% w porównaniu do 4%) oraz uderzeń gorąca (7% w porównaniu do 2%) była większa u pacjentów przyjmujących fumaran dimetylu niż placebo. Objaw ten opisywany jest zwykle jako nagłe zaczerwienienie skóry lub uderzenia gorąca, ale może obejmować także inne reakcje (np. uczucie gorąca, zaczerwienienie, świąd i uczucie pieczenia skóry). Zdarzenia te pojawiały się zwykle na początku leczenia (głównie
w pierwszym miesiącu). U pacjentów, w których tak się stało, nagłe zaczerwienienie skóry może powtarzać się okresowo w trakcie leczenia fumaranem dimetylu. U większości pacjentów z nagłym zaczerwieniem skóry nasilenie takiej reakcji było łagodne lub umiarkowane. Łącznie 3% pacjentów leczonych fumaranem dimetylu przerwało leczenie z powodu nagłego zaczerwienienia skóry.
Częstość występowania nagłego zaczerwienienia skóry o ciężkim nasileniu, które może przejawiać się w postaci uogólnionego rumienia, wysypki i (lub) świądu, obserwowano u mniej niż 1% pacjentów leczonych fumaranem dimetylu (patrz punkty 4.2, 4.4 i 4.5).
Zaburzenia żołądka i jelit
Częstość występowania zdarzeń ze strony układu pokarmowego [np. biegunka (14% w porównaniu do 10%), nudności (12% w porównaniu do 9%), bóle w nadbrzuszu (10 w porównaniu do 6%), ból
brzucha (9% w porównaniu do 4%), wymioty (8% w porównaniu do 5%) oraz niestrawność (5%
w porównaniu do 3%)] była większa u pacjentów przyjmujących fumaran dimetylu niż u pacjentów otrzymujących placebo. Zaburzenia ze strony układu pokarmowego pojawiały się zwykle na początku leczenia (głównie w pierwszym miesiącu). U pacjentów, u których występują zaburzenia ze strony układu pokarmowego, objawy te mogą pojawiać się okresowo w trakcie leczenia fumaranem
dimetylu. U większości pacjentów z objawami ze strony układu pokarmowego ich nasilenie było łagodne lub umiarkowane. Cztery procent (4%) pacjentów leczonych fumaranem dimetylu przerwało leczenie z powodu zaburzeń ze strony układu pokarmowego. Ciężkie zaburzenia ze strony układu pokarmowego, łącznie z zapaleniem żołądka i jelit oraz zapaleniem żołądka, obserwowano u 1% pacjentów leczonych fumaranem dimetylu (patrz punkt 4.2).
Czynność wątroby
Z danych uzyskanych w badaniach kontrolowanych placebo wynika, że u większości pacjentów
z podwyższoną aktywnością aminotransferaz wątrobowych wartości te były <3 razy większe niż górna granica normy. Zwiększoną częstość występowania podwyższonej aktywności aminotransferaz wątrobowych u pacjentów leczonych fumaranem dimetylu niż w grupie placebo obserwowano głównie w ciągu pierwszych 6 miesięcy leczenia. Zwiększona ≥3 razy górna granica normy aktywność aminotransferazy alaninowej i asparaginowej zaobserwowano u, odpowiednio, 5% i 2% pacjentów otrzymujących placebo oraz u 6% i 2% pacjentów leczonych fumaranem dimetylu. W związku ze zwiększoną aktywnością aminotransferaz leczenie przerwano w <1% przypadków zarówno u pacjentów leczonych fumaranem dimetylu, jak i u pacjentów otrzymujących placebo. W badaniach kontrolowanych placebo nie obserwowano zwiększenia aktywności aminotransferaz ≥3 razy GGN
z równoczesnym zwiększeniem stężenia bilirubiny całkowitej >2 razy GGN.
Po wprowadzeniu produktu do obrotu zgłaszano przypadki zwiększenia aktywności enzymów wątrobowych i przypadki polekowego uszkodzenia wątroby (jednoczesne zwiększenie aktywności aminotransferaz ≥3-krotnie przekroczona GGN oraz stężenia bilirubiny całkowitej >2-krotnie przekroczona GGN) w następstwie podania fumaranu dimetylu, które ustąpiły po przerwaniu leczenia.
Limfopenia
W badaniach kontrolowanych placebo większość pacjentów (>98%) miała prawidłową liczbę
limfocytów przed rozpoczęciem leczenia. Po rozpoczęciu leczenia fumaranem dimetylu średnia
liczba limfocytów zmniejszała się w ciągu pierwszego roku, osiągając następnie plateau. Ogólnie, liczba limfocytów zmniejszała się o około 30% w porównaniu do wartości wyjściowej. Średnia i mediana liczby limfocytów pozostawały w zakresie wartości prawidłowych. Liczbę limfocytów
<0,5 x 109/l stwierdzano u <1% pacjentów przyjmujących placebo i u 6% pacjentów leczonych fumaranem dimetylu. Liczbę limfocytów <0,2 * 109/l wykryto u 1 pacjenta leczonego fumaranem dimetylu. Takiej wartości nie zaobserwowano u ani jednego pacjenta z grupy przyjmującej placebo. W badaniach klinicznych (zarówno kontrolowanych jak i niekontrolowanych) u 41% pacjentów
leczonych fumaranem dimetylu występowała limfopenia (zdefiniowana w tych badaniach jako liczba limfocytów <0,91 x 109/l). Łagodną limfopenię (liczby limfocytów od ≥0,8 x 10/l do <0,91 x
109/l) zaobserwowano u 28% pacjentów; umiarkowaną limfopenię (liczby limfocytów od ≥0,5 x 109/l do <0,8 x 109/l) utrzymującą się przez co najmniej sześć miesięcy zaobserwowano u 11% pacjentów; ciężką limfopenię (liczba limfocytów <0,5 x 109/l) utrzymującą się przez co najmniej sześć miesięcy zaobserwowano u 2% pacjentów. W grupie z ciężką limfopenią większość stwierdzanych wartości liczbowych limfocytów pozostawała <0,5 x 109/l podczas kontynuacji leczenia.
Ponadto, po 48 tygodniach terapii fumaranem dimetylu w ramach niekontrolowanego,
prospektywnego badania porejestracyjnego (n=185) u maksymalnie 37% i 6% pacjentów stwierdzono, odpowiednio, umiarkowane (≥0,2 x 109/l do <0,4 x 109/l) lub istotne (<0,2 x 109/l) zmniejszenie liczby limfocytów T CD4+, przy czym częściej występował spadek limfocytów T CD8+, do poziomu
<0,2 × 109/l u maksymalnie 59% pacjentów i do poziomu <0,1 × 109/l u 25% pacjentów.
W kontrolowanych i niekontrolowanych badaniach klinicznych pacjentów z liczbą limfocytów poniżej DGN, u których przerwano leczenie fumaranem dimetylu, monitorowano pod kątem powrotu liczby limfocytów do wartości DGN (patrz punkt 5.1).
Zakażenia, w tym PML i zakażenia oportunistyczne
Zgłaszano przypadki zakażenia wirusem Johna-Cunninghama (JCV) powodującego postępującą wieloogniskową leukoencefalopatię (PML) w związku ze stosowaniem fumaranu dimetylu (patrz punkt 4.4). PML może prowadzić do zgonu lub ciężkiej niepełnosprawności. W jednym z badań
klinicznych u jednego pacjenta przyjmującego fumaran dimetylu wystąpiła zakończona zgonem
PML w przebiegu ciężkiej i długotrwałej limfopenii (liczby limfocytów przeważnie <0,5 x 109/l przez 3,5 roku). Po wprowadzeniu do obrotu PML wystąpiła też w przebiegu umiarkowanej i łagodnej limfopenii (>0,5 x 109/l do < DGN według zakresu referencyjnego określonego przez lokalne laboratorium).
U kilku pacjentów z PML, u których oznaczono liczbę podtypów limfocytów T w momencie rozpoznania PML, stwierdzono zmniejszenie liczby limfocytów T CD8+ do poziomu <0,1 x 109/l, podczas gdy redukcja liczby limfocytów T CD4+ była zróżnicowana (od <0,05 do 0,5 x 109/l) i bardziej skorelowana z ogólnym stopniem nasilenia limfopenii (<0,5 x 109/l do <DGN).
W efekcie u tych pacjentów występował podwyższony stosunek limfocytów CD4+/CD8+. Długotrwała umiarkowana lub ciężka limfopenia zwiększa ryzyko wystąpienia PML w związku ze
stosowaniem fumaranu dimetylu. Jednak PML występowała też u pacjentów z łagodną limfopenią. Ponadto większość przypadków PML po wprowadzeniu produktu leczniczego do obrotu występowała u pacjentów w wieku >50 lat.
W związku ze stosowaniem fumaranu dimetylu zgłaszano przypadki zakażenia półpaścem. Podczas trwającego długoterminowego badania uzupełniającego, w którym 1736 pacjentów ze stwardnieniem rozsianym jest leczonych fumaranem dimetylu, około 5% z nich zgłosiło, co najmniej jedno zdarzenie zachorowania na półpasiec o nasileniu przeważnie łagodnym lub umiarkowanym. U większości pacjentów, włączając tych, u których wystąpiło ciężkie zakażenie półpaścem, liczba limfocytów była wyższa niż DGN. U większości chorych ze współistniejącymi liczbami limfocytów poniżej wartości DGN limfopenię sklasyfikowano jako umiarkowaną lub ciężką. Po wprowadzeniu do obrotu większość przypadków zakażenia półpaścem stanowiły przypadki nieuznane za ciężkie, które ustąpiły po zastosowaniu leczenia. Istnieją ograniczone dane na temat bezwzględnej liczby limfocytów (ALC) u pacjentów z zakażeniem półpaścem z okresu po wprowadzeniu do obrotu. Jednak w momencie zgłaszania u większości pacjentów występowała limfopenia umiarkowana (od od ≥0,5 × 109/l do <0,8 x 109/l) lub ciężka (od <0,5 x 109/l do 0,2 x 109/l) (patrz punkt 4.4).
Nieprawidłowe wyniki badań laboratoryjnych
W badaniach kontrolowanych placebo stężenie ciał ketonowych w moczu (1+ lub więcej) było większe u pacjentów leczonych fumaranem dimetylu (45%) w porównaniu do placebo (10%). W badaniach klinicznych nie zaobserwowano niepożądanych następstw klinicznych.
Stężenia 1,25-dihydroksywitaminy D zmniejszały się u pacjentów leczonych fumaranem dimetylu bardziej niż w grupie placebo (procentowa mediana zmniejszenia stężenia po 2 latach w stosunku do wartości wyjściowej wynosiła odpowiednio 25% do 15%), natomiast stężenia parathormonu (PTH) zwiększały się bardziej u pacjentów leczonych fumaranem dimetylu w porównaniu do placebo (procentowa mediana zwiększenia stężenia po 2 latach w stosunku do wartości wyjściowej wynosiła odpowiednio 29% do 15%). Średnie wartości dla obu parametrów utrzymywały się w granicach normy.
W ciągu pierwszych dwóch miesięcy leczenia obserwowano przemijający wzrost średniej liczby
granulocytów kwasochłonnych.
Dzieci i młodzież
W 96-tygodniowym, otwartym, randomizowanym badaniu z grupą kontrolną przyjmującą czynny lek, przeprowadzonym u dzieci i młodzieży z RRMS w wieku od 10 do poniżej 18 lat (120 mg dwa razy na dobę przez 7 dni, a następnie 240 mg dwa razy na dobę przez pozostały czas leczenia; populacja badana n=78), profil bezpieczeństwa u dzieci i młodzieży wydawał się podobny do obserwowanego wcześniej u pacjentów dorosłych. Schemat badania klinicznego u dzieci różnił się od badań klinicznych kontrolowanych placebo u dorosłych. Z tego względu nie można wykluczyć, że zastosowanie innego schematu badania klinicznego przyczyniło się do wystąpienia różnic liczbowych w zakresie działań niepożądanych między populacją dzieci i młodzieży a populacją dorosłych.
Następujące zdarzenia niepożądane były zgłaszane częściej (≥10%) w populacji dzieci i młodzieży niż w populacji dorosłych:
leczonych interferonem beta-1a.
W niewielkim, 24-tygodniowym, otwartym, niekontrolowanym badaniu z udziałem dzieci i młodzieży w wieku od 13 do 17 lat z RRMS (120 mg dwa razy na dobę przez 7 dni, a następnie 240 mg dwa razy na dobę przez pozostały czas leczenia; grupa badana pod kątem bezpieczeństwa, n=22), po którym nastąpiło 96- tygodniowe badanie uzupełniające (240 mg dwa razy na dobę; grupa badana pod kątem bezpieczeństwa, n=20), profil bezpieczeństwa wydawał się podobny do obserwowanego u pacjentów dorosłych.
Dane dotyczące stosowania u dzieci w wieku od 10 do 12 lat są ograniczone. Nie określono dotychczas bezpieczeństwa stosowania ani skuteczności produktu Dimtruzic u dzieci w wieku poniżej 10 lat.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych
i Produktów Biobójczych: Al. Jerozolimskie 181C, 02-222 Warszawa tel.: + 48 22 49 21 301;
Zgłaszano przypadki przedawkowania fumaranu dimetylu. Objawy opisywane w tych przypadkach były zgodne z profilem znanych działań niepożądanych fumaranu dimetylu. Nie są znane żadne metody terapeutyczne, które mogłyby przyspieszyć eliminację fumaranu dimetylu, jak również nie jest znane antidotum. W razie przedawkowania zaleca się wdrożenie objawowego leczenia wspomagającego, stosownie do wskazań klinicznych.
Grupa farmakoterapeutyczna: leki immunosupresyjne, inne leki immunosupresyjne, kod ATC: L04AX07
Mechanizm działania
Mechanizm terapeutycznego działania fumaranu dimetylu w stwardnieniu rozsianym nie jest w pełni poznany. Wyniki badań przedklinicznych wskazują, że farmakodynamiczny efekt fumaranu dimetylu wynika głównie z aktywacji ścieżki transkrypcyjnej czynnika jądrowego Nrf2 [ang. (erythroid derived 2) like 2]. Wykazano, że fumaran dimetylu zwiększa u pacjentów ekspresję genów ochrony antyoksydacyjnej zależnych od Nrf2 (takich jak np. dehydrogenaza NAD(P)H, chinon 1; [NQO1]).
Działanie farmakodynamiczne
Działanie na układ odpornościowy
W badaniach przedklinicznych i klinicznych wykazano właściwości przeciwzapalne
i immunomodulacyjne fumaranu dimetylu. W modelach przedklinicznych fumaran dimetylu i fumaran monometylu, który jest głównym metabolitem fumaranu dimetylu, silnie hamowały aktywację komórek układu odpornościowego oraz wynikające z niej uwalnianie prozapalnych cytokin w odpowiedzi na bodźce zapalne. Co więcej, w badaniach klinicznych z udziałem pacjentów z łuszczycą fumaran dimetylu wpływał na fenotypy limfocytów poprzez zmniejszanie produkcji profilu cytokin prozapalnych (TH1, TH17) oraz pobudzał produkcję komórek przeciwzapalnych (TH2). Fumaran dimetylu wykazywał działanie terapeutyczne w wielorakich modelach urazów zapalnych i neurozapalnych. W badaniach III fazy u pacjentów ze stwardnieniem rozsianym (DEFINE, CONFIRM oraz ENDORSE) po rozpoczęciu leczenia fumaranem dimetylu średnia liczba limfocytów zmniejszała się w ciągu pierwszego roku przeciętnie o około 30% w stosunku do wartości wyjściowej, osiągając następnie plateau. W tych badaniach pacjentów, u których przerwano leczenie fumaranem dimetylu, gdy liczba limfocytów spadła poniżej DGN (910 komórek/mm3), monitorowano pod kątem powrotu liczby limfocytów do DGN.
Rycina 1 przedstawia odsetek pacjentów, u których oszacowano metodą Kaplana-Meiera osiągnięcie DGN bez przedłużającej się ciężkiej limfopenii. Wartość wyjściową powrotu do normy ( ang. recovery baseline, RBL) zdefiniowano jako ostatnią bezwzględną liczbę limfocytów (ang. Absolute Lymphocyte Count, ALC) w trakcie leczenia przed odstawieniem fumaranu dimetylu. Szacowany odsetek pacjentów, u których nastąpił powrót do wartości DGN (ALC ≥ 0,9 × 109/l) w tygodniu 12.
i 24., z łagodną, umiarkowaną lub ciężką limfopenią w punkcie RBL, przedstawiony jest w tabeli 1, tabeli 2 i tabeli 3, z 95% punktowymi przedziałami ufności. Błąd standardowy estymatora Kaplana- Meiera w odniesieniu do funkcji przeżycia obliczano za pomocą wzoru Greenwoooda.
Ryc. 1: Metoda Kaplana-Meiera; odsetek pacjentów, u których nastąpił powrót do wartości
≥910 komórek/mm3 DGN wobec wartości w punkcie wyjściowym RBL
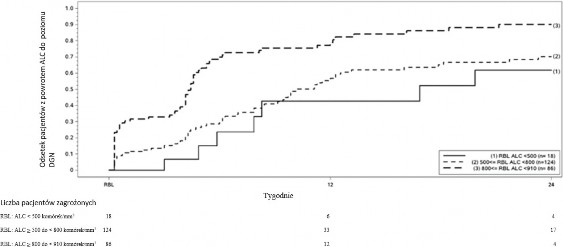
Tabela 1: Metoda Kaplana-Meiera; odsetek pacjentów, u których szacuje się osiągnięcie DGN, łagodna limfopenia w punkcie wyjściowym powrotu do normy (RBL), z wyłączeniem pacjentów z długotrwałą ciężką limfopenią
Liczba zagrożonych pacjentów z łagodną limfopeniąa | Okres wyjściowy N=86 | Tydzień 12 N=12 | Tydzień 24 N=4 |
Odsetek osiągających | 0,81 | 0,90 | |
DGN (95% CI) | (0,71; 0,89) | (0,81; 0,96) |
a Pacjenci z ALC <910 i ≥800 komórek/mm3 w punkcie RBL, z wyłączeniem pacjentów z długotrwałą ciężką limfopenią.
Tabela 2: Metoda Kaplana-Meiera; odsetek pacjentów, u których szacuje się osiągnięcie DGN, umiarkowana limfopenia w punkcie wyjściowym powrotu do normy (RBL), z wyłączeniem pacjentów z długotrwałą ciężką limfopenią
Liczba zagrożonych pacjentów z umiarkowaną limfopeniąa | Okres wyjściowy N=124 | Tydzień 12 N=33 | Tydzień 24 N=17 |
Odsetek osiągających | 0,57 | 0,70 | |
DGN (95% CI) | (0,46; 0,67) | (0,60; 0,80) |
a Pacjenci z ALC <800 i ≥500 komórek/mm3 w punkcie RBL, z wyłączeniem pacjentów z długotrwałą ciężką limfopenią.
Tabela 3: Metoda Kaplana-Meiera; odsetek pacjentów, u których szacuje się osiągnięcie DGN, ciężka limfopenia w punkcie wyjściowym powrotu do normy (RBL), z wyłączeniem pacjentów z długotrwałą ciężką limfopenią
Liczba zagrożonych pacjentów z ciężką limfopeniąa | Okres wyjściowy N=18 | Tydzień 12 N=6 | Tydzień 24 N=4 |
Odsetek osiągających | 0,43 | 0,62 | |
DGN (95% CI) | (0,20; 0,75) | (0,35; 0,88) |
a Pacjenci z ALC <500 komórek/mm3 w punkcie RBL, z wyłączeniem pacjentów z długotrwałą ciężką limfopenią.
Skuteczność kliniczna i bezpieczeństwo stosowania
Przeprowadzono dwa dwuletnie randomizowane badania kliniczne z zastosowaniem podwójnie ślepej próby, kontrolowane placebo (DEFINE z udziałem 1234 pacjentów i CONFIRM z udziałem 1417 pacjentów) z RRMS. W badaniach nie uczestniczyli pacjenci z postępującą postacią stwardnienia rozsianego.
Skuteczność (patrz tabela poniżej) i bezpieczeństwo wykazano u pacjentów z punktacją w skali EDSS
(Rozszerzona Skala Niewydolności Ruchowej) od 0 do 5 włącznie, u których wystąpił co najmniej
1 rzut choroby w ciągu roku poprzedzającego włączenie do badania lub u których badanie mózgu MRI wykonane w ciągu 6 tygodni poprzedzających randomizację, wykazało co najmniej jedną zmianę Gd+ (po wzmocnieniu gadolinem). Badanie CONFIRM prowadzono metodą podwójnie ślepej próby (tj. badacz lub lekarz oceniający odpowiedź na badany lek też nie wie, który lek pacjent przyjmuje)
z zastosowaniem leku porównawczego, octanu glatirameru.
Średnie wartości charakterystyki wyjściowej pacjentów w badaniu DEFINE przedstawiały się następująco: wiek 39 lat, czas trwania choroby 7,0 lat, punktacja w skali EDSS 2,0. Ponadto u
16% pacjentów wynik w skali EDSS wynosił >3,5, u 28% wystąpiły ≥2 rzuty w trakcie poprzedniego roku, a 42% było wcześniej leczonych innymi lekami stosowanymi zgodnie z zarejestrowanym wskazaniem w leczeniu stwardnienia rozsianego. W populacji pacjentów, u których wykonano badanie MRI, u 36% pacjentów włączonych do badania występowały w okresie wyjściowym zmiany Gd+ (średnia liczba zmian Gd+ wynosiła 1,4).
Średnie wartości charakterystyki wyjściowej pacjentów w badaniu CONFIRM przedstawiały się następująco: wiek 37 lat, czas trwania choroby 6,0 lat, punktacja w skali EDSS 2,5. Ponadto u 17% wynik w skali EDSS wynosił >3,5, u 32% wystąpiły ≥2 rzuty w trakcie poprzedniego roku, a
30% było wcześniej leczonych innymi lekami stosowanymi zgodnie z zarejestrowanym wskazaniem w leczeniu stwardnienia rozsianego. W populacji pacjentów, u których wykonano badanie MRI, u 45% pacjentów włączonych do badania występowały w okresie wyjściowym zmiany Gd+ (średnia liczba zmian Gd+ wynosiła 2,4).
W porównaniu do placebo u pacjentów leczonych fumaranem dimetylu uzyskano klinicznie znaczącą i statystycznie istotną redukcję względem: pierwszorzędowego punktu końcowego w badaniu DEFINE, czyli odsetka pacjentów, u których wystąpił nawrót choroby po 2 latach, oraz pierwszorzędowego punktu końcowego w badaniu CONFIRM, czyli rocznego wskaźnika rzutów (nawrotów) (ang. annualized relapse rate, ARR) po 2 latach.
W badaniu CONFIRM wskaźnik ARR dla octanu glatirameru i dla placebo wynosił odpowiednio 0,286 i 0,401, co odpowiadało redukcji o 29% (p=0,013), i co jest zgodne z zatwierdzoną Charakterystyką Produktu Leczniczego (ChPL).
(DEFINE) | (CONFIRM) | ||||
Placebo | Fumaran dimetylu 240 mg dwa razy na dobę | Placebo | Fumaran dimetylu 240 mg dwa razy na dobę | Octan glatirameru | |
Kliniczne punkty końcowea | |||||
Liczba pacjentów | 408 | 410 | 363 | 359 | 350 |
Roczny wskaźnik rzutów (nawrotów) | 0,364 | 0,172*** | 0,401 | 0,224*** | 0,286* |
Częstość względna (95% CI–przedział ufności) | 0,47 (0,37; 0,61) | 0,56 (0,42; 0,74) | 0,71 (0,55; 0,93) | ||
Odsetek nawrotów | 0,461 | 0,270*** | 0,410 | 0,291** | 0,321** |
Ryzyko względne (95% CI–przedział ufności) | 0,51 (0,40; 0,66) | 0,66 (0,51; 0,86) | 0,71 (0,55; 0,92) | ||
Odsetek przypadków 12- tygodniowej potwierdzonej progresji niepełnosprawności | 0,271 | 0,164** | 0,169 | 0,128# | 0,156# |
Ryzyko względne (95% CI-przedział ufności) | 0,62 (0,44; 0,87) | 0,79 (0,52; 1,19) | 0,93 (0,63; 1,37) | ||
Odsetek przypadków 24- tygodniowej potwierdzonej progresji niepełnosprawności | 0,169 | 0,128# | 0,125 | 0,078# | 0,108# |
Ryzyko względne (95% CI-przedział ufności) | 0,77 (0,52; 1,14) | 0,62 (0,37; 1,03) | 0,87 (0,55; 1,38) | ||
Punkty końcowe MRIb | |||||
Liczba pacjentów | 165 | 152 | 144 | 147 | 161 |
Średnia (mediana) liczba nowych lub na nowo powiększających się zmian w obrazach T2-zależnych w ciągu 2 lat | 16,5 (7,0) | 3,2 (1,0)*** | 19,9 (11,0) | 5,7 (2,0)*** | 9,6 (3,0)*** |
Średnia częstość zmian (95% CI–przedział ufności) | 0,15 (0,10; 0,23) | 0,29 (0,21; 0,41) | 0,46 (0,33; 0,63) | ||
Średnia (mediana) liczba zmian Gd w ciągu 2 lat | 1,8 (0) | 0,1 (0)*** | 2,0 (0,0) | 0,5 (0,0)*** | 0,7 (0,0)** |
Iloraz szans (95% CI–przedział ufności) | 0,10 (0,05; 0,22) | 0,26 (0,15; 0,46) | 0,39 (0,24; 0,65) | ||
Średnia (mediana) liczba nowych hipointensywnych zmian w obrazach T1- zależnych w ciągu 2 lat | 5,7 (2,0) | 2,0 (1,0)*** | 8,1 (4,0) | 3,8 (1,0)*** | 4,5 (2,0)** |
Średnia częstość zmian (95% CI–przedział ufności) | 0,28 (0,20; 0,39) | 0,43 (0,30; 0,61) | 0,59 (0,42; 0,82) |
aWszystkie analizy klinicznych punktów końcowych przeprowadzono na populacji ITT; bDo celów analizy wyników MRI wykorzystano kohortę badaną MRI
* P-wartość <0,05; ** P-wartość <0,01; *** P-wartość <0,0001; # statystycznie nieistotna
Do otwartego niekontrolowanego 8-letniego badania kontynuacyjnego (ENDORSE) włączono 1736 kwalifikujących się pacjentów z RRMS, którzy uczestniczyli w badaniach podstawowych (DEFINE i CONFIRM). Pierwszorzędowym celem badania była ocena długoterminowego bezpieczeństwa fumaranu dimetylu u pacjentów z RRMS. Spośród 1736 pacjentów około połowa
(909, 52%) była leczona przez 6 lat lub dłużej. We wszystkich 3 badaniach 501 pacjentów było stale leczonych fumaranem dimetylu w dawce 240 mg dwa razy na dobę, a 249 pacjentów, którzy wcześniej otrzymywali placebo w badaniach DEFINE i CONFIRM, otrzymywało 240 mg dwa razy na dobę w badaniu ENDORSE. Pacjenci, którzy otrzymywali stałe leczenie dwa razy na dobę byli leczeni maksymalnie 12 lat.
Podczas badania ENDORSE ponad połowa wszystkich pacjentów leczonych fumaranem dimetylu w dawce 240 mg dwa razy na dobę nie miała nawrotu choroby. W przypadku pacjentów stale leczonych dwa razy na dobę we wszystkich trzech badaniach, skorygowany wskaźnik ARR wynosił 0,187
(95% CI: 0,156; 0,224) w badaniach DEFINE i CONFIRM oraz 0,141 (95% CI: 0,119; 0,167) w
badaniu ENDORSE. W przypadku pacjentów wcześniej leczonych placebo skorygowany wskaźnik ARR zmniejszył się z 0,330 (95% CI: 0,266; 0,408) w badaniach DEFINE i CONFIRM do 0,149
(95% CI: 0,116; 0,190) w badaniu ENDORSE.
W badaniu ENDORSE większość pacjentów (> 75%) nie miała potwierdzonej progresji niepełnosprawności (mierzonej jako progresja niepełnosprawności utrzymująca się przez 6 miesięcy). Połączone wyniki z trzech badań wykazały, że u pacjentów leczonych fumaranem dimetylu odsetek przypadków potwierdzonej progresji niepełnosprawności był stały i niski, z niewielkim wzrostem średnich wyników w skali EDSS w całej populacji badania ENDORSE. Wyniki badania MRI (do
Podawany doustnie fumaran dimetylu podlega szybkiej przedukładowej hydrolizie przez esterazy
i jest przekształcany do metabolitu pierwotnego, fumaranu monometylu, który jest również czynny. Fumaran dimetylu nie występuje w osoczu w mierzalnych stężeniach po doustnym podaniu, a zatem wszystkie analizy farmakokinetyki dotyczące fumaranu dimetylu były przeprowadzane na podstawie osoczowych stężeń fumaranu monometylu. Dane farmakokinetyczne pochodziły od pacjentów ze stwardnieniem rozsianym oraz zdrowych ochotników.
Wchłanianie
Tmax fumaranu monometylu wynosi 2 do 2,5 godzin. Ponieważ kapsułki dojelitowe, twarde produktu Dimtruzic zawierają granulat powlekany dojelitową otoczką ochronną, wchłanianie rozpoczyna się dopiero, gdy opuszczą one żołądek (zwykle po upływie niecałej godziny).Po podaniu dawki 240 mg dwa razy na dobę z posiłkiem mediana maksymalnego stężenia (Cmax) wynosiła 1,72 mg/l, a całkowita ekspozycja wyrażona jako pole powierzchni pod krzywą (ang. area under the curve, AUC) wynosiła 8,02 mg·h/l u pacjentów ze stwardnieniem rozsianym. Łącznie Cmax i AUC zwiększały się w przybliżeniu proporcjonalnie do dawki w badanym zakresie dawek (120 mg do 360 mg). W badaniach z udziałem pacjentów ze stwardnieniem rozsianym dwie dawki po 240 mg podawano co 4 godziny w ramach schematu dawkowania TID (trzy razy na dobę). Wynikiem tego była minimalna kumulacja ekspozycji, dająca w rezultacie zwiększenie mediany Cmax o 12% w porównaniu do schematu dawkowania BID - dwa razy na dobę (1,72 mg/l w schemacie BIDw porównaniu do 1,93 mg/l w schemacie TID) bez wpływu na bezpieczeństwo. Pokarm nie wpływa w klinicznie istotnym stopniu na ekspozycję na fumaran dimetylu. Niemniej jednak fumaran dimetylu powinno się przyjmować z posiłkiem, gdyż poprawia to tolerancję odnośniedziałań niepożądanych, takich jak nagłe zaczerwienienie skóry i dolegliwości żołądkowo-jelitowe (patrz punkt 4.2).
Dystrybucja
Pozorna objętość dystrybucji po doustnym podaniu 240 mg fumaranu dimetylu waha się pomiędzy 60 l a 90 l. U ludzi wiązanie fumaranu monometylu z białkami osocza na ogół waha się w przedziale od 27% do 40%.
Metabolizm
W organizmie ludzkim fumaran dimetylu jest w znacznym stopniu metabolizowany i mniej niż 0,1% dawki wydalana jest z moczem w postaci niezmienionej, jako fumaran dimetylu. Jest on wstępnie metabolizowany przez esterazy, obecne w całym przewodzie pokarmowym, krwi i tkankach,
a następnie przedostaje się do krążenia układowego. Dalszy metabolizm odbywa się za pośrednictwem cyklu kwasów trikarboksylowych, bez udziału układu cytochromu P450 (CYP). W badaniu oceniającym pojedynczą dawkę 240 mg fumaranu dimetylu znakowanego węglem 14 Cjako główny metabolit w ludzkim osoczu zidentyfikowano glukozę. Do innych krążących metabolitów należały kwas fumarowy, kwas cytrynowy i fumaran monometylu. Metabolizm kolejnego produktu tego szlaku, kwasu fumarowego, odbywa się za pośrednictwem cyklu kwasów trikarboksylowych, przy czym główną drogą wydalania jest wydychanie w postaci dwutlenku węgla (CO2).
Eliminacja
Wydychanie CO2 to główna droga eliminacji fumaranu dimetylu, którą wydalane jest 60% dawki. Wydalanie z moczem i z kałem to wtórne drogi eliminacji, usuwające odpowiednio 15,5% i 0,9% dawki.
Okres półtrwania fumaranu monometylu w fazie eliminacji jest krótki (około 1 godziny) i po 24 godzinach w organizmie większości osób nie ma już pozostałości fumaranu monometylu. Po
podawaniu wielokrotnych dawek fumaranu dimetylu w ramach schematu dawkowania nie następuje
kumulacja leku macierzystego ani też fumaranu monometylu.
Liniowość
Ekspozycja na fumaran dimetylu zwiększa się w przybliżeniu proporcjonalnie do dawki przy
podawaniu pojedynczych i wielokrotnych dawek w badanym zakresie dawek, od 120 mg do 360 mg.
Farmakokinetyka u szczególnych grup pacjentów
W oparciu w wyniki analizy wariancji (ANOVA) masa ciała jest główną zmienną wpływającą na ekspozycję (wyrażoną w Cmax i AUC) u pacjentów z RRMS, ale czynnik ten nie wpływał na oceniane w badaniach klinicznych miary bezpieczeństwa i skuteczności.
Płeć i wiek nie wpływały w klinicznie istotnym stopniu na farmakokinetykę fumaranu dimetylu. Nie
przeprowadzono badań farmakokinetyki u pacjentów w wieku 65 lat i starszych.
Dzieci i młodzież
Profil farmakokinetyczny fumaranu dimetylu podawanego w dawce 240 mg dwa razy na dobę zostałoceniony w niewielkim, otwartym niekontrolowanym badaniu z udziałem pacjentów w wieku od
13 do 17 lat (n=21) z rzutowo-remisyjną postacią stwardnienia rozsianego (RRMS). Farmakokinetyka fumaranu dimetylu w tej grupie młodzieży była podobna do wcześniej obserwowanej u pacjentów dorosłych (Cmax: 2,00±1,29 mg/l; AUC0-12h: 3,62±1,16 h.mg/l, co odpowiada całkowitemu dziennemu AUC równemu 7,24 h.mg/l).
Zaburzenia czynności nerek
Z uwagi na fakt, że wydalanie przez nerki stanowi wtórną drogę eliminacji fumaranu dimetylu, którą
usuwane jest mniej niż 16% podanej dawki, nie przeprowadzono oceny farmakokinetyki u osób z zaburzeniami czynności nerek.
Zaburzenia czynności wątroby
Ponieważ fumaran dimetylu i fumaran monometylu są metabolizowane przez esterazy, bez udziału układu cytochromu P450 (CYP), nie przeprowadzono oceny farmakokinetyki u osób z zaburzeniami czynności wątroby.
W badaniach klinicznych nie obserwowano niepożądanych działań opisanych poniżej w punktach
„Toksykologia” oraz „Toksyczny wpływ na reprodukcję”, natomiast działania te obserwowano u zwierząt przy ekspozycji na poziomie podobnym do stężeń klinicznych.
Działanie mutagenne
Wyniki badań in vitro z zastosowaniem testu Amesa (test aberracji chromosomalnych w komórkach ssaków) były dla fumaranu dimetylu i fumaranu monometylu ujemne. Wyniki testu mikrojąderkowego in vivo u szczurów były dla fumaranu dimetylu ujemne.
Działanie rakotwórcze
Badania rakotwórczości fumaranu dimetylu prowadzono na myszach i szczurach przez okres do dwóch lat. Fumaran dimetylu podawano myszom w doustnych dawkach 25, 75, 200 i 400 mg/kg mc. na dobę oraz szczurom w dawkach 25, 50, 100 i 150 mg/kg mc. na dobę. U myszy częstość występowania raka komórek kanalikowych nerek i gruczolaków jąder z komórek Leydiga zwiększała się po dawce 75 mg/kg na dobę, przy ekspozycji (AUC) odpowiadającej zalecanej dawce u ludzi.
U szczurów częstość występowania raka komórek kanalikowych nerek zwiększała się po dawce 100 mg/kg na dobę - ekspozycji około2 razy większej niż po zalecanej dawce u ludzi. Znaczenie wyników tych badań dla ryzyka u ludzi nie jest znane.
Częstość występowania brodawczaka płaskonabłonkowego i raka w przedżołądku (bezgruczołowej części żołądka) zwiększała się u myszy przy ekspozycji odpowiadającej dawce zalecanej dla ludzi, a u szczurów - przy ekspozycji poniżej tej dawki (w oparciu o AUC). U ludzi nie występuje odpowiednik przedżołądka gryzoni.
Toksykologia
Niekliniczne badania na gryzoniach, królikach i małpach prowadzono z zastosowaniem fumaranu dimetylu w postaci zawiesiny (fumaran dimetylu w 0,8% roztworze hydroksypropylometylocelulozy) podawanej drogą doustną przez zgłębnik. Badanie przewlekłego stosowania u psów prowadzono
z zastosowaniem podawanego doustnie fumaranu dimetylu w postaci kapsułki.
Zmiany w nerkach obserwowano po wielokrotnym doustnym podawaniu fumaranu dimetylu u myszy, szczurów, psów i małp. Regenerację nabłonka kanalików nerkowych, wskazującą na uszkodzenie, obserwowano u wszystkich gatunków. Rozrost kanalików nerkowych obserwowano u szczurów, którym podawano fumaran dimetylu przez całe życie (badanie dwuletnie). U psów, które przez 11 miesięcy otrzymywały codziennie doustną dawkę fumaranu dimetylu, wyliczona graniczna dawka, przy której stwierdzano zanik kory, była trzykrotnie większa niż dawka zalecana (w oparciu o AUC). U małp, które przez 12 miesięcy otrzymywały codziennie doustną dawkę fumaranu dimetylu, zaobserwowano martwicę pojedynczych komórek przy dawkach dwukrotnie większych niż dawka zalecana (w oparciu o AUC). Włóknienie śródmiąższowe i zanik kory obserwowano przy dawce sześciokrotnie większej niż dawka zalecana (w oparciu o AUC). Znaczenie wyników tych badań dla ryzyka u ludzi nie jest znane.
W jądrach szczurów i psów obserwowano zwyrodnienie nabłonka plemnikotwórczego. Efekty te obserwowano u szczurów po dawkach podobnych do dawki zalecanej, a u psów po dawkach trzykrotnie wyższych od dawki zalecanej (w oparciu AUC). Znaczenie wyników tych badań dla ryzyka u ludzi nie jest znane.
Zmiany zaobserwowane w przedżołądku myszy i szczurów w ramach badań trwających przez
3 miesiące i dłuższych obejmowały rozrost komórek płaskonabłonkowych (hiperplazję) i znaczne zgrubienie warstwy rogowej (hiperkeratozę); stany zapalne oraz występowanie brodawczaka płaskonabłonkowego i raka. U ludzi nie występuje odpowiednik przedżołądka gryzoni.
Toksyczny wpływ na reprodukcję
Doustne podawanie fumaranu dimetylu samcom szczura w dawkach 75, 250 i 375 mg/kg na dobę przed parzeniem i w okresie parzenia nie miało wpływu na płodność samców, aż do najwyższej badanej dawki (co najmniej dwa razy większej od dawki zalecanej na podstawie AUC). Doustne podawanie fumaranu dimetylu samicom szczura w dawkach 25, 100 i 250 mg/kg na dobę przed parzeniem, w okresie parzenia i do 7. dnia ciąży, powodowało zmniejszenie liczby faz płodnych
w okresie 14-dniowym oraz zwiększało liczbę zwierząt z przedłużonym okresem międzyrujowym po najwyższej badanej dawce (11 razy większej od dawki zalecanej na podstawie AUC). Zmiany te nie miały negatywnego wpływu na płodność ani na liczbę żywych płodów.
Wykazano, że u szczurów i królików fumaran dimetylu przenika przez błonę łożyskową do krwi płodu, przy czym stosunek stężenia w osoczu płodu do stężenia w osoczu matki wynosił odpowiednio 0,48-0,64 i 0,1. Nie obserwowano wad rozwojowych po żadnej dawce fumaranu dimetylu u szczurów ani u królików. Podawanie fumaranu dimetylu w doustnych dawkach 25, 100 i 250 mg/kg na dobę ciężarnym samicom szczura w okresie organogenezy wywoływało działania niepożądane u samic po dawkach czterokrotnie wyższych od dawki zalecanej na podstawie AUC oraz prowadziło do niskiej masy ciała płodów oraz opóźnienia kostnienia (w obrębie kości śródstopia i paliczków kończyn tylnych) po dawkach 11-krotnie wyższych od dawki zalecanej na podstawie AUC. Niższą masę ciała płodów i opóźnienie kostnienia uważano za efekt wtórny w stosunku do toksycznego działania na matkę (zmniejszenie masy ciała i ilości przyjmowanego pokarmu).
Doustne podawanie fumaranu dimetylu w dawkach 25, 75 i 150 mg/kg na dobę ciężarnym samicom królika w okresie organogenezy nie wpływało w żaden sposób na rozwój zarodka i płodu, natomiast prowadziło do zmniejszenia masy ciała u matek po dawkach siedmiokrotnie wyższych od dawki zalecanej, a do większej liczby poronień po dawkach 16-krotnie wyższych od dawki zalecanejna podstawie AUC.
Doustne podawanie fumaranu dimetylu w dawkach 25, 100 i 250 mg/kg na dobę samicom szczura w trakcie ciąży i laktacji prowadziło do obniżenia masy ciała u potomstwa w pokoleniu F1 oraz opóźnienia dojrzałości płciowej u samców pokolenia F1 po dawkach 11-krotnie wyższych od dawki
zalecanej na podstawie AUC. Nie wykazano wpływu na płodność potomstwa w pokoleniu F1. Niższą masę ciała potomstwa uważano za efekt wtórny w stosunku do toksycznego działania na matkę.
Dwa badania toksyczności u młodych szczurów, którym codziennie podawano doustnie fumaran dimetylu od 28. do 90-93. dnia po urodzeniu (co u ludzi odpowiada wiekowi około 3 lat i powyżej) wykazały podobną toksyczność wobec narządu docelowego (w nerkach i przedżołądku), jak u dorosłych zwierząt. W pierwszym badaniu fumaran dimetylu nie wpływał na rozwój, efekty neurobehawioralne ani płodność samców i samic aż do najwyższej dawki 140 mg/kg na dobę (około 4,6-krotność zalecanej dawki u ludzi na podstawie ograniczonych danych dotyczących AUC u dzieci i młodzieży). Podobnie w drugim badaniu u młodych samców szczurów nie zaobserwowano wpływu na narządy rozrodcze i narządy dodatkowe samców aż do najwyższej dawki fumaranu dimetylu wynoszącej 375 mg/kg na dobę (około 15-krotność przypuszczalnej wartości AUC przy zalecanej dawce dla dzieci i młodzieży). Zaobserwowano jednak zmniejszoną zawartość minerałów i gęstość kości w kości udowej i kręgach lędźwiowych u młodych samców szczurów. Zmiany w densytometrii kości obserwowano również u młodych szczurów po doustnym podaniu fumaranu diroksymelu, innego estru kwasu fumarowego, który jest metabolizowany do tego samego aktywnego metabolitu fumaranu monometylu in vivo. Poziom, przy którym nie obserwuje się działań niepożądanych (NOAEL) w zakresie zmian densytometrycznych u młodych szczurów wynosi około 1,5-krotności przypuszczalnej wartości AUC przy zalecanej dawce dla dzieci i młodzieży. Możliwy jest związek efektów kostnych z niższą masą ciała, ale nie można wykluczyć udziału efektu bezpośredniego.
Wyniki dotyczące kości mają ograniczone znaczenie dla pacjentów dorosłych. W przypadku dzieci i młodzieży znaczenie tych wyników nie jest znane.
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Zawartość kapsułki Kroskarmeloza sodowa Krzemionka koloidalna bezwodna Sodu stearylofumaran
Kwasu metakrylowego i metylu metakrylanu kopolimer (1:1)
Talk
Trietylu cytrynian
Kwasu metakrylowego i etylu akrylanu kopolimer (1:1), dyspersja 30%
Glicerolu monostearynian 40-55 (E 471)
Polisorbat 80
Kapsułka Żelatyna
Tytanu dwutlenek (E 171) Żelaza tlenek żółty (E 172) Błękit brylantowy FCF (E 133)
Nadruk kapsułki (czarny tusz)
Szelak
Glikol propylenowy (E 1520)
Żelaza tlenek czarny (E 172) Amonowy wodorotlenek stężony 28%
Nie dotyczy.
3 lata
Nie przechowywać w temperaturze powyżej 30ºC.
Blistry lub blistry kalendarzowe lub perforowane blistry jednodawkowe z folii Al/PVC/PVDC. Dimtruzic, 120 mg, kapsułki dojelitowe twarde
Blistry 14 kapsułek dojelitowych twardych
Kalendarzowy blister - 14 kapsułek dojelitowych, twardych Perforowane blistry jednodawkowe 14 x1 kapsułka dojelitowa, twarda
Dimtruzic, 240 mg, kapsułki dojelitowe twarde
Blistry 56 kapsułek dojelitowych twardych
Kalendarzowy blister - 56 kapsułek dojelitowych twardych Perforowane blistry jednodawkowe 56 x 1 kapsułka dojelitowa, twarda Perforowane blistry jednodawkowe 168 x 1 kapsułka dojelitowa, twarda
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Bez specjalnych wymagań.
Sandoz GmbH
Biochemiestrasse 10
6250 Kundl
Austria
Dimtruzic, 120 mg Pozwolenie Nr 27552
Dimtruzic, 240 mg Pozwolenie Nr 27553
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 30.12.2022











