Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Dawkowanie i sposób podawania
Należy natychmiast zadzwonić po pomoc medyczną, wezwać karetkę i zgłosić wystąpienie reakcji anafilaktycznej, nawet jeśli objawy ustępują (patrz punkt 4.4).
Przytomnych pacjentów należy ułożyć płasko z uniesionymi nogami, lub, w przypadku trudności
z oddychaniem, w pozycji siedzącej. Pacjentów nieprzytomnych należy położyć na boku w pozycji bocznej ustalonej.
Jeśli to możliwe, pacjent powinien pozostać z inną osobą aż do przybycia pomocy medycznej.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania i przygotowania produktu leczniczego do stosowania.
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU I DATA PRZEDŁUŻENIA POZWOLENIA
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Jext, 150 mikrogramów, roztwór do wstrzykiwań we wstrzykiwaczu Jext, 300 mikrogramów, roztwór do wstrzykiwań we wstrzykiwaczu
Jext, 150 mikrogramów: Jeden wstrzykiwacz półautomatyczny napełniony dostarcza jedną dawkę 0,15 mL roztworu do wstrzykiwań, zawierającą 150 mikrogramów adrenaliny (w postaci winianu).
Jext, 300 mikrogramów: Jeden wstrzykiwacz półautomatyczny napełniony dostarcza jedną dawkę 0,3 mL roztworu do wstrzykiwań, zawierającą 300 mikrogramów adrenaliny (w postaci winianu).
1 mL roztworu zawiera 1 mg adrenaliny (w postaci winianu).
Substancje pomocnicze o znanym działaniu: sodu pirosiarczyn (E 223) i sodu chlorek. Produkt leczniczy Jext zawiera mniej niż 1 mmol (23 mg) sodu na dawkę.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Roztwór do wstrzykiwań we wstrzykiwaczu. Przejrzysty i bezbarwny roztwór.
Produkt leczniczy Jext jest wskazany w leczeniu nagłych przypadków ciężkich reakcji alergicznych
(anafilaksji) na użądlenia lub ukąszenia owadów, pożywienie, leki lub inne alergeny, a także w anafilaksji idiopatycznej lub wywołanej wysiłkiem fizycznym.
Dawkowanie
Dzieci i młodzież:
Osoby o masie ciała od 15 kg do 30 kg
Zazwyczaj stosowana dawka wynosi 150 mikrogramów.
U dzieci o masie ciała mniejszej niż 15 kg nie można zapewnić podania z wystarczającą dokładnością dawki mniejszej niż 150 mikrogramów, z tego względu nie zaleca się stosowania produktu leczniczego u tych dzieci, chyba że w stanach zagrożenia życia i na wyraźne zalecenie lekarza. U dzieci i młodzieży
o masie ciała powyżej 30 kg należy zalecić stosowanie produktu leczniczego Jext o mocy 300 mikrogramów.
Stosowanie u dorosłych pacjentów o masie ciała powyżej 30 kg Zazwyczaj stosowana dawka wynosi 300 mikrogramów.
U dorosłych o większej masie ciała może być konieczne podanie więcej niż jednego wstrzyknięcia w celu opanowania (ew. wyleczenia) objawów ciężkiej reakcji alergicznej.
Pacjentom o masie ciała od 15 kg do 30 kg należy zalecić stosowanie produktu leczniczego Jext o mocy 150 mikrogramów.
Pierwszą dawkę należy podać możliwie najszybciej po rozpoznaniu objawów anafilaksji.
Skuteczna dawka zazwyczaj mieści się w zakresie od 0,005 do 0,01 mg/kg mc., ale w niektórych przypadkach może być konieczne zastosowanie większej dawki.
W razie braku poprawy stanu klinicznego lub jego pogorszenia, po 5 do 15 minutach po pierwszym wstrzyknięciu może być podane drugie wstrzyknięcie dodatkowym wstrzykiwaczem produktu leczniczego Jext. Zaleca się przepisywanie pacjentom dwóch wstrzykiwaczy Jext, które powinni mieć zawsze przy sobie.
Sposób podawania Podanie domięśniowe.
Do jednorazowego użycia.
Produkt leczniczy Jext jest przeznaczony do podania domięśniowego w przednio-boczną część uda. Jest on zaprojektowany tak, aby mógł być wstrzyknięty przez ubranie lub bezpośrednio przez skórę.
Zaleca się rozmasowanie miejsca wstrzyknięcia leku, aby przyspieszyć wchłanianie produktu leczniczego.
Dokładna instrukcja użycia, patrz punkt 6.6.
Należy poinformować pacjenta i (lub) opiekuna, że po każdym użyciu produktu leczniczego Jext:
Nie są znane bezwzględne przeciwwskazania do stosowania produktu leczniczego Jext w nagłych reakcjach alergicznych.
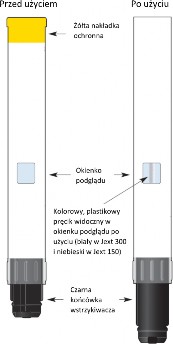
Nie wolno zdejmować żółtej nakładki ochronnej, dopóki wstrzykiwacz nie jest gotowy do użycia.
Produkt leczniczy Jext należy podawać w przednio-boczną część uda. Wstrzyknięcie podane jest natychmiast po silnym dociśnięciu czarnej osłonki igły automatycznego wstrzykiwacza do skóry lub innej powierzchni. Pacjentom należy zalecić, aby nie wstrzykiwali produktu leczniczego Jext do mięśnia pośladkowego wielkiego, ze względu na ryzyko przypadkowego wstrzyknięcia dożylnego.
Należy poinstruować pacjenta, żeby niezwłocznie po podaniu pierwszej dawki zadzwonił pod numer alarmowy 112, poprosił o przysłanie karetki i zgłosił reakcję anafilaktyczną wymagającą
natychmiastowej pomocy medycznej w celu umożliwienia dokładnej obserwacji, i w razie konieczności, dalszego leczenia pacjenta.
Należy poinformować pacjenta i (lub) opiekuna o możliwości wystąpienia dwufazowej reakcji
anafilaktycznej, która charakteryzuje się początkowym ustąpieniem objawów a następnie ich nawrotem kilka godzin później.
U pacjentów z astmą może występować zwiększone ryzyko ciężkiej reakcji anafilaktycznej.
Produkt leczniczy Jext zawiera sodu pirosiarczyn, który rzadko u podatnych osób, szczególnie u osób
z astmą w wywiadzie, może powodować ciężkie reakcje nadwrażliwości, w tym objawy anafilaksji oraz skurcz oskrzeli. Pacjenci z tymi stanami powinni zostać dokładnie poinformowani w jakich
okolicznościach należy stosować produkt leczniczy Jext.
Należy zachować szczególną ostrożność u pacjentów z chorobami układu krążenia, w tym z dławicą
piersiową, kardiomiopatią przerostową z zawężeniem drogi odpływu, zaburzeniami rytmu serca, sercem płucnym, miażdżycą i nadciśnieniem tętniczym, ze względu na zwiększone ryzyko wystąpienia działań niepożądanych po podaniu adrenaliny.
Szczególną ostrożność należy również zachować u pacjentów z nadczynnością tarczycy, guzem
chromochłonnym nadnerczy, jaskrą wąskiego kąta przesączania, ciężkimi zaburzeniami czynności nerek, gruczolakiem gruczołu krokowego prowadzącym do zalegania moczu, hiperkalcemią, hipokaliemią
i cukrzycą.
Należy również zachować ostrożność u osób w podeszłym wieku i kobiet w ciąży.
Jeśli wstrzyknięcie wykonywane jest przez opiekuna, należy poinstruować pacjenta, aby nie poruszał się, a podczas wstrzyknięcia należy zapewnić unieruchomienie nogi pacjenta, aby zmniejszyć ryzyko zranienia. Produkt leczniczy przeznaczony jest wyłącznie do jednorazowego użytku i nie można go ponownie zastosować.
U pacjentów z grubą warstwą podskórnej tkanki tłuszczowej istnieje ryzyko podania adrenaliny do tkanki podskórnej, co może spowodować wolniejsze wchłanianie adrenaliny (patrz punkt 5.2) i nieoptymalne działanie. Może być konieczne wstrzyknięcie dodatkowej dawki produktu leczniczego Jext
(patrz punkt 4.2).
Niedokrwienie obwodowe po przypadkowym wstrzyknięciu produktu leczniczego w dłonie lub stopy może prowadzić do zmniejszonego dopływ krwi do sąsiednich obszarów z powodu zwężenia naczyń krwionośnych.
Wszystkich pacjentów, którym przepisuje się produkt leczniczy Jext, należy dokładnie poinstruować w
zakresie wskazań do stosowania oraz właściwego sposobu podawania (patrz punkt 6.6). Usilnie zaleca się przeszkolenie osób z najbliższego otoczenia pacjenta (np. rodziców, opiekunów, nauczycieli) w zakresie poprawnego stosowania produktu leczniczego Jext w przypadku konieczności udzielenia pomocy w nagłej sytuacji.
Często, czas pomiędzy zaopatrzeniem pacjenta w produkt leczniczy Jext, a wystąpieniem reakcji alergicznej, wymagającej zastosowania adrenaliny, jest długi. Należy zalecić pacjentom regularne sprawdzanie produktu leczniczego Jext i dopilnowanie, aby został on wymieniony przed upływem jego terminu ważności.
Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) na dawkę, to znaczy produkt leczniczy uznaje się za „wolny od sodu”.
Należy ostrzec pacjentów o czynnikach wywołujących alergię oraz o konieczności wykonywania badań, kiedy jest to możliwe, w celu określenia specyficznych alergenów.
Należy zachować ostrożność u pacjentów otrzymujących leki mogące uwrażliwiać serce na zaburzenia rytmu, w tym glikozydy naparstnicy i chinidynę. Działanie adrenaliny może być zwiększone przez trójpierścieniowe leki przeciwdepresyjne, inhibitory monoaminooksydazy (inhibitory MAO) i inhibitory katecholo-O-metylotransferazy (inhibitory COMT), hormony tarczycy, teofilinę, oksytocynę, leki parasympatykolityczne, niektóre leki przeciwhistaminowe (difenhydramina, chlorfeniramina), lewodopę i alkohol.
Adrenalina hamuje wydzielanie insuliny, zwiększając stężenie glukozy we krwi. U pacjentów z cukrzycą otrzymujących adrenalinę może być konieczne zwiększenie dawki insuliny lub doustnych leków przeciwcukrzycowych.
Działanie pobudzające receptory alfa- i beta-adrenergiczne adrenaliny może być hamowane przez jednoczesne leczenie lekami alfa- i beta-adrenolitycznymi, a także parasympatykomimetykami.
Ciąża
Doświadczenie kliniczne dotyczące leczenia anafilaksji podczas ciąży jest ograniczone. Adrenalinę należy stosować podczas ciąży tylko wówczas, jeżeli potencjalna korzyść z leczenia jest większa niż potencjalne ryzyko dla płodu.
Karmienie piersią
Adrenalina nie jest biodostępna po podaniu doustnym. Nie należy się spodziewać, aby jakakolwiek ilość adrenaliny, która przenika do mleka matki wpływała na niemowlę karmione piersią.
Płodność
Brak danych klinicznych dotyczących wpływu produktu leczniczego Jext na płodność.
Produkt leczniczego Jext nie ma wpływu lub ma niewielki wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn, jednakże, pacjentom nie zaleca się prowadzenia pojazdów lub obsługiwania maszyn po podaniu adrenaliny, ponieważ objawy wstrząsu anafilaktycznego mogą mieć wpływ na stan pacjenta.
Podsumowanie profilu bezpieczeństwa
Działania niepożądane związane z aktywacją receptorów alfa- i beta-adrenergicznych mogą obejmować działania niepożądane ze strony układu krążenia, jak również działania niepożądane z ośrodkowego układu nerwowego.
Tabelaryczna lista działań niepożądanych
Poniższa tabela przedstawia działania niepożądane, które odnotowano w trzech badaniach klinicznych
i po wprowadzeniu produktu leczniczego do obrotu. Częstość ich występowania nie może być określona na podstawie dostępnych danych.
Klassyfikacja układów i narządów | Działanie niepożądane |
Zaburzenia metabolizmu i odżywiania | Hiperglikemia, hipokaliemia, kwasica metaboliczna |
Zaburzenia układu nerwowego | Drżenie, zawroty głowy, ból głowy, parestezje, niedoczulica |
Zaburzenia serca | Kołatanie serca, tachykardia, dławica piersiowa, zaburzenia rytmu serca, kardiomiopatia indukowana stresem, omdlenie |
Zaburzenia naczyniowe | Niedokrwienie obwodowe*, zwiększenie ciśnienia tętniczego krwi** |
Zaburzenia żołądka i jelit | Nudności, wymioty, suchość błony śluzowej jamy ustnej |
Zaburzenia mięśniowo-szkieletowe i tkanki łącznej | Drżenie mięśni |
Zaburzenia ogólne i stany w miejscu podania | Reakcje w miejscu wstrzyknięcia*, astenia, nadmierne pocenie się, dyskomfort w klatce piersiowej |
* Przypadkowe wstrzyknięcie w palce stóp lub dłoni może prowadzić do niedokrwienia obwodowego, obejmującego ochłodzenie, bladość, parestezje lub niedoczulicę w miejscu wstrzyknięcia, a także do reakcji w miejscu wstrzyknięcia, takich jak siniaki, krwawienie, ból i obrzęk.
** Zgłaszano pojedyncze przypadki nadciśnienia tętniczego i przełomu nadciśnieniowego.
Wykazano, że adrenalina powoduje wiele działań na organizm, wynikających z aktywacji receptorów
adrenergicznych, w tym hiperglikemię, hipokaliemię i kwasicę metaboliczną. Nie zgłaszano takich działań po podaniu adrenaliny we wstrzykiwaczach automatycznych.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań
niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departamentu Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych
i Produktów Biobójczych Al. Jerozolimskie 181C, 02-222 Warszawa, tel.: + 48 22 49 21 301,
faks: + 48 22 49 21 309, strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Przedawkowanie lub przypadkowe donaczyniowe wstrzyknięcie adrenaliny może spowodować krwotok mózgowy lub komorowe zaburzenia rytmu serca, spowodowane gwałtownym zwiększeniem ciśnienia tętniczego krwi. Może również wystąpić niedokrwienie i martwica mięśnia sercowego oraz zaburzenia czynności nerek. Może również dojść do zgonu z powodu obrzęku płuc spowodowanego skurczem naczyń obwodowych i jednoczesnym pobudzeniem pracy serca.
Obrzęk płuc może być leczony lekami alfa-adrenolitycznymi, takimi jak fentolamina. W przypadku zaburzeń rytmu serca można stosować leki beta-adrenolityczne.
Grupa farmakoterapeutyczna: Leki pobudzające serce, z wyjątkiem glikozydów nasercowych; leki wpływające na receptory adrenergiczne i dopaminergiczne;
kod ATC: C01CA24.
Adrenalina jest aminą katecholową, która działa pobudzająco na współczulny układ nerwowy (zarówno na receptory alfa, jak i beta), co prowadzi do zwiększenia częstości pracy serca, rzutu serca oraz krążenia wieńcowego. Przez działanie na receptory beta w mięśniach gładkich oskrzeli, adrenalina powoduje rozkurcz mięśni gładkich oskrzeli, co zmniejsza świsty i duszność.
Adrenalina jest naturalnie występującą substancją, wytwarzaną przez rdzeń nadnerczy i wydzielaną w odpowiedzi na wysiłek lub stres. Jest szybko inaktywowana w organizmie, głównie przez enzymy COMT i MAO. W wątrobie występuje duża ilość tych enzymów i wątroba jest ważnym, ale nie
niezbędnym, narządem biorącym udział w procesie degradacji adrenaliny. Znaczna część dawki adrenaliny jest wydalana w postaci metabolitów z moczem.
Okres półtrwania adrenaliny w osoczu wynosi około 2,5 minuty. Jednakże, miejscowy skurcz naczyń może opóźniać wchłanianie tak, że działanie trwa dłużej niż wynikałoby to z okresu półtrwania. Zaleca się rozmasowanie miejsca wstrzyknięcia leku, aby przyspieszyć wchłanianie produktu leczniczego.
Podczas wstępnych farmakokinetycznych/farmakodynamicznych badań klinicznych średnie stężenie w osoczu w funkcji czasu zmieniało się w sposób dwufazowy, z pierwszą maksymalną wartością występującą po około 8-10 minutach, następnie zwiększało się ono powoli się do osiągnięcia drugiej maksymalnej wartości (plateau) po około 30-40 minutach od wstrzyknięcia produktu leczniczego Jext.
Niemniej jednak, zaobserwowano dużą zmienność osobniczą w kształcie krzywej zmiany stężeń w osoczu w funkcji czasu. Wyniki wskazują, że wchłanianie adrenaliny u osób z grubą warstwą podskórnej tkanki tłuszczowej (ang. STMD, skin to muscle depth >20 mm) jest wolniejsze niż u osób z cieńszą
warstwą podskórnej tkanki tłuszczowej.
Podczas, gdy w populacji ogólnej, ekspozycja w osoczu w ciągu pierwszych 16 minut po podaniu
produktu leczniczego Jext była porównywalna z ekspozycją po wstrzyknięciu domięśniowym, gdy dane były analizowane w kohorcie STMD, to w kohorcie STMD > 20 mm ekspozycja w osoczu do 30 minuty w przypadku produktu leczniczego Jext była generalnie mniejsza w porównaniu ze standardowym wstrzyknięciem domięśniowym. Punkty estymacji dla produktu leczniczego Jext oraz standardowego wstrzyknięcia domięśniowego wynosiły 0,39 (90% CI 0,20-0,75) dla AUC0-8 min, 0,56 (90% CI 0,31-0,99) dla AUC0-16 min oraz 0,66 (90% CI 0,39-1,12) dla AUC0-30 min, co spójnie wskazuje na mniejszą ekspozycję w ciągu pierwszych 30 minut po podaniu produktu leczniczego Jext, w porównaniu ze standardowym wstrzyknięciem domięśniowym w kohorcie STMD > 20 mm.
Adrenalina jest stosowana w leczeniu nagłych przypadków ciężkich reakcji alergicznych od wielu lat. Brak danych przedklinicznych mających istotne znaczenie dla lekarza zalecającego stosowanie produktu leczniczego.
Sodu chlorek
Sodu pirosiarczyn (E 223) Kwas solny (do ustalenia pH) Woda do wstrzykiwań
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, ponieważ nie wykonano badań dotyczących zgodności.
22 miesiące.
Przechowywać w temperaturze poniżej 25ºC. Nie zamrażać.
Produkt leczniczy Jext jest dostarczany w plastikowym futerale, w celu zabezpieczenia produktu leczniczego podczas przenoszenia lub przechowywania. Produkt leczniczy Jext należy wyjąć z futerału przed użyciem lub podczas jego kontroli. Po sprawdzeniu należy ponownie umieścić produkt leczniczy Jext w futerale.
Wstrzykiwacz półautomatyczny napełniony, jednodawkowy, składający się z półautomatycznego wstrzykiwacza i wkładu, w tekturowym pudełku. Wkład jest wykonany ze szkła (typu 1), zamkniętego tłokiem z szarej bezlateksowej gumy i uszczelnieniem z bezlateksowej gumy bromobutylowej,
z aluminiowym wieczkiem. Półautomatyczny wstrzykiwacz i futerał wykonane są z tworzywa sztucznego.
Długość odsłoniętej igły:
Jext 150 mikrogramów: 13 mm
Jext 300 mikrogramów: 15 mm
Wielkość opakowania: Opakowanie jednostkowe zawierające 1 wstrzykiwacz półautomatyczny
napełniony, jednodawkowy. Opakowanie zbiorcze zawierające 2 wstrzykiwacze półautomatyczne napełnione, jednodawkowy.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Produkt leczniczy Jext to wstrzykiwacz do jednorazowego użytku, łatwy w użyciu dla każdej osoby.
Wstrzykiwacz półautomatyczny napełniony zostaje aktywowany jedynie poprzez dociśnięcie czarnej końcówki wstrzykiwacza do zewnętrznej części uda. Po dociśnięciu wstrzykiwacza do uda, zwolniony zostaje tłok, który wbije ukrytą igłę przez membranę znajdującą się na czarnej końcówce wstrzykiwacza w mięsień uda, wstrzykując dawkę adrenaliny. Można to zrobić przez ubranie.
Produkt leczniczy Jext 150 mikrogramów zawiera 1,4 mL roztworu adrenaliny do wstrzykiwań o stężeniu 1 mg/mL i po aktywacji podaje pojedynczą dawkę (0,15 mL) 150 mikrogramów adrenaliny. Po aktywacji wstrzykiwacza automatycznego we wstrzykiwaczu pozostaje 1,25 mL. Wszelkie niewykorzystane resztki roztworu należy wyrzucić.
Produkt leczniczy Jext 300 mikrogramów zawiera 1,4 mL roztworu adrenaliny do wstrzykiwań o stężeniu 1 mg/mL i po aktywacji podaje pojedynczą dawkę (0,3 mL) 300 mikrogramów adrenaliny. Po aktywacji wstrzykiwacza automatycznego we wstrzykiwaczu pozostaje 1,1 mL. Wszelkie niewykorzystane resztki roztworu należy wyrzucić.
We wstrzykiwaczu produktu leczniczego Jext może znajdować się mały pęcherzyk. Nie ma to wpływu na skuteczność działania leku.
Dla lekarzy przepisujących lek, pacjentów oraz opiekunów dostępne są materiały edukacyjne, dotyczące prawidłowego stosowania, przechowywania i dbania o produkt leczniczy Jext, w tym demonstracyjny wstrzykiwacz Jext Trainer, niezawierający igły i adrenaliny, przeznaczony do szkolenia pacjenta i innych osób w zakresie prawidłowego używania produktu leczniczego Jext.
Uwaga: żółta nakładka ochronna zabezpiecza przed niezamierzoną aktywacją i nie należy jej zdejmować dopóki wstrzykiwacz nie jest gotowy do użycia. Nie dotykać czarnej końcówki rękami.
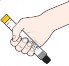
| 1. Należy chwycić wstrzykiwacz Jext ręką dominującą (ręką używaną do pisania) tak, aby kciuk znajdował się jak najbliżej żółtej nakładki ochronnej. |
| 2. Należy zdjąć żółtą nakładkę ochronną drugą ręką. |
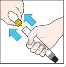
| 3. Czarną końcówkę wstrzykiwacza należy umieścić na zewnętrznej stronie uda pod kątem prostym (około 90°). |
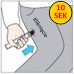
| 4. Należy mocno wcisnąć czarną końcówkę w zewnętrzną stronę uda, aż do usłyszenia „kliknięcia” potwierdzającego rozpoczęcie wstrzyknięcia, a następnie przytrzymać ją wciśniętą. Przytrzymać mocno wstrzykiwacz na udzie przez 10 sekund (odliczać wolno do 10), a następnie należy wyjąć go. Czarna końcówka wysunie się automatycznie i zakryje igłę. |
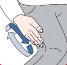
| 5. Miejsce wstrzyknięcia należy delikatnie rozmasować przez 10 sekund. Należy natychmiast zgłosić się po pomoc medyczną. Należy zadzwonić pod numer alarmowy 112, poprosić o przysłanie karetki i zgłosić reakcję anafilaktyczną. |
Pacjentowi i (lub) opiekunowi należy przekazać instrukcje dotyczące postępowania po każdym użyciu produktu leczniczego Jext, znajdujące się w punkcie 4.2.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
Należy okresowo sprawdzać produkt leczniczy Jext przez okienko podglądu, w celu upewnienia się, że roztwór jest przejrzysty i bezbarwny. Wstrzykiwacz półautomatyczny napełniony należy wymienić
i wyrzucić, jeśli roztwór zmienił kolor lub zawiera osad lub najpóźniej przed upływem terminu ważności. Termin ważności podany jest na etykiecie i nie należy używać produktu leczniczego Jext po upływie tej daty.
ALK-Abelló A/S Bøge Allé 6-8
2970 Hørsholm Dania
Jext, 150 mikrogramów Pozwolenie nr
Jext, ,300 mikrogramów Pozwolenie nr
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: