Spis treści:
- NAZWA PRODUKTU LECZNICZEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE
- NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
- DOZYMETRIA
- INSTRUKCJA PRZYGOTOWANIA PRODUKTÓW RADIOFARMACEUTYCZNYCH
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO
NAZWA PRODUKTU LECZNICZEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Wskazania do stosowania
Scyntygrafia szpiku kostnego. (Produkt nie jest odpowiedni do badania aktywności krwiotwórczej szpiku kostnego).
Obrazowanie ognisk zapalnych w okolicach innych niż jama brzuszna.
Podanie podskórne
Limfoscyntygrafia do oceny stanu układu limfatycznego i w diagnostyce różnicowej zastoju żylnego i limfatycznego.
Obrazowanie przedoperacyjne, a także śródoperacyjne wykrywanie węzłów wartowniczych w przebiegu czerniaka, raka piersi, raka gruczołu krokowego, raka prącia, raka płaskonabłonkowego jamy ustnej i raka sromu.
Dawkowanie i sposób podawania
Scyntygrafia szpiku kostnego: 185 - 500 MBq w pojedynczym wstrzyknięciu dożylnym.
Obrazowanie ognisk zapalnych: 370 - 500 MBq w pojedynczym wstrzyknięciu dożylnym.
Obrazowanie układu limfatycznego: Zalecana aktywność w jednym wstrzyknięciu lub w większej liczbie wstrzyknięć podskórnych (w tkankę śródmiąższową) wynosi 20 - 110 MBq na miejsce wstrzyknięcia.
Wykrywanie węzłów wartowniczych
Dawka radioaktywności zależy od czasu upływającego między wstrzyknięciem a badaniem obrazowym lub zabiegiem operacyjnym.
Czerniak: 10 - 120 MBq w kilku dawkach we wstrzyknięciu śródskórnym w okolicę nowotworu.
Rak piersi: 5 - 200 MBq w kilku dawkach po 5 - 20 MBq podawanych we wstrzyknięciu śródskórnym, podskórnym lub okołootoczkowym (guzy powierzchowne) i wstrzyknięciu do wnętrza guza lub w okolicę guza (guzy głębokie).
Rak gruczołu krokowego: Zaleca się wstrzykiwanie 65 - 400 MBq (mediana: 250 MBq) w jednej do czterech dawek do gruczołu krokowego pod kontrolą USG.
Rak prącia: 40 - 130 MBq w kilku dawkach po 20 MBq podawanych śródskórnie w okolicę guza.
Rak płaskonabłonkowy jamy ustnej: 15 - 120 MBq w jednym wstrzyknięciu lub w większej liczbie wstrzyknięć w okolicę nowotworu.
Rak sromu: 60 - 120 MBq we wstrzyknięciu w okolicę guza.
Zaburzenia czynności nerek lub wątroby
Konieczne jest staranne określenie podawanej aktywności, ponieważ u tych pacjentów może dojść do zwiększenia narażenia na promieniowanie.
Dzieci i młodzież
Zaleca się określenie aktywności podawanej dzieciom i młodzieży zgodnie z zalecanym zakresem aktywności podawanej dorosłym w przeliczeniu na masę ciała. Grupa Pediatryczna Europejskiego Towarzystwa Medycyny Nuklearnej (EANM, 1990) zaleca przeliczenie podawanej aktywności na podstawie masy ciała według następującej tabeli.
Masa ciała (kg)
Część dawki podawanej dorosłym
Masa ciała (kg)
Część dawki podawanej dorosłym
3
0,1
32
0,65
4
0,14
34
0,68
6
0,19
36
0,71
8
0,23
38
0,73
10
0,27
40
0,76
12
0,32
42
0,78
14
0,36
44
0,80
16
0,40
46
0,82
18
0,44
48
0,85
20
0,46
50
0,88
22
0,50
52 - 54
0,90
24
0,53
56 - 58
0,92
26
0,56
60 - 62
0,96
28
0,58
64 - 66
0,98
30
0,62
68
0,99
U bardzo małych dzieci (w wieku do 1 roku), aby uzyskać obrazy odpowiedniej jakości w
przypadku scyntygrafii szpiku kostnego, konieczna jest dawka minimalna 20 MBq.
W przypadku stosowania u dzieci produkt można rozcieńczyć przed podaniem (patrz punkt 12). Sposób podawania
Produkt przeznaczony do wielokrotnego dawkowania.
Podanie dożylne:
Scyntygrafia szpiku kostnego: pojedyncze wstrzyknięcie dożylne.
Obrazowanie ognisk zapalnych: pojedyncze wstrzyknięcie dożylne.
Podanie podskórne:
Limfoscyntygrafia: Produkt podaje się w jednym lub większej liczbie wstrzyknięć podskórnych w zależności od badanej lokalizacji anatomicznej oraz czasu upływającego między wstrzyknięciem a badaniem obrazowym. Wstrzykiwana objętość nie powinna przekraczać 0,2 - 0,3 ml. Nie wolno podawać objętości przekraczającej 0,5 ml na jedno miejsce wstrzyknięcia. Wstrzyknięcie podskórne należy wykonać sprawdzając (przez aspirację), czy nie doszło do przypadkowego nakłucia naczynia krwionośnego.
Wykrywanie węzłów wartowniczych:
Czerniak: aktywność podaje się w czterech dawkach wokół nowotworu lub blizny, wstrzykując objętości 0,1 - 0,2 ml.
Rak piersi: zaleca się pojedyncze wstrzyknięcie małej objętości (0,2 ml). W szczególnych okolicznościach lub stanach można wykonać więcej wstrzyknięć. Jeżeli wykonuje się wstrzyknięcia powierzchowne, duża objętość wstrzykiwanego roztworu może zakłócać prawidłowy przepływ chłonki, dlatego zaleca się podawanie objętości wynoszącej 0,05 - 0,5 ml. W przypadku wstrzyknięć w okolicę guza można stosować większe objętości (np. 0,5 - 1,0 ml).
Rak gruczołu krokowego: aktywność podaje się do płatów gruczołu krokowego przez odbyt pod kontrolą USG (0,3 ml w każdy płat gruczołu krokowego).
Rak prącia: dawkę należy podawać trzydzieści minut po miejscowym znieczuleniu aerozolem, we wstrzyknięciu śródskórnym do 3-4 miejsc gromadzenia się radioaktywności (miejsce depot) po 0,1 ml w okolicy guza o objętości 0,3 - 0,4 ml. W przypadku dużych guzów, które nie ograniczają się do żołędzi, produkt można podawać do napletka.
Rak płaskonabłonkowy jamy ustnej: aktywność podaje się w dwóch do czterech dawek w okolicę guza lub blizny w objętości całkowitej 0,1 - 1,0 ml.
Rak sromu: aktywność podaje się w czterech dawkach w okolicę guza w objętości całkowitej 0,2 ml.
Środki ostrożności, które należy podjąć przed użyciem lub podaniem produktu leczniczego Produkt leczniczy należy zrekonstytuować przed podaniem pacjentowi. Instrukcje sporządzania produktu leczniczego bezpośrednio przed podaniem, patrz punkt 12.
Przygotowanie pacjenta, patrz punkt 4.4.
Produkt nie jest przeznaczony do podawania regularnego ani ciągłego. Rejestracja obrazów
Podanie dożylne
Scyntygrafia szpiku kostnego: Obrazy można rejestrować 45 - 60 minut po podaniu.
Obrazowanie ognisk zapalnych: Obrazowanie dynamiczne przeprowadza się natychmiast. Obrazowanie statyczne obejmuje fazę wczesną 15 minut po wstrzyknięciu i fazę wypłukiwania 30 - 60 minut po wstrzyknięciu produktu leczniczego.
Podanie podskórne
Obrazowanie układu limfatycznego: W przypadku obrazowania kończyn dolnych, obrazy dynamiczne rejestruje się bezpośrednio po wstrzyknięciu, a obrazy statyczne po upływie 30 - 60 minut po wstrzyknięciu produktu leczniczego.
W przypadku obrazowania przymostkowych węzłów chłonnych konieczne mogą być wielokrotne wstrzyknięcia i dodatkowe obrazy.
Wykrywanie węzłów wartowniczych:
Czerniak: Obrazy limfoscyntygraficzne rejestruje się po wstrzyknięciu, a następnie w regularnych odstępach czasu do uwidocznienia węzła wartowniczego.
Rak piersi: Obrazy scyntygraficzne piersi i okolicy pachowej można rejestrować w fazie wczesnej (15 - 30 minut) i późnej (3 - 18 godzin) po wstrzyknięciu.
Rak gruczołu krokowego: znacznik wstrzykuje się w dniu poprzedzającym zabieg operacyjny. Pacjentowi podaje się wcześniej profilaktycznie antybiotykoterapię szerokospektralną (jak w przypadku każdej biopsji gruczołu krokowego). Obrazy scyntygraficzne rejestruje się bezpośrednio po oddaniu przez pacjenta moczu.
Rak prącia: obrazowanie dynamiczne można przeprowadzić bezpośrednio po wstrzyknięciu, z obrazowaniem statycznym po 30 minutach, 90 minutach i
2 godzinach od wstrzyknięcia przy użyciu dwugłowicowej kamery gamma.
Rak płaskonabłonkowy jamy ustnej: rejestracja dynamiczna przez 20 do 30 minut rozpoczynająca się bezpośrednio po wstrzyknięciu. Zaleca się rejestrację jednoczesną dwóch lub trzech obrazów statycznych z jednego lub obu boków w projekcjach przedniej i bocznej. Obrazy statyczne można rejestrować ponownie po 2 godzinach, 4 - 6 godzinach lub bezpośrednio przed zabiegiem operacyjnym. Obrazowanie SPECT może ułatwić identyfikację węzłów wartowniczych, w szczególności w pobliżu miejsca wstrzyknięcia. Można rozważyć wielokrotne wstrzyknięcia i obrazowanie; zaleca się jednak przeprowadzenie dyssekcji szyi w celu uniknięcia fałszywie ujemnych wyników dotyczących węzła wartowniczego.
Rak sromu: obrazy rejestruje się począwszy od momentu wstrzyknięcia, a następnie co 30 min aż do uwidocznienia węzłów wartowniczych. Wstrzyknięcie i obrazowanie można przeprowadzić w dniu poprzedzającym zabieg operacyjny lub w dniu zabiegu. Zaleca się rejestrację obrazów planarnych przez 3 - 5 minut w projekcjach przedniej i bocznej, a następnie obrazowanie SPECT/TK.
Przeciwwskazania
Specjalne ostrzeżenia i środki ostrożności dotyczące stosowania
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Wpływ na płodność, ciążę i laktację
Wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn
Działania niepożądane
Przedawkowanie
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Przedkliniczne dane o bezpieczeństwie
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i zawartość opakowania
Specjalne środki ostrożności dotyczące usuwania
PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE
NUMER POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU
DOZYMETRIA
INSTRUKCJA PRZYGOTOWANIA PRODUKTÓW RADIOFARMACEUTYCZNYCH
NanoSPECT, 0,5 mg, zestaw do sporządzania preparatu radiofarmaceutycznego
Każda fiolka zawiera 0,5 mg nanokoloidalnej albuminy ludzkiej.
Przynajmniej 95 % koloidalnych cząstek albuminy ludzkiej ma średnicę 80 nm. NanoSPECT sporządza się z albuminy surowicy ludzkiej otrzymywanej z krwi ludzkiej od dawców, badanej zgodnie z przepisami WE.
W skład zestawu nie wchodzi radionuklid. Substancja pomocnicza o znanym działaniu
Roztwór do wstrzykiwań zawiera po rozpuszczeniu 0,24 mg/ml sodu.
Pełny wykaz substancji pomocniczych, patrz punkt 6.1.
Zestaw do sporządzania radiofarmaceutyku
Proszek (do sporządzania roztworu do wstrzykiwań).
Produkt leczniczy przeznaczony wyłącznie do diagnostyki
Produkt leczniczy wskazany do stosowania u dorosłych oraz dzieci i młodzieży.
Po wyznakowaniu promieniotwórczym roztworem technecjanu (99mTc) sodu otrzymana zawiesina nanokoloidalnej albuminy wyznakowanej technetem (99mTc) jest stosowana w następujących wskazaniach:
Podanie dożylne
Ten produkt leczniczy powinien być podawany wyłącznie przez przeszkolony fachowy personel medyczny dysponujący doświadczeniem technicznym w zakresie przeprowadzania i opisu mapowania węzłów wartowniczych.
Dawkowanie
Dorośli i pacjenci w podeszłym wieku
Zalecana aktywność jest następująca:
Nadwrażliwość na substancję czynną (substancje czynne), na którąkolwiek substancję pomocniczą wymienioną w punkcie 6.1 lub którykolwiek składnik wyznakowanego radiofarmaceutyku.
Podawanie cząstek nanokoloidalnych albuminy wyznakowanej technetem (99mTc) jest w szczególności przeciwwskazane u pacjentów, u których w przeszłości występowała nadwrażliwość na produkty zawierające ludzką albuminę.
Nie zaleca się wykonywania scyntygrafii węzłów chłonnych w przypadku całkowitej niedrożności limfatycznej ze względu na ryzyko martwicy popromiennej w miejscu wstrzyknięcia.
Limfoscyntygrafia i identyfikacja węzłów wartowniczych w obrębie miednicy są bezwzględnie przeciwwskazane w czasie ciąży, ponieważ istnieje możliwość gromadzenia się produktu leczniczego w węzłach limfatycznych miednicy.
Ryzyko nadwrażliwości lub reakcji anafilaktycznych
Należy zawsze uwzględnić ryzyko nadwrażliwości, w szczególności poważnych, zagrażających życiu i śmiertelnych reakcji anafilaktycznych/rzekomoanafilaktycznych. W przypadku wystąpienia nadwrażliwości lub reakcji anafilaktycznych należy natychmiast przerwać podawanie produktu leczniczego i w razie konieczności rozpocząć leczenie dożylne. Koniecznie należy zapewnić łatwy dostęp do produktów leczniczych i sprzętu reanimacyjnego (np. rurki dotchawiczej i respiratora), niezbędnych do podjęcia natychmiastowych działań w nagłych przypadkach.
Indywidualna ocena stosunku korzyści do ryzyka
Każde narażenie pacjenta na promieniowanie jonizujące musi być uzasadnione spodziewaną korzyścią. Podawana aktywność powinna być zawsze możliwie jak najmniejsza, ale pozwalać na uzyskanie koniecznych danych diagnostycznych.
Zaburzenia czynności nerek lub wątroby
Konieczne jest staranne określenie stosunku korzyści do ryzyka u tych pacjentów, ponieważ może u nich dojść do zwiększonej ekspozycji na promieniowanie (patrz punkt 4.2).
Dzieci i młodzież
Informacje dotyczące stosowania u dzieci i młodzieży podano w punkcie 4.2. Należy starannie określić stosunek korzyści do ryzyka, ponieważ dawka skuteczna na jednostkę MBq jest większa niż u pacjentów dorosłych (patrz punkt 11).
Przygotowanie pacjenta
Pacjent powinien być dobrze nawodniony przed rozpoczęciem badania oraz poinformowany o konieczności jak najczęstszego oddawania moczu w ciągu pierwszych godzin po badaniu, aby zmniejszyć ekspozycję na promieniowanie.
Po wykonaniu procedury
W ciągu pierwszych 24 godzin od wstrzyknięcia należy unikać kontaktu z niemowlętami i kobietami w ciąży.
Specjalne ostrzeżenia
Zdecydowanie zaleca się, aby przy każdorazowym podaniu pacjentowi produktu NanoSPECT
odnotowywać nazwę i numer serii produktu, aby móc powiązać pacjenta z daną serią produktu.
Standardowe środki mające na celu zapobiec przenoszeniu czynników zakaźnych w wyniku stosowania produktów leczniczych sporządzonych z krwi ludzkiej lub osocza obejmują dokładną selekcję dawców, badanie każdego dawcy krwi i puli osocza pod kątem swoistych wskaźników
zakażenia i stosowanie na etapach wytwarzania skutecznych procesów dezaktywacji/eliminacji wirusów. Mimo to jednak, jeżeli stosuje się produkty lecznicze sporządzone z ludzkiej krwi lub osocza, nie jest możliwe całkowite wyeliminowanie ryzyka przenoszenia czynników zakaźnych.
Dotyczy to także nowych, nieznanych wirusów i innych patogenów.
Nie ma doniesień dotyczących przenoszenia wirusów razem z albuminami wytwarzanymi zgodnie z wytycznymi opisanymi w Farmakopei Europejskiej i udokumentowanymi procesami.
Ze względu na ryzyko napromienienia miejsc wstrzyknięcia nie zaleca się wykonywania limfoscyntygrafii u pacjentów z całkowitą niedrożnością limfatyczną.
Wstrzyknięcie podskórne należy wykonywać nie dopuszczając do ucisku luźnej tkanki łącznej.
Produkt leczniczy zawiera poniżej 1 mmol sodu (23 mg) w fiolce, to znaczy lek uznaje się za
„wolny od sodu”.
Środki ostrożności w odniesieniu do zagrożenia dla środowiska opisano w punkcie 6.6.
U dorosłych ani u dzieci nie przeprowadzono badań interakcji.
Środki kontrastowe zawierające jod, stosowane podczas limfoangiografii, mogą zaburzać obraz scyntygrafii układu limfatycznego z użyciem nanokoloidalnej albuminy wyznakowanej technetem (99mTc).
Kobiety w wieku rozrodczym
Jeśli konieczne jest podanie radiofarmaceutyku kobiecie w wieku rozrodczym, należy ustalić, czy kobieta nie jest w ciąży. Każda kobieta, u której opóźnia się miesiączka, powinna być (do czasu wykluczenia takiej ewentualności) uważana za ciężarną. W razie wątpliwości odnośnie możliwej ciąży (jeśli kobiecie opóźnia się miesiączka, jeśli miesiączka jest bardzo nieregularna, itp.) należy zaproponować pacjentce zastosowanie metod alternatywnych, o ile są one dostępne, niewymagających użycia promieniowania jonizującego.
Ciąża
Procedury z użyciem radionuklidów prowadzone u kobiet ciężarnych powodują napromieniowanie płodu. Dlatego u kobiet w ciąży powinny być prowadzone tylko niezbędne badania, jeżeli prawdopodobne korzyści z badania znacznie przewyższają ryzyko dla matki i płodu.
Limfoscyntygrafia w obrębie miednicy jest bezwzględnie przeciwwskazana w czasie ciąży, ponieważ istnieje możliwość gromadzenia w węzłach limfatycznych miednicy (patrz punkt 4.3).
Karmienie piersią
Przed podaniem radiofarmaceutyku matce karmiącej piersią należy zastanowić się, czy można opóźnić podanie radionuklidu do czasu zakończenia karmienia piersią oraz czy wybrano najbardziej odpowiedni radiofarmaceutyk mając na uwadze przenikanie podanej aktywności do mleka ludzkiego.
Jeżeli uzna się, że podanie jest konieczne, należy przerwać karmienie piersią na 24 godziny i odciągnięte mleko usunąć.
W ciągu pierwszych 24 godzin od wstrzyknięcia należy unikać bliskiego kontaktu pacjenta z
niemowlętami.
Płodność
Nie przeprowadzono badań wpływu na płodność.
Produkt leczniczy NanoSPECT nie ma wpływu lub wywiera bardzo niewielki wpływ na zdolność prowadzenia pojazdów i obsługiwania maszyn.
W poniższej tabeli zamieszczono klasyfikację częstości występowania podawanej w tym punkcie: bardzo często (≥ 1/10)
często (≥ 1/100 do < 1/10)
niezbyt często (≥ 1/1000 do < 1/100) rzadko (≥ 1/10 000 do < 1/1000) bardzo rzadko (< 1/10 000)
nieznana (częstość nie może być określona na podstawie dostępnych danych)
Zaburzenia układu immunologicznego
Nieznana: reakcja alergiczna (nadwrażliwości) na białka i reakcje nadwrażliwości (w tym, bardzo rzadko, anafilaksja zagrażająca życiu).
Bardzo rzadko: reakcje miejscowe, wysypka, świąd, zawroty głowy, niedociśnienie tętnicze.
Inne zaburzenia
Narażenie chorego na promieniowanie jonizujące jest powiązane z indukcją procesu nowotworzenia i ryzykiem wystąpienia wad wrodzonych. Dawka skuteczna, kiedy podaje się maksymalną zalecaną aktywność promieniowania wynoszącą 500 MBq, wynosi 2,3 mSv, dlatego występowanie działań niepożądanych jest mało prawdopodobne.
Zgłaszanie podejrzewanych działań niepożądanych
Po dopuszczeniu produktu leczniczego do obrotu istotne jest zgłaszanie podejrzewanych działań niepożądanych. Umożliwia to nieprzerwane monitorowanie stosunku korzyści do ryzyka stosowania produktu leczniczego. Osoby należące do fachowego personelu medycznego powinny zgłaszać wszelkie podejrzewane działania niepożądane za pośrednictwem Departament Monitorowania Niepożądanych Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych:
Al. Jerozolimskie 181C
PL-02 222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl.
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu. Środki ostrożności w odniesieniu do czynników zakaźnych opisano w punkcie 4.4.
W przypadku przedawkowania radioaktywności podanej w postaci nanokoloidalnej albuminy wyznakowanej technetem (99mTc) nie ma zalecanego praktycznego sposobu pozwalającego zmniejszyć ekspozycję tkanek, ponieważ znacznik jest powoli usuwany z organizmu z moczem i kałem.
Grupa farmakoterapeutyczna: Nanokoloid wyznakowany technetem (99mTc) (kod ATC: V09DB01)
Działanie farmakodynamiczne
W stężeniach stosowanych podczas badań diagnostycznych nanokoloidalna albumina znakowana technetem (99mTc) nie wywiera działania farmakodynamicznego.
Dystrybucja
Po wstrzyknięciu dożylnym nanokoloid znakowany 99mTc jest szybko usuwany z osocza, a ponad 95% jest usuwane w ciągu 15 minut przez komórki siateczkowo-śródbłonkowe wątroby, śledziony i szpiku kostnego. Około 15-20% kumuluje się w szpiku kostnym, a pozostała część przechodzi do wątroby (70%) i śledziony (10%), przy czym stężenie w tych narządach jest stałe przez 0,5 do 2 godzin. Po podaniu podskórnym ok. 30-40% cząstek koloidalnych (o wielkości cząstki poniżej 100 nm) albuminy znakowanej 99mTc jest filtrowanych przez kapilary limfatyczne, których główną funkcją jest odprowadzanie białek z płynu śródmiąższowego i kierowanie ich ponownie do krwi. Następnie cząstki są transportowane przez naczynia limfatyczne do regionalnych węzłów chłonnych i głównych naczyń chłonnych, skąd ostatecznie są wchłaniane do komórek układu siateczkowego głównych węzłów chłonnych. Część podanej dawki podlega fagocytozie przez histiocyty w miejscu wstrzyknięcia. Inna część podanej dawki przedostaje się do krwi i jest kumulowana głównie w układzie siateczkowo-śródbłonkowym wątroby, śledziony i szpiku kostnego, a niewielkie ilości eliminowane są przez nerki.
Eliminacja
Niewielka część radioaktywności 99mTc przechodzi do nerek i jest eliminowana z moczem. Rozkład proteolityczny koloidu rozpoczyna się bezpośrednio po wchłonięciu przez układ siateczkowo- śródbłonkowy, a produkty rozkładu są usuwane przez nerki.
Okres półtrwania
Nanokoloid jest szybko usuwany z osocza po podaniu dożylnym, a efektywny okres półtrwania wynosi 2 minuty w wyniku dystrybucji w tkankach. Nanokoloid rozkłada się powoli, a biologiczny okres półtrwania wynosi ok. 32 godzin.
Zaburzenia czynności nerek i wątroby
Produktu NanoSPECT nie badano u pacjentów z ciężkimi zaburzeniami czynności nerek lub wątroby.
Dzieci i młodzież
Nie przeprowadzono specjalnych badań u dzieci i młodzieży. Nie ma powodu, aby zakładać, że farmakokinetyka u dzieci jest inna niż u osób dorosłych.
W badaniach toksykologicznych po podaniu dawki 800 mg myszom i 950 mg szczurom w pojedynczym wstrzyknięciu dożylnym, nie obserwowano zgonów ani zmian patomorfologicznych w badaniu sekcyjnym. Po wstrzyknięciu podskórnym dawki 1 g nanokoloidalnych cząstek albuminy/kg mc. w 0,9 % soli fizjologicznej nie obserwowano reakcji miejscowych u myszy ani u szczurów.
Dawki te odpowiadają zawartości 50 fiolek na kg mc., czyli są 3500 razy większe od maksymalnej dawki stosowanej u człowieka.
Ten produkt leczniczy nie jest przeznaczony do podawania regularnego ani ciągłego.
Badań mutagenności ani długotrwałych badań działania rakotwórczego nie przeprowadzono. Nie ma badań działania toksycznego na rozrodczość.
Cyny(II) chlorek dwuwodny Glukoza
Disodu fosforan dwuwodny Sodu fitynian
Kwas solny
Sodu wodorotlenek
Nie mieszać tego produktu leczniczego z innymi produktami leczniczymi, oprócz wymienionych w punkcie 12.
Zestaw przed rozpuszczeniem: 24 miesiące od daty produkcji.
Produkt rozpuszczony należy użyć po wyznakowaniu w ciągu 6 godzin.
Produkt leczniczy nie wymaga specjalnych warunków przechowywania po wyznakowaniu.
Warunki przechowywania po wyznakowaniu produktu leczniczego podano w punkcie 6.3.
Radiofarmaceutyki należy przechowywać zgodnie z przepisami krajowymi dotyczącymi materiałów radioaktywnych.
Fiolka wielodawkowa ze szkła typu I o pojemności 10 ml zamknięta korkiem z gumy bromobutylowej, zabezpieczonym metalowym wieczkiem typu flip-off, w tekturowym pudełku.
Wielkości opakowań: każdy zestaw zawiera 5 fiolek.
Ogólne ostrzeżenia
Radiofarmaceutyki mogą być otrzymywane, stosowane i podawane wyłącznie przez osoby mające odpowiednie uprawnienia, w wyznaczonych placówkach klinicznych. Ich otrzymywanie, magazynowanie, stosowanie, przenoszenie i utylizacja podlegają odpowiednim przepisom i (lub) pozwoleniom wydanym przez kompetentne władze. Radiofarmaceutyki należy przygotować w sposób odpowiedni do wymagań dotyczących zarówno zasad bezpieczeństwa radiologicznego, jak i jakości farmaceutycznej. Należy zapewnić odpowiednie warunki aseptyczne.
Zawartość fiolki jest przeznaczona wyłącznie do sporządzania roztworu nanokoloidalnej albuminy wyznakowanej technetem (99mTc) i nie można jej bezpośrednio podawać pacjentom przed przygotowaniem.
Instrukcje sporządzania produktu leczniczego bezpośrednio przed podaniem podano w punkcie 12.
W przypadku naruszenia szczelności fiolki na dowolnym etapie przygotowywania produktu nie należy stosować produktu.
Produkt należy podawać w taki sposób, aby ograniczyć do minimum ryzyko zanieczyszczenia produktu leczniczego i napromieniowania personelu. Należy stosować odpowiednie osłony.
Zawartość zestawu przed przygotowaniem bezpośrednio przed użyciem nie jest radioaktywna. Jednak po dodaniu nadtechnecjanu sodu (99mTc) Ph. Eur. należy stosować odpowiednie osłony do przechowywania gotowego preparatu.
Stosowanie radiofarmaceutyków stwarza ryzyko dla osób postronnych związane z emisją promieniowania na zewnątrz lub ryzyko zanieczyszczenia poprzez kontakt z rozlanym moczem, wymiocinami i innymi płynami ustrojowymi. Dlatego konieczne jest stosowanie środków ochrony radiologicznej zgodnie z przepisami krajowymi.
Wszelkie niewykorzystane resztki produktu leczniczego lub jego odpady należy usunąć zgodnie z lokalnymi przepisami.
DO OBROTU
ROTOP Pharmaka GmbH Bautzner Landstrasse 400
01328 Dresden Niemcy
Tel.: +49 (0) 351 – 26 310 100
Faks: +49 (0) 351 – 26 310 303
E-mail: service@rotop-pharmaka.de
numer pozwolenia:
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: {DD miesiąc RRRR}
CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
{DD miesiąc RRRR}
Technet (99mTc) jest wytwarzany w generatorze (99Mo/99mTc) i jego rozpad wiąże się z emisją promieniowania gamma o średniej energii 140 keV i okresie półtrwania wynoszącym 6,02 godziny, co prowadzi do powstania technetu (99Tc), który ze względu na okres połowicznego rozpadu wynoszący 2,13 x 105 roku jest uważany za względnie stabilny.
Ekspozycja na promieniowanie
Szacowaną dawkę radioaktywności w przypadku szeregu narządów określa się według MIRD dla organizmu ludzkiego oraz wartości MIRD S. Obliczono ją na podstawie danych biologicznych dotyczących wychwytu przez narządy i klirensu krwi.
Wstrzyknięcie dożylne
Poniżej podano dawki radioaktywności pochłoniętej przez pacjenta o masie ciała 70 kg, po wstrzyknięciu dożylnym koloidalnych cząstek albuminy ludzkiej wyznakowanej 99mTc.
Narząd | Dawka pochłonięta µGy/MBq |
Wątroba | 78 |
Ściana pęcherza moczowego | 25 |
Śledziona | 18 |
Szpik kostny (czerwony) | 14 |
Jajniki | 3,2 |
Jądra | 1,1 |
Całe ciało | 5,1 |
Dawka skuteczna wynikająca z podania aktywności 500 MBq osobie dorosłej o masie ciała 70 kg wynosi ok. 2,5 mSv.
Po podaniu aktywności 500 MBq przeciętna dawka pochłonięta przez narząd krytyczny (wątroba) wynosi 39 mGy, a przeciętna dawka pochłonięta przez narząd docelowy (czerwony szpik kostny) wynosi 7,0 mGy.
Wstrzyknięcie podskórne
Limfoscyntygrafia
Poniżej podano dawki radioaktywności pochłoniętej przez pacjenta o masie ciała 70 kg, po wstrzyknięciu podskórnym koloidalnych cząstek albuminy ludzkiej wyznakowanej 99mTc.
Narząd | Dawka pochłonięta µGy/MBq |
Miejsce wstrzyknięcia | 12000 |
Węzły chłonne | 590 |
Wątroba | 16 |
Ściana pęcherza moczowego | 9,7 |
Śledziona | 4,1 |
Szpik kostny (czerwony) | 5,7 |
Jajniki | 5,9 |
Jądra | 3,5 |
Całe ciało | 4,6 |
Dawka skuteczna wynikająca z podania podskórnego maksymalnej zalecanej aktywności 110 MBq
osobie dorosłej o masie ciała 70 kg wynosi ok. 0,44 mSv.
Po podaniu aktywności 110 MBq przeciętna dawka pochłonięta przez narząd docelowy (węzły chłonne) wynosi 65 mGy, a przeciętna dawka pochłonięta przez narząd krytyczny (miejsce wstrzyknięcia) wynosi 1320 mGy.
Wykrywanie węzłów wartowniczych
Zakłada się, że w przypadku podawania podskórnego przy wykrywaniu węzłów wartowniczych można pominąć dawkę w miejscu wstrzyknięcia, która zmienia się znacznie w zależności od lokalizacji, wstrzykiwanej objętości, liczby podań i retencji, ze względu na małą wrażliwość skóry na promieniowanie i niewielki udział tego efektu w ogólnej dawce skutecznej.
Poniższe dane (ICRP 106) w przypadku wykrywania węzłów wartowniczych w przebiegu raka piersi podano przy założeniu, że nie dochodzi do wycieku, a dawka pochłonięta przez pozostałą część piersi jest równa dawce pochłoniętej przez płuca.
Dawka pochłonięta na jednostkę podanej aktywności (mGy/MBq) | ||||
Narządy | 6 godzin do usunięcia | 18 godzin do usunięcia | ||
Dorosły | 15 lat | Dorosły | 15 lat | |
Nadnercza | 0,00079 | 0,00093 | 0,0014 | 0,0016 |
Ściana pęcherza moczowego | 0,000021 | 0,000039 | 0,000036 | 0,000068 |
Powierzchnie kości | 0,0012 | 0,0015 | 0,0021 | 0,0026 |
Mózg | 0,000049 | 0,000058 | 0,000087 | 0,00010 |
Pierś | 0,0036 | 0,0039 | 0,0064 | 0,0069 |
Ściana pęcherzyka żółciowego | 0,00053 | 0,00072 | 0,00093 | 0,0013 |
Przewód pokarmowy | ||||
Żołądek | 0,00092 | 0,0013 | 0,0016 | 0,0023 |
Jelito cienkie | 0,00011 | 0,00015 | 0,0002 | 0,00027 |
Jelito grube | 0,000083 | 0,00019 | 0,00014 | 0,00033 |
Ściana górnego odcinka jelita grubego | 0,00012 | 0,00028 | 0,00020 | 0,00049 |
Ściana dolnego odcinka jelita grubego | 0,000038 | 0,00007 | 0,000066 | 0,00012 |
Serce | 0,0041 | 0,0052 | 0,0071 | 0,0091 |
Nerki | 0,00031 | 0,00042 | 0,00054 | 0,00073 |
Wątroba | 0,0011 | 0,0014 | 0,0019 | 0,0024 |
Płuco | 0,0036 | 0,0039 | 0,0064 | 0,0069 |
Mięśnie | 0,00066 | 0,00083 | 0,0012 | 0,0015 |
Przełyk | 0,0036 | 0,0050 | 0,0062 | 0,0087 |
Jajniki | 0,000041 | 0,000048 | 0,000071 | 0,000083 |
Trzustka | 0,00097 | 0,0011 | 0,0017 | 0,0020 |
Czerwony szpik kostny | 0,00086 | 0,00092 | 0,0015 | 0,0016 |
Skóra | 0,0012 | 0,0014 | 0,0021 | 0,0024 |
Śledziona | 0,00068 | 0,00083 | 0,0012 | 0,0015 |
Grasica | 0,0036 | 0,0050 | 0,0062 | 0,0087 |
Tarczyca | 0,00047 | 0,00062 | 0,00082 | 0,0011 |
Macica | 0,000041 | 0,000064 | 0,000071 | 0,00011 |
Pozostałe narządy | 0,00066 | 0,00083 | 0,0012 | 0,0015 |
Dawka skuteczna (mSv/MBq) | 0,0012 | 0,0014 | 0,0020 | 0,0024 |
Dawka skuteczna wynikająca z podania podskórnego maksymalnej zalecanej aktywności 200 MBq osobie dorosłej o masie ciała 70 kg w przypadku usunięcia miejsca wstrzyknięcia 18 godzin po wstrzyknięciu wynosi ok. 0,4 mSv.
Produkt należy pobierać z fiolki w warunkach aseptycznych. Fiolkę można otworzyć dopiero po dezynfekcji korka, a roztwór należy pobierać przez korek za pomocą strzykawki jednodawkowej wyposażonej w odpowiednią osłonę ochronną i jednorazową jałową igłę lub za pomocą dopuszczonego do stosowania automatycznego systemu do wstrzykiwania.
Tego produktu leczniczego nie należy stosować w przypadku naruszenia szczelności fiolki. Sposób przygotowania
NanoSPECT nie zawiera środków konserwujących.
Należy pracować w warunkach aseptycznych i stosować ochronę radiologiczną.
Tworzenie nanokoloidalnej albuminy wyznakowanej technetem (99mTc) zależy od odpowiedniej zawartości cyny w stanie zredukowanym. Utlenianie może mieć wpływ na jakość produktu leczniczego. Należy bezwzględnie nie dopuścić do przedostania się powietrza do fiolki.
Aktywność właściwa podawanej nanokoloidalnej albuminy wyznakowanej technetem (99mTc) powinna być możliwie najwyższa, ponieważ zaledwie ok. 1 - 2 % aktywności przedostaje się do węzłów chłonnych po podaniu podskórnym. W związku z tym zaleca się stosowanie świeżego eluatu z generatora, wyeluowanego bezpośrednio przed wyznakowaniem. Znakowanie należy przeprowadzić przy najwyższej możliwej aktywności bezpośrednio przed podaniem produktu leczniczego.
W przypadku stosowania u dzieci można rozcieńczyć produkt leczniczy w stosunku 1:50 0,9 %
solą fizjologiczną do wstrzykiwań.
Znakowanie radioizotopem i przygotowywanie zawiesiny do wstrzykiwań
Metoda A
Płytka do TLC: | Płytki aluminiowe nasączone żelem krzemionkowym (KG-60) |
Rozpuszczalnik: | Aceton R |
Próbka: | 2 - 5 µl |
Początek: | 1,5 cm od dolnego końca |
Odległość rozwijania: | 10 - 15 cm |
Czas rozwijania: | 15 - 20 minut, bezpośrednio po nałożeniu próbki |
Detektor: | stosuje się odpowiedni detektor |
Po rozwinięciu wyjąć płytki z komory chromatograficznej, wysuszyć na powietrzu i po obu stronach przykleić folię samoprzylepną.
Migrację aktywności mierzy się i pokazuje na chromatogramie. Oblicza się procentową aktywność pojedynczych pików.
Nanokoloidalna albumina wyznakowana technetem (99mTc) pozostaje w miejscu startu, a wolny (99mTc)nadtechnecjan pokazuje się na czole rozpuszczalnika.
Nie należy podawać gotowej do użycia zawiesiny do wstrzykiwań zawierającej ponad 5 % wolnego (99mTc)nadtechnecjanu. Gotową do użycia zawiesinę do wstrzykiwań należy zużyć w ciągu 6 godzin.
Metoda B (alternatywna)
Płytka do TLC: | Płytki z włókna szklanego nasączone kwasem krzemowym (ITLC-SA) |
Rozpuszczalnik: | Keton metylowo-etylowy (MEK) |
Początek: | 1,0 cm od dolnego końca |
Próbka: | 1 - 2 µl |
Odległość rozwijania: | 6 - 8 cm |
Czas rozwijania: | 5 - 10 minut, bezpośrednio po nałożeniu próbki |
Detektor: | stosuje się odpowiedni detektor |
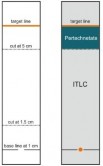
Po rozwinięciu wyjąć płytki z komory chromatograficznej, wysuszyć na powietrzu i po obu stronach przykleić folię samoprzylepną.
Migrację aktywności mierzy się i pokazuje na chromatogramie. Oblicza się procentową aktywność pojedynczych pików.
Nanokoloidalna albumina wyznakowana technetem (99mTc) pozostaje w miejscu startu, a wolny (99mTc)nadtechnecjan pokazuje się na czole rozpuszczalnika.
Nie należy podawać gotowej do użycia zawiesiny do wstrzykiwań zawierającej ponad 5 % wolnego (99mTc)nadtechnecjanu. Gotową do użycia zawiesinę do wstrzykiwań należy zużyć w ciągu 6 godzin.
Wykrywanie przy użyciu mierników radioaktywności bez specjalnej rozdzielczości:
Po rozwinięciu wyjąć płytkę z komory chromatograficznej, wysuszyć na powietrzu i przeciąć wzdłuż odpowiedniej linii. Oddzielnie zmierzyć radioaktywność obu części. Obliczyć stosunek aktywności w części górnej do aktywności całkowitej.
Wykrywanie przy użyciu skanera promieniowania:
Po rozwinięciu wyjąć płytkę z komory chromatograficznej, wysuszyć na powietrzu oraz zmierzyć dystrybucję aktywności i wyświetlić na chromatogramie. Obliczyć procentową aktywność pojedynczych pików.
Zanieczyszczenie [%] = Aktywność (część górna) × 100 %
Aktywność (obie części)











