Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES(-Y) KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
- INNE INFORMACJE
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
Hyogen emulsja do wstrzykiwań dla świń
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRES(-Y) KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
INNE INFORMACJE
ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
Podmiot odpowiedzialny:
Ceva Animal Health Polska Sp. z o.o. ul. Okrzei 1A, 03-715 Warszawa Polska
Wytwórca odpowiedzialny za zwolnienie serii: Ceva-Phylaxia Co. Ltd.
1107 Budapeszt Szállás u. 5
Węgry
Hyogen emulsja do wstrzykiwań dla świń
Każda dawka (2 ml) zawiera:
Substancja czynna:
Inaktywowana
Mycoplasma hyopneumoniae szczep 2940: min. 5,5 EU*
Adiuwanty:
Parafina ciekła lekka 187 µl
Escherichia coli J5 LPS maks. 38000 jednostek endotoksyny
Substancja pomocnicza:
Tiomersal 50 µg
*Średnie miano przeciwciał – podane w jednostkach ELISA M. hyopneumoniae – po 28 dniach od
immunizacji królików połową dawki szczepionki podawanej świni (1 ml).
Biaława, homogenna emulsja.
Do czynnego uodparniania tuczników powyżej 3 tygodnia życia w celu redukcji występowania i nasilenia zmian w płucach powodowanych przez zakażenia Mycoplasma hyopneumoniae.
Rozwinięcie się odporności: 3 tygodnie po szczepieniu. Czas trwania odporności: 26 tygodni po szczepieniu.
Brak
W dniu szczepienia bardzo często dochodzi do przemijającego wzrostu temperatury ciała średnio o 1,3°C. U poszczególnych osobników wzrost ten może osiągnąć nawet 2°C, jednakże we wszystkich przypadkach temperatura ciała wraca do normy następnego dnia.
Bardzo często w miejscu podania wystąpić może reakcja miejscowa w postaci obrzęku o średnicy do 5 cm, utrzymującego się do trzech dni. Reakcje te są przemijające i nie wymagają dalszego leczenia.
Niezbyt często mogą występować po szczepieniu natychmiastowe, łagodne reakcje podobne do nadwrażliwości, powodujące przemijające objawy kliniczne takie jak wymioty.
Po wprowadzeniu produktu do obrotu bardzo rzadko zgłaszano poważne reakcje typu anafilaktycznego (wstrząs, zaleganie), które mogą być śmiertelne. Takie reakcje wymagają szybkiego zastosowania leczenia objawowego.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
Można również zgłosić działania niepożądane poprzez krajowy system raportowania
(www.urpl.gov.pl).
Świnie (tuczniki)
Podanie domięśniowe. Świnie należy szczepić z boku szyi. Podać jedną dawkę (2 ml) od 3 tygodnia
życia.
Przed podaniem dobrze wstrząsnąć.
Używać sterylnych igieł i strzykawek, przestrzegać zasad aseptyki. Podawanie produktu Hyogen po zmieszaniu z produktem Circovac : Prosięta od 3 tygodnia życia:
Hyogen | Circovac |
100 dawek (200 ml szczepionki) w butelce 250 ml | 100 dawek dla prosiąt (50 ml zawiesiny i emulsji po rekonstytucji) |
Urządzenia do szczepienia powinny być używane w warunkach aseptycznych i zgodnie z instrukcją urządzenia dostarczoną przez producenta.
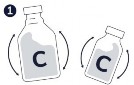
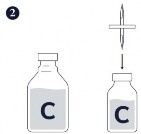
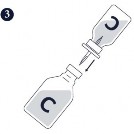
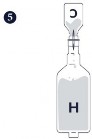
Krok 1.-3. Przygotować Circovac (C) energicznie wstrząsając fiolką z zawiesiną antygenu, a następnie wstrzykując jej zawartość do fiolki z emulsją zawierającą adiuwant.
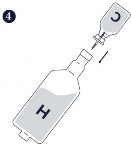
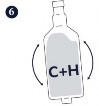
Krok 4.-6. Zmieszać 200 ml produktu Hyogen (H) i 50 ml produktu Circovac i delikatnie wstrząsać do uzyskania jednorodnej białej emulsji.
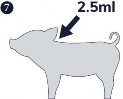
Krok 7. Podać jedną dawkę 2,5 ml mieszaniny poprzez wstrzyknięcie domięśniowe, w bok szyi. Całą mieszaninę szczepionek należy zużyć natychmiast po wymieszaniu.
|
|
|
|
|
|
|
Zero dni.
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Przechowywać i transportować w stanie schłodzonym (2 ˚C – 8 ˚C). Nie zamrażać.
Chronić przed światłem.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na
etykiecie po upływie EXP.
Okres ważności po pierwszym otwarciu pojemnika: 10 godzin.
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt:
Należy szczepić tylko zdrowe zwierzęta.
Dostępne dane są niewystarczające, by wykluczyć interakcje przeciwciał matczynych przeciwko Mycoplasma hyopneumoniae z pobieraną szczepionką. Interakcje z przeciwciałami matczynymi są znane i należy je wziąć pod uwagę. Zaleca się opóźnienie szczepienia prosiąt mających w wieku 3 tygodni pozostałości MDA przeciwko Mycoplasma hyopneumoniae.
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Nie dotyczy
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom:
Po przypadkowej samoiniekcji należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Dla użytkownika:
Ten produkt leczniczy weterynaryjny zawiera olej mineralny. Przypadkowe wstrzyknięcie może powodować znaczną bolesność oraz obrzęk, szczególnie w przypadku wstrzyknięcia do stawu lub
palca, a w rzadkich przypadkach może doprowadzić do utraty palca, jeśli nie zostanie udzielona natychmiastowa pomoc lekarska. W przypadku omyłkowego wstrzyknięcia niniejszego produktu
leczniczego weterynaryjnego, należy zwrócić się o pomoc lekarską nawet, jeśli wstrzyknięta została niewielka ilość produktu, należy zabrać ze sobą ulotkę informacyjną. Jeśli bolesność utrzymuje się dłużej niż 12 godzin po udzieleniu pomocy lekarskiej, należy ponownie udać się do lekarza.
Dla lekarza:
Ten produkt leczniczy weterynaryjny zawiera olej mineralny. Nawet jeśli wstrzyknięta została bardzo niewielka ilość produktu, może to spowodować znaczną bolesność oraz obrzęk, a w konsekwencji martwicę niedokrwienną a nawet utratę palca. Konieczna jest fachowa i SZYBKA pomoc
chirurgiczna, mogąca obejmować wczesne nacięcie i irygację miejsca iniekcji, szczególnie, jeśli dotyczy to opuszki palca lub ścięgna.
Ciąża i laktacja:
Nie dotyczy
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Dostępne są dane dotyczące bezpieczeństwa i skuteczności wskazujące, że ta szczepionka może być mieszana z produktem Circovac i podawana prosiętom w jedno miejsce wstrzyknięcia. Należy
szczepić prosięta od 3 tygodnia życia.
Przed podaniem zmieszanych produktów należy zapoznać się z ulotką informacyjną Circovac.
Czas powstania odporności: 3 tygodnie po szczepieniu, w przypadku zmieszania z produktem Circovac
Czas trwania odporności: 23 tygodnie, w przypadku zmieszania z produktem Circovac
W przypadku zmieszania z produktem Circovac, bardzo często po podaniu mogą wystąpić niewielkie i przemijające reakcje miejscowe, głównie opuchnięcie (0,5 cm - 5 cm), łagodny ból i zaczerwienienie, a w niektórych przypadkach obrzęk. Reakcje te ustępują samoistnie w ciągu maksymalnie 4 dni.
Bardzo często w dniu szczepienia może wystąpić przemijający letarg, który ustępuje samoistnie w ciągu jednego dnia. Często wystąpić może wzrost temperatury rektalnej o 2,5°C, utrzymujący się zwykle krócej niż 24 godziny. Powyższe działania niepożądane obserwowano w badaniach klinicznych.
Brak informacji dotyczących bezpieczeństwa i skuteczności tej szczepionki stosowanej jednocześnie z innym produktem leczniczym weterynaryjnym, oprócz zmieszania z Circovac. Dlatego decyzja o zastosowaniu tej szczepionki przed lub po podaniu innego produktu leczniczego weterynaryjnego powinna być podejmowana indywidualnie.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki): Ponieważ szczepionka jest inaktywowana, badania dotyczące bezpieczeństwa produktu w przypadku przedawkowania nie są wymagane.
Główne niezgodności farmaceutyczne:
Nie mieszać z innymi produktami leczniczymi weterynaryjnymi, oprócz Circovac.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z
obowiązującymi przepisami.
Właściwości immunologiczne:
Inaktywowana szczepionka bakteryjna, zawierająca koncentrat z całych komórek Mycoplasma hyopneumoniae szczep 2940. W celu stymulacji odporności, antygen ten jest włączony w adiuwant, oparty na kombinacji parafiny ciekłej lekkiej i Escherichia coli J5 LPS bez komórek. Produkt stymuluje rozwój czynnej odporności u świń przeciw Mycoplasma hyopneumoniae.
W warunkach doświadczalnych wykazano, iż redukcja kolonizacji przez M. hyopneumoniae
utrzymywała się 44-50 dni po szczepieniu.
50, 100, 200 lub 250 ml w polietylenowej butelce, w tekturowym pudełku. Wielkości opakowań:
1 x 50 ml (1x25 dawek)
1 x 100 ml (1x50 dawek)
1 x 200 ml (1x100 dawek) w butelce 200 ml 1 x 200 ml (1x100 dawek) w butelce 250 ml 1 x 250 ml (1x125 dawek)
5 x 50 ml (5x25 dawek)
5 x 100 ml (5x50 dawek)
5 x 200 ml (5x100 dawek) w butelkach 200 ml 5 x 200 ml (5x100 dawek) w butelkach 250 ml 5 x 250 ml (5x125 dawek)
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z podmiotem odpowiedzialnym.