Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNYCH I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES(-Y) KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
- INNE INFORMACJE
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
Spizobactin 750 000 IU / 125 mg Tabletki do rozgryzania i żucia dla psów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNYCH I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane),
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt),
niezbyt często (więcej niż 1, ale mniej niż 10 na 1 000 leczonych zwierząt),
rzadko (więcej niż 1, ale mniej niż 10 na 10 000 leczonych zwierząt),
bardzo rzadko (mniej niż 1 na 10 000 leczonych zwierząt, włączając pojedyncze raporty).
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRES(-Y) KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
INNE INFORMACJE
Podmiot odpowiedzialny:
Nazwa: Le Vet Beheer B.V. Adres: Wilgenweg 7
3421 TV Oudewater Holandia
Wytwórca odpowiedzialny za zwolnienie serii: Nazwa: LelyPharma B.V.
Adres: Zuiveringweg 42
8243 PZ Lelystad Holandia
Spizobactin vet 750 000 IU/125 mg tabletki do rozgryzania i żucia dla psów
Każda tabletka zawiera:
Substancje czynne:
Spiramycyna 750 000 IU
Metronidazol 125 mg
Jasnobrązowa z brązowymi kropkami, okrągła i wypukła, aromatyzowana tabletka do rozgryzania i żucia z linią podziału w kształcie krzyża z jednej strony.
Tabletki można podzielić na 2 lub 4 równe części.
Do stosowania wspomagająco w mechanicznej lub chirurgicznej terapii periodontologicznej w leczeniu wielobakteryjnych zakażeń przyzębia i powiązanych chorób (około)ustnych, takich jak: zapalenie dziąseł, zapalenie jamy ustnej, zapalenie języka, zapalenie przyzębia, zapalenie migdałków, przetoka zębowa i inne rany przetokowe w jamie ustnej, zapalenie warg i zapalenie zatok u psów wywołanych przez mikroorganizmy wrażliwe na połączenie spiramycyny i metronidazolu, takie jak bakterie Gram-dodatnie i beztlenowce (patrz również punkt 12 Specjalne ostrzeżenia) .
Nie stosować w przypadkach zaburzeń czynności wątroby.
Nie stosować w przypadkach nadwrażliwości na substancje czynne lub na dowolną substancję pomocniczą.
Wymioty obserwowano rzadko u psów.
Nadwrażliwość może występować w rzadkich przypadkach. W przypadkach reakcji nadwrażliwości należy przerwać leczenie.
Zaburzenia spermatogenezy mogą wystąpić w bardzo rzadkich przypadkach. Hematurię można było zaobserwować w bardzo rzadkich przypadkach.
Częstość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Psy.
Podanie doustne.
75 000 IU spiramycyny + 12,5 mg metronidazolu na kg masy ciała, w cięższych przypadkach 100 000 IU spiramycyny + 16,7 mg metronidazolu na kg masy ciała, podawane codziennie przez 6-10 dni
w zależności od nasilenia choroby. W ciężkich przypadkach można rozpocząć od większej dawki i w trakcie leczenia powrócić do dawki mniejszej.
Dawkę dobową można podawać raz na dobę lub równo podzieloną podawać dwa razy na dobę. Leczenie należy zawsze kontynuować przez 1-2 dni po ustąpieniu objawów w celu zapobiegnięcia nawrotom.
W celu zapewnienia podawania prawidłowej dawki należy jak najdokładniej określić masę ciała, aby uniknąć podawania zbyt małych dawek. Poniższa tabela służy jako wskazówka odnośnie podawania produktu w przybliżeniu w standardowej dawce 75 000 IU spiramycyny + 12,5 mg metronidazolu na kg masy ciała na dobę.
Masa ciała | Spizobactin 750 000 IU / 125 mg dla psów | Spizobactin 1 500 000 IU/250 mg dla psów | Spizobactin 3 000 000 IU/500 mg dla psów |
2,5 kg |
| ||
5,0 kg |
|
| |
7,5 kg |
| ||
10 kg |
|
| |
12,5 kg |
| ||
15 kg |
|
| |
17,5 kg |
| ||
20 kg |
|
| |
25 kg |
| ||
30 kg |
| |
35 kg |
| |
40 kg |
| |
50 kg |
| |
60 kg |
| |
70 kg |
| |
80 kg |
|




= ¼ tabletki = ½ tabletki = ¾ tabletki = 1 tabletka
Tabletki należy podawać głęboko do jamy ustnej (przy podstawie języka) lub podawać z małą ilością pożywienia zawierającego tabletkę, aby zapewnić spożycie całej tabletki.
Tabletki można dzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania. Tabletkę umieścić na płaskiej powierzchni ze stroną z linią podziału skierowaną do góry i stroną wypukłą (zaokrągloną) skierowaną do powierzchni.
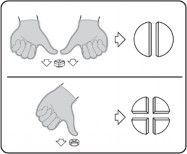
Połówki: nacisnąć kciukami po obu stronach tabletki.
Ćwiartki: nacisnąć kciukiem na środku tabletki.
Nie dotyczy.
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Okres ważności podzielonych tabletek po pierwszym otwarciu opakowania bezpośredniego: 3 dni. Nie przechowywać w temperaturze powyżej 30°C.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na pudełku i blistrze po upływie "Termin ważności (EXP)". Termin ważności oznacza ostatni dzień danego miesiąca.
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt:
W wielu przypadkach choroby endodontycznej i (lub) periodontologicznej leczenie podstawowe jest niefarmakologiczne i nie wymaga podawania leków przeciwbakteryjnych.
W czasie lub przed leczeniem przeciwbakteryjnym choroby przyzębia należy przeprowadzić leczenie endodontyczne i (lub) profesjonalne czyszczenie zębów, zwłaszcza w przypadku zaawansowanej
choroby. Właścicieli psów należy zachęcać do regularnego szczotkowania zębów psów w celu usunięcia płytki nazębnej, aby zapobiegać lub kontrolować choroby przyzębia.
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Połączenia spiramycyny i metronidazolu nie należy stosować jako leczenia empirycznego pierwszego rzutu. W miarę możliwości metronidazol i spiramycynę należy stosować wyłącznie w oparciu
o badanie lekowrażliwości patogenów.
Ograniczenie czasu trwania leczenia metronidazolem jest konieczne, ponieważ nie można wykluczyć uszkodzenia komórek rozrodczych. Również w badaniach długoterminowych z dużymi dawkami obserwowano zwiększenie występowania określonych nowotworów u gryzoni. Tabletki do żucia są aromatyzowane. Aby uniknąć przypadkowego połknięcia, przechowuj tabletki poza zasięgiem zwierząt.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom:
Metronidazol ma potwierdzone właściwości mutagenne i genotoksyczne u zwierząt laboratoryjnych i u ludzi. Jest też potwierdzonym czynnikiem rakotwórczym u zwierząt laboratoryjnych i ma potencjalne działanie rakotwórcze u ludzi. Brak jest jednak wystarczających dowodów na rakotwórczość metronidazolu u ludzi.
Metronidazol może być szkodliwy dla płodu. Kobiety w ciąży powinny zachować ostrożność podczas obchodzenia się z tym produktem leczniczym weterynaryjnym. Spiramycyna i metronidazol mogą
w rzadkich przypadkach wywoływać reakcje nadwrażliwości, np. kontaktowe zapalenie skóry. Należy unikać bezpośredniego kontaktu ze skórą lub błonami śluzowymi podającego ze względu na ryzyko uczulenia. Nie podawać produktu w przypadku znanej nadwrażliwości na substancje czynne lub na dowolną substancję pomocniczą. Podczas podawania produktu NALEŻY UŻYWAĆ NIEPRZEPUSZCZALNYCH RĘKAWIC w celu uniknięcia styczności skóry lub kontaktu ręka- usta z produktem.
Metronidazol może wywołać niepożądane (neurologiczne) skutki w przypadku spożycia przez dziecko. W celu uniknięcia przypadkowego połknięcia, zwłaszcza przez dziecko, niezużyte części tabletki należy włożyć z powrotem do otwartego blistra i do pudełka tekturowego.
Po przypadkowym połknięciu należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Umyć dokładnie ręce po podaniu tabletek. Ciąża i laktacja:
Nie wykazano działania teratogennego ani działania toksycznego spiramycyny na zarodek i płód. Badania na zwierzętach laboratoryjnych wykazały niespójne wyniki w odniesieniu do teratogennego i toksycznego dla zarodka działania metronidazolu. Z tego powodu nie zaleca się stosowania tego produktu w czasie ciąży. Metronidazol i spiramycyna przenikają do mleka i z tego powodu nie zaleca się stosowania w okresie laktacji.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Nie stosować jednocześnie z antybiotykami bakteriobójczymi.
Makrolidy, takie jak np. spiramycyna, działają antagonistycznie do penicylin i cefalosporyn. Produktu nie należy stosować jednocześnie z innymi antybiotykami z grupy makrolidów.
Metronidazol może mieć hamujący wpływ na rozkład innych leków w wątrobie, takich jak fenytoina, cyklosporyna i warfaryna.
Fenobarbital może zwiększać metabolizm wątrobowy metronidazolu, prowadząc do zmniejszonego stężenia metronidazolu w surowicy.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki):
W przypadku wystąpienia objawów neurologicznych należy przerwać leczenie, a pacjenta należy leczyć objawowo.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Blister aluminiowy - PCV/PE/PVDC. Wielkości opakowań:
Pudełko tekturowe zawierające 1, 2 lub 3 blistry po 10 tabletek.
Pudełko tekturowe zawierające 10 oddzielnych pudełek tekturowych, zawierających po 1 blistrze po 10 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego.
Dechra Veterinary Products sp. z o.o., ul. Modlińska 61, 03-199 Warszawa, Polska
Podzielna tabletka






































