Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES(-Y) KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI.
- INNE INFORMACJE
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
Prednicortone 5 mg, tabletki dla psów i kotów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt włączając pojedyncze raporty).
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej,
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA (-I) I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRES(-Y) KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
Osoby o znanej nadwrażliwości na prednizolon lub inne kortykosteroidy lub substancje pomocnicze
powinny unikać kontaktu z produktem leczniczym weterynaryjnym.
Aby uniknąć przypadkowego połknięcia, szczególnie przez dziecko, niewykorzystane części tabletki należy umieścić w otwartym blistrze i włożyć z powrotem do opakowania zewnętrznego.
Po przypadkowym połknięciu, szczególnie przez dziecko, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Kortykosteroidy mogą powodować wady rozwojowe płodu. W związku z tym zaleca się by kobiety w ciąży unikały kontaktu z produktem leczniczym weterynaryjnym.
Po podaniu tabletek, należy natychmiast dokładnie umyć ręce.
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI.
INNE INFORMACJE
Podmiot odpowiedzialny:
Dechra Regulatory B.V. Handelsweg 25
5531 AE Bladel Holandia
Wytwórca odpowiedzialny za zwolnienie serii: LelyPharma B.V.
Zuiveringweg 42
8243 PZ Lelystad
Holandia
Genera Inc. Svetonedeljska cesta 2 Kalinovica
10436 Rakov Potok
Chorwacja
Jedynie miejsce testowania i zwalniania partii produktu będzie wymienione na wydrukowanej ulotce.
Prednicortone 5 mg, tabletki dla psów i kotów prednizolon
Każda tabletka zawiera
Substancja czynna:
Prednizolon 5 mg
Jasnobrązowa z brązowymi plamkami, okrągła i wypukła tabletka smakowa z linią podziału w kształcie krzyża po jednej stronie.
Tabletki można dzielić na 2 lub 4 równe części.
Leczenie objawowe lub leczenie wspomagające stanów zapalnych i chorób o podłożu
immunologicznym u psów i kotów.
Nie stosować u zwierząt cierpiących na zakażenia wirusowe lub grzybicze, które nie są kontrolowane za pomocą odpowiedniego leczenia.
Nie stosować u zwierząt chorujących na cukrzycę lub hiperkortyzolemię.
Nie stosować u zwierząt z osteoporozą.
Nie stosować u zwierząt z zaburzeniami pracy serca lub nerek. Nie stosować u zwierząt z owrzodzeniem rogówki.
Nie stosować u zwierząt z owrzodzeniem układu pokarmowego. Nie stosować u zwierząt z oparzeniami.
Nie stosować jednocześnie z żywymi atenuowanymi szczepionkami. Nie stosować u zwierząt z jaskrą.
Nie stosować w czasie ciąży (patrz również punkt Specjalne ostrzeżenia: Stosowanie w ciąży i
laktacji).
Nie stosować w przypadkach nadwrażliwości na substancję czynną, na kortykosteroidy lub na
dowolną substancję pomocniczą.
Patrz również punkt: Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji.
Kortykosteroidy o działaniu przeciwzapalnym, takie jak prednizolon, wywołują wiele działań niepożądanych. Pojedyncze wysokie dawki są na ogół dobrze tolerowane, jednak długotrwałe stosowanie może wywołać ciężkie działania niepożądane. W związku z tym, w przypadku średnio- lub długotrwałego stosowania należy podawać jak najniższą dawkę konieczną do kontrolowania objawów. Znaczna supresja kortyzolu, zależna od dawki obserwowana w przebiegu terapii jest wynikiem hamowania osi podwzgórze-przysadka-nadnercza po podaniu skutecznej dawki. Po zaprzestaniu leczenia, mogą wystąpić objawy niewydolności kory nadnerczy obejmujące zanik kory nadnerczy, co może spowodować, trudności w radzeniu sobie ze stresującymi sytuacjami przez zwierzęta. W związku z tym należy rozważyć wprowadzenie środków służących zminimalizowaniu problemu niewydolności kory nadnerczy występującego w następstwie zakończenia podawani produktu leczniczego.
Odnotowany znaczny wzrost stężenia trójglicerydów może być objawem jatrogennego hiperadrenokortycyzmu (zespół Cushinga) powodującego istotne zmiany w metabolizmie tłuszczów, węglowodanów, białek i minerałów, co prowadzi na przykład do redystrybucji tkanki tłuszczowej w organizmie, przyrostu masy ciała, osłabienia i zaniku mięśni oraz osteoporozy. Supresja kortyzolu i zwiększenie stężenia trójglicerydów w osoczu są bardzo częstymi działaniami niepożądanymi w czasie terapii kortykoidami (więcej niż 1 na 10 zwierząt).
Podwyższona aktywność fosfatazy alkalicznej spowodowana glikokortykosteroidami może być powiązana z powiększeniem wątroby (hepatomegalia) z towarzyszącym wzrostem aktywności enzymów wątrobowych w surowicy.
Inne zmiany w parametrach biochemicznych i hematologicznych krwi prawdopodobnie związane ze stosowaniem prednizolonu wywierały istotny wpływ na dehydrogenazę mleczanową (obniżenie aktywności) i albuminy (podwyższenie stężenia) oraz na eozynofile, limfocyty (spadek liczby) i podzielone neutrofile (wzrost liczby).
Zaobserwowano również spadek aktywności aminotransferazy asparaginianowej.
Kortykosteroidy podawane ogólnie mogą powodować poliurię, polidypsję i polifagię, zwłaszcza w początkowym okresie leczenia. Długotrwałe stosowanie niektórych kortykosteroidów może powodować retencję sodu i wody w organizmie oraz hipokaliemię. Kortykosteroidy podawane ogólnie powodują odkładanie się wapnia w skórze (wapnica skóry).
Stosowanie kortykosteroidów może opóźniać gojenie się ran, a ich działanie immunosupresyjne może osłabiać odporność lub nasilać istniejące zakażenia. W przypadku istniejącego zakażenia wirusowego, kortykosteroidy mogą nasilać objawy choroby lub przyspieszać jej postępowanie.
U zwierząt leczonych kortykosteroidami zgłaszano wystąpienie owrzodzeń przewodu pokarmowego. Kortykosteroidy mogą powodować zaostrzenie owrzodzenia układu pokarmowego u zwierząt, którym podaje się niesteroidowe leki przeciwzapalne i u zwierząt z urazem rdzenia kręgowego.
Inne działania niepożądane, które mogą wystąpić obejmują: zahamowanie wzrostu kości na długość, zanik skóry, cukrzycę, euforię, zapalenie trzustki, spadek syntezy hormonów tarczycy, wzrost syntezy hormonów przytarczyc.
Patrz również punkt Specjalne ostrzeżenia: Stosowanie w ciąży i laktacji.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Psy i koty.
Podanie doustne.
Lekarz weterynarii dobiera dawkę i ustala okres leczenia indywidualnie dla każdego przypadku w zależności od nasilenia objawów. Konieczne jest stosowanie najniższej skutecznej dawki.
Dawka początkowa: 0,5 – 4 mg na kg masy ciała na dzień.
Leczenie długotrwałe: w momencie, gdy po okresie codziennego podawania dawki uzyskano pożądane działanie, dawkę należy zmniejszać do czasu uzyskania najniższej skutecznej dawki. Zmniejszanie dawki powinno się odbywać z zastosowaniem leczenia co drugi dzień i/lub zmniejszając dawkę o połowę co 5-7 dni do momentu uzyskania najniższej skutecznej dawki.
Leczenie u psów należy stosować rano, natomiast u kotów wieczorem ze względu na różnice w rytmie
dnia.
Tabletki można podzielić na 2 lub 4 równe części, co zapewnia dokładne dawkowanie. Tabletkę należy umieścić na płaskiej powierzchni stroną z liniami podziału skierowaną do góry i wypukłą (zaokrągloną) stroną skierowaną do powierzchni.
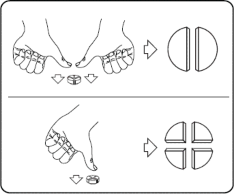
Połówki: nacisnąć kciukami obie strony tabletki. Ćwiartki: nacisnąć kciukiem środek tabletki.
Nie dotyczy
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Okres ważności podzielonych tabletek: 4 dni.
Niewykorzystaną część tabletki należy ponownie umieścić w otwartym blistrze i włożyć z powrotem do opakowania zewnętrznego. Brak specjalnych środków ostrożności dotyczących temperatury przechowywania produktu leczniczego.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na etykiecie i pudełku po: EXP.
Termin ważności oznacza ostatni dzień danego miesiąca.
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt:
Stosowanie kortykoidów ma na celu raczej niwelowanie objawów klinicznych, a nie wyleczenie. Leczenie należy stosować w skojarzeniu z leczeniem choroby podstawowej i/lub z kontrolą warunków otoczenia.
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
W przypadkach istniejącego zakażenia bakteryjnego, produkt należy stosować w skojarzeniu z
odpowiednim leczeniem przeciwbakteryjnym.
Ze względu na właściwości farmakologiczne prednizolonu, należy zachować szczególną ostrożność podczas stosowania produktu leczniczego weterynaryjnego u zwierząt z osłabionym układem odpornościowym.
Kortykoidy, takie jak prednizolon, nasilają katabolizm białek. W związku z tym produkt należy stosować ostrożnie u starszych i niedożywionych zwierząt.
Dawki wywołujące efekt farmakologiczny mogą powodować zanik kory nadnerczy prowadzący do niewydolności kory nadnerczy. Tego typu niewydolność może się ujawnić zwłaszcza po zakończeniu leczenia kortykosteroidem. Niewydolność kory nadnerczy można minimalizować wprowadzając leczenie co drugi dzień, jeśli jest to możliwe. Dawkę należy zmniejszać i wycofywać stopniowo, aby uniknąć wystąpienia niewydolności kory nadnerczy (patrz punkt: Dawkowanie i droga podawania). Kortykoidy, takie jak prednizolon, należy stosować ostrożnie u pacjentów z nadciśnieniem tętniczym, padaczką, wcześniejszą miopatią posterydową, u zwierząt z obniżoną odpornością oraz u młodych zwierząt, ponieważ kortykosteroidy mogą powodować opóźniony wzrost.
Tabletki są aromatyzowane. Aby uniknąć przypadkowego spożycia, tabletki należy przechowywać poza zasięgiem zwierząt.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom: Prednizolon lub inne kortykosteroidy mogą powodować nadwrażliwość (reakcje alergiczne).
Ciąża i laktacja:
Nie stosować u zwierząt w ciąży. Badania na zwierzętach laboratoryjnych wykazały, że podawanie na początku ciąży może powodować nieprawidłowości u płodu. Stosowanie na późniejszych etapach ciąży może powodować poronienie lub przedwczesny poród. Patrz również punkt dotyczący przeciwskazań.
Glikokortykoidy przenikają do mleka i mogą powodować zaburzenia wzrostu u osesków.
Do stosowania w czasie laktacji jedynie po dokonaniu przez lekarza weterynarii oceny bilansu
korzyści/ryzyka wynikającego ze stosowania produktu
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Fenytoina, barbiturany, efedryna i ryfampicyna mogą zwiększać klirens metaboliczny kortykosteroidów zmniejszając ich stężenie we krwi i osłabiając ich działanie fizjologiczne. Jednoczesne podawanie tego produktu leczniczego weterynaryjnego z niesteroidowymi lekami przeciwzapalnymi może zaostrzyć owrzodzenie przewodu pokarmowego. Ponieważ kortykosteroidy mogą osłabiać odpowiedź immunologiczną na szczepienie, prednizolonu nie należy stosować jednocześnie ze szczepionkami lub w ciągu dwóch tygodni po szczepieniu.
Podanie prednizolonu może wywołać hipokaliemię tym samym zwiększać ryzyko wystąpienia toksyczności po podaniu glikozydów nasercowych. Ryzyko hipokaliemii może wzrosnąć w przypadku jednoczesnego stosowania prednizolonu z lekami moczopędnymi obniżającymi poziom potasu.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki): Przedawkowanie nie powoduje żadnych działań niepożądanych innych niż te określone w punkcie dotyczącym działań niepożądanych. Odtrutka nie jest znana. W razie przedawkowania należy zastosować leczenie objawowe.
Pudełko tekturowe zawiera 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 25 lub 50 blistrów po 10 tabletek każdy. Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Podzielna tabletka
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego.
Dechra Veterinary Products Sp. z o.o., ul. Modlińska 61, 03-199 Warszawa, Polska











