Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNYCH I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES(-Y) KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
- INNE INFORMACJE
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
Traumeel LT ad us. vet., roztwór do wstrzykiwań dla koni, bydła, świń, owiec, kóz, psów, kotów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNYCH I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRES(-Y) KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
INNE INFORMACJE
Podmiot odpowiedzialny i wytwórca odpowiedzialny za zwolnienie serii: Biologische Heilmittel Heel GmbH
Dr.-Reckeweg-Str. 2-4, 76532 Baden-Baden, Niemcy
tel.: +49 7221 501 00, faks: +49 7221 501 210 e-mail:
Traumeel LT ad us. vet., roztwór do wstrzykiwań dla koni, bydła, świń, owiec, kóz, psów, kotów
1 ampułka 5 ml (5 g) zawiera:
Substancje czynne:
500 mg | Achillea millefolium | D5 |
300 mg | Aconitum napellus | D4 |
500 mg | Arnica montana | D4 |
500 mg | Atropa bella-donna | D4 |
250 mg | Bellis perennis | D4 |
500 mg | Calendula officinalis | D4 |
125 mg | Echinacea | D4 |
125 mg | Echinacea purpurea e planta tota | D4 |
50 mg | Hamamelis virginiana | D4 |
500 mg | Hepar sulfuris | D6 |
150 mg | Hypericum perforatum | D4 |
500 mg | Matricaria recutita | D5 |
250 mg | Mercurius solubilis Hahnemanni | D8 |
500 mg | Symphytum officinale | D8 |
Substancje pomocnicze:
Woda do wstrzykiwań, sodu chlorek.
1 ampułka (5 g) zawiera 23,1 mg etanolu i 7,1 mg laktozy.
Produkt leczniczy homeopatyczny weterynaryjny bez wskazań leczniczych. Stosować zgodnie z zaleceniem lekarza.
Nie stosować w przypadku nadwrażliwości na którykolwiek składnik produktu leczniczego.
Nieznane.
O wystąpieniu działań niepożądanych po podaniu tego produktu lub zaobserwowaniu jakichkolwiek niepokojących objawów niewymienionych w ulotce (w tym również objawów u człowieka na skutek kontaktu z lekiem), należy powiadomić właściwego lekarza weterynarii, podmiot odpowiedzialny lub Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych.
Formularz zgłoszeniowy należy pobrać ze strony internetowej http://www.urpl.gov.pl (Pion Produktów Leczniczych Weterynaryjnych).
Koń, bydło, świnia, owca, koza, pies, kot
W przypadku, jeśli lekarz nie zaleci inaczej należy przyjąć następujący schemat dawkowania: Konie, bydło (powyżej 500 kg): 10 ml raz dziennie
Konie, bydło (do 500 kg): 5 ml raz dziennie Świnie: 3-5 ml raz dziennie
Owce, kozy: 3-4 ml raz dziennie
Duże psy (ponad 25 kg): 3-4 ml raz dziennie Średnie psy (15-25 kg): 2 ml raz dziennie Małe psy, koty (do 15 kg): 1-2 ml raz dziennie.
Początkowo, w nasilonych objawach pojedyncza dawka może być powtórzona po 24 godzinach. Następnie należy kontynuować leczenie zwykle zalecaną dawką.
W przypadku długotrwałego leczenia chorób przewlekłych należy stosować dawkę dzienną w odstępach 4-dniowych.
Droga podania
Lek należy podawać podskórnie (s.c.).
Brak
Tkanki jadalne – zero dni. Mleko – zero godzin.
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Brak specjalnych środków ostrożności dotyczących przechowywania.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na pudełku, po upływie „Termin ważności (EXP):”. Termin ważności oznacza ostatni dzień danego miesiąca.
Ciąża i laktacja:
Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego w czasie ciąży i laktacji nie zostało określone. Stosowanie w tym okresie jest uzależnione od oceny korzyści do ryzyka przez lekarza weterynarii.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji: Nieznane.
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci. O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii. Pomogą one chronić środowisko.
Wydawany z przepisu lekarza - Rp. Wyłącznie dla zwierząt. Wielkości opakowań:
Ampułki ze szkła bezbarwnego typu I, o pojemności 5 ml, pakowane po 5 lub 50 sztuk w pudełka
tekturowe.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Instrukcja otwierania szklanej ampułki:
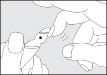
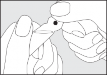
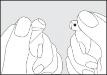
Nie jest konieczne nacinanie szkła w celu otworzenia ampułki. Zawartość ampułki sprowadzić do dolnej jej części poprzez stukanie lub wstrząsanie. Nacisnąć w miejscu, w którym zaznaczono kolorową kropkę i odłamać główkę ampułki.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z podmiotem odpowiedzialnym.











