Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNYCH I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
- INNE INFORMACJE
ULOTKA INFORMACYJNA
Alpramil 5 mg/50 mg tabletki dla psów o wadze co najmniej 0,5 kg Alpramil 12,5 mg/125 mg tabletki dla psów o wadze co najmniej 5 kg Alpramil 20 mg/200 mg tabletki dla psów o wadze co najmniej 8 kg
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNYCH I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
Tasiemce:
Dipylidium caninum Taenia spp.
Echinococcus spp. Mesocestoides spp.
Nicienie:
Ancylostoma caninum Toxocara canis Toxascaris leonina Trichuris vulpis
Crenosoma vulpis (zmniejszenie poziomu zarażenia)
Angiostrongylus vasorlus (zmniejszenie poziomu zarażenia przez niedojrzałe dorosłe (L5) i dorosłe postaci pasożytów; patrz szczegółowe schematy leczenia i zapobiegania chorobom w punkcie
„Dawkowanie dla każdego gatunku, droga(-i) i sposób podania”)
Thelazia callipaeda (patrz szczegółowy schemat leczenia w punkcie „Dawkowanie dla każdego gatunku, droga(-i) i sposób podania”)
Produkt można również stosować w zapobieganiu dirofilariozie (Dirofilaria immitis), jeśli wskazane jest jednoczesne leczenie przeciwko tasiemcom.
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(-a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt),
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt),
rzadko (więcej niż 1, ale mniej niż 10 na 10 000 leczonych zwierząt),
bardzo rzadko (mniej niż 1 na 10 000 leczonych zwierząt, włączając pojedyncze raporty).
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRES KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI
INNE INFORMACJE
Podmiot odpowiedzialny i wytwórca odpowiedzialny za zwolnienie serii: Alfasan Nederland B.V.
Kuipersweg 9
3449 JA Woerden Holandia
Wytwórca odpowiedzialny za zwolnienie serii: LelyPharma B.V.
Zuiveringsweg 42
8243 PZ Lelystad Holandia
Alpramil 5 mg/50 mg tabletki dla psów o wadze co najmniej 0,5 kg Alpramil 12,5 mg/125 mg tabletki dla psów o wadze co najmniej 5 kg Alpramil 20 mg/200 mg tabletki dla psów o wadze co najmniej 8 kg milbemycyny oksym i prazykwantel
Każda tabletka 5 mg/50 mg zawiera:
Substancje czynne:
Milbemycyny oksym 5,0 mg
Prazykwantel 50,0 mg
Jasnobrązowa z brązowymi plamkami, okrągła i wypukła tabletka 11 mm, z linią podziału w kształcie krzyża po jednej stronie. Tabletki mogą być dzielone na połówki i ćwiartki.
Każda tabletka 12,5 mg/125 mg zawiera:
Substancje czynne:
Milbemycyny oksym 12,5 mg
Prazykwantel 125,0 mg
Jasnobrązowa z brązowymi plamkami, okrągła i wypukła tabletka 15 mm.
Każda tabletka 20 mg/200 mg zawiera:
Substancje czynne:
Milbemycyny oksym 20,0 mg
Prazykwantel 200,0 mg
Jasnobrązowa z brązowymi plamkami, okrągła i wypukła tabletka 18 mm.
Leczenie zakażeń mieszanych wywołanych przez dorosłe postaci tasiemców i nicieni następujących gatunków, wrażliwych na prazykwantel i milbemycyny oksym:
Tabletka 5 mg/50 mg: Nie stosować u psów o wadze poniżej 0,5 kg. Tabletka 12,5 mg/125 mg: Nie stosować u psów o wadze poniżej 5 kg. Tabletka 20 mg/200 mg: Nie stosować u psów o wadze poniżej 8 kg.
Nie stosować w znanych przypadkach nadwrażliwości na substancje czynne lub na dowolną substancję pomocniczą.
Patrz także punkt „Specjalne ostrzeżenia (Specjalne środki ostrożności dotyczące stosowania u zwierząt)”.
W bardzo rzadkich przypadkach po podaniu psom kombinacji milbemycyny oksymu i prazykwantelu obserwowano reakcje nadwrażliwości, objawy ogólnoustrojowe (takie jak ospałość), objawy neurologiczne (drżenie mięśni i ataksja) i (lub) objawy żołądkowo-jelitowe (takie jak wymioty, biegunka, brak łaknienia i ślinotok).
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
Można również zgłosić działania niepożądane poprzez krajowy system raportowania (www.urpl.gov.pl).
Tabletka 5 mg/50 mg: psy o wadze co najmniej 0,5 kg Tabletka 12,5 mg/125 mg: psy o wadze co najmniej 5 kg Tabletka 20 mg/200 mg: psy o wadze co najmniej 8 kg
Podanie doustne.
Minimalna zalecana dawka: 0,5 mg milbemycyny oksymu i 5 mg prazykwantelu na kg m.c. podaje się doustnie w pojedynczej dawce.
Produkt należy podawać w trakcie lub po posiłku.
Należy zważyć zwierzęta w celu określenia prawidłowego dawkowania. W zależności od masy ciała psa i dostępności tabletek praktyczne dawkowanie jest następujące:
Tabletka 5 mg/50 mg:
Waga (kg) | Tabletka 5 mg/50 mg | |
0,5–2,5 |
| ¼ tabletki |
> 2,5–5 |
| ½ tabletki |
> 5–10 |
| 1 tabletka |
> 10–15 |
| 1½ tabletki |
Tabletka 12,5 | mg/125 mg: | |
Waga (kg) | Tabletka 12,5 mg/125 mg | |
> 5–25 |
| 1 tabletka |
> 25–50 |
| 2 tabletki |
Tabletka 20 mg/200 mg:
Waga (kg) | Tabletka 20 mg/200 mg | |
> 8–40 |
| 1 tabletka |
> 40–80 |
| 2 tabletki |
W przypadkach, gdy stosuje się profilaktykę dirofilariozy i jednocześnie wymagane jest leczenie przeciwko tasiemcom, produkt ten może zastąpić jednoskładnikowy produkt do zapobiegania dirofilariozie.
W leczeniu zarażenia Angiostrongylus vasorum milbemycyny oksym powinien być podany cztery razy w odstępach tygodniowych. W przypadkach gdy wskazane jest jednoczesne leczenie przeciwko tasiemcom, zaleca się jednokrotne zastosowanie produktu i kontynuowanie leczenia jednoskładnikowym produktem zawierającym sam milbemycyny oksym przez kolejne trzy tygodnie.
Na obszarach endemicznych podawanie produktu co cztery tygodnie zapobiega angiostrongylozie poprzez zmniejszenie liczby niedojrzałych postaci (L5) i dojrzałych pasożytów, w przypadku gdy wskazane jest jednoczesne leczenie przeciw tasiemcom.
W leczeniu Thelazia callipaeda milbemycyny oksym należy podać dwukrotnie, z zachowaniem siedmiodniowego odstępu. W przypadku, gdy wskazane jest równoczesne leczenie przeciw tasiemcom, produkt może zastąpić jednoskładnikowy produkt zawierający sam milbemycyny oksym.
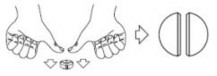
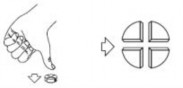
W celu zapewnienia dokładnego dawkowania tabletki 5 mg/50 mg można dzielić na połówki
i ćwiartki. Tabletkę umieścić na płaskiej powierzchni stroną z linią podziału skierowaną do góry i stroną wypukłą (zaokrągloną) skierowaną do powierzchni.
Połówki: nacisnąć kciukami po obu stronach tabletki:
Ćwiartki: nacisnąć kciukiem na środku tabletki:
Nie dotyczy.
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Brak szczególnych środków ostrożności dotyczących przechowywania produktu leczniczego weterynaryjnego.
Nie używać tego produktu leczniczego weterynaryjnego po upływie terminu ważności podanego na pudełku po upływie „EXP”. Termin ważności oznacza ostatni dzień danego miesiąca.
Tabletka 5 mg/50 mg: Okres ważności podzielonych tabletek po pierwszym otwarciu opakowania bezpośredniego: 7 dni.
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt:
W przypadku mieszanych zakażeń nicieniami i tasiemcami stosowanie produktu powinno być poprzedzone odpowiednią diagnostyką z uwzględnieniem historii i cech zwierzęcia (np. wiek, stan zdrowia), środowiska (np. psy w hodowli, psy myśliwskie), żywienia (np. dostęp do surowego mięsa), położenia geograficznego i podróży. Oceny podawania produktu u psów zagrożonych ponownym zarażeniem mieszanym lub w szczególnych sytuacjach zagrożenia (takich jak zagrożenia zoonotyczne) powinien dokonać właściwy lekarz weterynarii.
W celu opracowania skutecznego programu dotyczącego odrobaczania należy uwzględnić lokalne informacje epidemiologiczne oraz ryzyko narażenia psa; zaleca się zasięgnięcie profesjonalnej porady.
Zaleca się jednoczesne leczenie wszystkich zwierząt żyjących w tym samym gospodarstwie domowym.
Jeśli potwierdzono zakażenie tasiemcem D. caninum, należy omówić z lekarzem weterynarii jednoczesne zwalczanie żywicieli pośrednich, takich jak pchły i wszy, aby zapobiec ponownemu zakażeniu.
Oporność pasożytów na poszczególne klasy leków przeciwrobaczych może rozwinąć się w następstwie częstego, wielokrotnego stosowania leków przeciwrobaczych z tej klasy. Nieuzasadnione podawanie leków przeciwpasożytniczych lub stosowanie odbiegające od zaleceń może zwiększyć presję selekcji oporności i prowadzić do zmniejszenia skuteczności. W krajach trzecich (USA) odnotowano oporność Dipylidium caninum na prazykwantel oraz przypadki wielolekooporności Ancylostoma caninum na milbemycyny oksym.
Specjalne środki ostrożności dotyczące stosowania u zwierząt:
Badania milbemycyny oksymu wskazują, że margines bezpieczeństwa u psów z mutacją MDR1 (-/-) rasy Collie lub ras pokrewnych jest mniejszy niż u innych ras. U tych psów należy ściśle przestrzegać zalecanej dawki. Nie badano tolerancji produktu leczniczego weterynaryjnego u szczeniąt tych ras.
Objawy kliniczne u tych psów są podobne do obserwowanych u całej populacji psów (patrz Działania niepożądane).
Leczenie psów z dużą liczbą krążących mikrofilarii może czasami prowadzić do wystąpienia reakcji nadwrażliwości, takich jak bladość błon śluzowych, wymioty, drżenie, ciężki oddech lub ślinotok. Reakcje te są związane z uwalnianiem białek z martwych lub obumierających mikrofilarii i nie są bezpośrednim efektem toksycznym produktu. U psów dotkniętych mikrofilaremią użycie produktu nie jest wskazane.
W rejonach podwyższonego ryzyka dirofilariozy lub w przypadku gdy wiadomo, że pies podróżował do i z rejonów zagrożonych występowaniem dirofilariozy, przed podaniem produktu leczniczego zaleca się przeprowadzenie konsultacji weterynaryjnej w celu wykluczenia jednoczesnego zarażenia Dirofilaria immitis. W przypadku pozytywnej diagnozy, wskazane jest zwalczenie postaci dorosłych przed podaniem produktu leczniczego.
Nie przeprowadzono badań nad stosowaniem leku psów bardzo osłabionych lub z poważnie zaburzoną funkcją nerek lub wątroby. Produkt nie jest zalecany dla takich zwierząt lub może być stosowany tylko w zależności od oceny korzyści/ryzyka dokonanej przez odpowiedzialnego lekarza weterynarii.
U psów w wieku poniżej 4 tygodni zakażenie tasiemcem jest rzadkie. Z tego względu leczenie zwierząt w wieku poniżej 4 tygodni produktem złożonym może nie być konieczne.
Tabletki są aromatyzowane, dlatego powinny być przechowywane w bezpiecznym miejscu niedostępnym dla zwierząt.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom: Produkt leczniczy weterynaryjny może być szkodliwy po połknięciu, szczególnie dla dzieci.
Należy unikać przypadkowego połknięcia.
Wszelkie niewykorzystane części tabletek 5 mg/50 mg należy wyrzucić lub umieścić z powrotem
w otwartym blistrze, włożyć do opakowania zewnętrznego i zużyć przy następnym podaniu. Produkt należy przechowywać w bezpiecznym miejscu.
W razie przypadkowego połknięcia należy niezwłocznie zwrócić się o pomoc lekarską oraz pokazać lekarzowi ulotkę informacyjną lub opakowanie.
Po podaniu umyć ręce.
Inne środki ostrożności:
Echinokokoza stanowi zagrożenie dla ludzi. Ponieważ echinokokoza jest chorobą podlegającą obowiązkowi zgłoszenia do Światowej Organizacji Zdrowia Zwierząt (OIE), należy uzyskać od właściwych organów szczegółowe wytyczne dotyczące leczenia i dalszego postępowania oraz ochrony osób.
Ciąża i laktacja:
Produkt może być stosowany u psów hodowlanych, w tym u suk w okresie ciąży i laktacji.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Równoczesne stosowanie produktu z selamektyną jest dobrze tolerowane. Nie zaobserwowano żadnych interakcji, gdy podczas leczenia produktem w zalecanej dawce podawano zalecaną dawkę laktonu makrocyklicznego selamektyny. Ze względu na brak dalszych badań należy zachować ostrożność w przypadku jednoczesnego stosowania produktu z jakimkolwiek innym makrocyklicznym laktonem. Takich badań nie przeprowadzano również na zwierzętach przeznaczonych do rozrodu .
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki): Nie zaobserwowano innych objawów niż wymienione po podaniu zalecanej dawki (patrz „Działania niepożądane”).
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
Produkt nie powinien przedostawać się do cieków wodnych, ponieważ może być niebezpieczny dla ryb i innych organizmów wodnych.
O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii lub farmaceutę. Pomogą one chronić środowisko.
Blistry OPA/aluminium/PVC-aluminium zawierające 1, 2 lub 4 tabletki. Pudełko z 1 blistrem zawierającym 1 tabletkę.
Pudełko z 1 blistrem zawierającym 2 tabletki. Pudełko z 1 blistrem zawierającym 4 tabletki. Pudełko z 10 blistrami każdy zawierający 1 tabletkę. Pudełko z 10 blistrami każdy zawierający 2 tabletki. Pudełko z 10 blistrami każdy zawierający 4 tabletki. Pudełko z 25 blistrami każdy zawierający 1 tabletkę. Pudełko z 25 blistrami każdy zawierający 2 tabletki. Pudełko z 25 blistrami każdy zawierający 4 tabletki.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.