Spis treści:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
- WSKAZANIA LECZNICZE
- PRZECIWWSKAZANIA
- DZIAŁANIA NIEPOŻĄDANE
- DOCELOWE GATUNKI ZWIERZĄT
- DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA I SPOSÓB PODANIA
- ZALECENIA DLA PRAWIDŁOWEGO PODANIA
- OKRES KARENCJI
- SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
- SPECJALNE OSTRZEŻENIA
- SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
- DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI.
- INNE INFORMACJE
ULOTKA INFORMACYJNA
Epityl 60 mg tabletki dla psów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO ORAZ WYTWÓRCY
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
ZAWARTOŚĆ SUBSTANCJI CZYNNEJ (-CH) I INNYCH SUBSTANCJI
WSKAZANIA LECZNICZE
PRZECIWWSKAZANIA
DZIAŁANIA NIEPOŻĄDANE
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
DOCELOWE GATUNKI ZWIERZĄT
DAWKOWANIE DLA KAŻDEGO GATUNKU, DROGA I SPOSÓB PODANIA
ZALECENIA DLA PRAWIDŁOWEGO PODANIA
OKRES KARENCJI
SPECJALNE ŚRODKI OSTROŻNOŚCI PODCZAS PRZECHOWYWANIA
SPECJALNE OSTRZEŻENIA
Barbiturany mogą powodować nadwrażliwość. Osoby o znanej nadwrażliwości na barbiturany powinny unikać kontaktu z tym produktem leczniczym weterynaryjnym.
Przypadkowe połknięcie może wywołać zatrucie i może być śmiertelne, szczególnie dla dzieci. Należy dołożyć wszelkich starań, aby uniemożliwić dzieciom kontakt z produktem.
Fenobarbital ma działanie teratogenne i może być toksyczny dla płodu i dzieci karmionych piersią; może wpływać na rozwijający się mózg i prowadzić do zaburzeń funkcji poznawczych. Fenobarbital przenika do mleka matki. Kobiety w ciąży, kobiety w wieku rozrodczym oraz karmiące piersią powinny unikać przypadkowego połknięcia i długotrwałego kontaktu produktu ze skórą.
Aby zapobiec przypadkowemu połknięciu, należy przechowywać produkt w oryginalnym opakowaniu.
W celu ograniczenia kontaktu ze skórą, zaleca się noszenie jednorazowych rękawiczek podczas
podawania produktu.
Po przypadkowym połknięciu należy niezwłocznie zwrócić się o pomoc lekarską oraz pokazać lekarzowi ulotkę informacyjną lub etykietę. Jeśli to możliwe, należy poinformować lekarza kiedy i ile produktu zostało połknięte, ponieważ informacje te mogą pomóc w zapewnieniu odpowiedniego leczenia.
Za każdym razem, gdy niewykorzystana część tabletki jest przechowywana do następnego podania, należy ją umieścić z powrotem w otwartym blistrze i ponownie włożyć do pudełka tekturowego.
Po podaniu należy dokładnie umyć ręce.
SPECJALNE ŚRODKI OSTROŻNOŚCI DOTYCZĄCE USUWANIA NIEZUŻYTEGO PRODUKTU LECZNICZEGO WETERYNARYJNEGO LUB POCHODZĄCYCH Z NIEGO ODPADÓW, JEŚLI MA TO ZASTOSOWANIE
DATA ZATWIERDZENIA LUB OSTATNIEJ ZMIANY TEKSTU ULOTKI.
INNE INFORMACJE
ODPOWIEDZIALNEGO ZA ZWOLNIENIE SERII, JEŚLI JEST INNY
Podmiot odpowiedzialny i wytwórca odpowiedzialny za zwolnienie serii: Chanelle Pharmaceuticals Manufacturing Ltd.
Loughrea, Co. Galway, Irlandia
Epityl 60 mg tabletki dla psów Fenobarbital
Każda tabletka zawiera:
Substancja czynna:
Fenobarbital 60 mg
Biała, okrągła tabletka z liniami podziału w kształcie krzyża po jednej stronie
Tabletki mogą być dzielone na 2 lub 4 równe części.
Zapobieganie napadom spowodowanym uogólnioną padaczką u psów.
Nie stosować u zwierząt z poważną niewydolnością wątroby.
Nie stosować u zwierząt z poważną niewydolnością nerek lub układu krążenia. Nie stosować u psów o masie ciała poniżej 6 kg.
Nie stosować w przypadkach nadwrażliwości na substancję czynną, na inne barbiturany lub na dowolną substancję pomocniczą.
Wszystkie działania niepożądane wymienione poniżej były zgłaszane bardzo rzadko.
Na początku terapii może wystąpić ataksja i sedacja, ale objawy te są zwykle przemijające i ustępują
u większości, ale nie u wszystkich pacjentów, stale otrzymujących lek.
Niektóre zwierzęta mogą wykazywać paradoksalną nadpobudliwość, szczególnie przy rozpoczęciu terapii po raz pierwszy. Nadpobudliwość ta nie jest związana z przedawkowaniem, dlatego nie ma potrzeby zmniejszania dawki.
Poliuria, polidypsja i polifagia mogą wystąpić, gdy stężenia terapeutyczne osiągają wartości średnie
lub wysokie ; skutki te można zmniejszyć poprzez ograniczenie spożycia zarówno pożywienia, jak
i wody. Gdy stężenia w surowicy osiągają górne granice zakresu terapeutycznego, często poważnymi
problemami są sedacja i ataksja.
Wysokie stężenia w osoczu mogą być związane z hepatotoksycznością. Fenobarbital może mieć szkodliwy wpływ na komórki macierzyste szpiku kostnego. Konsekwencjami są immunotoksyczna pancytopenia i/lub neutropenia.
Działania te ustępują po przerwaniu leczenia. Leczenie psów fenobarbitalem może obniżać u nich poziom TT4 lub FT4 w surowicy, jednak nie musi to wskazywać na niedoczynność tarczycy. Leczenie zastępcze hormonami tarczycy należy rozpoczynać tylko wtedy, gdy występują kliniczne objawy choroby.
W przypadku poważnych działań niepożądanych zaleca się zmniejszenie podawanej dawki. Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
W razie zaobserwowania działań niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, poinformuj o tym lekarza weterynarii.
Można również zgłosić działania niepożądane poprzez krajowy system raportowania
(www.urpl.gov.pl).
Psy
Podanie doustne.
Wymagane dawkowanie może się w pewnym stopniu różnić u poszczególnych zwierząt oraz
w zależności od charakteru i stopnia zaburzenia.
Aby zapewnić skuteczność leczenia, tabletki należy podawać codziennie o tej samej porze, w sposób
zsynchronizowany z porą karmienia.
Lek należy podawać doustnie, zaczynając od dawki 2–5 mg na kg masy ciała dziennie. Dawkę należy podzielić i podawać dwa razy dziennie.
Stężenia stacjonarne w surowicy są osiągane po upływie 1–2 tygodni po rozpoczęciu leczenia. Pełne działanie leku nie pojawia się przed upływem dwóch tygodni i w tym czasie nie należy zwiększać dawki.
W przypadku niewystarczającej skuteczności zapobiegania napadom padaczkowym, dawkę można zwiększać, jednorazowo o 20%, jednocześnie monitorując stężenie fenobarbitalu w surowicy. Stężenie fenobarbitalu w surowicy można sprawdzić po osiągnięciu stanu stacjonarnego, a jeśli jest niższe niż 15 µg/ml, dawkę można odpowiednio dostosować. W przypadku nawrotu napadów padaczkowych można zwiększyć dawkę do maksymalnego stężenia w surowicy wynoszącego 45 µg/ml. Wysokie stężenia w osoczu mogą być związane z hepatotoksycznością. Jednocześnie można pobrać krew do oznaczenia stężenia fenobarbitalu w osoczu. Najlepiej pobierać ją tuż przed wyznaczonym czasem podania kolejnej dawki fenobarbitalu, kiedy jego stężenie powinno być najniższe. W celu określenia poziomu fenobarbitalu w osoczu krew najlepiej pobierać tuż przed wyznaczonym czasem podania kolejnej dawki fenobarbitalu, kiedy jego stężenie powinno być najniższe.
Stężenia w osoczu należy interpretować w połączeniu z obserwowaną odpowiedzią na terapię i pełną oceną kliniczną, obejmującą również monitorowanie pod kątem występowania działań toksycznych u danego zwierzęcia.
Dane kliniczne wskazują, że u niektórych zwierząt można zaobserwować znaczne różnice w stężeniach fenobarbitalu w osoczu. Ta zmienność może skutkować wystąpieniem u zwierzęcia minimalnego stężenia fenobarbitalu poniżej typowego minimalnego poziomu terapeutycznego i maksymalnego stężenia w osoczu zbliżonego do maksymalnego poziomu. Jeżeli kontrola napadów padaczkowych u takich zwierząt jest niewystarczająca, należy zachować ostrożność podczas zwiększania dawki, ponieważ może dojść do osiągnięcia lub przekroczenia poziomów toksyczności. U takich zwierząt może być konieczne oznaczenie maksymalnego i minimalnego stężenia fenobarbitalu w osoczu (maksymalne stężenie w osoczu osiągane jest w ciągu około 3 godzin po podaniu).
Jeśli nie udaje się w satysfakcjonujący sposób zapobiegać występowaniu napadów, a maksymalne stężenie fenobarbitalu w osoczu wynosi około 40 µg/ml, należy rozważyć zweryfikowanie rozpoznania i (lub) dodać do protokołu leczenia drugi produkt przeciwpadaczkowy (jak np. bromki).
W celu zapewnienia właściwego dawkowania tabletki mogą być podzielone na 2 lub 4 równe części. Aby przełamać tabletkę z nacięciem krzyżowym na ćwiartki, należy położyć tabletkę stroną z liniami podziału do góry na równej powierzchni i nacisnąć kciukiem środek.
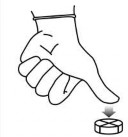
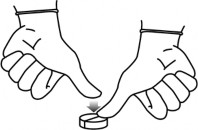
Aby przełamać tabletkę na połowy, należy położyć tabletkę stroną z liniami podziału do góry na
równej powierzchni, przytrzymać jedną połowę i nacisnąć drugą połowę.
Stężenia stacjonarne w surowicy są osiągane po upływie 1–2 tygodni po rozpoczęciu leczenia. Pełne działanie leku nie pojawia się przed upływem dwóch tygodni i w tym czasie nie należy zwiększać dawki.
W przypadku niewystarczającej skuteczności zapobiegania napadom padaczkowym, dawkę można zwiększać, jednorazowo o 20%, jednocześnie monitorując stężenie fenobarbitalu w surowicy. Stężenie fenobarbitalu w surowicy można sprawdzić po osiągnięciu stanu stacjonarnego, a jeśli jest niższe niż 15 mikrogramów/ml, dawkę można odpowiednio dostosować. W przypadku nawrotu napadów padaczkowych dawkę można zwiększyć do maksymalnego stężenia 45 mikrogramów/ml.
Wysokie stężenia w osoczu mogą być związane z hepatotoksycznością. W celu określenia poziomu fenobarbitalu w osoczu krew najlepiej pobierać tuż przed wyznaczonym czasem podania kolejnej dawki fenobarbitalu, kiedy jego stężenie powinno być najniższe.
Odstawienie lub przejście z innego rodzaju leczenia przeciwpadaczkowego powinno odbywać się stopniowo, aby uniknąć wzrostu częstotliwości napadów.
Nie dotyczy.
Niewykorzystane połowy lub ćwiartki tabletki należy zużyć w ciągu 2 dni Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Za każdym razem, gdy niewykorzystana część tabletki jest przechowywana do następnego użycia, należy ją umieścić z powrotem w otwartym blistrze i włożyć z powrotem do pudełka tekturowego lub ponownie włożyć do pojemnika i przechowywać w bezpiecznym miejscu niedostępnym
i niewidocznym dla dzieci, aby uniknąć zagrożenia dla zdrowia małych dzieci w razie przypadkowego
połknięcia.
Brak specjalnych środków ostrożności dotyczących przechowywania.
Nie używać po upływie „Terminu ważności (EXP)” podanego na etykiecie i opakowaniu
zewnętrznym.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Zaleca się ostrożność w przypadku zwierząt z niewydolnością wątroby i nerek, hipowolemią, niedokrwistością oraz niewydolnością serca lub układu oddechowego. Prawdopodobieństwo skutków ubocznych w postaci hepatotoksyczności można zmniejszyć lub opóźnić poprzez zastosowanie możliwie najniższej skutecznej dawki. W przypadku długotrwałej terapii zaleca się monitorowanie parametrów wątrobowych.
Zaleca się ocenę stanu klinicznego pacjenta 2–3 tygodnie po rozpoczęciu leczenia, a następnie co 4–6 miesięcy, np. badanie enzymów wątrobowych i kwasów żółciowych w surowicy. Należy pamiętać, że wskutek niedotlenienia po napadzie może dochodzić do wzrostu poziomu enzymów wątrobowych po napadzie. Fenobarbital może zwiększać aktywność fosfatazy alkalicznej
i aminotransferaz w surowicy. Nie musi to wynikać ze zmian patologicznych, ale może również być skutkiem uszkodzenia wątroby, dlatego w przypadku podejrzenia hepatotoksyczności zalecane jest wykonanie badań czynności wątroby W przypadku gdy poziom kwasów żółciowych w surowicy mieści się w normie, podwyższone wartości enzymów wątrobowych nie wymagają zmniejszenia dawki fenobarbitalu.
U ustabilizowanych pacjentów z padaczką nie zaleca się zmiany leku z fenobarbitalu w innych postaciach na produkt Epityl 60 mg. Jeśli jednak nie można tego uniknąć, należy zachować dodatkowe środki ostrożności. Obejmuje to częstsze badanie stężenia w osoczu w celu upewnienia się, że poziomy terapeutyczne są utrzymane. Aż do potwierdzenia stabilizacji należy regularnie obserwować pacjenta w celu wykrycia ewentualnych nasilonych działań niepożądanych i zaburzeń czynności wątroby.
Odstawienie lub przejście z innego rodzaju leczenia przeciwpadaczkowego powinno odbywać się stopniowo, aby uniknąć wzrostu częstotliwości napadów.
Tabletki są aromatyzowane. Aby uniknąć przypadkowego połknięcia, tabletki należy przechowywać poza zasięgiem zwierząt
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Fenobarbital może potencjalnie zmniejszyć terapeutyczne poziomy wielu leków ze względu na jego indukujący wpływ na enzymy wątrobowe.
Dawka terapeutyczna fenobarbitalu stosowana do leczenia przeciwpadaczkowego może znacząco indukować białka osocza (takie jak α-1-kwaśna glikoproteina AGP), które wiążą leki. Fenobarbital może zmniejszać aktywność niektórych leków, poprzez zwiększanie tempa metabolizmu wskutek pobudzenia enzymów metabolizujących leki w mikrosomach wątroby. Z tego względu należy zwracać szczególną uwagę na farmakokinetykę i dawki jednocześnie podawanych leków . W przypadku równoczesnego podawania fenobarbitalu, stężenie szeregu leków w osoczu zmniejsza się.
Cymetydyna i ketokonazol są inhibitorami enzymów wątrobowych: Stosowanie ich jednocześnie z fenobarbitalem może powodować wzrost stężenia fenobarbitalu w surowicy. Fenobarbital może zmniejszać wchłanianie gryzeofulwiny.
Jednoczesne stosowanie z bromkiem potasu zwiększa ryzyko zapalenia trzustki.
Jednoczesne stosowanie z innymi lekami o ośrodkowym działaniu depresyjnym może nasilać działanie fenobarbitalu.
Nie zaleca się stosowania fenobarbitalu w tabletkach w połączeniu z prymidonem, ponieważ fenobarbital jest głównym metabolitem prymidonu.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki): Toksyczność może rozwinąć się przy dawkach powyżej 20 mg/kg/dobę lub gdy stężenie fenobarbitalu w surowicy wzrośnie powyżej 45 mikrogramów/ml.
Objawy przedawkowania to:
‐ zahamowanie czynności ośrodkowego układu nerwowego objawiające się w różny sposób, od snu do śpiączki,
‐ problemy z oddychaniem,
‐ problemy sercowo-naczyniowe, hipotensja i wstrząs prowadzące do niewydolności nerek i śmierci.
W przypadku przedawkowania należy usunąć połknięty produkt z żołądka, np. przez płukanie. Można podać węgiel aktywowany. W razie potrzeby zastosować wspomaganie układu oddechowego i sercowo-naczyniowego.
Nie istnieje specyficzna odtrutka, ale substancje stymulujące ośrodkowy układ nerwowy (takie jak doksapram) mogą pobudzać ośrodek oddechowy. Zapewnić wsparcie tlenowe.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami. O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii lub farmaceutę. Pomogą one chronić środowisko.
Blistry (10 tabletek) dostępne są w opakowaniach o wielkości 10, 20, 30, 40, 50, 60, 70, 80, 90, 100,
500 i 1000.
Wielkości opakowań HDPE to 100 i 500 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
W celu uzyskania informacji na temat niniejszego produktu leczniczego weterynaryjnego, należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego:
LIVISTO Sp. z o.o.
ul. Chwaszczyńska 198 a
81-571 Gdynia











