Spis treści:
- Nazwa weterynaryjnego produktu leczniczego
- Skład
- Docelowe gatunki zwierząt
- Wskazania lecznicze
- Przeciwwskazania
- Specjalne ostrzeżenia
- Zdarzenia niepożądane
- Dawkowanie dla każdego gatunku, drogi i sposób podania
- Zalecenie dla prawidłowego podania
- Okresy karencji:
- Specjalne środki ostrożności podczas przechowywania
- Specjalne środki ostrożności dotyczące usuwania
- Klasyfikacja weterynaryjnych produktów leczniczych
- Numery pozwolenia na dopuszczenie do obrotu i wielkości opakowań
- Data ostatniej aktualizacji ulotki informacyjnej
- Dane kontaktowe
ULOTKA INFORMACYJNA
Nazwa weterynaryjnego produktu leczniczego
Skład
Docelowe gatunki zwierząt
Wskazania lecznicze
Przeciwwskazania
Specjalne ostrzeżenia
Zdarzenia niepożądane
Dawkowanie dla każdego gatunku, drogi i sposób podania
Zalecenie dla prawidłowego podania
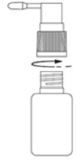
- Odkręcić zakrętkę

- Przykręcić do butelki pompkę rozpylającą.
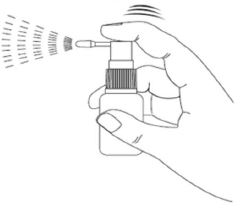
- Następnie przyciskać pompkę do momentu uwolnienia produktu.
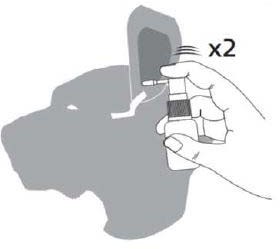
- Wprowadzić kaniulę atraumatyczną do kanału słuchowego. Podczas podawania wymaganej dawki produktu do chorego ucha (uszu) należy trzymać produkt możliwie jak najbardziej w pozycji pionowej. Zalecana dawka jest uwalniana poprzez dwukrotne naciśnięcie pompki rozpylającej (podczas każdorazowego rozpylenia nacisnąć pompkę do samego końca).
Okresy karencji:
Specjalne środki ostrożności podczas przechowywania
Specjalne środki ostrożności dotyczące usuwania
Klasyfikacja weterynaryjnych produktów leczniczych
Numery pozwolenia na dopuszczenie do obrotu i wielkości opakowań
Data ostatniej aktualizacji ulotki informacyjnej
Dane kontaktowe
Cortotic 0,584 mg/ml aerozol do uszu, roztwór dla psów
Każdy ml zawiera:
Substancja czynna:
Aceponian hydrokortyzonu 0,584 mg
Substancja pomocnicza:
Eter metylowy glikolu propylenowego Klarowny, bezbarwny do lekko żółtego roztwór.
Pies
Leczenie ostrego rumieniowo-woszczynowego zapalenia ucha zewnętrznego.
Nie stosować w przypadkach nadwrażliwości na substancję czynną, na pozostałe kortykosteroidy lub na dowolną substancję pomocniczą.
Nie stosować u zwierząt z uszkodzoną błoną bębenkową. Nie stosować w przypadkach występowania owrzodzeń.
Bakteryjne i grzybicze zapalenie ucha ma często charakter wtórny. Należy rozpoznać i leczyć pierwotną chorobę skóry.
W przypadkach pasożytniczego zapalenia ucha należy wdrożyć odpowiednie leczenie roztoczobójcze. Należy wykluczyć obecność ciał obcych, guzów i wszelkich innych nietypowych przyczyn zapalenia ucha.
Do klinicznych badań terenowych włączono tylko te psy, u których zdiagnozowano zapalenie ucha zewnętrznego z przerostem bakterii i (lub) drożdżaków. Wykazano, że weterynaryjny produkt leczniczy nie był gorszy w leczeniu ostrego zapalenia ucha w porównaniu z produktem złożonym do stosowania miejscowego zawierającym kortykosteroid, antybiotyk i lek przeciwgrzybiczy jako substancje czynne. Wykazano wtórne zmniejszenie przerostu bakterii i drożdży, a jednoczesne leczenie lekiem przeciwdrobnoustrojowym nie było konieczne.
Produkt jest więc polecany jako lek pierwszego rzutu w przypadku ostrego rumieniowo- woszczynowego zapalenia ucha zewnętrznego.
Specjalne środki ostrożności dotyczące bezpiecznego stosowania u docelowych gatunków zwierząt:
Przed zastosowaniem weterynaryjnego produktu leczniczego należy dokładnie zbadać zewnętrzny przewód słuchowy w celu upewnienia się, że błona bębenkowa nie jest uszkodzona, aby uniknąć ryzyka przeniesienia zakażenia do ucha środkowego oraz aby zapobiec uszkodzeniu aparatu przedsionkowo-ślimakowego.
Unikać kontaktu produktu z oczami psa przytrzymując jego głowę, co zapobiega jej potrząsaniu. W razie przypadkowego kontaktu, należy dokładnie przemyć oczy wodą.
Nie przeprowadzono oceny bezpieczeństwa i skuteczności produktu u psów w wieku poniżej 7 miesięcy lub ważących mniej niż 2,8 kg. W tych przypadkach produkt powinien być stosowany po dokonaniu przez lekarza weterynarii oceny stosunku korzyści do ryzyka wynikającego ze stosowania produktu.
W przypadku braku szczegółowych informacji stosowanie u zwierząt cierpiących na zespół Cushinga lub z podejrzeniem lub potwierdzeniem zaburzeń endokrynologicznych (np. cukrzyca), bądź z uogólnioną demodekozą, opiera się na ocenie stosunku korzyści do ryzyka.
Nie przeprowadzono oceny działania produktu w ropnym zapaleniu ucha zewnętrznego. Do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny stosunku korzyści do ryzyka wynikającego ze stosowania produktu.
Specjalne środki ostrożności dla osób podających weterynaryjny produkt leczniczy zwierzętom:
Weterynaryjny produkt leczniczy działa drażniąco na oczy. Należy unikać kontaktu z oczami, w tym dotykania oczu rękoma. W razie przypadkowego kontaktu z oczami należy obficie przemyć je wodą. Jeśli podrażnienie oczu nie ustępuje, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Zawarta w produkcie substancja czynna jest potencjalnie farmakologicznie czynna przy ekspozycji na wysokie dawki. Należy unikać kontaktu ze skórą. Należy unikać kontaktu z jamą ustną. Bezpośrednio po użyciu umieścić butelkę z powrotem w zewnętrznym opakowaniu tekturowym i przechowywać w bezpiecznym miejscu poza zasięgiem wzroku dzieci. W razie przypadkowego kontaktu ze skórą zaleca się dokładne przemycie wodą.
Po przypadkowym połknięciu, zwłaszcza przez dzieci, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie. Po użyciu należy umyć ręce.
Weterynaryjny produkt leczniczy jest łatwopalny. Nie rozpylać nad otwartym płomieniem lub żarzącym się materiałem. Nie palić papierosów podczas obchodzenia się z weterynaryjnym produktem leczniczym.
Inne środki ostrożności:
Rozpuszczalnik zawarty w tym produkcie może pozostawiać plamy na niektórych materiałach, w tym na malowanych, lakierowanych lub w inny sposób pokrytych powierzchniach mebli domowych.
Ciąża i laktacja:
Bezpieczeństwo weterynaryjnego produktu leczniczego stosowanego w czasie ciąży i laktacji nie zostało określone. Ze względu na nieznaczne wchłanianie ogólnoustrojowe aceponianu hydrokortyzonu jest mało prawdopodobne, aby przy zalecanym dawkowaniu u psów wystąpiło działanie teratogenne, toksyczne dla płodu lub szkodliwe dla samicy.
Do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny stosunku korzyści do ryzyka wynikającego ze stosowania produktu.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Brak.
Przedawkowanie:
W badaniach dotyczących przedawkowania po podaniu miejscowym odnotowano odwracalne zmniejszenie zdolności do wytwarzania kortyzolu (czasowe zahamowanie czynności nadnerczy).
Główne niezgodności farmaceutyczne:
Nie dotyczy.
Psy:
Bardzo rzadko (<1 zwierzę / 10 000 leczonych zwierząt, włączając pojedyncze raporty): |
Przechylenie głowy – choroba uszu |
Częstość nieznana. Nie może być określona na podstawie dostępnych danych: |
Zmętnienie błony bębenkowej* |
*przejściowe, odwracalne i niezwiązane z zaburzeniem słuchu lub głuchotą
Zgłaszanie zdarzeń niepożądanych jest istotne, ponieważ umożliwia ciągłe monitorowanie bezpieczeństwa stosowania weterynaryjnego produktu leczniczego. W razie zaobserwowania zdarzeń niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, w pierwszej kolejności poinformuj o tym lekarza weterynarii. Można również zgłosić zdarzenia niepożądane do podmiotu odpowiedzialnego lub lokalnego przedstawiciela podmiotu odpowiedzialnego przy użyciu danych kontaktowych zamieszczonych w końcowej części tej ulotki lub poprzez krajowy system zgłaszania:
Departament Oceny Dokumentacji i Monitorowania Niepożądanych Działań Produktów Leczniczych Weterynaryjnych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych
Al. Jerozolimskie 181C, PL-02-222 Warszawa, Polska Tel.: +48 22 49-21-687 Faks: +48 22 49-21-605
https://smz.ezdrowie.gov.pl
Podanie do ucha.
Zalecana dawka wynosi 0,44 ml weterynaryjnego produktu leczniczego na jedno chore ucho raz dziennie przez 7 kolejnych dni. Zalecana dawka uwalniana jest poprzez dwukrotne naciśnięcie pompki rozpylającej.
Jeśli lekarz weterynarii uzna, że choroba nie została całkowicie wyleczona w ciągu 7 dni, leczenie może zostać przedłużone do 14 dni. Maksymalna odpowiedź kliniczna może być widoczna dopiero po 28 dniach od pierwszego podania.
Instrukcja prawidłowego stosowania produktu:
Przed pierwszym podaniem produktu należy odkręcić zakrętkę i przykręcić do butelki pompkę rozpylającą.
Następnie należy naciskać pompkę rozpylającą aż do uwolnienia produktu. Może być konieczne 3- krotne naciśnięcie.
Wprowadzić kaniulę atraumatyczną do kanału słuchowego i podać produkt poprzez dwukrotne naciśnięcie pompki. Podczas podawania produktu do chorego ucha (uszu) należy trzymać produkt w pozycji pionowej.
Po użyciu należy pozostawić pompkę rozpylającą przykręconą do butelki.
Jeśli pompka nie była używana przez dłuższy czas, należy ją jednokrotnie nacisnąć przed ponownym podaniem produktu do ucha.
Pojemność butelki pozwala na leczenie 2 uszu przez 14 dni.
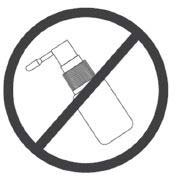
Nie należy zbyt mocno przechylać butelki.
Nie dotyczy.
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Brak specjalnych środków ostrożności dotyczących przechowywania.
Nie używać tego weterynaryjnego produktu leczniczego po upływie terminu ważności podanego na etykiecie po oznaczeniu „Exp.”
Termin ważności oznacza ostatni dzień danego miesiąca.
Okres ważności po pierwszym otwarciu opakowania: 6 miesięcy.
Leków nie należy usuwać do kanalizacji.
Należy skorzystać z krajowego systemu odbioru odpadów w celu usunięcia niewykorzystanego weterynaryjnego produktu leczniczego lub materiałów odpadowych pochodzących z jego zastosowania w sposób zgodny z obowiązującymi przepisami oraz właściwymi krajowymi systemami odbioru odpadów. Pomoże to chronić środowisko.
O sposoby usunięcia niepotrzebnych leków zapytaj lekarza weterynarii.
Wydawany na receptę weterynaryjną.
Butelka z polietylenu o wysokiej gęstości (HDPE) o pojemności 20 ml zawierająca 16 ml roztworu, zamknięta zakrętką z HDPE i pompką dozującą z HDPE.
Wielkości opakowań:
Pudełko zawierające 1 butelkę i 1 pompkę dozującą.
{DD/MM/RRRR}
Szczegółowe informacje dotyczące powyższego weterynaryjnego produktu leczniczego są dostępne w unijnej bazie danych produktów (https://medicines.health.europa.eu/veterinary).
Podmiot odpowiedzialny oraz wytwórca odpowiedzialny za zwolnienie serii: VIRBAC
1ére avenue 2065 m LID 06516 Carros FRANCJA
W celu uzyskania informacji na temat niniejszego weterynaryjnego produktu leczniczego należy kontaktować się z lokalnym przedstawicielem podmiotu odpowiedzialnego.
Lokalny przedstawiciel oraz dane kontaktowe do zgłaszania podejrzeń zdarzeń niepożądanych:
PL: Polska
VIRBAC Sp. z o.o.
Tel.: + 48 22 855 40 46











