Spis treści:
- Nazwa weterynaryjnego produktu leczniczego
- Skład
- Docelowe gatunki zwierząt
- Wskazania lecznicze
- Przeciwwskazania
- Specjalne ostrzeżenia
- Zdarzenia niepożądane
- Dawkowanie dla każdego gatunku, drogi i sposób podania
- Zalecenia dla prawidłowego podania
- Okresy karencji
- Specjalne środki ostrożności podczas przechowywania
- Specjalne środki ostrożności dotyczące usuwania
- Klasyfikacja weterynaryjnych produktów leczniczych
- Numery pozwolenia na dopuszczenie do obrotu i wielkości opakowań
- Data ostatniej aktualizacji ulotki informacyjnej
- Dane kontaktowe
B. ULOTKA INFORMACYJNA
ULOTKA INFORMACYJNA
Nazwa weterynaryjnego produktu leczniczego
Skład
Docelowe gatunki zwierząt
Wskazania lecznicze
Przeciwwskazania
Specjalne ostrzeżenia
Zdarzenia niepożądane
Dawkowanie dla każdego gatunku, drogi i sposób podania
Zalecenia dla prawidłowego podania
Okresy karencji
Specjalne środki ostrożności podczas przechowywania
Specjalne środki ostrożności dotyczące usuwania
Klasyfikacja weterynaryjnych produktów leczniczych
Numery pozwolenia na dopuszczenie do obrotu i wielkości opakowań
Data ostatniej aktualizacji ulotki informacyjnej
Dane kontaktowe
Clavusan 500 mg + 125 mg tabletki dla psów
Każda tabletka zawiera:
Substancje czynne:
Amoksycylina (jako amoksycylina trójwodna) 500 mg
Kwas klawulanowy (jako potasu klawulanianu, rozcierka)
125 mg
Biała do jasno żółtej, okrągła i wypukła tabletka z linią podziału w kształcie krzyża po jednej stronie. Tabletki mogą być podzielone na 2 lub 4 równe części.
Psy.
Leczenie zakażeń wywołanych przez bakterie wrażliwe na amoksycylinę w połączeniu z kwasem klawulanowym, w tym: zapalenia skóry (powierzchowne i głębokie ropne zapalenie skóry), zakażenia tkanek miękkich (ropnie i zapalenia zatok okołoodbytowych), zakażenia stomatologiczne (np. zapalenie dziąseł); zakażenia dróg moczowych; zakażenia dróg oddechowych (górnych i dolnych); zapalenie jelit.
Nie stosować u królików, kawii domowych, chomików, myszoskoczków i szynszyli. Nie stosować w przypadkach stwierdzonej nadwrażliwości na substancje czynne, inne antybiotyki z grupy antybiotyków beta-laktamowych lub na dowolną substancję pomocniczą.
Nie stosować u zwierząt z poważnym zaburzeniem czynności nerek, z towarzyszącym bezmoczem i skąpomoczem.
Nie stosować u przeżuwaczy i koni.
Specjalne środki ostrożności dotyczące bezpiecznego stosowania u docelowych gatunków zwierząt: Stosowanie produktu powinno być oparte na identyfikacji i badaniu lekowrażliwości docelowego patogenu (docelowych patogenów). Jeżeli nie jest to możliwe, terapia powinna opierać się na informacjach epidemiologicznych i znajomości lekowrażliwości docelowych patogenów na poziomie lokalnym/regionalnym. Stosowanie produktu powinno być zgodne z oficjalną, krajową i regionalną polityką stosowania leków przeciwdrobnoustrojowych.
Antybiotyk o niższym ryzyku selekcji oporności na leki przeciwdrobnoustrojowe (niższa kategoria AMEG) powinien być stosowany w leczeniu pierwszego rzutu, gdy badanie lekowrażliwości sugeruje prawdopodobną skuteczność takiego podejścia.
Stosowanie amoksycyliny w połączeniu z kwasem klawulanowym należy ograniczyć do leczenia stanów klinicznych, w których reakcja na leczenie innymi lekami przeciwbakteryjnymi lub penicylinami o wąskim spektrum działania jest niedostateczna.
Wykazano oporność krzyżową pomiędzy amoksycyliną/kwasem klawulanowym a antybiotykami beta-laktamowymi. Należy starannie rozważyć stosowanie produktu, gdy w badaniu lekowrażliwości
wykazano oporność na antybiotyki beta-laktamowe, ponieważ skuteczność produktu może być zmniejszona.
Stosowanie produktu niezgodne z ChWPL może zwiększać częstość występowania bakterii opornych na amoksycylinę/kwas klawulanowy i może obniżać skuteczność leczenia antybiotykami beta- laktamowymi, w związku z możliwością wystąpienia oporności krzyżowej.
Należy zachować ostrożność podczas stosowania produktu u małych zwierząt roślinożernych innych niż wymienione w przeciwwskazaniach w punkcie 5.
U zwierząt z niewydolnością wątroby lub nerek należy dokładnie rozważyć schemat dawkowania.
Specjalne środki ostrożności dla osób podających weterynaryjny produkt leczniczy zwierzętom:
Penicyliny i cefalosporyny mogą powodować reakcje nadwrażliwości (alergię) po wstrzyknięciu, wdychaniu, połknięciu lub kontakcie ze skórą. Nadwrażliwość na penicyliny może prowadzić do reakcji krzyżowej na cefalosporyny i odwrotnie. Czasami reakcje uczuleniowe na te substancje mogą być ciężkie.
Osoby o znanej nadwrażliwości, lub którym zalecono unikanie kontaktu z tego typu produktami, nie powinny mieć kontaktu z tym weterynaryjnym produktem leczniczym.
Podczas kontaktu z tym weterynaryjnym produktem leczniczym należy zachować szczególną ostrożność i stosować wszystkie zalecane środki ostrożności, aby uniknąć narażenia.
W razie pojawienia się objawów po narażeniu na produkt, takich jak wysypka skórna, należy zwrócić się do lekarza i pokazać mu niniejsze ostrzeżenie. Poważniejsze objawy obejmują obrzęk twarzy, ust i oczu lub trudności z oddychaniem i wymagają natychmiastowej pomocy lekarskiej.
Po użyciu należy umyć ręce.
W celu uniknięcia przypadkowego połknięcia, szczególnie przez dziecko, niewykorzystane części tabletki należy umieścić z powrotem w gnieździe blistra, włożyć z powrotem do zewnętrznego opakowania i przechowywać w bezpiecznym miejscu, w miejscu niewidocznym i niedostępnym dla dzieci.
Ciąża i laktacja:
Produkt może być stosowany w okresie ciąży i laktacji.
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji:
Chloramfenikol, makrolidy, sulfonamidy i tetracykliny mogą hamować działanie przeciwbakteryjne penicylin z powodu szybkiego wystąpienia działania bakteriostatycznego. Należy brać pod uwagę możliwość wystąpienia alergicznych reakcji krzyżowych z innymi penicylinami. Penicyliny mogą nasilać działanie aminoglikozydów.
Przedawkowanie:
Do częściej obserwowanych objawów przedawkowania należą łagodne objawy żołądkowe-jelitowe (biegunka i wymioty).
Główne niezgodności farmaceutyczne:
Nie dotyczy.
Psy:
Bardzo rzadko (< 1 zwierzę/10 000 leczonych zwierząt, włączając pojedyncze raporty): zaburzenia żołądkowo-jelitowe (wymioty, biegunka, anoreksja).
Częstość nieznana (nie możne być określona na podstawie dostępnych danych): reakcje alergiczne (reakcje skórne, anafilaksja). W takich przypadkach należy przerwać podawanie produktu i zastosować leczenie objawowe.
Zgłaszanie zdarzeń niepożądanych jest istotne, ponieważ umożliwia ciągłe monitorowanie bezpieczeństwa stosowania weterynaryjnego produktu leczniczego. W razie zaobserwowania zdarzeń
niepożądanych, również niewymienionych w ulotce informacyjnej, lub w przypadku podejrzenia braku działania produktu, w pierwszej kolejności poinformuj o tym lekarza weterynarii. Można również zgłosić zdarzenia niepożądane do podmiotu odpowiedzialnego lub lokalnego przedstawiciela podmiotu odpowiedzialnego przy użyciu danych kontaktowych zamieszczonych w końcowej części tej ulotki lub poprzez krajowy system zgłaszania: Departament Oceny Dokumentacji i Monitorowania Niepożądanych Działań Produktów Leczniczych Weterynaryjnych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, Al. Jerozolimskie 181C, PL-02-222 Warszawa, Polska Tel.: +48 22 49-21-687 Faks: +48 22 49-21-605, https://smz.ezdrowie.gov.pl
Podanie doustne.
Zalecana dawka to 12,5 mg/kg masy ciała (10 mg amoksycyliny/2,5 mg kwasu klawulanowego na kg masy ciała), dwa razy dziennie.
Poniższa tabela zawiera wskazówki dotyczące podawania tabletek w zalecanej dawce.
Aby zapewnić prawidłowe dawkowanie, należy jak najdokładniej określić masę ciała zwierzęcia w celu uniknięcia podania zbyt małej dawki.
Liczba tabletek – dwa razy dziennie (dawka: 12,5 mg/kg m.c.) | |||
Masa ciała (kg) | Amoksycylina/kwas klawulanowy 50 mg + 12,5 mg | Amoksycylina/kwas klawulanowy 250 mg + 62,5 mg | Amoksycylina/kwas klawulanowy 500 mg + 125 mg |
1-1,25 | ¼ | - | - |
>1,25-2,5 | ½ | - | - |
>2,5-3,75 | ¾ | - | - |
>3,75-5 | 1 | - | - |
>5-6,25 | 1 ¼ | ¼ | - |
>6,25-12,5 | - | ½ | ¼ |
>12,5-18,75 | - | ¾ | - |
>18,75-25 | - | 1 | ½ |
>25-31,25 | - | 1 ¼ | - |
>31,25-37,5 | - | 1 ½ | - |
>37,5-50 | - | - | 1 |
>50-62,5 | - | - | 1 ¼ |
>62,5-75 | - | - | 1 ½ |







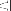























= ¼ tabletki = ½ tabletki = ¾ tabletki = 1 tabletka
Tabletki można podzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania.
Minimalny czas trwania leczenia wynosi 5 dni, a w większości typowych przypadków odpowiedź następuje po 5 – 7 dniach leczenia.
W przewlekłych lub trudnych przypadkach może być wymagane dłuższe leczenie, np. przewlekła choroba skóry 10 – 20 dni, przewlekłe zapalenie pęcherza moczowego 10 – 28 dni, choroba dróg oddechowych 8 – 10 dni.
W takich przypadkach całkowita długość leczenia zależy od decyzji lekarza, jednak powinna być wystarczająco długa, aby zapewnić całkowite ustąpienie choroby bakteryjnej.
Brak.
Nie dotyczy.
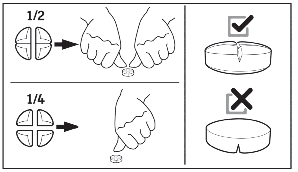
Przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Nie przechowywać w temperaturze powyżej 30ºC.
Przechowywać w oryginalnym opakowaniu. Jeżeli tabletki są dzielone, niewykorzystaną część tabletki należy ponownie umieścić w blistrze.
Nie używać tego weterynaryjnego produktu leczniczego po upływie terminu ważności podanego na pudełku po oznaczeniu Exp. Termin ważności oznacza ostatni dzień danego miesiąca
Jeżeli tabletki są dzielone, niewykorzystaną część tabletki należy ponownie umieścić w blistrze i zużyć w ciągu 36 godzin.
Leków nie należy usuwać do kanalizacji ani wyrzucać do śmieci.
Należy skorzystać z krajowego systemu odbioru odpadów w celu usunięcia niewykorzystanego weterynaryjnego produktu leczniczego lub materiałów odpadowych pochodzących z jego zastosowania w sposób zgodny z obowiązującymi przepisami oraz właściwymi krajowymi systemami odbioru odpadów. Pomoże to chronić środowisko.
Wydawany na receptę weterynaryjną.
Zgrzewany na gorąco blister oPA/Alu/PVC – PVC/Alu, każdy zawierający 10 tabletek. Wielkość opakowań:
Pudełko tekturowe zawierające 10, 30, 50, 100 lub 250 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Szczegółowe informacje dotyczące powyższego weterynaryjnego produktu leczniczego są dostępne w unijnej bazie danych produktów (https://medicines.health.europa.eu/veterinary).
Podmiot odpowiedzialny oraz wytwórca odpowiedzialny za zwolnienie serii oraz dane kontaktowe do zgłaszania podejrzeń działań niepożądanych:
Alfasan Nederland B.V.
Kuipersweg 9
3449 JA Woerden Holandia
Tel: +31-(0)348-416945
Wytwórca odpowiedzialny za zwolnienie serii: LelyPharma B.V.
Zuiveringweg 42
8243 PZ Lelystad Holandia











