Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
[Version 8.1, 01/2017]
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działania niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt włączając pojedyncze raporty).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Wyczyścić strzyk załączoną chusteczką do dezynfekcji.
Podanie płytkie - usunąć końcówkę zatyczki, zgodnie z rysunkiem.
Podanie głębokie - usunąć całą zatyczkę, zgodnie z rysunkiem.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Cobactan LC, maść dowymieniowa dla bydła
1 tubostrzykawka (8 g) zawiera:
Substancja czynna:
Cefquinom 75 mg (w postaci cefquinomu siarczanu 88,9 mg) Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Maść dowymieniowa.
Biała do lekko żółtej, oleista lepka, homogenna maść.
Bydło (krowy w okresie laktacji).
Leczenie u krów w okresie laktacji stanów zapalnych wymienia wywołanych przez drobnoustroje wrażliwe na działanie cefquinomu takie jak: Streptococcus uberis, Streptococcus dysgalactiae, Streptococcus agalactiae, Staphylococcus aureus, Escherichia coli.
Nie stosować u zwierząt uczulonych na cefalosporyny i inne antybiotyki -laktamowe.
Nie stosować chusteczek do higieny strzyków w przypadku widocznych i niezagojonych ran.
Brak
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Stosowanie produktu powinno się opierać na badaniach wrażliwości oraz brać pod uwagę oficjalne i lokalne zasady antybiotykoterapii. Nieodpowiednie stosowanie produktu może być przyczyną rozpowszechniania bakterii opornych na cefquinom i zmniejszania skuteczności leczenia innymi
antybiotykami β-laktamowymi na skutek oporności krzyżowej.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Penicyliny i cefalosporyny mogą powodować występowanie reakcji nadwrażliwości (alergii) w przypadku wstrzyknięcia, inhalacji, spożycia lub kontaktu ze skórą. Nadwrażliwość na penicyliny może prowadzić do wystąpienia nadwrażliwości krzyżowej na cefalosporyny i odwrotnie. Reakcje alergiczne na te substancje mogą mieć niekiedy poważny przebieg.
Bardzo rzadko, po podaniu produktu, stwierdzano u zwierząt występowanie reakcji anafilaktycznych. Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
4.7. Stosowanie w ciąży, laktacji lub w okresie nieśności
Ciąża:
Ponieważ nie prowadzono specyficznych badań na gatunku docelowym, u zwierząt zarodowych oraz w ciąży stosować jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu. Badania laboratoryjne prowadzone na szczurach i królikach nie wykazały niekorzystnego wpływu na reprodukcję i działania teratogennego.
Laktacja:
Produkt leczniczy weterynaryjny - przeznaczony jest do stosowania w okresie laktacji.
Nieznane
Produkt podaje się co 12 godzin w dawce 1 tubostrzykawki na każdą zakażoną ćwiartkę wymienia, po 3 kolejnych udojach.
Sposób podawania:
Przed podaniem produktu należy dokładnie zdoić wydzielinę z leczonych ćwiartek oraz starannie umyć i zdezynfekować strzyki, a zwłaszcza okolicę ujścia kanału strzykowego. Produkt podaje się wprowadzając ujście tubostrzykawki do kanału strzykowego i powoli wstrzykując jej zawartość. Następnie należy poprzez delikatny masaż strzyku w kierunku ku zatoce mlekonośnej rozprowadzić produkt w obrębie kanału strzykowego i zatoki mlekonośnej.
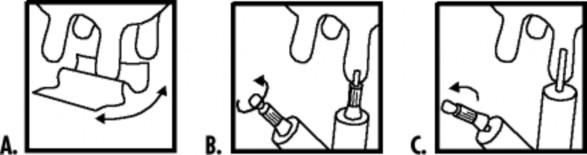
Nie dotykać konusa tubostrzykawki palcami. Podawać z zachowaniem ostrożności.
Nieznane
Tkanki jadalne: 48 godzin. Mleko: 4 dni.
Grupa farmakoterapeutyczna: Antybiotyki do stosowania dowymieniowego, cefalosporyny IV generacji.
Kod ATC vet: QJ51DA90.
Cefquinom jest antybiotykiem z grupy cefalosporyn o szerokim spektrum działania przeciwbakteryjnego, wykazującym aktywność w stosunku do następujących drobnoustrojów Gram- ujemnych i Gram-dodatnich: Escherichia coli, Staphylococcus aureus, Streptococcus dysgalactiae, Streptococcus agalactiae, Streptococcus uberis.
Cefquinom odznacza się wysokim stopniem oporności na działanie penicylinazy i innych enzymów z grupy -laktamaz. Wartość MIC90 dla Staphylococcus aureus określono in vitro na około 1 μg/ml. W przypadku szczepów bakteryjnych wrażliwych na cefalosporyny może wystąpić zjawisko wrażliwości krzyżowej na różne antybiotyki z tej grupy.
Po 12 godzinach od ostatniego podania dowymieniowego średnią zawartość cefquinomu w mleku określono na 19 µg/ml. Po drugim udoju od ostatniego podania stwierdzono jeszcze przeciętnie 2,5 µg/ml, po trzecim udoju zaś przeciętnie 0,75 µg/ml cefquinomu w mleku. Badania
farmakokinetyki cefquinomu prowadzone u szczurów, psów, cieląt oraz krów wskazują na to, iż po podaniu parenteralnym (iniekcja domięśniowa lub podskórna) cefquinom charakteryzuje się stosunkowo krótkim okresem półtrwania w osoczu/surowicy krwi, zaś jego metabolity eliminowane są głównie z moczem i w bardzo niewielkim stopniu z kałem.
Wazelina biała Parafina ciekła
Nieznane
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata.
Okres ważności po pierwszym otwarciu opakowania bezpośredniego (opakowanie jednorazowego użytku): zużyć natychmiast.
Przechowywać w temperaturze poniżej 25°C.
Tubostrzykawka dowymieniowa o pojemności 10 ml, zawierająca 8 g produktu, wykonana z polietylenu.
Tubostrzykawki pakowane są po 3, 15, 20 lub 24 sztuki w pudełka tekturowe.
Pudełka zawierają chusteczki nasączone alkoholem izopropylowym do higieny strzyków w ilości korespondującej z tubostrzykawkami.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Intervet International B.V. Wim de Körverstraat 35 5831 AN Boxmeer Holandia
1203/01
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 23/10/2001 Data przedłużenia pozwolenia:
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB STOSOWANIA
Nie dotyczy











