Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działania niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres (-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Amoxid, 800 mg/g proszek do sporządzania roztworu doustnego dla bydła, świń, kur i indyków
1 gram produktu zawiera:
Substancja czynna:
Amoksycylina trójwodna 800 mg (co odpowiada 696,8 mg amoksycyliny)
Substancje pomocnicze:
Disodu edetynian 4mg
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Proszek do sporządzania roztworu doustnego Proszek barwy białej do kremowej
Bydło (cielęta), świnie, kury (brojlery), indyki
Leczenie miejscowych i uogólnionych infekcji wywołanych przez drobnoustroje Gram-dodatnie i Gram-ujemne wrażliwe na amoksycylinę, a w szczególności:
Cielęta: salmonelloza, zapalenie płuc, pastereloza
Świnie: zapalenie płuc wywoływane przez Actinobacillus pleuropneumoniae, pastereloza, salmonelloza i kolibakterioza
Kury (brojlery): pastereloza, kolibakterioza Indyki: pastereloza
Nie stosować u świnek morskich, królików i przeżuwaczy z rozwiniętą funkcją przedżołądków. Nie stosować, jeśli u zwierząt występuje ciężka niewydolność nerek, objawiająca się oligurią lub anurią.
Nie stosować, jeśli występują zakażenia drobnoustrojami wytwarzającymi β-laktamazy.
Nie stosować w przypadku nadwrażliwości na antybiotyki β-laktamowe lub dowolną substancję pomocniczą.
Brak
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Stosowanie produktu powinno się opierać na badaniach wrażliwości oraz brać pod uwagę oficjalne i lokalne zasady antybiotykoterapii.
Nieodpowiednie stosowanie produktu może być przyczyną rozpowszechniania bakterii opornych na amoksycylinę i zmniejszania skuteczności leczenia innymi antybiotykami β-laktamowymi na skutek oporności krzyżowej.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Penicyliny i cefalosporyny mogą wywoływać reakcje nadwrażliwości (alergię) po ich podaniu parenteralnym, po przypadkowym dostaniu się do dróg oddechowych, spożyciu oraz kontakcie ze skórą.
Nadwrażliwość na penicyliny może prowadzić do krzyżowej nadwrażliwości na cefalosporyny i odwrotnie.
Reakcja alergiczna na te substancje może w niektórych przypadkach być poważna.
Osoby o znanej nadwrażliwości na antybiotyki β-laktamowe powinny unikać kontaktu z produktem leczniczym weterynaryjnym.
Podczas stosowania produktu leczniczego weterynaryjnego należy używać osobistej odzieży i sprzętu ochronnego, na które składa się ubranie ochronne, maski, rękawice ochronne i okulary.
Jeśli w wyniku przypadkowego kontaktu z produktem rozwinęły się objawy takie jak wysypka na skórze, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Obrzęk twarzy, ust, okolic oczu lub trudności w oddychaniu są znacznie poważniejszymi objawami i mogą wymagać natychmiastowej interwencji medycznej.
U osobników uczulonych na penicylinę może wystąpić reakcja alergiczna. W takich przypadkach należy zastosować terapię przeciwwstrząsową.
Zaburzenia żołądkowo-jelitowe oraz reakcje nadwrażliwości, począwszy od lekkiej pokrzywki do śmiertelnego wstrząsu anafilaktycznego. Mogą wystąpić alergie krzyżowe ze wszystkimi innymi penicylinami. Długotrwałe stosowanie produktu może spowodować wyjałowienie jelit i prowadzić do rozwoju niewrażliwych drobnoustrojów.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
4.7. Stosowanie w ciąży, laktacji lub w okresie nieśności
Ciąża:
Może być stosowany w okresie ciąży.
Laktacja:
Nie stosować w okresie laktacji ze względu na przenikanie amoksycyliny do mleka.
Nie zaleca się jednoczesnego podawania produktów o działaniu bakteriostatycznym.
Cielęta i świnie: 20–30 mg amoksycyliny trójwodnej/kg m.c. dziennie, co odpowiada 25–37,5 mg produktu/kg m.c. Dawkę dzienną należy podzielić na dwie równe porcje. Jednorazowa dawka wynosi 10–15 mg amoksycyliny trójwodnej/kg m.c., co odpowiada 12,5–18,75 mg produktu/kg m.c.
Kury (brojlery) i indyki: 20–30 mg amoksycyliny trójwodnej/kg m.c. dziennie, co odpowiada 25–37,5 mg produktu/kg m.c. Dawkę dzienną należy podzielić na dwie równe porcje. Jednorazowa dawka wynosi 10-15 mg amoksycyliny trójwodnej/kg m.c., co odpowiada 12,5-18,75 mg produktu/kg m.c.
Produkt leczniczy należy podawać przez 3–5 dni.
Roztwór leczniczy nie wypity w ciągu 6 godzin należy usunąć.
Produkt leczniczy weterynaryjny rozpuścić w wodzie przestrzegając zalecanej dawki zgodnie z następującym wzorem:
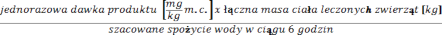 = mg produktu/1 podanie Przygotowanie roztworu:
= mg produktu/1 podanie Przygotowanie roztworu:
Produkt rozpuścić w wodzie w proporcji ok. 2 g/litr. Następnie uzupełnić wodą do uzyskania odpowiedniego stężenia. Roztwór leczniczy należy przygotować bezpośrednio przed każdym podaniem.
W celu uniknięcia nieprawidłowego dawkowania masa ciała leczonych zwierząt powinna być oszacowana jak najdokładniej.
Spożycie wody jest uzależnione od wielu czynników, m. in. stanu klinicznego zwierząt, warunków otoczenia. W celu zapewnienia prawidłowego dawkowania należy monitorować spożycie wody
i odpowiednio dostosować stężenie roztworu leczniczego. Jeżeli nie jest to możliwe, należy zastosować inny produkt leczniczy weterynaryjny.
Amoxid podawany świniom, cielętom, kurom i indykom w dawce 50 mg/kg m.c. (dwukrotnie wyższej od zalecanej) przez 5 dni nie wywołał reakcji niepożądanych.
Tkanki jadalne:
Bydło (cielęta) – 48 godzin Świnie – 24 godziny
Kury, indyki – 24 godziny
Nie stosować u kur niosek produkujących jaja przeznaczone do spożycia przez ludzi. Nie stosować u krów produkujących mleko przeznaczone do spożycia przez ludzi.
Grupa farmakoterapeutyczna: Leki przeciwbakteryjne do stosowania ogólnego. Antybiotyki beta- laktamowe. Penicyliny o rozszerzonym spektrum.
Kod ATCvet: QJ01CA04
Mechanizm działania amoksycyliny polega na blokowaniu enzymów odpowiedzialnych za wytwarzanie ściany komórkowej bakterii (transpeptydaz). Powoduje to osłabienie struktury ściany i w konsekwencji nagłą lizę komórki spowodowaną wzrostem ciśnienia osmotycznego. Amoksycylina wykazuje się aktywnością w stosunku do wielu bakterii Gram-dodatnich i Gram-ujemnych.
Cielęta | |||
Bakteria | Liczba badanych szczepów | MIC 50 (µg/ml) | MIC 90 (µg/ml) |
Pasteurella multocida | 20 | < 0,5 | 1 |
Świnie | |||
Bakteria | Liczba badanych szczepów | MIC 50 (µg/ml) | MIC 90 (µg/ml) |
Pasteurella multocida | 20 | < 0,5 | < 0,5 |
Drób | |||
Bakteria | Liczba badanych szczepów | MIC 50 (µg/ml) | MIC 90 (µg/ml) |
Pasteurella multocida | 10 | < 0,5 | 1 |
Amoksycylina podana doustnie jest szybko absorbowana z przewodu pokarmowego (głównie w jelicie cienkim) i osiąga Cmax w osoczu w czasie 2–3 godzin od podania. Wiąże się z białkami osocza w 17–18%.
Wysokie stężenie antybiotyku stwierdza się również w wątrobie, żółci, mięśniach, tłuszczu, nerkach oraz w tkance płuc. Wydalana jest w formie niezmienionej z moczem (w małym stopniu z żółcią) w ciągu 12 godzin od podania.
Obecność treści pokarmowej nie wpływa na zmniejszenie wchłaniania amoksycyliny.
Sodu węglan bezwodny Boraks
Glicyna
Krzemionka koloidalna uwodniona Laurylosiarczan sodowy
Disodu edetynian Laktoza jednowodna
Nieznane
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata Okres ważności po pierwszym otwarciu opakowania bezpośredniego: 3 miesiące
Okres ważności po rozcieńczeniu zgodnie z instrukcją: 6 godzin.
Nie przechowywać w temperaturze powyżej 25˚C
Pojemniki polietylenowe zawierające: 358 g, 1000 g, 1430 g produktu, zamknięte polietylenowym korkiem i polietylenową zakrętką.
Warstwowy worek poliester/aluminium/polietylen zawierający 1000g 1430 g, 4290 g produktu z termouszczelnionym zamknięciem.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Industria Italiana Integratori Trei SpA Viale Corassori 62 - 41124 Modena Włochy
1796/08
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 11-08-2008 Data przedłużenia pozwolenia: 16-04-2018
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB STOSOWANIA
Nie dotyczy.











