Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 zwierząt wykazujących działanie(a) niepożądane w jednym cyklu leczenia)
często (więcej niż 1ale mniej niż 10 na 100 zwierząt)
niezbyt często (więcej niż 1ale mniej niż 10 na 1000 zwierząt)
rzadko (więcej niż 1ale mniej niż 10 na 10000 zwierząt)
bardzo rzadko (mniej niż 1na 10000 zwierząt włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres (-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego Rodzaj opakowania bezpośredniego:
tubostrzykawki,
tłoka,
nasadki.
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Mastiplan LC 300 mg + 20 mg/8 g zawiesina dowymieniowa dla krów w okresie laktacji W Hiszpanii:
Mastiplan, 300mg/20mg (Cefapirin/Prednisolone), intramammary suspension for lactating cows
Wszystkie pozostałe kraje:
Mastiplan LC, 300mg/20mg (Cefapirin/Prednisolone), intramammary suspension for lactating cows
Każda tubostrzykawka z 8 g zawiesiny zawiera:
Substancje czynne:
300 mg cefapiryny w postaci cefapiryny sodowej 20 mg prednizolonu
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Zawiesina dowymieniowa
Homogenna, oleista zawiesina w kolorze złamanej bieli/żółtym do różowego.
Bydło (krowy mleczne w okresie laktacji)
Leczenie klinicznych postaci mastitis wywoływanych przez wrażliwe na cefapirynę Staphylococcus aureus, gronkowce koagulazoujemne, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis i Escherichia coli u krów mlecznych w okresie laktacji.
Nie stosować w przypadkach nadwrażliwości na cefalosporyny, inne antybiotyki β-laktamowe lub na dowolną substancję pomocniczą.
Brak
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Nie stosować chusteczek do czyszczenia strzyków z otwartymi ranami.
Należy uwzględniać oficjalne krajowe i regionalne wytyczne dotyczące stosowania antybiotyków podczas stosowania produktu. Stosowanie produktu powinno być oparte na badaniach
lekowrażliwości bakterii izolowanych od zwierzęcia. Jeśli nie jest to możliwe, podczas leczenia należy uwzględniać lokalne (regionalne, na poziomie gospodarstwa) dane epidemiologiczne dotyczące wrażliwości bakterii docelowych. Stosowanie produktu odbiegające od instrukcji podanych w CHPLW może zwiększać rozpowszechnienie bakterii opornych na cefapirynę oraz może obniżać skuteczność leczenia.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Penicyliny i cefalosporyny mogą wywoływać reakcje nadwrażliwości (alergii) po wstrzyknięciu, inhalacji, spożyciu lub kontakcie ze skórą. Nadwrażliwość na penicyliny może prowadzić do wystąpienia nadwrażliwości krzyżowej na cefalosporyny i odwrotnie. Reakcje alergiczne na te substancje mogą mieć niekiedy poważny przebieg.
Osoby o znanej nadwrażliwości na penicyliny lub cefalosporyny, lub którym zalecono unikanie kontaktu z takimi produktami, nie powinny stosować tego produktu.
W celu uniknięcia ekspozycji, produktem należy posługiwać się ostrożnie stosując wszelkie zalecane środki ostrożności.
Jeżeli po kontakcie z produktem wystąpią objawy, takie jak wysypka na skórze, należy zwrócić się o pomoc lekarską pokazując lekarzowi niniejsze ostrzeżenie. Obrzęk twarzy, warg lub oczu lub trudności w oddychaniu są poważniejszymi objawami i wymagają udzielenia natychmiastowej pomocy lekarskiej.
Po użyciu chusteczek do dezynfekcji strzyków należy umyć ręce. Jeżeli podejrzewa się, lub występuje, podrażnienie skóry w wyniku kontaktu z alkoholem izopropylowym, należy stosować rękawiczki ochronne.
Bardzo rzadko mogą występować natychmiastowe reakcje nadwrażliwości.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Produkt leczniczy weterynaryjny jest przeznaczony do stosowania w okresie laktacji.
Badania laboratoryjne prowadzone na myszach, szczurach, królikach i chomikach nie wykazały działania teratogennego, toksycznego dla płodu czy organizmu matki.
Ze względu na fakt, że nie prowadzono specyficznych badań u gatunku docelowego, u zwierząt reprodukcyjnych oraz w ciąży, produkt należy stosować jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści do ryzyka.
Równoczesne stosowanie z antybiotykami o działaniu bakteriostatycznym może powodować wystąpienie działania antagonistycznego.
Równoczesne, parenteralne podawanie aminoglikozydów lub innych leków o działaniu nefrotoksycznym nie jest zalecane.
Zawartość jednej tubostrzykawki należy wprowadzić do każdej ćwiartki wymienia objętej procesem chorobowym przez kanał strzykowy bezpośrednio po udoju, co 12 godzin po 4 kolejnych udojach.
Każda tubostrzykawka zawiera 300 mg cefapiryny i 20 mg prednizolonu. Tubostrzykawka może być stosowana wyłącznie jednorazowo do jednego strzyku.
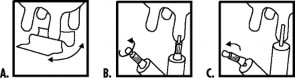
Przed podaniem należy dokładnie zdoić wymię. Strzyk i ujście kanału strzykowego należy dokładnie oczyścić i zdezynfekować przy użyciu załączonej chusteczki (A). Należy przedsięwziąć środki ostrożności, aby nie dopuścić do zanieczyszczenia końcówki tubostrzykawki. Odłamać końcówkę nasadki i wprowadzić ostrożnie 5 mm końcówki tubostrzykawki (B) lub usunąć całą nasadkę (C) i wprowadzić ostrożnie całą końcówkę tubostrzykawki do kanału strzykowego. Podać całą zawartość tubostrzykawki do ćwiartki wymienia. Rozprowadzić produkt przy pomocy delikatnego masażu strzyku i wymienia krowy dotkniętej schorzeniem.
Nieznane
Tkanki jadalne: 4 dni (96 godzin)
Mleko: 5,5 dnia (132 godziny)
Grupa farmakoterapeutyczna: Produkty przeciwbakteryjne do podawania dowymieniowego, produkty złożone zawierające leki przeciwbakteryjne i kortykosteroidy
Kod ATCvet: QJ51RV01
Cefapiryna jest cefalosporyną pierwszej generacji działającą przez hamowanie syntezy ściany komórkowej. Wykazuje działanie bakteriobójcze o mechanizmie zależnym od czasu, charakteryzuje się szerokim spektrum działania terapeutycznego.
In vitro wykazano działanie przeciw powszechnie występującym bakteriom Gram-dodatnim i Gram- ujemnym, w tym Escherichia coli, Staphylococcus aureus, gronkowce koagulazoujemne, Streptococcus dysgalactiae, Streptococcus agalactiae i Streptococcus uberis.
Poniższa tabela zawiera zestawienie wartości MIC50 i MIC90 dla powszechnie występujących patogenów bakteryjnych wywołujących mastitis, zebranych w przebiegu programu monitorowania oporności [program VetPath Europejskiego Centrum Badań Zdrowia Zwierząt (CEESA)], z wyjątkiem danych dotyczących Streptococcus agalactiae (które zostały zebrane w trakcie prowadzenia badań klinicznych w okresie 1984-2005):
Izolowany gatunek bakterii | N | MIC50 (µg/ml) | MIC90 (µg/ml) |
Staphylococcus aureus | 192 | 0,12 | 0,25 |
gronkowce koagulazoujemne | 165 | 0,12 | 0,25 |
Streptococcus uberis | 188 | 0,25 | 0,5 |
Streptococcus dysgalactiae | 95 | 0,06 | 0,06 |
Streptococcus agalactiae | 58 | 0,25 | 0,25 |
Escherichia coli | 207 | 16 | > 32 |
W okresie ostatnich 10 lat obserwowano jedynie wzrost wartości MIC90 dla E. coli.
Prednizolon wywiera działanie przeciwzapalne poprzez hamowanie wczesnych i późnych etapów zapalenia. Po podaniu dowymieniowym prednizolon prowadzi do ograniczenia obrzęku, a w konsekwencji do zmniejszenia ćwiartki wymienia objętej procesem chorobowym oraz przyczynia się do przywrócenia normalnej temperatury ciała zakażonych zwierząt.
Po dowymieniowym podaniu produktu, cefapiryna i prednizolon wydalane są głównie z mlekiem w trakcie udoju. Wchłanianie do krwiobiegu, zarówno cefapiryny, jak i prednizolonu, jest szybkie i ma ograniczony charakter. Wchłonięte frakcje cefapiryny oraz prednizolonu eliminowane są głównie z moczem.
Poniższa tabela zawiera zestawienie stężeń cefapiryny i prednizolonu występujących w mleku podczas trwania leczenia:
Substancja czynna | Średnie stężenie substancji czynnych w mleku, w kolejnych udojach od pierwszego podania produktu | ||||
0 | I udój | II udój | III udój | IV udój | |
cefapiryna (µg/ml) | 0 | 27,0 ± 6,2 | 30,2 ± 7,9 | 40,0 ± 8,8 | 34,6 ± 6,5 |
prednizolon (ng/ml) | 0 | 182,0 ± 61,7 | 100,8 ± 51,0 | 283,7 ± 129,8 | 101,5 ± 38,8 |
Glicerolu monostearynian Wapniowo-sodowy glinokrzemian Olej arachidowy oczyszczony
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 3 lata.
Przechowywać w temperaturze poniżej 25 ˚C.
Tubostrzykawki przechowywać w saszetkach aluminiowych i w zewnętrznym pudełku tekturowym.
Tubostrzykawka polietylenowa 10 ml składająca się z 3 elementów:
Tubostrzykawki umieszczone są w laminowanych saszetkach z folii aluminiowej.
Wielkość opakowań:
Pudełko zawierające 1 saszetkę z 4 tubostrzykawkami oraz 4 chusteczki do higieny strzyków.
Pudełko zawierające 1 saszetkę z 20 tubostrzykawkami oraz 20 chusteczek do higieny strzyków. Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Chusteczki do higieny strzyków:
Papierowe chusteczki do czyszczenia zwilżone roztworem 70% v/v alkoholu izopropylowego (2,4 ml/chusteczkę).
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Intervet International B.V. Wim de Körverstraat 35 NL-5831 AN BOXMEER
Holandia
1755/07
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 31/05/2007 Data przedłużenia pozwolenia: 21/11/2017
13/09/2022











