Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(-i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres (-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Fortamox, 500 mg/g, proszek do sporządzania roztworu doustnego dla kur, indyków, kaczek i świń
1 g proszku zawiera:
Substancja czynna:
Amoksycylina trójwodna 500 mg (co odpowiada 435 mg amoksycyliny)
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Proszek do sporządzania roztworu doustnego Proszek barwy białej.
Kura, indyk, kaczka, świnia
Kury: leczenie pasterelozy i kolibakteriozy. Indyki: leczenie pasterelozy.
Kaczki: leczenie infekcji wywołanych przez Streptococcus bovis, Pasteurella anatipestifer i
Escherichia coli.
Świnie: leczenie salmonelozy i pasterelozy wywołanej przez szczepy wrażliwe na amoksycylinę.
Nie stosować u zwierząt nadwrażliwych na penicyliny.
Nie stosować u królików, chomików, gerbili i świnek morskich.
Brak.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Użycie tego produktu powinno być poparte oceną wrażliwości drobnoustrojów. Odnotowano wysoką oporność E. coli izolowanych od brojlerów (powyżej 50%).
Nieprawidłowe stosowanie produktu może być przyczyną rozpowszechniania bakterii opornych na amoksycylinę i zmniejszania skuteczności leczenia innymi antybiotykami beta-laktamowymi na skutek oporności krzyżowej.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Unikać wdychania proszku. Umyć ręce po użyciu produktu. Penicyliny i cefalosporyny mogą powodować nadwrażliwość po wstrzyknięciu, wdychaniu, spożyciu oraz podczas kontaktu ze skórą.
Nadwrażliwość na penicyliny może prowadzić do wystąpienia reakcji krzyżowej z cefalosporynami i odwrotnie. Reakcja alergiczna na te substancje może być niekiedy bardzo niebezpieczna.
Unikać bezpośredniego kontaktu z produktem, szczególnie jeżeli jest się uczulonym na substancje w nim zawarte. Jeżeli wystąpiło niepożądane działanie po ekspozycji na produkt, takie jak
zaczerwienienie skóry, należy skontaktować się z lekarzem i pokazać mu załączoną ulotkę
informacyjną. Natomiast w przypadku pojawienia się objawów, takich jak obrzęk twarzy, ust i powiek oraz duszność, wymagana jest natychmiastowa pomoc lekarska.
Możliwe jest wystąpienie reakcji alergicznej oraz zaburzeń ze strony przewodu pokarmowego w postaci biegunki.
Badania laboratoryjne na szczurach nie wykazały działania teratogennego podczas stosowania amoksycyliny.
Produkt do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Neomycyna, erytromycyna, tetracykliny, jony metali i środki alkalizujące hamują wchłanianie amoksycyliny.
Fortamox należy podawać po rozpuszczeniu w wodzie do picia.
Kury: podawać w wodzie do picia w dawce 15 mg amoksycyliny trójwodnej na kg m.c. (co odpowiada 0,03 g produktu na kg m.c.). Produkt należy stosować co drugi dzień przez 3 dni (tj. 1 i 3 dnia leczenia), a w ciężkich przypadkach przez 5 dni (tj. 1, 3 i 5 dnia leczenia).
Kaczki: podawać w wodzie do picia w dawce 20 mg amoksycyliny trójwodnej na kg m.c.(co odpowiada 0,04 g produktu na kg m.c.). Produkt należy stosować co drugi dzień przez 3 dni (tj. 1 i 3 dnia leczenia).
Indyki: podawać w wodzie do picia w dawce 15–20 mg amoksycyliny trójwodnej na kg m.c. (co odpowiada 0,03–0,04 g produktu na kg m.c.). Produkt należy stosować przez 5 dni co drugi dzień (tj. 1, 3 i 5 dnia leczenia).
Świnie: podawać w wodzie do picia w dawce 20 mg amoksycyliny trójwodnej/kg m.c./dzień (co odpowiada 0,04 g produktu na kg m.c.). Zalecana dawka powinna zostać podzielona i podawana co 12 godzin przez 5 dni.
Stężenie leku w wodzie do picia powinno być przeliczone w zależności od ilości przyjmowanej wody oraz ciężaru ciała leczonych zwierząt.
W celu obliczenia stężenia leku w wodzie do picia można posłużyć się następującym wzorem:
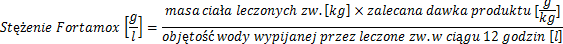
Roztwory wodne produktu przygotować bezpośrednio przed użyciem. Woda z lekiem powinna być zużyta w ciągu 12 godzin od rozpuszczenia leku. Po tym czasie woda z lekiem, która nie została wypita przez zwierzęta powinna zostać usunięta.
Podczas stosowania produktu, zwierzęta nie mogą mieć dostępu do innego źródła wody niż woda z lekiem.
Nie obserwowano. W przypadku wystąpienia objawów przedawkowania, należy prowadzić leczenie objawowe. Nie ma specyficznej odtrutki.
Tkanki jadalne:
Kury: 1 dzień
Indyki: 5 dni
Kaczki: 9 dni
Świnie: 2 dni
Produkt nie dopuszczony do stosowania u niosek produkujących jaja przeznaczone do spożycia przez ludzi.
Grupa farmakoterapeutyczna: Leki przeciwbakteryjne do stosowania ogólnego. Antybiotyki β- laktamowe, penicyliny o rozszerzonym spektrum.
Kod ATCvet: QJ01CA04
Mechanizm działania amoksycyliny polega na hamowaniu aktywności PBP (białek wiążących penicyliny), które są enzymami niezbędnymi do tworzenia wiązań poprzecznych pomiędzy
łańcuchami peptydoglikanu w ścianie komórek bakteryjnych. Działanie takie prowadzi do zmiany struktury ściany komórki bakteryjnej, co skutkuje zmianami przepuszczalności dla związków drobnocząsteczkowych i utratą możliwości funkcjonowania bakterii.
Amoksycylina po podaniu doustnym wchłania się szybko z przewodu pokarmowego. Czas
wchłaniania jest różny u poszczególnych gatunków zwierząt. U świń po podaniu doustnym Tmax wynosi 3,6 ± 1,5 godz., a Cmax wynosi 0,8 ± 0,3 µg/ml. Biodostępność wynosi 28 i 33%, odpowiednio dla świń karmionych i głodzonych. U drobiu po podaniu doustnym amoksycylina wchłania się bardzo szybko z przewodu pokarmowego, osiągając maksymalne stężenie po około 0,5–1 godz. Po podaniu amoksycyliny w dawce 10 mg/kg m.c. Cmax przekracza 3,5 µg/ml (osiągając niekiedy wartość 160 µg/ml). Biodostępność wynosi ponad 60%. We krwi amoksycylina w niewielkim stopniu wiąże się z białkami osocza. Stopień wiązania zależy od koncentracji leku i waha się od 1 do 15% (średnio 8%). Objętość dystrybucji u ptaków przekracza 1 l/kg m.c. Wysoką koncentrację amoksycylina uzyskuje w wątrobie, nerkach, ścianie jelit i żołądka gruczołowego. Eliminacja jest zmienna gatunkowo.
Biologiczny okres półtrwania w fazie eliminacji wynosi około 1 godz. (ale może również osiągać ponad 9 godz.). Amoksycylina wydalana jest z moczem. U ptaków metabolizowana jest w około 50%.
Laktoza jednowodna Sodu węglan bezwodny Sodu wodorowęglan
Nieznane.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata Okres ważności po pierwszym otwarciu opakowania bezpośredniego: 10 dni
Okres ważności po rekonstytucji zgodnie z instrukcją: 12 godzin
Przechowywać w temperaturze poniżej 25oC.
Pojemniki wykonane z HDPE z zamknięciem z LDPE. Wielkość opakowań: 50 g, 100 g, 1000 g.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
„Biofaktor” Sp. z o.o. ul. Czysta 4
96-100 Skierniewice
2060/11
/ DATA PRZEDŁUŻENIA POZWOLENIA
21.02.2011 /
ZAKAZ SPRZEDAŻY, DOSTAWY I/LUB STOSOWANIA, JEŻELI DOTYCZY
Nie dotyczy.











