Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(-i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Wpływ na środowisko
DANE FARMACEUTYCZNE:
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Foresto 4,50 g + 2,03 g obroża dla psów > 8 kg
Seresto 4.50 g + 2.03 g, collar for dogs > 8 kg [AT, BE, CY, DE, DK, EL, ES, FI, FR, IE, IS, IT, LU, NL, NO, PT, SE, UK]
Foresto 4.50 g + 2.03 g, collar for dogs > 8 kg [BG, CZ, EE, HU, LT, LV, RO, SK, SI]
Substancje czynne:
Jedna obroża o długości 70 cm (45 g) zawiera imidaklopryd w dawce 4,5 g oraz flumetrynę w dawce
2,03 g jako substancje czynne.
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Obroża.
Obroża w kolorze szarym, bezzapachowa.
Psy ( > 8 kg)
W celu leczenia i zapobiegania inwazji pcheł (Ctenocephalides felis,C. canis) przez okres 7 do 8 miesięcy. W celu ochrony bezpośredniego otoczenia zwierzęcia przed rozwojem larw pcheł przez 8 miesięcy.
Foresto może być stosowane jako element strategii zwalczania alergicznego pchlego zapalenia skóry (APZS).
Produkt wykazuje długotrwałą skuteczność roztoczobójczą (zabija kleszcze) w przypadku inwazji kleszczy (Ixodes ricinus, Rhipicephalus sanguineus, Dermacentor reticulatus) oraz odstraszającą (zapobiega żerowaniu) przy inwazji kleszczy (Ixodes ricinus, Rhipicephalus sanguineus) przez okres 8 miesięcy. Produkt wykazuje skuteczne działanie przeciwko larwom, nimfom i dorosłym osobnikom kleszczy.
W przypadku uprzedniego występowania kleszczy u psa przed rozpoczęciem leczenia, założenie obroży może nie spowodować śmierci pajęczaków w ciągu 48 godzin; kleszcze mogą pozostać wczepione i widoczne. Dlatego też zaleca się usunięcie kleszczy występujących już na zwierzęciu w momencie zakładania obroży. Działanie zapobiegające inwazji nowych kleszczy rozpoczyna się w ciągu 2 dni po założeniu obroży.
Produkt zapewnia pośrednią ochronę przed przeniesieniem patogenów Babesia canis vogeli oraz Ehrlichia canis przez gatunek kleszcza Rhipicephalus sanguineus tym samym redukuje ryzyko babeszjozy oraz erlichiozy psów przez okres 7 miesięcy.
Ograniczenie ryzyka zarażenia pierwotniakami Leishmania infantum przenoszonymi przez muchówki
Phlebotomus (muchy piaskowe), przez okres do 8 miesięcy.
W celu leczenia inwazji wszołów (Trichodectes canis).
Nie stosować u szczeniąt w wieku poniżej 7 tygodni.
Nie stosować w przypadku nadwrażliwości na substancje czynne lub na dowolną substancję
pomocniczą.
Ogółem, w ciągu 24 do 48 godzin po inwazji produkt spowoduje śmierć kleszczy i ich odpadanie od żywiciela, bez możliwości uprzedniego pożywienia się krwią. Nie można wykluczyć ryzyka wczepienia się pojedynczych kleszczy po zastosowaniu leczenia. Dlatego też nie można całkowicie wykluczyć ryzyka przenoszenia chorób zakaźnych przez kleszcze, w przypadku wystąpienia niekorzystnych warunków.
Mimo że wykazano u psów znaczące zmniejszenie częstotliwości występowania Leishmania infantum, produkt wykazuje zmienną skuteczność odstraszania (zapobiegania żerowaniu) oraz skuteczność owadobójczą wobec much piaskowych Phlebotomus perniciosus. W związku z tym mogą się zdarzać ukąszenia przez muchy piaskowe i nie można całkowicie wykluczyć ryzyka przeniesienia Leishmania infantum. Obroża powinna być założona tuż przed rozpoczęciem sezonu aktywności much piaskowych (wektorów zarażenia), odpowiadającemu okresowi transmisji Leishmania infantum oraz noszona w sposób ciągły przez cały ten okres ryzyka.
Najlepiej, gdy obroża jest zakładana przed początkiem sezonu występowania pcheł lub kleszczy.
Tak jak w przypadku wszystkich produktów do długotrwałego stosowania miejscowego, okresy nadmiernego sezonowego zrzucania sierści mogą prowadzić do tymczasowego niewielkiego zmniejszenia skuteczności leczenia w wyniku utraty tej części dawki substancji czynnych, która została rozprowadzona na sierści. Uzupełnienie dawki substancji czynnych z obroży rozpoczyna się natychmiast, dzięki czemu pełna skuteczność zostaje ponownie osiągnięta bez konieczności stosowania dodatkowego leczenia lub wymiany obroży.
Dla uzyskania optymalnego efektu eliminacji pcheł przy silnej inwazji w pomieszczeniach domowych, może być konieczne zastosowanie w środowisku odpowiedniego produktu owadobójczego.
Produkt jest wodoodporny; jego skuteczność pozostaje niezmieniona w przypadku zmoczenia zwierzęcia. Jednakże, należy unikać długotrwałej, intensywnej ekspozycji na działanie wody lub nadmiernego stosowania szamponu, gdyż może to spowodować skrócenie czasu działania produktu. Badania wykazują, że comiesięczne mycie szamponem lub zanurzanie w wodzie nie powoduje znaczącego skrócenia 8-miesięcznego okresu skuteczności przeciwkleszczowej po rozprzestrzenieniu się substancji czynnej w okrywie włosowej, podczas gdy skuteczność przeciwpchelna produktu stopniowo ulega zmniejszeniu, począwszy od 5 miesiąca.
Wpływ mycia szamponem lub zanurzania się w wodzie na przeniesienie leiszmaniozy nie był badany.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Nie dotyczy
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Torebkę zawierającą obrożę należy przechowywać w opakowaniu zewnętrznym do momentu zastosowania produktu.
Tak jak w przypadku wszystkich produktów leczniczych weterynaryjnych, należy uniemożliwić małym dzieciom zabawę obrożą oraz wkładanie jej do ust. Nie powinno się zezwalać zwierzętom noszącym obrożę na spanie w tym samym łóżku co właściciele, a zwłaszcza dzieci.
Podczas noszenia obroży imidaklopryd i flumetryna są uwalniane z obroży w sposób ciągły na powierzchnię skóry i sierści.
U niektórych ludzi produkt może wywołać reakcję nadwrażliwości.
Osoby, u których występuje nadwrażliwość (alergia) na składniki obroży powinny unikać kontaktu
z tym produktem leczniczym weterynaryjnym.
W bardzo rzadkich przypadkach u niektórych osób produkt może powodować podrażnienie skóry, oczu i dróg oddechowych.
W przypadku podrażnienia oczu, dokładnie przepłukać oczy zimną wodą. W przypadku podrażnienia skóry, umyć skórę mydłem i zimną wodą.
Jeśli objawy się utrzymują należy zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Należy natychmiast usunąć pozostałości lub odcięte fragmenty obroży (patrz punkt 4.9).
Po założeniu obroży należy umyć ręce zimną wodą.
W rzadkich przypadkach w ciągu pierwszych kilku dni po założeniu obroży może wystąpić zmiana w zachowaniu polegająca na ukrywaniu się, wokalizacji, nadpobudliwości, nadmiernym lizaniu i/ lub pielęgnacji, drapaniu miejsca aplikacji, u zwierząt, które nie są przyzwyczajone do noszenia obroży. W bardzo rzadkich przypadkach zgłaszano agresję po założeniu obroży. Należy upewnić się, że obroża została założona prawidłowo.
Mogą wystąpić reakcje w miejscu podania takie jak świąd, rumień oraz utrata sierści. Reakcje te są zgłaszane jako rzadkie i zazwyczaj ustępują w ciągu 1 do 2 tygodni. W pojedynczych przypadkach może być zalecane tymczasowe zdjęcie obroży do momentu ustąpienia objawów.
W bardzo rzadkich przypadkach, mogą wystąpić takie reakcje w miejscu podania jak zapalenie skóry, egzema, uszkodzenie skóry oraz krwawienie i w takiej sytuacji zalecane jest zdjęcie obroży.
W rzadkich przypadkach u psów mogą wystąpić objawy neurologiczne takie jak ataksja, konwulsje i drgawki. W takich przypadkach zalecane jest zdjęcie obroży.
Również w rzadkich przypadkach u psów, mogą początkowo wystąpić lekkie i przemijające objawy takie jak osowiałość, zmiana apetytu, ślinienie, wymioty i biegunka.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Badania laboratoryjne dotyczące flumetryny lub imidakloprydu przeprowadzone na szczurach
i królikach nie wykazały żadnego szkodliwego działania na płodność lub zdolności rozrodcze, jak również nie wykazały żadnych działań teratogennych lub toksycznych dla płodu. Jednakże, nie określono bezpieczeństwa stosowania omawianego produktu leczniczego weterynaryjnego u docelowego gatunku zwierząt w okresie ciąży i laktacji. Dlatego też, w związku z brakiem danych na ten temat, nie zaleca się stosowania produktu u suk w ciąży i w okresie laktacji.
Nieznane
Podanie na skórę. Jedna obroża do założenia na szyję zwierzęcia.
U psów o masie ciała powyżej 8 kg należy zastosować jedną obrożę o długości 70 cm.
U małych psów o masie ciała do 8 kg należy zastosować jedną obrożę dla psów o masie ciała ≤ 8 kg o
długości 38 cm.
Wyłącznie do użytku zewnętrznego.
Należy wyjąć obrożę z torebki ochronnej bezpośrednio przed zastosowaniem. Należy rozwinąć obrożę i upewnić się, że na jej wewnętrznej stronie nie ma żadnych pozostałości plastikowych łączeń. Należy założyć obrożę na szyję zwierzęcia i dostosować jej długość nie zaciskając zbyt mocno (wskazówka: powinno być możliwe wsunięcie dwóch palców pomiędzy obrożę a szyję zwierzęcia). Należy przeciągnąć wolną końcówkę obroży przez szlufkę i odciąć niepotrzebny odcinek na długości 2 cm.
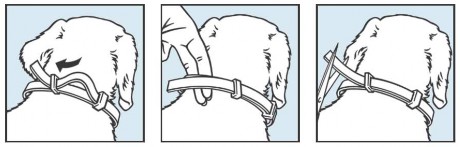
Zwierzę powinno nosić obrożę nieprzerwanie w celu zapewnienia 8-miesięcznego okresu ochrony. Obrożę należy zdjąć po upływie okresu leczenia. Należy okresowo sprawdzać i dostosowywać zamocowanie obroży, jeżeli będzie to konieczne, w szczególności w okresie szybkiego rozwoju szczeniąt.
Charakter produktu sprawia, że prawdopodobieństwo przedawkowania jest niewielkie i nie oczekuje się wystąpienia objawów przedawkowania.
Zbadano przedawkowanie produktu w wyniku założenia 5 obroży u dorosłych psów na okres 8 miesięcy oraz u 7-tygodniowych szczeniąt na okres 6 miesięcy i nie stwierdzono żadnych działań niepożądanych z wyjątkiem niewielkiej utraty sierści i łagodnych reakcji skórnych.
W przypadku zjedzenia obroży przez zwierzę (choć wystąpienie takiego zdarzenia jest mało prawdopodobne), mogą wystąpić objawy żołądkowo-jelitowe o łagodnym stopniu nasilenia (np. luźne stolce).
Nie dotyczy
Grupa farmakoterapeutyczna: leki przeciwko pasożytom zewnętrznym, produkty owadobójcze i repelenty, pyretryny i pyretroidy. Produkty skojarzone zawierające flumetrynę
Kod ATCvet: QP53AC55
Imidaklopryd jest insektycydem, należącym do grupy związków o nazwie chloronikotynyle. Ze względu na właściwości chemiczne związek ten można sklasyfikować jako nitroguanidynę chloronikotynylu. Imidaklopryd wykazuje aktywne działanie przeciwko larwom pcheł we wszystkich stadiach rozwoju, jak również przeciwko dorosłym osobnikom pcheł oraz wszy i wszołów.
Aktywność przeciwko pchłom (Ctenocephalides felis oraz Ctenocephalides canis) rozpoczyna się w ciągu 48 godzin po założeniu obroży.
Oprócz wskazań leczniczych wymienionych w punkcie 4.2 stwierdzono, że produkt wykazuje działanie przeciwko pchłom z gatunku Pulex irritans.
Imidaklopryd charakteryzuje się wysokim powinowactwem do nikotynergicznych receptorów acetylocholiny w postsynaptycznym obszarze ośrodkowego układu nerwowego (OUN) pchły. Następujące w konsekwencji zahamowanie przewodnictwa cholinergicznego u owadów prowadzi do ich paraliżu i śmierci. Z powodu słabej interakcji z nikotynergicznymi receptorami u ssaków oraz postulowanego niewielkiego stopnia przenikania substancji czynnej przez barierę krew-mózg u ssaków, produkt nie wykazuje praktycznie żadnego wpływu na OUN u ssaków. Imidaklopryd wykazuje minimalną aktywność farmakologiczną u ssaków.
Flumetryna jest akarycydem, należącym do grupy syntetycznych pyretroidów. Zgodnie ze stanem obecnej wiedzy, syntetyczne pyretroidy zakłócają działanie kanałów sodowych błony komórkowej neuronu, prowadząc do opóźnienia repolaryzacji neuronu i w konsekwencji – śmierci pasożyta. W badaniach dotyczących zależności pomiędzy budową a aktywnością związku chemicznego zaobserwowano kilka przypadków zakłócenia przez pyretroidy aktywności receptorów o określonej strukturze chiralnej, powodujących w konsekwencji wybiórcze działanie tych produktów na ektopasożyty. W przypadku omawianej grupy związków chemicznych nie zaobserwowano działania przeciwcholinesterazowego. Flumetryna jest odpowiedzialna za roztoczobójcze właściwości omawianego produktu leczniczego weterynaryjnego oraz zapobiega produkcji zapłodnionych jaj poprzez działanie bójcze na samice kleszczy. W przeprowadzonych badaniach in-vitro od 5 do 10% kleszczy gatunku Rhipicephalus sanguineus eksponowanych na działanie subletalnych dawek flumetryny 4 mg/l, składało jaja o zmienionym wyglądzie (pomarszczone, matowe i suche) co wskazuje na istnienie efektu sterylizującego.
Oprócz gatunków kleszczy wymienionych w punkcie 4.2 stwierdzono, że produkt wykazuje działanie przeciwko kleszczom z gatunku Ixodes hexagonus i I. scapularis oraz przeciwko niewystępującemu w Europie gatunkowi kleszcza Dermacentor variabilis i australijskiemu gatunkowi kleszcza I. holocyclus, który powoduje paraliż.
Produkt wykazuje działanie odstraszające (zapobiegające żerowaniu) w przypadku wymienionych kleszczy, uniemożliwiając pasożytom żywienie się krwią, co w konsekwencji pośrednio pomaga zmniejszyć ryzyko transmisji chorób psów przenoszonych przez wektory.
Oprócz patogenów wymienionych w sekcji 4.2, w pojedynczym badaniu laboratoryjnym, w 28 dniu od podania wykazano pośrednie działanie ochronne przed przeniesieniem Babesia canis canis (przenoszona przez gatunek kleszcza Dermacentor reticulatus), a także w pojedynczym badaniu laboratoryjnym, po 2 miesiącach od podania wykazano pośrednie działanie ochronne przeciwko przeniesieniu Anaplasma phagocytophilum (przez kleszcza Ixodes ricinus) i tym samym zmniejszenie ryzyka chorób powodowanych przez te patogeny w warunkach powyższych badań.
Dane uzyskane z badań skuteczności w stosunku do much piaskowych (Phlebotomus perniciosus) wykazały zmienną skuteczność odstraszania (zapobiegania żerowaniu) much piaskowych wynoszącą od 65 do 89% przez okres 7-8 miesięcy od założenia obroży. Dane uzyskane z trzech badań klinicznych przeprowadzonych na terenach endemicznych wykazały znaczącą redukcję ryzyka przeniesienia Leishmania infantum przez muchy piaskowe u psów leczonych w porównaniu z grupą nieleczoną. Zależnie od stopnia nasilenia inwazji much piaskowych, efektywność ograniczenia ryzyka zarażenia leiszmaniozą utrzymuje się na poziomie od 88,3 do 100%.
Stosowanie obroży spowodowało zmniejszenie stopnia inwazji świerzbowca ludzkiego Sarcoptes scabiei u uprzednio zarażonych psów, prowadząc następnie do całkowitego wyleczenia po trzech miesiącach.
Obydwie substancje czynne są w sposób powolny i ciągły uwalniane z macierzy polimerowej obroży na skórę zwierzęcia. Obydwie substancje są obecne w sierści psa w stężeniach zapewniających
roztoczobójcze/owadobójcze działanie przez cały okres skuteczności produktu. Substancje czynne ulegają rozprowadzeniu z miejsca bezpośredniego kontaktu produktu ze skórą na całą powierzchnię skóry zwierzęcia. Badania dotyczące przedawkowania i oceniające parametry kinetyczne w surowicy krwi w docelowej grupie zwierząt wykazały, że imidaklopryd pojawiał się w krążeniu ustrojowym jedynie krótkotrwale, podczas gdy flumetryna była głównie niemierzalna. Wchłanianie doustne nie ma znaczenia dla skuteczności klinicznej.
Patrz punkt 6.6.
Tytanu dwutlenek (E 171) Żelaza tlenek czarny (E 172) Di-n-butylu adypinian
Glikolu propylenowego dikaprylokapronian Olej sojowy epoksydowany
Kwas stearynowy Winylu polichlorek
Nieznane
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 5 lat
Brak specjalnych środków ostrożności dotyczących przechowywania.
Pudełko zawierające jedną lub dwie obroże o długości 70 cm, wykonane z poli(chlorku winylu) i pakowane pojedynczo w torebki z PETP/PE.
Pudełko tekturowe zawierające dwanaście obroży o długości 70 cm, wykonanych z poli(chlorku winylu) i pakowanych pojedynczo w torebki z PETP/PE.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
weterynaryjnego lub pochodzących z niego odpadów
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Produkt ten nie powinien się przedostawać do cieków wodnych, ponieważ może być niebezpieczny dla ryb i innych organizmów wodnych.
Bayer Animal Health GmbH
Kaiser Wilhelm Allee 50, 51373 Leverkusen Niemcy
2140/11
OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
03/10/2011
13/09/2017
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB STOSOWANIA
Nie dotyczy











