Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO
Amflee 402 mg roztwór do nakrapiania dla psów
1 pipetka (4,02 ml) zawiera:
Substancja czynna:
Fipronil 402 mg
Substancje pomocnicze:
Butylohydroksyanizol (E320) 0,80 mg
Butylohydroksytoluen (E321) 0,40 mg
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Roztwór do nakrapiania Roztwór o barwie jasnożółtej.
Psy
Leczenie i zapobieganie inwazji pcheł (Ctenocephalides spp.), kleszczy (Rhipicephalus spp.,
Dermacentor spp., Ixodes spp.) i wszołów (Trichodectes canis) u psów.
Produkt wykazuje trwałe działanie insektobójcze przez okres do 2 miesięcy wobec pcheł i działanie bójcze do 4 tygodni wobec kleszczy.
Produkt może być stosowany jako element strategii leczenia alergicznego pchlego zapalenia skóry (APZS), o ile zostało ono wcześniej rozpoznane przez lekarza weterynarii.
Ze względu na brak dostępnych danych produktu nie należy stosować u szczeniąt w wieku poniżej 8 tygodni lub ważących mniej niż 2 kg.
Nie stosować produktu u zwierząt chorych (cierpiących na choroby ogólne, gorączkę) lub u zwierząt w okresie rekonwalescencji.
Nie stosować produktu u królików ze względu na ryzyko wystąpienia działań niepożądanych, a nawet zgonu.
Nie stosować produktu u kotów ze względu na ryzyko przedawkowania.
Nie stosować u zwierząt z nadwrażliwością na substancję czynną lub na dowolną substancję pomocniczą.
Przed użyciem produktu należy usunąć ze zwierzęcia kleszcze w celu zmniejszenia ryzyka przeniesienia chorób.
Ze względu na brak danych dotyczących skuteczności produktu po kąpieli/umyciu zwierzęcia szamponem, nie należy kąpać zwierzęcia 2 dni po podaniu produktu i częściej niż raz w tygodniu. Przed zastosowaniem produktu można użyć szamponu zmiękczającego, jednak
cotygodniowe stosowanie go po podaniu produktu skraca czas trwania ochrony przed pchłami do około 5 tygodni.
W trwającym 6 tygodni badaniu kąpiel zwierzęcia raz w tygodniu z użyciem szamponu
leczniczego zawierającego 2% chloroheksydynę nie miała wpływu na skuteczność produktu przeciwko pchłom.
Pomimo podania produktu możliwe jest zagnieżdżanie się pojedynczych kleszczy, zatem nie można całkowicie wykluczyć ryzyka transmisji chorób zakaźnych w niekorzystnych
warunkach. Zakłada się, że kleszcze zostaną zabite i odpadną z gospodarza w ciągu 24 do 48 godzin po inwazji, z powodu braku dostępu do jego krwi jako pokarmu. Zagnieżdżenie pojedynczych kleszczy po zastosowaniu produktu nie może być wykluczone.
Pchły atakujące zwierzęta występują także w legowiskach oraz miejscach, w których często przebywają, takich jak dywany oraz miękka tapicerka, które w przypadkach masowej inwazji oraz na początku działań kontrolnych powinny być również poddawane działaniu
odpowiednich preparatów owadobójczych i regularnie odkurzane za pomocą odkurzacza.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Chronić oczy zwierzęcia przed kontaktem z produktem.
Bardzo ważne jest, by podać produkt w miejscu, z którego zwierzę nie może go zlizać, oraz nie dopuścić do wylizywania go przez inne zwierzęta, z którymi przebywa.
Psy nie powinny pływać w ciekach wodnych przez 2 dni po podaniu produktu (patrz punkt 6.6).
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Produkt może wywołać podrażnienie błon śluzowych i oczu. Należy chronić usta i oczy przed kontaktem z produktem.
Osoby o znanej nadwrażliwości na środki owadobójcze lub alkohol powinny unikać kontaktu z produktem leczniczym weterynaryjnym. Należy unikać bezpośredniego kontaktu produktu z dłońmi. W przypadku, gdy taki kontakt miał miejsce, należy umyć dłonie wodą i mydłem.
Jeśli dojdzie do przypadkowego kontaktu produktu z oczami, należy przepłukać je bieżącą wodą.
Po podaniu produktu należy umyć ręce.
Należy unikać dotykania leczonych zwierząt i nie należy zezwalać dzieciom na zabawę z nimi, aż do momentu wyschnięcia miejsca zastosowania produktu. Dlatego też zaleca się podanie produktu zwierzęciu w godzinach wieczornych. Wkrótce po zabiegu zwierzęta nie powinny spać z właścicielami, a w szczególności z dziećmi.
Podczas podawania produktu nie należy palić, pić ani jeść.
Jeżeli dojdzie do zlizania produktu może pojawić się krótkotrwałe ślinienie wywołane działaniem nośnika. Bardzo rzadko obserwowano również przejściowe reakcje skórne w miejscu podania (odbarwienie skóry i utrata sierści, świąd, zaczerwienienie skóry) oraz
uogólniony świąd i wyłysienia. Czasami obserwowano nadmierne ślinienie się, odwracalne objawy neurologiczne (przeczulica, depresja, nerwowość) lub wymioty.
Należy unikać przedawkowania.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Bezpieczeństwo produktu zostało zbadane u suk hodowlanych i ciężarnych oraz suk w okresie laktacji, którym podano dawkę trzykrotnie większą od zalecanej. Produkt może być podawany hodowlanym i ciężarnym sukom oraz sukom w okresie laktacji.
Nieznane.
Dawkowanie:
Jedna pipetka jednodawkowa zawierająca 4,02 ml roztworu do nakrapiania na psa o masie powyżej 40 kg.
W ten sposób podana zostanie minimalna zalecana dawka fipronilu wynosząca 6,7 mg/kg.
Ze względu na brak odpowiednich badań dotyczących bezpieczeństwa minimalny okres pomiędzy kolejnymi zabiegami wynosi 4 tygodnie.
Zaleca się comiesięczne podawanie produktu w przypadku wysokiego ryzyka powtarzających się inwazji pcheł, jeżeli pies jest uczulony na ukąszenia pcheł oraz w przypadku koniecznej kontroli inwazji kleszczy lub częstych kąpieli psa z użyciem szamponów hipoalergicznych lub zmiękczających. W obszarach, w których nie istnieje poważne zagrożenie inwazją pcheł i
kleszczy, produkt może być podawany co drugi lub trzeci miesiąc. Droga podawania: Podanie przez nakrapianie.
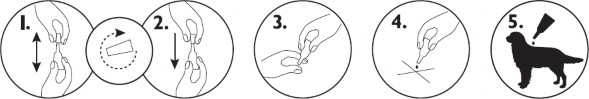
Sposób podawania:
Należy wyjąć pipetkę jednodawkową z opakowania. Trzymając pipetkę w pozycji pionowej, odkręcić i zdjąć końcówkę. Odwrócić końcówkę i umieścić drugim końcem na pipetce.
Nacisnąć i przekręcić końcówkę, aby przebić zamknięcie, po czym zdjąć ją z pipetki.
Odgarnąć sierść zwierzęcia na grzbiecie pomiędzy łopatkami tak, aby widoczna była skóra. Przyłożyć koniec pipetki do skóry i kilkukrotnie ścisnąć, w celu wyciśnięcia jej zawartości bezpośrednio na skórę.
Badania laboratoryjne dotyczące bezpieczeństwa produktu u gatunków docelowych,
prowadzone na szczeniętach w wieku 8 tygodni i psach w okresie wzrostu o masie ciała 2 kg, którym podano dawkę pięciokrotnie większą od zalecanej, nie wykazały żadnych działań
niepożądanych. Jednakże ryzyko wystąpienia działań niepożądanych wzrasta w przypadku przedawkowania (patrz punkt 4.6), dlatego też należy zastosować pipetę jednodawkową o odpowiedniej wielkości, w zależności od masy ciała zwierzęcia.
Nie dotyczy.
Grupa farmakoterapeutyczna: Środki do zwalczania pasożytów zewnętrznych, do podania miejscowego
Kod ATC vet: QP53AX15
Fipronil jest środkiem owadobójczym/roztoczobójczym należącym do grupy fenylopirazoli. Niszczy on stawonogi poprzez interakcję z ligandami kanałów chlorkowych, zwłaszcza tymi regulowanymi przez neurotransmiter kwasu gamma aminomasłowego (GABA). Blokuje w ten sposób pre- i postsynaptyczny transfer jonów chlorowych przez błony komórkowe, czego wynikiem jest niekontrolowana aktywność ośrodkowego układu nerwowego i śmierć owadów lub roztoczy.
Produkt ten zawiera substancję czynną fipronil, która posiada unikalny mechanizm działania przeciwko pchłom i kleszczom. Gromadzi się ona w lipidowej strukturze skóry i mieszkach włosowych, skąd jest sukcesywnie wydzielana na powierzchnię skóry i sierści, co zapewnia długoterminowe działanie produktu.
Po miejscowym zastosowaniu produktu u psów, fipronil jest wchłaniany w stopniu
umiarkowanym (około 15%). U psów obserwowano zmienne stężenia fipronilu w surowicy. Po podaniu produktu, fipronil rozprzestrzenia się za pośrednictwem gradientu stężeń w skórze i sierści zwierząt od miejsca podania do obszarów peryferyjnych (lędźwiowych, bocznych, itd.)
U psów głównym produktem przemiany fipronilu jest jego sulfon (RM 1602), który również wywiera działanie owadobójcze i roztoczobójcze.
U psów stężenie fipronilu w sierści maleje do około 3 – 4 µg/g w okresie 56 dni po podaniu.
Butylohydroksytoluen (E321) Butylohydroksyanizol (E320) Etanol 96%
Polisorbat 80 Powidon K25
Glikolu dietylowego monoetylowy eter
Nieznane.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 3 lata.
Przechowywać w opakowaniu oryginalnym w celu ochrony przed światłem.
Brak szczególnych środków ostrożności dotyczących temperatury przechowywania produktu leczniczego weterynaryjnego.
Pipetka (PP), zamknięcie z przebijakiem (PE lub POM): pipetki jednodawkowe zawierające 4,02 ml roztworu do nakrapiania w trójwarstwowej saszetce (PETP/Al/LDPE).
Pudełko tekturowe zawiera 1, 3, 6, 10 lub 20 pipetek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Produkt Amflee roztwór do nakrapiania dla psów nie powinien się przedostawać do cieków wodnych, ponieważ może być niebezpieczny dla ryb i innych organizmów wodnych.
KRKA, d.d., Novo mesto Šmarješka cesta 6
8501 Novo mesto Słowenia
2333/14
31.01.2014 r.











