Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- Pojemnik (o pojemności 2,5 litra lub 5 litrów)
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
zbyt częste i wielokrotne stosowanie leków przeciwrobaczych z tej samej grupy farmakologicznej w dłuższym okresie czasu;
podawanie zbyt niskich dawek, które może wynikać z niedoszacowania masy ciała, nieprawidłowego podania produktu lub braku kalibracji urządzenia dozującego (jeśli dotyczy).
Podejrzenia przypadków klinicznych oporności na leki przeciwrobacze wymagają dokładniejszego zbadania przy użyciu odpowiednich testów (np. testu redukcji liczby wydalanych jaj w kale). Jeśli wyniki tych testów potwierdzają występowanie oporności, należy zastosować lek przeciwrobaczy z innej grupy farmakologicznej i o innym mechanizmie działania.
Dotychczas nie stwierdzono przypadków oporności na eprynomektynę (lakton makrocykliczny) u bydła w obrębie Unii Europejskiej. Obserwowano jednak oporność na inne laktony makrocykliczne u gatunków będących pasożytami bydła w obrębie Unii Europejskiej. Stosowanie tego produktu powinno być oparte na krajowych (lokalnych, z gospodarstwa) danych epidemiologicznych dotyczących wrażliwości nicieni oraz na zaleceniach dotyczących sposobów ograniczania dalszej selekcji w kierunku oporności na leki przeciwrobacze.
Jeśli istnieje ryzyko ponownego zakażenia, należy zasięgnąć porady lekarza weterynarii co do potrzeby i częstotliwości kolejnych podań.
Aby uzyskać najlepsze wyniki, stosowanie produktu powinno być częścią programu zwalczania wewnętrznych i zewnętrznych pasożytów bydła, opartego o epidemiologię tych pasożytów.
Specjalne środki ostrożności dotyczące stosowania
specjalne środki ostrożności dotyczące stosowania u zwierząt
Wyłącznie do stosowania zewnętrznego.
Aby uniknąć działań niepożądanych związanych z obumieraniem larw gzów w przełyku lub kanale kręgowym, zaleca się podawanie produktu po zakończeniu wylęgania się larw gzów bydlęcych z jaj i w okresie poprzedzającym dotarcie larw do miejsc docelowych w organizmie. W celu określenia prawidłowego momentu podania produktu należy skontaktować się z lekarzem weterynarii.
Dla zapewnienia skuteczności produktu nie należy go stosować na okolice zadu zanieczyszczone błotem lub obornikiem. Produkt należy stosować wyłącznie na zdrową skórę.
specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Ten produkt może być drażniący dla skóry i oczu oraz może powodować nadwrażliwość (reakcje alergiczne).
Unikać bezpośredniego kontaktu produktu ze skórą lub oczami podczas stosowania produktu i podczas kontaktu z niedawno leczonymi zwierzętami.
Osoby ze stwierdzoną nadwrażliwością na eprynomektynę powinny unikać kontaktu z produktem. Osoby stosując produkt powinny nosić gumowe rękawice, obuwie i wodoodporny płaszcz.
W razie przypadkowego kontaktu produktu ze skórą, miejsce to należy niezwłocznie zmyć wodą z mydłem. Jeśli produkt dostanie się przypadkowo do oka, należy je natychmiast przepłukać wodą.
Odzież zanieczyszczoną produktem możliwie szybko zdjąć i uprać przed ponownym użyciem. Ten produkt może oddziaływać na centralny układ nerwowy, jeśli zostanie połknięty. Unikaj przypadkowego połknięcia produktu, w tym poprzez kontakt rąk z ustami.
W razie połknięcia produktu przepłukać usta wodą i niezwłocznie zwrócić się o pomoc lekarską. Umyć ręce po zastosowaniu produktu.
Nie palić, nie jeść i nie pić podczas podawania produktu.
inne środki ostrożności
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Pojemnik (o pojemności 2,5 litra lub 5 litrów)
FlexiBag (2,5-litrowy, 4,5-litrowy lub 8-litrowy miękki worek)
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
Wpływ na środowisko
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
1-litrowe białe nieprzezroczyste butelki z HDPE, z zabezpieczającym kapslem aluminiowym, zakrętką z HDPE i dawkomierzem z PP wyposażonym w komorę odmierzającą dawki wyskalowaną co 5 ml do 60 ml;
2,5- i 5-litrowe białe nieprzezroczyste pojemniki z HDPE, z zabezpieczającym kapslem aluminiowym, zakrętką z PP i zakrętką z PP z półprzepuszczalną membraną i łącznikiem;
2,5-litrowe, 4,5-litrowe i 8-litrowe wielowarstwowe, miękkie worki z PET/aluminium/PA/PE, z zakrętką z PP i z łącznikiem typu POM “E-lock”.
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Neoprinil Pour-On 5 mg/ml roztwór do polewania dla bydła
1 ml roztworu zawiera:
Substancja czynna:
Eprynomektyna 5,00 mg
Substancje pomocnicze:
Butylohydroksytoluen (E321) 0,10 mg All-rac-alfa-tokoferol (E307) 0,06 mg
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Roztwór do polewania
Żółtawy, przezroczysty, oleisty roztwór.
Bydło
Bydło mięsne i mleczne:
Leczenie inwazji następujących pasożytów wrażliwych na eprynomektynę:
Nicienie żołądkowo-jelitowe (postacie dojrzałe i larwy L4): Ostertagia ostertagi (w tym larwy drzemiące – L4), Ostertagia lyrata (wyłącznie postacie dojrzałe), Haemonchus placei, Trichostrongylus axei, Trichostrongylus colubriformis, Cooperia sp. (w tym larwy drzemiące – L4), Cooperia oncophora, Cooperia punctata, Cooperia pectinata, Cooperia surnabada, Bunostomum phlebotomum, Nematodirus helvetianus, Oesophagostomum radiatum, Oesophagostomum sp. (wyłącznie postacie dojrzałe), Trichuris discolor (wyłącznie postacie dojrzałe);
Nicienie płucne: Dictyocaulus viviparus (postacie dojrzałe i L4);
Gzy bydlęce (stadia pasożytnicze): Hypoderma bovis, Hypoderma lineatum;
Świerzbowce: Chorioptes bovis, Sarcoptes scabiei var. Bovis;
Wszy: Linognathus vituli, Haematopinus eurysternus, Solenopotes capillatus; Wszoły: Damalinia bovis;
Muchy: Haematobia irritans.
Produkt chroni zwierzęta przed reinwazją następujących pasożytów:
- Nematodirus helvetianus przez 14 dni.
- Trichostrongylus axei i Haemonchus placei przez 21 dni.
- Dictyocaulus viviparus, Cooperia oncophora, Cooperia punctata, Cooperia surnabada, Oesophagostomum radiatum i Ostertagia ostertagi przez 28 dni.
Nie stosować u gatunków innych niż wymienione w punkcie 4.1 i 4.2. Nie podawać doustnie czy we wstrzyknięciu.
Nie stosować u zwierząt ze stwierdzoną nadwrażliwością na substancję czynną lub na dowolną substancję pomocniczą.
Awermektyny mogą nie być dobrze tolerowane u gatunków niebędących gatunkami docelowymi
(w tym psy, koty i konie). Zejścia śmiertelne odnotowano u psów, szczególnie u owczarka szkockiego Collie, owczarka staroangielskiego, u ras pokrewnych i mieszańców tych ras, a także u żółwi wodnych i lądowych.
Należy dołożyć wszelkich starań, aby unikać opisanego poniżej postępowania, ponieważ zwiększa ono ryzyko rozwoju oporności i może ostatecznie doprowadzić do nieskuteczności leczenia:
Eprynomektyna jest wysoce toksyczna dla organizmów wodnych, długotrwale utrzymuje się w glebie oraz może kumulować się w osadach. Kał zawierający eprynomektynę i wydalany na pastwisko przez leczone zwierzęta może czasowo zmniejszyć dużą ilość organizmów bytujących na pastwisku i żywiących się odchodami. Po leczeniu bydła tym produktem, różne ilości eprynomektyny, które są potencjalnie toksyczne dla much żywiących się odchodami, mogą być wydalane przez okres dłuższy niż 4 tygodnie i mogą zmniejszać w tym okresie ilość much żywiących się odchodami. W przypadku wielokrotnego stosowania eprynomektyny (i produktów należących do tej samej grupy farmakologicznej leków przeciwrobaczych) wskazane jest, aby nie wypasać zwierząt za każdym razem na tym samym pastwisku, aby w ten sposób umożliwić odbudowę populacji fauny koprofagicznej.
Eprynomektyna jest toksyczna dla organizmów wodnych. Produkt powinien być używany tylko zgodnie z ulotką. W oparciu o profil wydalania eprynomektyny po podaniu w postaci pour-on, leczone zwierzęta nie powinny mieć dostępu do cieków wodnych podczas pierwszych 7 dni po leczeniu.
Bardzo rzadko obserwowano lizanie o charakterze przemijającym, drżenie skóry w miejscu podania produktu oraz łagodne reakcje miejscowe, takie jak łupież i złuszczanie się skóry w miejscu podania.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
W badaniach laboratoryjnych (na szczurach, królikach) nie uzyskano żadnych danych wskazujących na teratogenne lub embriotoksyczne działanie eprynomektyny w dawkach terapeutycznych.
Potwierdzono bezpieczeństwo stosowania produktu leczniczego weterynaryjnego u krów w okresie ciąży lub laktacji oraz u buhajów rozpłodowych. Można stosować u krów w okresie ciąży lub laktacji oraz u buhajów rozpłodowych.
Ponieważ eprynomektyna wiąże się w dużym stopniu z białkami osocza, należy to brać pod uwagę w przypadku stosowania jej w połączeniu z lekami o innej budowie cząsteczkowej wykazującymi tę samą cechę.
Do stosowania zewnętrznego. Do stosowania przez polewanie.
Stosować zewnętrznie w jednorazowej dawce 500 μg eprynomektyny na kg masa ciała, co odpowiada 1 ml na 10 kg masy ciała.
Roztwór do polewania powinien być stosowany poprzez polewanie na grzbiet zwierzęcia wąskim pasem wzdłuż kręgosłupa, od kłębu do ogona.
W celu zapewnienia podania prawidłowej dawki należy najdokładniej jak to możliwe określić masę ciała zwierzęcia i sprawdzić dokładność urządzenia dozującego. Jeżeli zwierzęta są leczone grupowo, nie indywidualnie, należy je pogrupować w zależności od masy ciała i podać właściwą dawkę, aby uniknąć podania zbyt niskich czy też zbyt wysokich dawek.
Wszystkie zwierzęta należące do tej samej grupy powinny być leczone w tym samym czasie.
System dozujący (butelka o pojemności 1 litra)
1 i 2. Zdjąć z butelki zabezpieczający kapsel aluminiowy. 3 i 4. Przykręcić do butelki pojemnik dozujący.
Nastawić dawkę poprzez przekręcenie górnej części pojemnika dozującego w taki sposób, aby znacznik odpowiadał określonej masie ciała zwierzęcia.
W przypadku gdy masa ciała zwierzęcia wypada pomiędzy liniami podziałki, wybrać wyższą wartość podziałki.
Podłączyć odpowiedni pistolet dozujący i odciągnąć węże od tylnej strony plecaka w sposób opisany poniżej.
1 i 2. Zdjąć z butelki zabezpieczający kapsel aluminiowy.
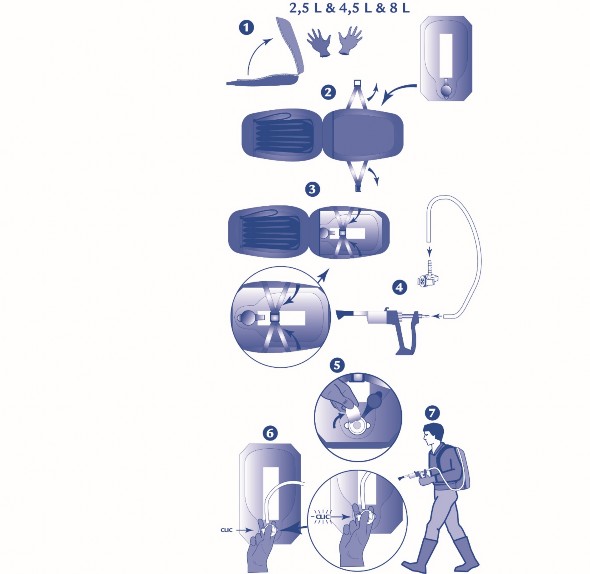
Podłączyć odpowiedni pistolet dozujący do worka FlexiBag w sposób opisany poniżej.
1 do 4. Połączyć jeden koniec węża z systemem łączącym E-lock, a drugi z pistoletem dozującym. 5 i 6. Połączyć system łączący E-lock z workiem FlexiBag.
7. Ostrożnie przygotować pistolet dozujący, sprawdzając przed właściwym użyciem czy wszystkie połączenia są szczelne.
Należy stosować się do instrukcji producenta pistoletu dozującego dotyczącej dostosowywania dawki oraz właściwego użytkowania i konserwacji pistoletu dozującego po jego użyciu.
W przypadku gdy masa ciała zwierzęcia wypadnie pomiędzy liniami podziałki, wybrać wyższą wartość podziałki.
Nie obserwowano objawów toksyczności po podawaniu dawek wyższych nawet pięciokrotnie od zalecanych. Specyficzna odtrutka na eprynomektynę nie jest znana.
Tkanki jadalne: 15 dni. Mleko: zero godzin.
Grupa farmakoterapeutyczna: leki przeciwrobacze, laktony makrocykliczne, awermektyny. Kod ATCvet: QP54AA04.
Eprynomektyna jest cząsteczką o działaniu przeciwrobaczym, należącą do grupy laktonów makrocyklicznych. Związki należące do tej grupy łączą się z wysokim powinowactwem bramkowanymi glutaminianem kanałami chlorkowymi komórek nerwowych lub mięśniowych bezkręgowców. Związki te wiążą się z tymi kanałami selektywnie, co prowadzi do zwiększenia przepuszczalności błony komórkowej dla jonów chlorkowych z hiperpolaryzacją komórek nerwowych lub mięśniowych, a w efekcie do porażenia i śmierci pasożyta.
Związki z tej grupy mogą również wchodzić w interakcje z kanałami chlorkowymi bramkowanymi innymi ligandami, np. bramkowanymi neuroprzekaźnikiem kwasem gamma-aminomasłowym (GABA).
U bydła biodostępność eprynomektyny podawanej miejscowo wynosi około 30%, z największym nasileniem wchłaniania do 10 dni po podaniu. Po podaniu miejscowym u bydła eprynomektyna nie podlega intensywnemu metabolizmowi. We wszystkich matrycach biologicznych komponent B1a eprynomektyny stanowi jedyną pozostałość występującą w największych ilościach.
Eprynomektyna składa się z komponentów B1a ( 90%) i B1b ( 10%), które różnią się jednostką
metylenową i nie ulegają intensywnemu metabolizmowi u bydła. Metabolity stanowią około 10% całkowitych pozostałości w osoczu, mleku, tkankach jadalnych i kale.
Parametry metaboliczne w wyżej wymienionych matrycach biologicznych są niemal identyczne pod względem ilościowym i jakościowym, z upływem czasu po podaniu eprynomektyny nie ulegają istotnej zmianie. Udział procentowy B1a i B1b w ogólnej puli metabolitów utrzymuje się na stałym poziomie. Stosunek obu komponentów leku w matrycach biologicznych jest identyczny jak w produkcie co dowodzi, że oba komponenty eprynomektyny są metabolizowane z niemal równą, stałą szybkością. Ponieważ metabolizm i dystrybucja tkankowa obu komponentów są bardzo podobne, ich farmakokinetyka również powinna być podobna.
Eprynomektyna jest w wysokim stopniu związana z białkami osocza (w 99%). Główną drogą eliminacji jest wydalanie z kałem.
Podobnie jak inne laktony makrocykliczne, eprynomektyna może wpływać niekorzystnie na organizmy inne niż jej organizmy docelowe. Po leczeniu zwierzęta mogą wydalać potencjalnie toksyczne ilości eprynomektyny przez okres kilku tygodni. Kał zawierający eprynomektynę wydalany
na pastwisku przez leczone zwierzęta może prowadzić do zmniejszenia populacji organizmów koprofagicznych, co może mieć niekorzystny wpływ na rozkład obornika.
Eprynomektyna jest wysoce toksyczna dla organizmów wodnych oraz może kumulować się w osadach. Eprynomektyna długotrwale utrzymuje się w glebie.
Butylohydroksytoluen (E321) All-rac-alfa-tokoferol (E307)
Glikolu propylenowego dikaprylokapronian
Ponieważ nie wykonano badań dotyczących zgodności, tego produktu leczniczego weterynaryjnego nie wolno mieszać z innymi produktami leczniczymi weterynaryjnymi.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 3 lata. Okres ważności po pierwszym otwarciu opakowania bezpośredniego (butelka i pojemnik): 1 rok. Okres ważności po pierwszym otwarciu opakowania bezpośredniego (worek): 2 lata.
Brak specjalnych środków ostrożności dotyczących przechowywania.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Produkt bardzo niebezpieczny dla ryb i organizmów wodnych. Nie zanieczyszczać stawów, cieków wodnych lub rowów odwadniających produktem lub zużytym opakowaniem. Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
VIRBAC
1ère avenue – 2065 m – LID 06516 Carros
FRANCJA
2517/16
16/02/2016











