Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/ DATA PRZEDŁUŻENIA POZWOLENIA
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1 ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1 ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1 ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMERY POZWOLEŃ NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU/ DATA PRZEDŁUŻENIA POZWOLENIA
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Effipro duo 134 mg/40 mg roztwór do nakrapiania dla średnich psów
Effipro comp 134 mg/40 mg spot-on solution for medium dogs (DK, NO, SE) Fipronil Pyriproxyfen Virbac 134 mg/40 mg spot-on solution for medium dogs (UK)
Każda pipetka 1,34 ml zawiera:
Substancje czynne | Pipetka 1,34 ml |
Fipronil | 134,0 mg |
Pyryproksyfen | 40,2 mg |
Substancje pomocnicze | |
Butylohydroksyanizol (E320) | 0,268 mg |
Butylohydroksytoluen (E321) | 0,134 mg |
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Roztwór do nakrapiania.
Klarowny, bezbarwny do żółtawego roztwór.
Psy (10 - 20 kg)
Zwalczanie inwazji pcheł lub jednoczesnej inwazji pcheł i kleszczy. Pchły:
Zwalczanie inwazji pcheł (Ctenocephalides felis). Jednokrotne podanie produktu zapobiega kolejnej inwazji
przez 7 tygodni.
Zapobieganie namnażaniu się pcheł poprzez uniemożliwienie wylęgania się dojrzałych pcheł z jaj w okresie 12 tygodni od podania.
Produkt leczniczy weterynaryjny może być stosowany jako element zwalczania alergicznego pchlego zapalenia skóry (AZPS), rozpoznanego wcześniej przez lekarza weterynarii.
Kleszcze:
Zwalczanie inwazji kleszczy (Ixodes ricinus).
Jednokrotne podanie produktu zapobiega przez 2 tygodnie kolejnej inwazji Ixodes ricinus oraz przez 4 tygodnie inwazji Dermacentor reticulatus i Rhipicephalus sanguineus.
Jeśli w momencie podania produktu obecne są kleszcze niektórych gatunków (Dermacentor reticulatus, Rhipicephalus sanguineus), nie wszystkie kleszcze mogą zostać zabite w ciągu 48 godzin.
Nie stosować u królików ze względu na możliwość wystąpienia działań niepożądanych, nawet śmierci. Nie stosować w przypadkach znanej nadwrażliwości na substancje czynne lub na dowolną substancję pomocniczą.
Kąpanie z użyciem szamponu lub zanurzanie zwierzęcia w wodzie tuż po podaniu produktu może skrócić czas działania produktu. Produkt leczniczy weterynaryjny pozostaje skuteczny przeciwko pchłom przez
5 tygodni, gdy po podaniu produktu pies jest kąpany z użyciem szamponu w odstępach jednomiesięcznych. Jeśli konieczne jest wykąpanie psa z użyciem szamponu, zaleca się zrobienie tego jeszcze przed podaniem produktu leczniczego weterynaryjnego.
Dwukrotne zanurzenie w wodzie psa po podaniu produktu nie miało wpływu na działanie produktu przeciwko dojrzałym pchłom oraz nie wpłynęło na jego skuteczność w zapobieganiu wylęgania się dojrzałych pcheł z jaj.
Nie badano wpływu zanurzania w wodzie oraz mycia z użyciem szamponu na skuteczność produktu leczniczego weterynaryjnego wobec kleszczy.
Podejmując działania profilaktyczne w przypadku inwazji należy zastosować odpowiedni produkt owadobójczy i regularnie odkurzać koszyk zwierzęcia, legowisko oraz miejsca, gdzie zwierzę zwykle odpoczywa, np. dywan i meble tapicerowane.
W celu ograniczenia rozprzestrzeniania się pcheł, u wszystkich zwierząt znajdujących się w gospodarstwie domowym należy zastosować odpowiedni produkt leczniczy weterynaryjny przeciwko pchłom.
Produkt nie zapobiega przyczepianiu się kleszczy do zwierząt. W niesprzyjających warunkach nie można całkowicie wykluczyć przeniesienia chorób zakaźnych przez kleszcze.
Wykazano natychmiastową skuteczność przeciwko Ixodes ricinus. Jest prawdopodobne, że kleszcze tego gatunku zginą w ciągu 48 godzin od podania produktu. Jeśli w momencie podania obecne są kleszcze Dermacentor reticulatus lub Rhipicephalus sanguineus, mogą one nie zostać zabite w ciągu 48 godzin. Martwe kleszcze często odpadają od skóry zwierzęcia. Martwe kleszcze, które nie odpadły, można ostrożnie usunąć upewniając się, że ich narząd gębowy nie został w skórze psa.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Tylko do użytku zewnętrznego.
Przed leczeniem należy dokładnie określić masę ciała zwierzęcia.
Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego u szczeniaków młodszych niż 10 tygodni i (lub) o masie ciała mniejszej niż 2 kg nie zostało określone.
Należy zachować ostrożność, aby zawartość pipetki nie miała kontaktu z oczami psa lub nie dostała się do pyska. Należy szczególnie unikać zlizywania produktu przez psa oraz inne zwierzęta.
Produktu nie należy stosować na rany lub uszkodzoną skórę.
Z powodu braku dodatkowych badań dotyczących bezpieczeństwa, nie należy podawać produktu częściej niż co 4 tygodnie.
Nie badano wpływu stosowania produktu u psów chorych i osłabionych.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Produkt może działać neurotoksycznie. Produkt może być szkodliwy po połknięciu.
Należy unikać połknięcia, w tym kontaktu rąk z ustami. Nie należy palić, pić ani jeść podczas podawania produktu.
Po przypadkowym połknięciu należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Ten produkt może powodować podrażnienie oka, w tym spojówki.
Należy unikać kontaktu ze skórą, oczami i ustami, w tym kontaktu rąk z oczami.
Po przypadkowym kontakcie ze skórą lub oczami należy niezwłocznie i dokładnie przepłukać je wodą. Jeśli podrażnienie skóry lub oczu utrzymuje się, należy zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Po podaniu należy umyć ręce.
Leczone zwierzęta nie powinny być dotykane do czasu wyschnięcia sierści, do tego również czasu dzieci nie powinny również bawić się ze zwierzętami. Stąd zaleca się, by produktu nie stosować w ciągu dnia, lecz wieczorem oraz by leczone zwierzęta nie spały z właścicielami, szczególnie z dziećmi.
Pipetki należy przechowywać w oryginalnym opakowaniu do momentu podania, a po użyciu należy je natychmiast usunąć.
Inne środki ostrożności
Fipronil i pyryproksyfen mogą mieć negatywny wpływ na organizmy wodne. Psy nie powinny pływać w strumieniach i rzekach w okresie 48 godzin od momentu zastosowania produktu (patrz również punkt 6.6). Produkt może uszkodzić meble tapicerowane, malowane, lakierowane oraz inne powierzchnie wyposażenia domu. Przed kontaktem z tymi materiałami miejsce podania produktu powinno wyschnąć.
W miejscu podania mogą wystąpić przemijające zmiany skórne, takie jak mokry wygląd skóry lub lekkie łuszczenie skóry.
Biorąc pod uwagę dostępne dane dotyczące obydwu substancji czynnych stosowanych w postaci roztworu do nakrapiania, w miejscu podania możliwe jest wystąpienie przemijających zmian skórnych (łuszczenie, miejscowe łysienie, świąd, rumień, przebarwienie skóry) oraz reakcji uogólnionych, takich jak świąd
i łysienie. Bardzo rzadko mogą wystąpić nadmierne ślinienie, odwracalne objawy neurologiczne (nadwrażliwość na dotyk, apatia, objawy ze strony układu nerwowego), objawy ze strony układu oddechowego oraz wymioty.
Częstość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Badania laboratoryjne nie wykazały działania teratogennego ani embriotoksycznego fipronilu oraz pyryproksyfenu. Nie przeprowadzono badań tego produktu leczniczego weterynaryjnego na ciężarnych oraz karmiących sukach. Do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Nieznane.
Podanie przez nakrapianie.
Dawkowanie:
Zawartość jednej pipetki 1,34 ml należy nakropić na jednego psa o masie ciała od 10 do 20 kg, co odpowiada minimalnej zalecanej dawce 6,7 mg fipronilu na kilogram masy ciała oraz 2 mg pyryproksyfenu na kilogram masy ciała.
Objętość | Masa psa | Fipronil (mg) | Pyryproksyfen (mg) |
0,67 ml | 2 - 10 kg | 67 | 20,1 |
1,34 ml | 10 - 20 kg | 134 | 40,2 |
2,68 ml | 20 - 40 kg | 268 | 80,4 |
4,02 ml | 40 - 60 kg | 402 | 120,6 |
U psów o masie ciała powyżej 60 kg należy zastosować odpowiednią kombinację pipetek. Sposób podawania:
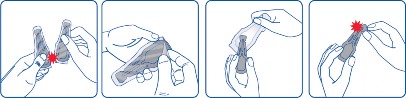
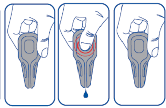
Wyjąć pipetkę z blistra. Trzymać pipetkę skierowaną do góry. Postukać palcem w węższą część pipetki, aby upewnić się, że zawartość znajduje się w jej głównej części. Odłamać końcówkę pipetki wzdłuż przerywanej linii.
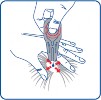
Odgarnąć sierść zwierzęcia u podstawy szyi, w okolicy międzyłopatkowej tak, aby widoczna była skóra. Końcówkę pipetki przyłożyć bezpośrednio do skóry i kilkukrotnie ją ścisnąć, aż do opróżnienia. Jeśli jest to konieczne, zawartość pipetki można podać w jednym lub dwóch dodatkowych miejscach na grzbiecie zwierzęcia w celu ograniczenia spływania produktu lub jego lepszego rozprowadzenia w sierści, szczególnie u dużych psów.
System zapobiegający kapaniu (produkt wypływa z pipetki wyłącznie po ściśnięciu jej głównej części).
Wystarczy podanie jednej pipetki, z możliwością wykonywania powtórzeń w odstępach jednomiesięcznych. W celu optymalnego zwalczania inwazji pcheł i kleszczy oraz ograniczenia namnażania się pcheł, schemat stosowania produktu może być oparty o zalecenia wynikające z lokalnej sytuacji epidemiologicznej.
W badaniu bezpieczeństwa na 10-tygodniowych szczeniakach nie obserwowano ciężkich działań niepożądanych podczas stosowania dawek przekraczających 5-krotnie maksymalną zalecaną dawkę, podawanych 3 razy co 4 tygodnie oraz podczas stosowania maksymalnej zalecanej dawki 6 razy co 4 tygodnie.
Ryzyko wystąpienia działań niepożądanych (patrz punkt 4.6) może być jednak zwiększone po przedawkowaniu, dlatego zawsze należy stosować pipetkę o wielkości odpowiedniej do masy ciała zwierzęcia.
Nie dotyczy.
Grupa farmakoterapeutyczna: Produkty przeciwpasożytnicze do stosowania miejscowego, fipronil w połączeniach.
Kod ATCvet: QP53AX65
Fipronil jest środkiem owadobójczym i roztoczobójczym należącym do pochodnych fenylopirazolu. Fipronil i jego metabolit, sulfon fipronilu działają na kanały chlorkowe bramkowane ligandem,
w szczególności na bramkowane neurotransmiterem kwasem gamma aminomasłowym (GABA), jak również desensytyzowane (D) oraz niedesensytyzowane (N) kanały bramkowane glutaminianem (Glu, specyficzne dla bezkręgowców kanały chlorkowe bramkowane ligandem). Blokują w ten sposób pre- i postsynaptyczny transfer jonów chlorkowych przez błonę komórkową. Wynikiem tego działania jest niekontrolowana aktywność ośrodkowego układu nerwowego i śmierć owadów lub roztoczy.
Pyryproksyfen jest regulatorem wzrostu owadów (insect growth regulator – IGR), należącym do grupy analogów hormonów juwenilnych. Pyryproksyfen sterylizuje dojrzałe pchły i zapobiega rozwojowi owadów niedojrzałych. Pyryproksyfen, poprzez kontakt, uniemożliwia powstanie dojrzałych owadów poprzez hamowanie rozwoju jaj, larw oraz poczwarek, które są następnie zabijane. Po kontakcie i (lub) spożyciu przez dojrzałe pchły, substancja ta działa również poprzez sterylizację jaj podczas ich dojrzewania oraz przed złożeniem. Pyryproksyfen zapobiega skażeniu otoczenia, w którym znajdują się leczone zwierzęta, przez niedojrzałe stadia pcheł.
Połączenie fipronilu i pyryproksyfenu działa owadobójczo i roztoczobójczo wobec pcheł (Ctenocephalides felis), kleszczy (Rhipicephalus sanguineus, Dermacentor reticulatus, Ixodes ricinus) oraz dodatkowo uniemożliwia rozwój dojrzałych pcheł z jaj złożonych w otoczeniu.
Po podaniu miejscowym na skórę psa, w normalnych warunkach fipronil i pyryproksyfen są szeroko dystrybuowane w sierści w ciągu 24 godzin.
Głównym metabolitem fipronilu jest pochodna sulfonowa, która również posiada właściwości owadobójcze i roztoczobójcze.
Stężenia fipronilu, sulfonu fipronilu oraz pyryproksyfenu w sierści zmniejszają się stopniowo, jednak substancje te są wykrywalne przez przynajmniej 84 dni od podania.
Maksymalne stężenie fipronilu w osoczu jest osiągane po 3 do 7 dniach od podania, natomiast w przypadku sulfonu fipronilu, po 7 do 14 dniach. Maksymalne stężenie pyryproksyfenu w osoczu jest osiągane 1 do
3 dni od podania.
Stężenia fipronilu oraz pyryproksyfenu w osoczu zmniejszają się stopniowo. Substancje te są oznaczalne w osoczu w okresie do 50 dni od podania.
Butylohydroksyanizol E320 Butylohydroksytoluen E321
Glikolu dietylenowego monoetylowy eter
Nieznane.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 3 lata.
6.4. Specjalne środki ostrożności podczas przechowywania
Nie przechowywać w temperaturze powyżej 30°C. Przechowywać w suchym miejscu.
Przechowywać blister w opakowaniu zewnętrznym w celu ochrony przed światłem.
Przezroczysta, wielowarstwowa, plastikowa, jednodawkowa pipetka zawierająca 1,34 ml, wytworzona poprzez formowanie na gorąco przezroczystej, złożonej części dennej (poliakrylonitryl-metakrylan, polipropylen lub polietylen-alkohol etylowinylowy-polietylen, cykliczne kopolimery olefinowe, polipropylen) i zamknięta poprzez zgrzewanie ze złożonym wieczkiem (poliakrylonitryl-metakrylan lub polietylen-alkohol etylowinylowy-polietylen, aluminium, politereftalan etylenu).
Pudełka zawierają pojedyncze pipetki zapakowane w blistry z polipropylenu, cyklicznego kopolimeru olefinowego, polipropylenu, zamknięte wieczkiem z politereftalanu etylenu, aluminium, polipropylenu.
Pudełka zawierające 1, 4, 24 lub 60 pipetek (duże pudełka zawierają koperty przeznaczone do wydawania mniejszej liczby pipetek).
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Produktu leczniczego weterynaryjnego oraz pustych opakowań nie należy wyrzucać do stawów, cieków wodnych lub kanałów, ponieważ mogą być niebezpieczne dla ryb i innych organizmów wodnych.
VIRBAC
1ère avenue – 2065m – L.I.D. 06516 Carros
Francja
2646/17
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu : 03.04.2017 Data przedłużenia pozwolenia:











