Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER (-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane),
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt),
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt),
rzadko (więcej niż 1, ale mniej niż 10 na 10 000 leczonych zwierząt),
bardzo rzadko (mniej niż 1 na 10 000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER (-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Spizobactin vet 1 500 000 IU/250 mg tabletki do rozgryzania i żucia dla psów Spizobactin 1 500,000 IU/250 mg chewable tablets for dogs
(AT, BE, BG, CY, CZ, DE, EL, ES, FR, HR, HU, IE, IT, LU, NL, PT, RO, SI, SK, UK(NI))
Spizobactin vet 1 500,000 IU/250 mg chewable tablets for dogs (DK, FI, IS, NO, EE, LT, LV)
Każda tabletka zawiera:
Substancje czynne:
Spiramycyna 1 500 000 IU
Metronidazol 250 mg
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Tabletka do rozgryzania i żucia.
Jasnobrązowa z brązowymi kropkami, okrągła i wypukła, aromatyzowana tabletka z linią podziału w kształcie krzyża z jednej strony.
Tabletki można podzielić na 2 lub 4 równe części.
Psy.
Do stosowania wspomagająco w mechanicznej lub chirurgicznej terapii periodontologicznej
w leczeniu wielobakteryjnych zakażeń przyzębia i powiązanych chorób (około)ustnych, takich jak: zapalenie dziąseł, zapalenie jamy ustnej, zapalenie języka, zapalenie przyzębia, zapalenie migdałków, przetoka zębowa i inne rany przetokowe w jamie ustnej, zapalenie warg i zapalenie zatok u psów wywołanych przez mikroorganizmy wrażliwe na połączenie spiramycyny i metronidazolu, takie jak bakterie Gram-dodatnie i beztlenowce (patrz również punkt 4.4 i 4.5) .
Nie stosować w przypadkach zaburzeń czynności wątroby.
Nie stosować w przypadkach nadwrażliwości na substancje czynne lub na dowolną substancję pomocniczą.
W wielu przypadkach choroby endodontycznej i (lub) periodontologicznej leczenie podstawowe jest niefarmakologiczne i nie wymaga podawania leków przeciwbakteryjnych.
W czasie lub przed leczeniem przeciwbakteryjnym choroby przyzębia należy przeprowadzić leczenie endodontyczne i (lub) profesjonalne czyszczenie zębów, zwłaszcza w przypadku zaawansowanej
choroby. Właścicieli psów należy zachęcać do regularnego szczotkowania zębów psów w celu usunięcia płytki nazębnej, aby zapobiegać lub kontrolować choroby przyzębia.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Połączenia spiramycyny i metronidazolu nie należy stosować jako leczenia empirycznego pierwszego rzutu.
W miarę możliwości metronidazol i spiramycynę należy stosować wyłącznie w oparciu o badanie lekowrażliwości patogenów.
W przypadku stosowania produktu leczniczego weterynaryjnego należy uwzględniać oficjalne, krajowe i regionalne wytyczne dotyczące leków przeciwbakteryjnych.
Ograniczenie czasu trwania leczenia metronidazolem jest konieczne, ponieważ nie można wykluczyć uszkodzenia komórek rozrodczych. Również w badaniach długoterminowych z dużymi dawkami obserwowano zwiększenie występowania określonych nowotworów u gryzoni.
Tabletki do żucia są aromatyzowane. Aby uniknąć przypadkowego połknięcia, przechowuj tabletki poza zasięgiem zwierząt.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Metronidazol ma potwierdzone właściwości mutagenne i genotoksyczne u zwierząt laboratoryjnych i u ludzi. Jest też potwierdzonym czynnikiem rakotwórczym u zwierząt laboratoryjnych i ma potencjalne działanie rakotwórcze u ludzi. Brak jest jednak wystarczających dowodów na rakotwórczość metronidazolu u ludzi.
Metronidazol może być szkodliwy dla płodu. Kobiety w ciąży powinny zachować ostrożność podczas obchodzenia się z tym produktem leczniczym weterynaryjnym.
Spiramycyna i metronidazol mogą w rzadkich przypadkach wywoływać reakcje nadwrażliwości, np. kontaktowe zapalenie skóry.
Należy unikać bezpośredniego kontaktu ze skórą lub błonami śluzowymi podającego ze względu na ryzyko uczulenia. Nie podawać produktu leczniczego weterynaryjnego w przypadku znanej nadwrażliwości na substancje czynne lub na dowolną substancję pomocniczą.
Podczas podawania produktu leczniczego weterynaryjnego należy używać nieprzepuszczalnych rękawic w celu uniknięcia styczności skóry lub kontaktu ręka-usta z produktem.
Metronidazol może wywołać niepożądane (neurologiczne) skutki w przypadku spożycia przez dziecko. W celu uniknięcia przypadkowego połknięcia, zwłaszcza przez dziecko, niezużyte części tabletki należy włożyć z powrotem do otwartego blistra i do pudełka tekturowego.
Po przypadkowym połknięciu należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Umyć dokładnie ręce po podaniu tabletek.
Wymioty obserwowano rzadko u psów.
Nadwrażliwość może występować w rzadkich przypadkach. W przypadkach reakcji nadwrażliwości należy przerwać leczenie.
Zaburzenia spermatogenezy mogą wystąpić w bardzo rzadkich przypadkach. Hematurię można było zaobserwować w bardzo rzadkich przypadkach.
Częstość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Nie wykazano działania teratogennego ani działania toksycznego spiramycyny na zarodek i płód. Badania na zwierzętach laboratoryjnych wykazały niespójne wyniki w odniesieniu do teratogennego i toksycznego dla zarodka działania metronidazolu. Z tego powodu nie zaleca się stosowania tego produktu w czasie ciąży. Metronidazol i spiramycyna przenikają do mleka i z tego powodu nie zaleca się stosowania w okresie laktacji.
Nie stosować jednocześnie z antybiotykami bakteriobójczymi.
Makrolidy, takie jak np. spiramycyna, działają antagonistycznie do penicylin i cefalosporyn. Produktu nie należy stosować jednocześnie z innymi antybiotykami z grupy makrolidów.
Metronidazol może mieć hamujący wpływ na rozkład innych leków w wątrobie, takich jak fenytoina, cyklosporyna i warfaryna.
Fenobarbital może zwiększać metabolizm wątrobowy metronidazolu, prowadząc do zmniejszonego stężenia metronidazolu w surowicy.
Podanie doustne.
75 000 IU spiramycyny + 12,5 mg metronidazolu na kg masy ciała, w cięższych przypadkach 100 000 IU spiramycyny + 16,7 mg metronidazolu na kg masy ciała, podawane codziennie przez 6-10 dni
w zależności od nasilenia choroby.
W ciężkich przypadkach można rozpocząć od większej dawki i w trakcie leczenia powrócić do dawki mniejszej.
Dawkę dobową można podawać raz na dobę lub równo podzieloną podawać dwa razy na dobę. Leczenie należy zawsze kontynuować przez 1-2 dni po ustąpieniu objawów w celu zapobiegnięcia nawrotom. Tabletki należy podawać głęboko do jamy ustnej (przy podstawie języka) lub z małą ilością pożywienia zawierającego tabletkę, aby zapewnić spożycie całej tabletki.
W celu zapewnienia podawania prawidłowej dawki należy jak najdokładniej określić masę ciała, aby uniknąć podawania zbyt małych dawek. Poniższa tabela służy jako wskazówka odnośnie podawania produktu w przybliżeniu w standardowej dawce 75 000 IU spiramycyny + 12,5 mg metronidazolu na kg masy ciała na dobę.
Masa ciała | Spizobactin vet 750 000 IU / 125 mg dla psów | Spizobactin vet 1 500 000 IU/250 mg dla psów | Spizobactin vet 3 000 000 IU/500 mg dla psów |
2,5 kg |
| ||
5,0 kg |
|
| |
7,5 kg |
| ||
10 kg |
|
| |
12,5 kg |
| ||
15 kg |
|
| |
17,5 kg |
| ||
20 kg |
|
| |
25 kg |
| ||
30 kg |
| ||
35 kg |
| ||
40 kg |
| ||
50 kg |
| |
60 kg |
| |
70 kg |
| |
80 kg |
|




= ¼ tabletki = ½ tabletki = ¾ tabletki = 1 tabletka
Tabletki można dzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania. Tabletkę umieścić na płaskiej powierzchni ze stroną z linią podziału skierowaną do góry i stroną wypukłą (zaokrągloną) skierowaną do powierzchni.
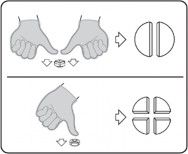
Połówki: nacisnąć kciukami po obu stronach tabletki.
Ćwiartki: nacisnąć kciukiem na środku tabletki.
W przypadku wystąpienia objawów neurologicznych należy przerwać leczenie, a pacjenta należy leczyć objawowo.
Nie dotyczy.
Grupa farmakoterapeutyczna: leki przeciwbakteryjne do stosowania ogólnego, spiramycyna i metronidazol
Kod ATCvet: QJ01RA04
Spiramycyna jest antybiotykiem z grupy makrolidów. Działa wyraźnie bakteriostatycznie poprzez zahamowanie syntezy białek (zakłócając reakcję translacji na rybosomie). Spektrum działania obejmuje głównie bakterie Gram-dodatnie. Trzy różne mechanizmy odpowiadają za oporność bakterii na działanie makrolidów: (1) metylacja rRNA, (2) aktywne wypompowywanie z komórki bakteryjnej i (3) inaktywacja enzymatyczna. Dwa pierwsze mechanizmy są najczęstsze. Geny kodujące te mechanizmy znajdują się często na elementach ruchomych. Metylacja rRNA, kodowana przez geny oporności na erytromycynę o aktywności metylazy (ang. erythromycin-resistant methylase, erm) prowadzi do oporności krzyżowej na makrolidy, linkozamidy i streptograminę B (oporność MLSB).
Metronidazol jest pochodną imidazolu i działa przeciwko przedstawicielom pierwotniaków (wiciowcom i pełzakom) i przeciwko beztlenowcom Gram-dodatnim i Gram-ujemnym.
Połączenie spiramycyny i metronidazolu rozszerza spektrum działania dzięki uzupełniającemu się działaniu przeciwbakteryjnemu tych dwóch leków. Wykazano działania synergiczne u niektórych patogenów w badaniach in vitro i w zakażeniach eksperymentalnych zwierząt laboratoryjnych.
Po podaniu doustnym szczytowe stężenie spiramycyny-I (głównego składnika spiramycyny) w osoczu wynoszące 4,4 µg/ml jest osiągane w ciągu 1,3 godziny. Spiramycyna szybko osiąga wysokie stężenie w tkankach, 10-15-krotnie większe niż w osoczu. Stężenie w błonach śluzowych i ślinie jest szczególnie wysokie. Po pojedynczej dawce doustnej stężenie spiramycyny pozostaje obecne przez około 30-40 godzin.
Spiramycyna jest wydalana u psów z żółcią. Końcowy okres półtrwania wynosi około 8,6 godziny.
Po podaniu doustnym szczytowe stężenie metronidazolu w osoczu wynoszące 18 µg/ml jest osiągane w ciągu 1,4 godziny. Po spożyciu doustnym metronidazol przenika szybko i całkowicie do wszystkich tkanek organizmu. Po 24 godzinach stężenie we krwi >0,5 µg/ml jest nadal wykrywalne u większości psów. Wydalanie odbywa się z moczem. Końcowy okres półtrwania wynosi około 5,3 godziny.
Skrobia wstępnie żelowana Celuloza mikrokrystaliczna Laktoza jednowodna Hydroksypropyloceluloza Drożdże (suszone)
Aromat kurczaka
Krzemionka koloidalna bezwodna Magnezu stearynian
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 18 miesięcy. Okres ważności podzielonych tabletek po pierwszym otwarciu opakowania bezpośredniego: 3 dni.
6.4. Specjalne środki ostrożności podczas przechowywania
Nie przechowywać w temperaturze powyżej 30°C.
Blister aluminiowy - PCV/PE/PVDC. Wielkości opakowań:
Pudełko tekturowe zawierające 1, 2 lub 3 blistry po 10 tabletek.
Pudełko tekturowe zawierające 10 oddzielnych pudełek tekturowych, zawierających po 1 blistrze po 10 tabletek.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Le Vet Beheer B.V.
Wilgenweg 7
3421 TV Oudewater Holandia
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu 13/04/2018 Data przedłużenia pozwolenia<{DD/MM/RRRR}
{DD/MM/RRRR}






































