Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Finadyne vet. 50 mg/ml roztwór do polewania dla bydła
EL: Finixin Transdermal 50 mg/ml pour-on solution for cattle
DK: Finadyne Transdermal vet 50 mg/ml pour-on solution for cattle EE, FI, LT, LV, SE: Finadyne vet. 50 mg/ml pour-on solution for cattle
Każdy ml zawiera:
Substancja czynna:
Fluniksyna: 50 mg (co odpowiada 83 mg fluniksyny megluminianu)
Substancje pomocnicze:
Lewomentol: 50 mg
Czerwień allura AC (E129): 0,2 mg Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Roztwór do polewania.
Klarowny, czerwony płyn wolny od widocznych cząstek.
Bydło
Ograniczenie gorączki związanej z chorobami układu oddechowego bydła.
Ograniczenie gorączki związanej z ostrymi stanami zapalnymi gruczołu mlekowego.
Ograniczenie bolesności i kulawizny związanej z występowaniem ropowicy skóry międzyracicowej, zapalenia skóry międzyracicowej i zapalenia skóry palców.
Nie stosować u zwierząt ze schorzeniami serca, wątroby lub nerek oraz w przypadkach stwierdzonego owrzodzenia lub krwawienia przewodu pokarmowego.
Nie stosować u poważnie odwodnionych, hipowolemicznych zwierząt, ponieważ istnieje potencjalne ryzyko zwiększonej toksyczności dla nerek.
Nie stosować produktu w okresie 48 godzin przed przewidywanym terminem porodu u krów. Nie stosować w przypadku nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
Podawać wyłącznie na suchą skórę, zapobiegać zmoczeniu przez okres co najmniej 6 godzin po podaniu produktu.
W przypadku zakażeń bakteryjnych, należy rozważyć równoczesne prowadzenie terapii z zastosowaniem antybiotyków.
Specjalne środki ostrożności dotyczące stosowania u zwierząt Należy zapoznać się także z treścią części 4.7.
Niesteroidowe leki przeciwzapalne (NLPZ) posiadają znany potencjał opóźniania porodu poprzez działanie tokolityczne na drodze hamowania prostaglandyn, które odgrywają istotną rolę w sygnalizowaniu rozpoczęcia porodu. Stosowanie produktu w okresie następującym bezpośrednio po porodzie może oddziaływać z inwolucją macicy i wydalaniem błon płodowych prowadząc do
zatrzymania łożyska.
Badania bezpieczeństwa nie były prowadzone u buhajów przeznaczonych do rozrodu. Badania laboratoryjne prowadzone na szczurach nie wykazały toksycznego działania na układ rozrodczy. Stosować jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Stosowanie u cieląt z nierozwiniętą funkcją przedżołądków oraz u zwierząt w zaawansowanym wieku może być związane z dodatkowym ryzykiem. Jeżeli nie można uniknąć takiego stosowania, zwierzęta mogą wymagać zredukowania dawki oraz troskliwej opieki klinicznej.
Podawać wyłącznie na nieuszkodzoną skórę.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Niesteroidowe leki przeciwzapalne (NLPZ) mogą wywoływać nadwrażliwość (alergię).
Osoby o znanej nadwrażliwości na NLPZ powinny unikać kontaktu z produktem.
Wykazano, że produkt powoduje ciężkie i nieodwracalne uszkodzenia oczu oraz powoduje nieznaczne podrażnienie skóry. Połknięcie produktu lub kontakt produktu ze skórą mogą być szkodliwe.
Należy unikać kontaktu produktu z oczami z uwzględnieniem kontaktu zanieczyszczonych rąk z oczami. Należy unikać kontaktu produktu ze skórą. Należy unikać kontaktu z obszarami poddanymi leczeniu (umożliwienie rozprzestrzenienia się produktu) bez stosowania rękawic ochronnych, przez okres co najmniej trzech dni lub do czasu całkowitego wyschnięcia obszaru aplikacji produktu (jeśli ten okres jest dłuższy). Należy zapobiegać dostępowi dzieci do produktu lub zwierząt poddanych leczeniu.
Podczas stosowania produktu należy używać osobistej odzieży i sprzętu ochronnego, na które składają się nieprzepuszczalne rękawice, odzież ochronna oraz atestowane okulary ochronne.
Po przypadkowym połknięciu lub kontakcie z jamą ustną należy natychmiast przepłukać usta dużą ilością wody i zwrócić się o pomoc lekarską.
W przypadku zanieczyszczenia oczu produktem, oczy należy natychmiast przepłukać dużą ilością czystej wody i zwrócić się o pomoc lekarską.
W przypadku zanieczyszczenia skóry produktem, skórę należy umyć dokładnie wodą z mydłem. Podczas pracy z produktem nie należy palić, jeść i spożywać napojów.
Po stosowaniu produktu należy umyć ręce.
Często raportowano występowanie w miejscu podania przejściowego obrzęku, rumienia, łupieżu, połamanych/łamliwych włosów, ścieńczenia włosów, wyłysień lub zgrubienia skóry. Na ogół nie jest wymagane stosowanie specyficznego leczenia. Niektóre zwierzęta mogą wykazywać przejściowe objawy rozdrażnienia, pobudzenia i dyskomfortu po podaniu produktu. Bardzo rzadko mogą wystąpić reakcje anafilaktyczne, które mogą mieć ciężki przebieg, takie reakcje wymagają leczenia objawowego.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Produkt można stosować w okresie ciąży oraz laktacji z wyjątkiem okresu 48 godzin poprzedzających poród. Ze względu na zwiększone ryzyko zatrzymania łożyska, produkt można podawać w okresie pierwszych 36 godzin od porodu wyłącznie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu a leczone zwierzęta należy monitorować pod kątem zatrzymania łożyska.
Nie należy podawać innych niesteroidowych leków przeciwzapalnych równolegle oraz w okresie 24 godzin od podania produktu.
Niektóre niesteroidowe leki przeciwzapalne mogą wiązać się silnie z białkami osocza i konkurować z innymi lekami wiążącymi się w wysokim stopniu z białkami osocza, co może prowadzić do
wystąpienia działania toksycznego. Należy unikać równoczesnego stosowania leków potencjalnie nefrotoksycznych.
Podanie przez polewanie. Do jednokrotnego podania. Zalecana dawka lecznicza wynosi 3,33 mg fluniksyny/kg masy ciała (odpowiednik 1 ml/15 kg masy ciała). Komora dozująca butelki jest
skalibrowana w kilogramach masy ciała. Aby zapewnić podanie właściwej dawki należy wyznaczyć masę ciała tak dokładnie jak to jest tylko możliwe. Należy kilkukrotnie praktycznie przećwiczyć instrukcję podawania w celu zapoznania się z postępowaniem z opakowaniem, przed przystąpieniem do podawania produktu zwierzętom.
Krok 1: Podczas pierwszego użycia należy usunąć zakrętkę i zerwać uszczelnienie z komory dozującej butelki. Nie należy usuwać zakrętki z butelki.
Krok 2: Należy trzymać butelkę pionowo na wysokości oczu, powoli i delikatnie ściskając butelkę napełnić komorę dozującą do wybranego poziomu.
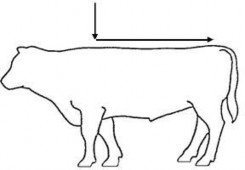
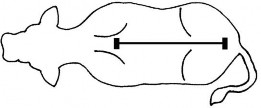
Krok 3: Należy wylać odmierzoną objętość produktu w linii środkowej grzbietu zwierzęcia rozpoczynając od kłębu do nasady ogona. Należy unikać podawania miejscowego w mniejszych obszarach.
Krok 1 Przy pierwszym użyciu należy usunąć Nie zakrętkę i należy zerwać usuwać uszczelnienie zakrętki z z komory butelki. dozującej. | Krok 2 Należy trzymać butelkę pionowo na wysokości oczu, powoli i delikatnie ściskając butelkę Komora napełnić komorę dozująca dozującą do wybranego poziomu. Jeśli dojdzie do przepełnienia komory dozującej, należy postąpić zgodnie z instrukcją dotyczącą redukcji zbyt dużej dawki. |
Krok 3 Należy wylać odmierzoną objętość produktu w linii środkowej grzbietu zwierzęcia rozpoczynając od kłębu do nasady ogona. Niewielka ilość płynu pozostanie na ściankach komory, lecz kalibracja komory uwzględnia tę ilość produktu. Należy unikać ściskania ścianek opakowania podczas wylewania produktu z komory dozującej. |





Instrukcja dotycząca redukcji zbyt dużej dawki.
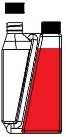
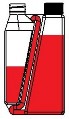
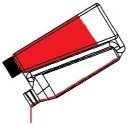
Krok 1 Zakręć Zakręć zakrętkę zakrętkę na na butelkę i komorę dokręć ją (jeśli dozującą i wymagane). dokręć ją. | Krok 2 Rurka przelewowa Kieszonka powietrza Należy przechylić butelkę, aby umożliwić powstanie kieszonki powietrza w okolicy początku rurki przelewowej w butelce. |
Krok 3 Rurka przelewowa Należy trzymać butelkę poziomo, aby produkt pokrył koniec rurki przelewowej w komorze dozującej. | Krok 4
Należy kilkukrotnie ściskać butelkę. Produkt powróci do butelki przez rurkę przelewową. |



Po zastosowaniu dawki 5 mg/kg raportowano występowanie miejscowych zmian zapalnych oraz martwicy skóry. U zwierząt otrzymujących dawkę 3 krotnie przekraczającą zalecaną dawkę leczniczą obserwowano uszkodzenia trawieńca o charakterze nadżerek i owrzodzeń. U niektórych zwierząt otrzymujących dawkę 5 krotnie przekraczającą zalecaną dawkę leczniczą obserwowano krew utajoną w kale. Brak specjalnych procedur w przypadku przedawkowania.
Tkanki jadalne: 7 dni. Mleko: 36 godzin.
Ze względu na możliwość krzyżowego zanieczyszczenia zwierząt nie poddanych leczeniu tym produktem spowodowaną czyszczeniem (wylizywaniem), zwierzęta poddane leczeniu powinny być utrzymywane osobno od zwierząt nie poddawanych leczeniu przez cały okres karencji. Nie stosowanie się do tego zalecenia może prowadzić do występowania pozostałości u zwierząt nie poddanych leczeniu.
Grupa farmakoterapeutyczna: produkty przeciwzapalne i przeciwreumatyczne; niesteroidowe, fenamaty, fluniksyna.
Kod ATC vet: QM01AG90
Substancja czynna fluniksyna (w postaci soli megluminianowej) jest, należącym do grupy kwasu karboksylowego, niesteroidowym lekiem przeciwzapalnym (NLPZ) wykazującym nienarkotyczne działanie przeciwbólowe oraz przeciwgorączkowe. Wykazuje silne hamowanie systemu cyklooksygenaz (COX-1 i COX-2). COX przekształca kwas arachidonowy do niestabilnych cyklicznych endoperoksydaz, które przekształcane są do prostaglandyn, prostacyklin i tromboksanu.
Hamowanie syntezy tych składników jest odpowiedzialne za działanie przeciwbólowe, przeciwgorączkowe i przeciwzapalne fluniksyny megluminianu.
W jednym badaniu, poddano ocenie Finadyne Transdermal u 64 krów z zapaleniem wymienia, skuteczność w obniżaniu temperatury wewnętrznej mierzonej w odbycie porównywano z placebo,
które zastosowano u 66 krów. Sześć godzin po leczeniu 95,3% krów leczonych Finadyne Transdermal wykazało spadek temperatury wewnętrznej, mierzonej w odbycie o więcej niż 1,1 °C, w porównaniu z 34,9% krów w grupie otrzymującej placebo. Po sześciu godzinach, kiedy wprowadzono leczenie
antybiotykiem, nie było różnic w temperaturze wewnętrznej mierzonej w odbycie pomiędzy obu grupami.
Po podaniu na skórę fluniksyna jest umiarkowanie wchłaniana przez skórę bydła (biodostępność około 44%). U bydła (z wyjątkiem cieląt), objętość dystrybucji jest generalnie niska ze względu na silny stopień (około 99%) wiązania z białkami osocza. Okres połowicznej eliminacji z osocza po podaniu na skórę wynosi około 7,8 godzin. Metabolizm fluniksyny jest raczej ograniczony, większość leku odpowiada niezmienionemu związkowi macierzystemu a pozostałe metabolity pochodzą z procesu hydroksylacji. U bydła eliminacja zachodzi głównie na drodze wydalania z żółcią. Po podaniu na skórę obserwowano szybsze wchłanianie fluniksyny w cieplejszych warunkach w porównaniu z zimniejszymi warunkami. W ciepłych warunkach (temperatura środowiska pomiędzy 13 °C a 30 °C) Tmax wynosił około 2 godzin, podczas gdy w warunkach chłodnych (temperatura środowiska pomiędzy
-3 °C a 7 °C) wynosił około 6 godzin. Wykazano występowanie działania przeciwgorączkowego w 4 godziny od podania produktu.
Pirolidon Lewomentol
Glikolu propylenowego dikaprylokapronian Czerwień allura AC (E129)
Glicerolu monokaprylan
Ponieważ nie wykonywano badań dotyczących zgodności, tego produktu leczniczego weterynaryjnego nie wolno mieszać z innymi produktami leczniczymi weterynaryjnymi.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata. Okres ważności po pierwszym otwarciu opakowania bezpośredniego: 6 miesięcy.
Brak specjalnych środków ostrożności dotyczących przechowywania.
Butelki z polietylenu wysokiej gęstości (HDPE) z zamknięciami polipropylenowymi (PP) posiadającymi usuwalną laminowaną folię, wewnętrzną folię indukcyjną oraz wykładzinę.
Butelki zaopatrzone są w wyskalowaną komorę dawkowania i są dostarczane w indywidualnych pudełkach tekturowych.
Trzy wielkości opakowania: 100 ml, 250 ml i 1000 ml.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy unieszkodliwić w sposób zgodny z obowiązującymi przepisami.
Intervet International B.V. Wim de Körverstraat 35 5831 AN Boxmeer Holandia
2803/18
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: {DD/MM/RRRR} Data przedłużenia pozwolenia: {DD/MM/RRRR}
{MM/RRRR}
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB STOSOWANIA
Nie dotyczy.