Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI IMMUNOLOGICZNE
- DANE FARMACEUTYCZNE:
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1 ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1 ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1 ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres (-y) karencji
WŁAŚCIWOŚCI IMMUNOLOGICZNE
DANE FARMACEUTYCZNE:
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Versican Plus Bb Oral liofilizat i rozpuszczalnik do sporządzania zawiesiny doustnej dla psów
Każda 1 ml dawka zawiera:
Substancje czynne:
Liofilizat:
Żywe, atenuowane bakterie Bordetella bronchiseptica, szczep 92B 1,4 x 108 - 5,5 x 109 CFU*
*CFU – jednostka tworząca kolonię
Substancje pomocnicze:
Rozpuszczalnik:
Woda wysokooczyszczona 1 ml Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Liofilizat i rozpuszczalnik do sporządzania zawiesiny doustnej.
Liofilizat: jednorodny, liofilizowany proszek koloru złamanej bieli Rozpuszczalnik: klarowny, bezbarwny płyn
Psy
Czynne uodparnianie psów w wieku 8 tygodni lub starszych w celu zmniejszenia nasilenia objawów klinicznych i siewstwa bakterii związanych z infekcją Bordetella bronchiseptica.
Początek odporności: 3 tygodnie
Czas trwania odporności: 12 miesięcy
Brak.
Szczepić tylko zdrowe zwierzęta.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Produkt zawiera żywe bakterie, podawany jest wyłącznie drogą doustną. Podanie parenteralne może powodować ropnie i zapalenie tkanki łącznej.
Zaszczepione psy mogą rozsiewać szczepionkowy szczep Bordetella bronchiseptica do 35 dni drogą ustno-nosową i przez co najmniej 70 dni w kale.
W związku z atenuowaną formą szczepu w szczepionce, nie jest konieczne trzymanie oddzielnie psów szczepionych i nieszczepionych, jednak należy w tym czasie unikać kontaktu psów o obniżonej odporności z psami szczepionymi.
Wykazano, że bakterie Bordetella bronchiseptica zawarte w szczepionce są bezpieczne dla świń
narażonych na szczep szczepionkowy (np. poprzez kontakt ze szczepionymi psami). Koty narażone na kontakt ze szczepem szczepionkowym (np. poprzez kontakt ze szczepionymi psami) mogą
wykazywać umiarkowane objawy kliniczne takie jak kichanie, wydzielina z nosa i oczu.
Bezpieczeństwo bakterii zawartych w szczepionce, rozsiewanych przez zaszczepione psy nie było badane u innych gatunków zwierząt.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Po podaniu zdezynfekować ręce oraz sprzęt.
Po przypadkowej samoiniekcji podczas rekonstytucji produktu, niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie.
Osoby podające produkt psom powinny być ostrzeżone, że powtórna ekspozycja na produkt może powodować rzadkie reakcje nadwrażliwości.
Osobom o obniżonej odporności zaleca się unikanie styczności ze szczepionką i zaszczepionymi psami w okresie rozsiewania drogą ustno-nosową.
Łagodna wydzielina z oczu może wystąpić rzadko po szczepieniu.
Łagodna, przejściowa biegunka, wymioty, wydzielina z nosa, łagodny, przejściowy kaszel lub letarg mogą wystąpić bardzo rzadko do 14 dni po szczepieniu.
Jeśli zwierzę wykazuje poważniejsze objawy oddechowe, należy wdrożyć odpowiednie leczenie objawowe.
W bardzo rzadkich przypadkach mogą wystąpić reakcje nadwrażliwości. W przypadku wystąpienia takich reakcji należy niezwłocznie wdrożyć odpowiednie leczenie objawowe.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Bezpieczeństwo produktu leczniczego weterynaryjnego stosowanego w czasie ciąży i laktacji nie zostało określone. Z tego powodu nie zaleca się stosowania u suk w czasie ciąży i laktacji.
Nie stosować środków immunosupresyjnych w czasie 1. miesiąca po podaniu produktu. Nie podawać antybiotyków przez 14 dni po szczepieniu.
Wykazano bezpieczeństwo produktu po podaniu w tym samym czasie produktów serii Versican Plus i Vanguard zawierających żywy, psi parwowirus, adenowirus, wirus nosówki i wirus parainfluenzy, jak również inaktywowaną Leptospirę i wirus wścieklizny. Skuteczność po jednoczesnym stosowaniu nie została zbadana.
Brak informacji dotyczących bezpieczeństwa i skuteczności tej szczepionki stosowanej jednocześnie z innym produktem leczniczym weterynaryjnym. Dlatego decyzja o zastosowaniu tej szczepionki przed lub po podaniu innego produktu leczniczego weterynaryjnego powinna być podejmowana indywidualnie.
Podanie doustne.
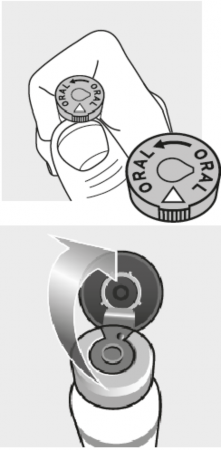
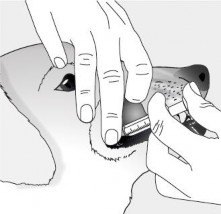
Chwycić fiolkę liofilizatu palcami i położyć kciuk bezpośrednio pod wytłoczonym trójkątem na korku fiolki. | |
Przy użyciu kciuka, unieść korek fiolki do góry od wytłoczonego trójkąta, aby umożliwić dostęp do gumowej zatyczki. Nie usuwać aluminiowego kapsla ani aluminiowego kołnierza, ponieważ nie są one przeznaczone do usunięcia, ale do użycia ze strzykawką i igłą. Aseptycznie rozpuścić liofilizat z rozpuszczalnikiem. Produkt po rekonstytucji powinien być płynem koloru pomarańczowego do żółtego. Wstrząsnąć produkt po rekonstytucji. | |
Pobrać płyn strzykawką i usunąć igłę. Szczepionka powinna być natychmiast zużyta. |
Szczepionkę należy podać doustnie psom w wieku 8 tygodni lub starszym. Sposób i droga podawania:
Głowa psa powinna być przytrzymywana z nosem skierowanym ku górze i otwartą jamą ustną. Podać całą dawkę 1 ml do kieszonki policzkowej (pomiędzy zębami i błoną śluzową dziąseł). |
|
Szczepienie podstawowe:
Szczepienie 1 dawką 1ml na psa od 8. tygodnia życia.
Szczepienie przypominające:
Jedna dawka rocznie.
Nie zaobserwowano innych działań niepożądanych, poza tymi wymienionymi w punkcie 4.6, po podaniu 10-krotnie większej dawki szczepionki.
Nie dotyczy
Grupa farmakoterapeutyczna: Szczepionki dla psowatych, żywe szczepionki bakteryjne Kod ATC vet: QI07AE01.
Żywa szczepionka pobudzająca odporność czynną przeciw Bordetella bronchiseptica u psów.
Nie mieszać z innym produktem leczniczym weterynaryjnym z wyjątkiem rozpuszczalnika do stosowania z tym produktem leczniczym weterynaryjnym.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata. Okres ważności po rekonstytucji zgodnie z instrukcją: zużyć natychmiast.
Przechowywać i transportować w stanie schłodzonym (2˚C – 8˚C). Chronić przed światłem.
Nie zamrażać.
Liofilizat:
Fiolka: fiolka ze szkła typu I
Zamknięcie: korek z gumy chlorobutylowej zabezpieczony aluminiowym kołnierzem i kolorowym, plastikowym kapslem.
Rozpuszczalnik:
Fiolka: fiolka ze szkła typu I
Zamknięcie: korek z gumy chlorobutylowej zabezpieczony aluminiowym kołnierzem i kolorowym, plastikowym kapslem.
Wielkości opakowań:
Pudełko plastikowe zawierające 5 fiolek z 1 dawką liofilizatu i 5 fiolek z 1 ml rozpuszczalnika Pudełko plastikowe zawierające 10 fiolek z 1 dawką liofilizatu i 10 fiolek z 1 ml rozpuszczalnika Pudełko plastikowe zawierające 25 fiolek z 1 dawką liofilizatu i 25 fiolek z 1 ml rozpuszczalnika
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Zoetis Polska Sp. z o.o. Postępu 17 B
02-676 Warszawa
2897/19
/ DATA PRZEDŁUŻENIA POZWOLENIA
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu: 19/07/2019
08/2020
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB STOSOWANIA
Nie dotyczy.