Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazuje działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Arentor DC 250 mg zawiesina dowymieniowa dla krów w okresie zasuszenia
Arentor DC 250mg Intramammary Suspension for Dry Cows (all countries except EE, ES, LV, LT) Arentor secado 250mg Intramammary Suspension for Dry Cows (ES)
Arentor DC (EE, LV, LT)
Każda 3 g tubostrzykawka dowymieniowa zawiera:
Substancja czynna:
Cefalon 250 mg (w postaci cefalonu dwuwodnego)
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Zawiesina dowymieniowa
Zawiesina koloru bladożółto-kremowego
Bydło (krowy w okresie zasuszenia)
Leczenie subklinicznej postaci zapalenia wymienia u krów podczas wchodzenia w okres zasuszenia oraz zapobieganie nowym bakteryjnym zakażeniom gruczołu mlekowego w okresie nielaktacyjnym, spowodowanym przez wrażliwe na cefalon bakterie Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis, Trueperella pyogenes, Escherichia coli i Klebsiella spp.
Nie stosować u zwierząt ze stwierdzoną nadwrażliwością na cefalosporyny, inne antybiotyki ß- laktamowe lub dowolną z substancji pomocniczych.
Patrz pkt. 4.7
Brak
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Produkt należy stosować opierając się na wynikach badań wrażliwości bakterii wyizolowanych z próbek mleka od danego zwierzęcia. Jeśli nie jest to możliwe leczenie należy stosować w oparciu o dane epidemiologiczne (lokalne, regionalne lub z danego gospodarstwa) dotyczące wrażliwości docelowej bakterii.
Zastosowanie produktu odbiegające od instrukcji zawartych w Charakterystyce Produktu Leczniczego Weterynaryjnego może zwiększyć rozpowszechnienie bakterii opornych na cefalon i może obniżyć skuteczność leczenia innymi beta-laktamowymi antybiotykami.’
Protokoły dotyczące leczenia krów w okresie zasuszenia powinny brać pod uwagę lokalne i narodowe wytyczne w zakresie stosowania środków przeciwbakteryjnych i podlegać regularnym inspekcjom weterynaryjnym.
Należy unikać karmienia cieląt mlekiem zawierającym pozostałości cefalonu, co mogłoby wyselekcjonować bakterie oporne na środki przeciwbakteryjne (np. wytwarzające beta-laktamazy), przez okres do końca karencji na mleko, za wyjątkiem fazy pojenia siarą.
Skuteczność produktu określona jest tylko w stosunku do patogenów wymienionych w punkcie 4.2 Wskazania lecznicze. W wyniku tego po okresie zasuszenia może wystąpić poważne, ostre (potencjalnie śmiertelne) zapalenie wymienia spowodowane przez inny gatunek patogenów, szczególnie Pseudomonas aeruginosa. Aby zmniejszyć ryzyko należy skrupulatnie przestrzegać zasad dobrej higieny.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
Penicylina i cefalosporyny mogą w następstwie wstrzyknięcia, inhalacji, połknięcia lub kontaktu ze skórą wywołać uczulenie (alergię). Wrażliwość na penicylinę może prowadzić do wrażliwości krzyżowej na cefalosporyny i odwrotnie. Reakcje alergiczne na te substancje mogą czasem być poważne.
Osoby, które wiedzą, że są uczulone na ten produkt lub którym radzono nie pracować z takimi
produktami nie powinny się z nimi obchodzić.
Z produktem tym należy się obchodzić dokładając wszelkich starań, aby uniknąć wystawienia na jego działanie, stosując wszystkie zalecane środki ostrożności.
Jeśli po wystawieniu na jego działanie pojawią się objawy, takie jak wysypka, należy zwrócić się o pomoc lekarską i pokazać lekarzowi to ostrzeżenie. Obrzęk twarzy, warg lub oczu, albo trudności z oddychaniem, są bardziej poważnymi objawami i wymagają pilnej opieki lekarskiej.
Po użyciu należy umyć ręce.
Chusteczki do higieny strzyków dołączone do dowymieniowego produktu zawierają alkohol izopropylowy. Jeśli wiadomo, lub podejrzewa się, że alkohol izopropylowy wywołuje podrażnienie skóry, należy nosić rękawice ochronne. Należy unikać kontaktu z oczami, ponieważ alkohol izopropylowy powoduje podrażnienie oczu.
W bardzo rzadkich przypadkach u niektórych zwierząt obserwowano natychmiastowe reakcje nadwrażliwości (niepokój, drżenie, obrzęk gruczołu mlekowego, powiek i warg). Reakcje te mogą prowadzić do śmierci.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Produkt przeznaczony jest do stosowania podczas ostatniego trymestru ciąży, po osiągnięciu okresu zasuszenia u krów mlecznych. Nie ma niepożądanych działań na płód.
Produktu nie wolno stosować u krów w okresie laktacji.
Cefalosporyn nie należy stosować jednocześnie z bakteriostatycznymi środkami przeciwbakteryjnymi. Stosowanie cefalosporyn równocześnie z lekami nefrotoksycznymi może zwiększyć toksyczne działanie na nerki.
Podanie dowymieniowe.
Tubostrzykawka dowymieniowa służy tylko do jednorazowego użytku.
Zawartość jednej tubostrzykawki dowymieniowej należy podawać do kanału strzykowego każdej ćwiartki natychmiast po ostatnim udoju w laktacji. Nie zginać dyszy. Należy unikać zanieczyszczenia dyszy po zdjęciu wieczka. Przed podaniem strzyk powinien być dokładnie oczyszczony i zdezynfekowany (np. dołączoną do opakowania chusteczką do higieny strzyków).
Opcja 1: Podanie dowymieniowe z krótką dyszą: trzymając w jednej ręce tłok tubostrzykawki dowymieniowej i podstawę wieczka, odkręcić i zdjąć małą górną część wieczka, znajdującą się nad znakiem nacięcia (podstawowa część wieczka pozostaje na tubostrzykawce dowymieniowej). Należy uważać, by nie zanieczyścić dyszy.
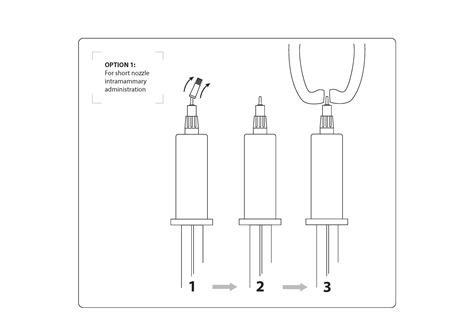
Opcja 2: Podanie dowymieniowe z pełną dyszą: zdjąć całe wieczko trzymając mocno tłok tubostrzykawki dowymieniowej na jednej ręce i pchając kciukiem wieczko do góry wzdłuż całej jego długości, aż wieczko odskoczy z trzaskiem. Należy uważać, by nie zanieczyścić dyszy.
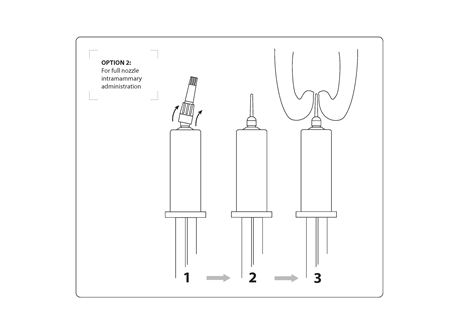
Wprowadzić dyszę do kanału strzykowego i stosować stały nacisk na tłok tubostrzykawki dowymieniowej, aż dostarczona zostanie cała dawka. Trzymając koniec strzyku jedną ręką, drugą ręką łagodnie masować w górę, aby ułatwić rozprzestrzenienie się antybiotyku do ćwiartki.
Po podaniu zalecane jest zanurzenie strzyków w specjalnie do tego celu przeznaczonym antyseptycznym preparacie.
Wielokrotne dawki zastosowane u bydła przez trzy kolejne dni nie wykazały ani nie wywołały żadnych działań niepożądanych.
Tkanki jadalne: 21 dni.
Mleko: 96 godzin po wycieleniu, jeżeli okres zasuszenia jest dłuższy niż 54 dni.
58 dni po leczeniu, jeżeli okres zasuszenia jest krótszy lub wynosi 54 dni
Grupa farmakoterapeutyczna: Inne środki przeciwbakteryjne beta-laktamowe do stosowania dowymieniowego, cefalosporyny pierwszej generacji.
Kod ATC vet: QJ51DB90.
Cefalon jest lekiem przeciwbakteryjnym z grupy cefalosporyn pierwszej generacji, których działanie hamuje syntezę ściany komórkowej (działanie bakteriobójcze). To przeciwbakteryjne działanie nie jest upośledzone w obecności mleka.
Znane są trzy mechanizmy oporności na cefalosporyny: zmniejszona przepuszczalność ściany komórkowej, inaktywacja enzymatyczna i brak specyficznych miejsc wiązania penicyliny. U bakterii Gram-dodatnich, a szczególnie u gronkowców, głównym mechanizmem oporności na cefalosporyny są modyfikacje białek wiążących penicyliny. U bakterii Gram-ujemnych oporność może polegać na produkcji β-laktamaz (o szerokim lub rozszerzonym spektrum działania).
Cefalon działa na Staphylococcus aureus, Streptococcus agalactiae, Streptococcus dysgalactiae, Streptococcus uberis, Trueperella pyogenes, Escherichia coli i Klebsiella spp. wrażliwe na cefalon.
Cefalon jest w znacznym stopniu, ale powoli, wchłaniany z gruczołu mlekowego i wydalany, głównie z moczem. Między 7 a 13% substancji czynnej usuwane jest z moczem każdego z pierwszych trzech dni po podaniu dawki, podczas gdy dzienne wydalanie z kałem wynosi w tym samym okresie <1%.
Średnie stężenie we krwi utrzymuje się na dość stałym poziomie w ciągu około 10 dni po podaniu dawki, co świadczy o powolnym, ale długotrwałym wchłanianiu cefalonu z gruczołu mlekowego.
Długotrwałe utrzymywanie się cefalonu w zasuszonym gruczole mlekowym badane było przez okres 10 tygodni po podaniu. Skuteczny poziom cefalonu pozostawał w wydzielinach gruczołu mlekowego do 10 tygodni po podaniu.
Glinu distearynian
Parafina ciekła
Nie dotyczy
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata.
Nie przechowywać w temperaturze powyżej 25°C.
Barwna tubostrzykawka dowymieniowa z LDPE, z barwną dwuczęściową nasadką z LDPE, zawierająca 3 g produktu.
Wielkości opakowań:
Pudełko tekturowe zawierające 20 tubostrzykawek dowymieniowych i 20 pojedynczo zapakowanych chusteczek do higieny strzyków, nasączonych alkoholem izopropylowym.
Wiaderko zawierające 120 tubostrzykawek dowymieniowych i 120 pojedynczo zapakowanych chusteczek do higieny strzyków, nasączonych alkoholem izopropylowym.
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
Univet Ltd Tullyvin Cootehill
Co. Cavan H16 T183
Irlandia
2909/19
OBROTU/DATA PRZEDŁUŻENIA POZWOLENIA
11/09/2019
03/2019
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB
STOSOWANIA
Nie dotyczy.











