Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU /DATA PRZEDŁUŻENIA POZWOLENIA
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(-a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres (-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Właściwości farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU /DATA PRZEDŁUŻENIA POZWOLENIA
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Metrovis 250 mg tabletki dla psów i kotów
1 tabletka zawiera:
Substancja czynna:
Metronidazol 250 mg
Substancja(-e) pomocnicza(-e):
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Tabletka.
Beżowe, okrągłe tabletki z linią podziału w kształcie krzyża po jednej stronie. Tabletki mogą być dzielone na 2 lub 4 równe części.
Psy i koty.
Leczenie zakażeń układu pokarmowego wywołanych przez Giardia spp. i Clostridium spp. (tj.
C. perfringens lub C. difficile).
Leczenie zakażeń układu moczowo-płciowego, jamy ustnej, gardła oraz skóry wywołanych przez bakterie bezwzględnie beztlenowe (np. Clostridium spp.) wrażliwe na metronidazol.
Nie stosować w przypadku zaburzeń czynności wątroby.
Nie stosować w przypadku nadwrażliwości na substancję czynną lub na dowolną substancję pomocniczą.
Brak.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Ze względu na prawdopodobną zmienność (w czasie, geograficzną) występowania bakterii opornych na metronidazol zalecane jest pobieranie próbek bakteriologicznych i wykonywanie badań wrażliwości.
W miarę możliwości produkt należy stosować wyłącznie w oparciu o badanie wrażliwości.
Produkt leczniczy weterynaryjny powinien być stosowany zgodnie z urzędowymi, krajowymi i lokalnymi przepisami dotyczącymi stosowania antybiotyków.
W bardzo rzadkich przypadkach mogą wystąpić objawy neurologiczne, szczególnie po przedłużonym leczeniu metronidazolem.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Metronidazol wykazuje potwierdzone właściwości mutagenne i genotoksyczne u zwierząt laboratoryjnych i u ludzi. Metronidazol jest potwierdzonym czynnikiem kancerogennym u zwierząt laboratoryjnych i ma potencjalne działanie kancerogenne u ludzi. Brak jest jednak wystarczających dowodów na kancerogenność metronidazolu u ludzi.
Metronidazol może mieć szkodliwy wpływ na nienarodzone dziecko.
Podczas podawania produktu należy nosić nieprzepuszczalne rękawice, aby uniknąć kontaktu produktu ze skórą.
Aby uniknąć przypadkowego połknięcia, szczególnie przez dziecko, niezużyte tabletki i części tabletek należy włożyć z powrotem do otwartego blistra, następnie z powrotem do zewnętrznego opakowania i przechowywać w miejscu niewidocznym i niedostępnym dla dzieci. Po przypadkowym połknięciu, należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub etykietę. Po kontakcie z tabletkami dokładnie umyć ręce.
Metronidazol może powodować reakcje nadwrażliwości. W przypadku znanej nadwrażliwości na metronidazol należy unikać kontaktu z produktem leczniczym weterynaryjnym.
Po podaniu metronidazolu mogą wystąpić następujące działania niepożądane: wymioty, hepatotoksyczność, neutropenia oraz objawy neurologiczne.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Ciąża:
W badaniach na zwierzętach laboratoryjnych uzyskano niespójne wyniki, jeśli chodzi
o teratogenne/embriotoksyczne działanie metronidazolu. Z tego względu stosowanie tego produktu w czasie ciąży nie jest zalecane.
Laktacja:
Metronidazol jest wydalany z mlekiem, dlatego stosowanie w czasie laktacji nie jest zalecane.
Metronidazol może wpływać hamująco na degradację innych leków w wątrobie, takich jak fenytoina, cyklosporyna i warfaryna.
Cymetydyna może zmniejszać metabolizm wątrobowy metronidazolu, prowadząc do podwyższonego stężenia metronidazolu w surowicy.
Fenobarbital może zwiększać metabolizm wątrobowy metronidazolu, prowadząc do obniżonego stężenia metronidazolu w surowicy.
Do podania doustnego.Zalecana dawka wynosi 50 mg metronidazolu na kg masy ciała dziennie przez 5–7 dni. Dzienna dawka może zostać podzielona na dwa podania w ciągu dnia (tj. 25 mg/kg masy ciała dwa razy dziennie).
W celu zapewnienia podania prawidłowej dawki należy możliwie jak najdokładniej ustalić masę ciała. Poniższa tabela ma służyć jako wskazówka odnośnie podawania produktu w zalecanej dawce, albo 50 mg na kg masy ciała, podawanej raz dziennie, albo, co jest preferowane, podawanej dwa razy dziennie po 25 mg na kg masy ciała.
Liczba tabletek | |||
Dwa razy dziennie | Raz dziennie | ||
Masa ciała (kg) | Rano | Wieczorem | |
5 kg | ½ | ½ | 1 |
7,5 kg | ¾ | ¾ | 1 ½ |
10 kg | 1 | 1 | 2 |
12,5 kg | 1 ¼ | 1 ¼ | 2 ½ |
15 kg | 1 ½ | 1 ½ | 3 |
17,5 kg | 1 ¾ | 1 ¾ | 3 ½ |
20 kg | 2 | 2 | 4 |
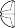


 = ¼ tabletki = ½ tabletki = ¾ tabletki = 1 tabletka
= ¼ tabletki = ½ tabletki = ¾ tabletki = 1 tabletka
Tabletki można podzielić na 2 lub 4 równe części, w celu zapewnienia właściwego dawkowania. Tabletkę umieścić na płaskiej powierzchni, stroną z oznaczeniem skierowaną do góry, a stroną wypukłą (zaokrągloną) skierowaną do powierzchni.
Połówki: nacisnąć kciukami po obu stronach tabletki. Ćwiartki: nacisnąć kciukiem środek tabletki.
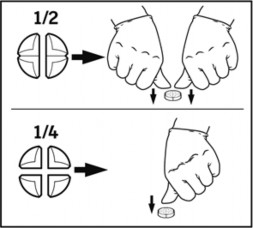
Występowanie działań niepożądanych jest bardziej prawdopodobne przy dawkach i długości leczenia przekraczających zalecany schemat dawkowania. W przypadku wystąpienia objawów neurologicznych należy przerwać leczenie i wdrożyć leczenie objawowe pacjenta.
Nie dotyczy.
Grupa farmakoterapeutyczna: Leki przeciwpierwotniacze przeciwko chorobom wywoływanym przez pierwotniaki, pochodne (nitro-) imidazolu
Kod ATC vet: QP51AA01
Po przeniknięciu metronidazolu do bakterii cząsteczka jest redukowana przez wrażliwe bakterie (beztlenowe). Wytworzone metabolity mają toksyczne działanie na bakterie poprzez wiązanie się z bakteryjnym DNA. Metronidazol ma ogólnie działanie bakteriobójcze na wrażliwe bakterie w stężeniach równych lub nieznacznie większych niż minimalne stężenie hamujące (MIC).
Metronidazol jest niezwłocznie i dobrze wchłaniany po podaniu doustnym. Dostępność biologiczna metronidazolu wynosi prawie 100%.
U psów po 1 godzinie po podaniu pojedynczej dawki doustnej wynoszącej 62 mg/kg m.c. obserwowane jest stężenie Cmax 79,5 µg/ml. Końcowy okres półtrwania w osoczu wynosi około 5,3 godziny (od 3,5 do 7,3 godziny).
U kotów po 1,5 godziny po podaniu pojedynczej dawki doustnej wynoszącej 83 mg/kg m.c. obserwowane jest stężenie Cmax 93,6 µg/ml. Końcowy okres półtrwania w osoczu wynosi około 6,7 godziny (od 5,2 do 8,3 godziny).
Metronidazol dobrze przenika do tkanek i płynów ustrojowych, takich jak ślina, mleko, wydzieliny pochwy i nasienie. Metronidazol jest metabolizowany głównie w wątrobie. W ciągu 24 godzin po podaniu doustnym 35–65% podanej dawki (metronidazol i jego metabolity) jest wydalane z moczem.
Celuloza, mikrokrystaliczna Karboksymetyloskrobia sodowa, typ A Hydroksypropyloceluloza
Drożdże (suszone) Aromat wołowy Magnezu stearynian
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 3 lata Okres ważności podzielonych tabletek: 3 dni
Brak specjalnych środków ostrożności dotyczących przechowywania produktu leczniczego weterynaryjnego.
Blister Aluminium – PVC/PE/PVDC
Pudełko tekturowe zawierające 1, 2, 5, 10, 25 lub 50 blistrów po 10 tabletek Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
LIVISTO Int'l S.L.
Av. Universitat Autònoma 29 08290 Cerdanyola del Vallès Barcelona, Hiszpania
2917/19
25.10.2019
07.2020











