Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
tabletka zawiera:
Substancja czynna:
Tramadolu chlorowodorek 20 mg
co odpowiada 17,6 mg tramadolu
Substancje pomocnicze:
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Docelowe gatunki zwierząt
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia
Specjalne środki ostrożności dotyczące stosowania
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży i laktacji
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
równe części: nacisnąć kciukami po obu stronach tabletki.
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki)
Okres(-y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA OSTATNIEJ AKTUALIZACJI TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO WETERYNARYJNEGO
Tralieve 20 mg tabletki do rozgryzania i żucia dla psów
(AT, BE, BG, CY, CZ, DE, EL, ES, HR, HU, IE, IT, LU, NL, PL, PT, RO, SI, SK, UK)
Tralieve vet 20 mg chewable tablets for dogs (DK, FI, IS, NO, SE, EE, LT, LV)
Tralieve 17,6 mg chewable tablets for dogs (FR)
Tabletka 20 mg:
Tabletka do rozgryzania i żucia.
Tabletka 20 mg: Jasnobrązowa z brązowymi plamkami, okrągła i wypukła, aromatyzowana 7 mm tabletka z linią podziału w kształcie krzyża po jednej stronie.
Tabletki można podzielić na 2 lub 4 równe części.
Psy.
Do zmniejszenia ostrego i przewlekłego bólu tkanek miękkich i mięśniowo-szkieletowego o łagodnym nasileniu.
Nie podawać w połączeniu z trójcyklicznymi lekami przeciwdepresyjnymi, inhibitorami monoaminooksydazy i inhibitorami wychwytu zwrotnego serotoniny.
Nie stosować w przypadkach nadwrażliwości na tramadol lub na dowolną substancję pomocniczą. Nie stosować u zwierząt z padaczką.
Działanie przeciwbólowe chlorowodorku tramadolu może być zmienne. Uważa się, że wynika to
z indywidualnych różnic w metabolizmie leku do głównego aktywnego metabolitu
O-demetylotramadolu. U niektórych psów (niereagujących) może to spowodować, że produkt nie zapewni analgezji. W przypadku przewlekłego bólu należy rozważyć analgezję multimodalną. Psy powinny być regularnie monitorowane przez lekarza weterynarii w celu zapewnienia odpowiedniego złagodzenia bólu. W przypadku ponownego wystąpienia bólu lub niewystarczającej analgezji może być konieczne ponowne rozpatrzenie stosowanego leczenia przeciwbólowego.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Stosować z zachowaniem ostrożności u psów z zaburzeniami czynności nerek lub wątroby. U psów z zaburzeniami czynności wątroby metabolizm tramadolu do aktywnych metabolitów może być mniejszy, co może zmniejszać skuteczność produktu. Jeden z aktywnych metabolitów tramadolu jest wydalany przez nerki i dlatego u psów z zaburzeniami czynności nerek może być konieczne zastosowanie odpowiedniego schematu dawkowania. Podczas stosowania tego produktu należy dokładnie monitorować czynność nerek i wątroby. Długotrwałe leczenie przeciwbólowe należy
w miarę możliwości stopniowo przerywać.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom Tramadol może powodować sedację, nudności i zawroty głowy po przypadkowym połknięciu, zwłaszcza u dzieci. W celu uniknięcia przypadkowego połknięcia, zwłaszcza przez dziecko, niezużyte części tabletki należy włożyć z powrotem do otwartego blistra i do pudełka tekturowego oraz przechowywać w bezpiecznym miejscu niewidocznym i niedostępnym dla dzieci, ponieważ stanowią one zagrożenie dla zdrowia małych dzieci po przypadkowym połknięciu. Po przypadkowym połknięciu, zwłaszcza przez dzieci, należy zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub opakowanie. Po przypadkowym połknięciu przez dorosłych: NIE PROWADZIĆ POJAZDU, ponieważ może wystąpić sedacja.
Osoby o znanej nadwrażliwości na tramadol lub na dowolną substancję pomocniczą powinny unikać kontaktu z produktem leczniczym weterynaryjnym.
Umyć ręce po użyciu.
Często może wystąpić łagodna sedacja i senność, zwłaszcza w przypadku podawania większych dawek.
U psów po podaniu tramadolu sporadycznie obserwowano nudności i wymioty.W rzadkich przypadkach może wystąpić nadwrażliwość. W przypadku reakcji nadwrażliwości należy przerwać leczenie.
W bardzo rzadkich przypadkach tramadol może wywołać drgawki u psów z niskim progiem drgawkowym.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Ciąża:
Badania laboratoryjne u myszy i (lub) szczurów i królików nie wykazały działania teratogennego, toksycznego dla płodu, szkodliwego dla samicy. Do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Laktacja:
Badania laboratoryjne u myszy i (lub) szczurów i królików nie wykazały działania niepożądanego dla rozwoju potomstwa w okresie około- i poporodowym. Do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Płodność:
W badaniach laboratoryjnych u myszy i (lub) szczurów i królików stosowanie tramadolu w dawkach terapeutycznych nie wpływało niekorzystnie na zdolności rozrodcze i płodność u samców i samic. Do stosowania jedynie po dokonaniu przez lekarza weterynarii oceny bilansu korzyści/ryzyka wynikającego ze stosowania produktu.
Jednoczesne podawanie produktu z produktami leczniczymi działającymi depresyjnie na ośrodkowy układ nerwowy może nasilać działanie depresyjne na OUN i układ oddechowy.
Tramadol może zwiększać działanie leków obniżających próg drgawkowy.
Leki hamujące (np. cymetydyna i erytromycyna) lub indukujące (np. karbamazepina) metabolizm z udziałem cytochromu CYP450 mogą wpływać na działanie przeciwbólowe tramadolu. Znaczenie kliniczne tych interakcji nie było badane u psów.
Skojarzenie mieszanych agonistów/antagonistów (np. buprenorfiny, butorfanolu) i tramadolu nie jest zalecane, ponieważ działanie przeciwbólowe czystego agonisty może być teoretycznie zmniejszone w takich okolicznościach.
Patrz również punkt 4.3.
Podanie doustne.
Zalecana dawka to 2-4 mg chlorowodorku tramadolu na kg masy ciała co 8 godzin lub w miarę potrzeb w oparciu o nasilenie bólu.
Minimalny odstęp między dawkami wynosi 6 godzin. Zalecana maksymalna dawka dobowa wynosi 16 mg/kg. Indywidualna reakcja na tramadol jest zmienna i zależy częściowo od dawkowania, wieku pacjenta, indywidualnych różnic w zakresie wrażliwości na ból i stanu ogólnego, dlatego optymalny schemat dawkowania należy indywidualnie dostosować przy użyciu powyższych zakresów dawek i odstępów ponownego leczenia. Pies powinien być regularnie badany przez lekarza weterynarii w celu oceny, czy wymagana jest dodatkowa analgezja, która może być uzyskana poprzez zwiększenie dawki tramadolu aż do osiągnięcia maksymalnej dawki dobowej i (lub) metodą analgezji multimodalnej poprzez dodanie innych odpowiednich leków przeciwbólowych.
Należy stosować odpowiednie moce tabletek, aby zminimalizować liczbę podzielonych tabletek do przechowywania, do czasu podania następnej dawki.
Należy pamiętać, że tabela dawkowania stanowi wytyczną dla dawkowania produktu w górnym zakresie dawek: 4 mg/kg masy ciała Podana jest tu liczba tabletek wymagana do podania 4 mg chlorowodorku tramadolu na kg masy ciała.
Masa ciała | Tramadol 20 mg |
1,25 kg |
|
2,5 kg |
|
3,75 kg |
|
5 kg |
|
6,25 kg |
|
7,5 kg |
|
10 kg |
|
15 kg |
|

= ¼ tabletki  = ½ tabletki
= ½ tabletki  = ¾ tabletki
= ¾ tabletki  = 1 tabletka
= 1 tabletka
Tabletki można dzielić na 2 lub 4 równe części w celu zapewnienia właściwego dawkowania. Tabletkę umieścić na płaskiej powierzchni ze stroną z linią podziału skierowaną do góry i stroną wypukłą (zaokrągloną) skierowaną do powierzchni.
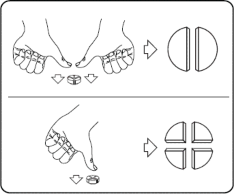
4 równe części: nacisnąć kciukiem w połowie tabletki.
W przypadkach zatrucia tramadolem mogą wystąpić objawy podobne do tych obserwowanych
w przypadku innych działających ośrodkowo leków przeciwbólowych (opioidów). Obejmują one
w szczególności zwężenie źrenic, wymioty, zapaść sercowo-naczyniową, zaburzenia świadomości aż do śpiączki, drgawki i depresję oddechową aż do zatrzymania oddychania.
Ogólne działania w nagłych przypadkach: Utrzymanie drożności dróg oddechowych, wspomaganie czynności serca i układu oddechowego w zależności od objawów. Wywołanie wymiotów w celu opróżnienia żołądka jest odpowiednie. Jeśli zwierzę wykazuje obniżoną świadomość można rozważyć płukanie żołądka. Antidotum na depresję oddechową jest nalokson. Nalokson może jednak nie być przydatny we wszystkich przypadkach przedawkowania tramadolu, ponieważ może tylko częściowo znieść niektóre z jego działań. W przypadku drgawek należy podać diazepam.
Nie dotyczy
Grupa farmakoterapeutyczna: Opioidowe leki przeciwbólowe, inne opioidy
Kod ATCvet: QN02AX02
5.1. Właściwości farmakodynamiczne
Tramadol jest ośrodkowo działającym lekiem przeciwbólowym o złożonym mechanizmie działania wywieranym przez 2 enancjomery i główny metabolit, obejmującym receptory opioidowe, norepinefryny i serotoniny. Enancjomer (+) tramadolu wykazuje małe powinowactwo do receptorów opioidowych µ, hamuje wychwyt serotoniny i zwiększa jej uwalnianie. Enancjomer (-) preferencyjnie hamuje wychwyt ponowny norepinefryny. Metabolit O-demetylotramadol (M1) wykazuje większe powinowactwo do receptorów opioidowych µ.
W przeciwieństwie do morfiny, tramadol nie wywieradziałania depresyjnego na oddychanie dla szerokiego zakresu dawek przeciwbólowych. Również nie ma wpływu na perystaltykę przewodu pokarmowego. Wpływ na układ sercowo-naczyniowy jest zwykle łagodny. Siła działania przeciwbólowego tramadolu wynosi około 1/10 do 1/6 siły działania morfiny.
5.2 Właściwości farmakokinetyczne
Tramadol jest łatwo wchłaniany: Po podaniu doustnym pojedynczej dawki 4,4 mg chlorowodorku tramadolu na kg masy ciała szczytowe stężenie w osoczu wynoszące 65 ng tramadolu na ml było uzyskane w ciągu 45 minut. Pokarm nie wpływa znacząco na wchłanianie leku.
Tramadol jest metabolizowany w wątrobie na drodze demetylacji z udziałem cytochromu P450, a następnie sprzęgania z kwasem glukuronowym. U psów tworzone są mniejsze poziomy aktywnego metabolitu O-demetylotramadolu niż u ludzi. Eliminacja następuje głównie przez nerki z okresem półtrwania w fazie eliminacji wynoszącym około 0,5-2 godzin.
Celuloza mikrokrystaliczna Laktoza jednowodna
Karboksymetyloskrobia sodowa (typ A) Magnezu stearynian
Krzemionka koloidalna uwodniona
Aromat kurczaka Drożdże (suszone)
Nie dotyczy.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata.
Okres ważności podzielonych tabletek po pierwszym otwarciu opakowania bezpośredniego: 3 dni.
Nie przechowywać w temperaturze powyżej 30°C.
Przechowywać w oryginalnym opakowaniu w celu ochrony przed wilgocią.
Blister Aluminium/PCV/PE/PVDC
Pudełko tekturowe zawierające 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 lub 25 blistrów po 10 tabletek.
Pudełko tekturowe zawierające 10 oddzielnych pudełek tekturowych. W każdym z pudełek znajdują się
3 blistry po 10 tabletek
Niektóre wielkości opakowań mogą nie być dostępne w obrocie.
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny
z obowiązującymi przepisami.
Dechra Regulatory B.V. Handelsweg 25
5531 AE Bladel
Holandia
Pozwolenie: 2979/20
/ DATA PRZEDŁUŻENIA POZWOLENIA
20-05-2020
ZAKAZ WYTWARZANIA, IMPORTU, POSIADANIA, SPRZEDAŻY, DOSTAWY I/LUB
STOSOWANIA
Nie dotyczy.