Spis treści:
- NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
- SKŁAD JAKOŚCIOWY I ILOŚCIOWY
- POSTAĆ FARMACEUTYCZNA
- SZCZEGÓŁOWE DANE KLINICZNE
- WŁAŚCIWOŚCI FARMAKOLOGICZNE
- DANE FARMACEUTYCZNE
- NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
- NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
- DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
CHARAKTERYSTYKA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
NAZWA PRODUKTU LECZNICZEGO WETERYNARYJNEGO
SKŁAD JAKOŚCIOWY I ILOŚCIOWY
POSTAĆ FARMACEUTYCZNA
SZCZEGÓŁOWE DANE KLINICZNE
Gatunki docelowe
Wskazania lecznicze dla poszczególnych docelowych gatunków zwierząt
Przeciwwskazania
Specjalne ostrzeżenia dla każdego z docelowych gatunków zwierząt
Specjalne środki ostrożności dotyczące stosowania
Enrofloksacyna i kwas sorbinowy mogą powodować nadwrażliwość (reakcje alergiczne). Osoby o znanej nadwrażliwości na enrofloksacynę lub jakąkolwiek substancję pomocniczą powinny unikać kontaktu z produktem leczniczym weterynaryjnym.
Ten produkt leczniczy weterynaryjny może podrażniać skórę i oczy.
Unikać kontaktu produktu leczniczego weterynaryjnego ze skórą i oczami. W razie przypadkowego kontaktu ze skórą i (lub) oczami należy natychmiast zmyć wodą wszelkie pozostałości produktu ze skóry lub oczu.
W trakcie podawania produktu leczniczego weterynaryjnego nie należy jeść, pić oraz palić.
Po spożyciu enrofloksacyna może wpływać niekorzystnie na układ pokarmowy, powodując na przykład ból brzucha i biegunkę. W celu uniknięcia przypadkowego połknięcia, zwłaszcza przez dziecko, nie należy pozostawiać strzykawki zawierającej roztwór w miejscu widocznym i dostępnym przez dzieci. Wykorzystaną strzykawkę należy przechowywać wraz z produktem w oryginalnym pudełku tekturowym. Po przypadkowym połknięciu należy niezwłocznie zwrócić się o pomoc lekarską oraz przedstawić lekarzowi ulotkę informacyjną lub etykietę.
Po użyciu umyć ręce.
Działania niepożądane (częstotliwość i stopień nasilenia)
bardzo często (więcej niż 1 na 10 leczonych zwierząt wykazujących działanie(a) niepożądane)
często (więcej niż 1, ale mniej niż 10 na 100 leczonych zwierząt)
niezbyt często (więcej niż 1, ale mniej niż 10 na 1 000 leczonych zwierząt)
rzadko (więcej niż 1, ale mniej niż 10 na 10 000 leczonych zwierząt)
bardzo rzadko (mniej niż 1 na 10 000 leczonych zwierząt, włączając pojedyncze raporty).
Stosowanie w ciąży, laktacji lub w okresie nieśności
Interakcje z innymi produktami leczniczymi i inne rodzaje interakcji
Dawkowanie i droga(i) podawania
Przedawkowanie (objawy, sposób postępowania przy udzielaniu natychmiastowej pomocy, odtrutki), jeśli konieczne
Okres(y) karencji
WŁAŚCIWOŚCI FARMAKOLOGICZNE
Właściwości farmakodynamiczne
Dane farmakokinetyczne
DANE FARMACEUTYCZNE
Wykaz substancji pomocniczych
Główne niezgodności farmaceutyczne
Okres ważności
Specjalne środki ostrożności podczas przechowywania
Rodzaj i skład opakowania bezpośredniego
Specjalne środki ostrożności dotyczące usuwania niezużytego produktu leczniczego weterynaryjnego lub pochodzących z niego odpadów
NAZWA I ADRES PODMIOTU ODPOWIEDZIALNEGO
NUMER(-Y) POZWOLENIA NA DOPUSZCZENIE DO OBROTU
DATA WYDANIA PIERWSZEGO POZWOLENIA NA DOPUSZCZENIE DO OBROTU / DATA PRZEDŁUŻENIA POZWOLENIA
Enrocat flavour 25 mg/ml zawiesina doustna dla kotów
Enrocat flavour 25 mg/ml oral suspension for cats [AT, BG, CZ, DE, DK, EL, ES, HU, IE, IS, IT, LT, LV, PT, RO, SI, UK]
Enrocat flavour, 25 mg/ml oral suspension for cats [EE] Enrocat vet 25 mg/ml oral suspension for cats [FI]
Każdy ml zawiera:
Substancja czynna:
Enrofloksacyna 25 mg
Substancje pomocnicze:
Kwas sorbinowy (E200) 1 mg
Wykaz wszystkich substancji pomocniczych, patrz punkt 6.1.
Zawiesina doustna
Zawiesina biała do jasnożółtej.
Koty
Leczenie pojedynczych lub mieszanych zakażeń bakteryjnych układu oddechowego, pokarmowego i moczowego, zapalenia ucha zewnętrznego, zakażeń skóry i ran wywołanych przez następujące bakterie Gram-dodatnie i Gram-ujemne wrażliwe na enrofloksacynę: Staphylococcus spp., Escherichia coli, Haemophilus spp. oraz Pasteurella spp.
Nie stosować u zwierząt z istniejącym zaburzeniem wzrostu chrząstki.
Nie stosować u zwierząt z napadami drgawkowymi w przeszłości, ponieważ enrofloksacyna może powodować stymulację ośrodkowego układu nerwowego (OUN).
Nie stosować u zwierząt ze stwierdzoną nadwrażliwością na fluorochinolony lub na dowolną substancję pomocniczą.
Nie stosować u zwierząt w wieku poniżej 8 tygodni.
Brak.
Specjalne środki ostrożności dotyczące stosowania u zwierząt
Fluorochinolony powinny być zarezerwowane do leczenia przypadków klinicznych, które słabo reagowały lub oczekuje się, że będą słabo reagować na inne klasy antybiotyków.
Jeśli tylko jest to możliwe, stosowanie fluorochinolonów powinno się opierać na badaniach lekowrażliwości.
Stosowanie produktu niezgodnie z zaleceniami podanymi w ChPLW może prowadzić do zwiększenia częstości występowania bakterii opornych na fluorochinolony i może zmniejszyć skuteczność leczenia innymi chinolonami z powodu potencjalnej oporności krzyżowej.
Podczas stosowania produktu należy przestrzegać oficjalnych oraz lokalnych zaleceń polityki stosowania środków przeciwdrobnoustrojowych.
W przypadkach ropnego zapalenia skóry należy zidentyfikować i leczyć możliwe choroby pierwotne. Enrofloksacyna jest częściowo wydalana przez nerki; podobnie jak w przypadku wszystkich fluorochinolonów, wydalanie może być zatem opóźnione u osobników z istniejącym uszkodzeniem nerek.
Produkt leczniczy weterynaryjny należy stosować ostrożnie u zwierząt z ciężkimi zaburzeniami czynności nerek lub wątroby.
Po przekroczeniu zalecanej dawki mogą wystąpić efekty retinotoksyczne, w tym ślepota.
Nie stosować w przypadkach stwierdzonej oporności na chinolony lub fluorochinolony ze względu na prawie całkowitą oporność krzyżową na chinolony i całkowitą oporność krzyżową na fluorochinolony.
Specjalne środki ostrożności dla osób podających produkt leczniczy weterynaryjny zwierzętom
W bardzo rzadkich przypadkach można zaobserwować łagodne i przemijające zaburzenia układu pokarmowego, takie jak nadmierne ślinienie, wymioty lub biegunka. W rezultacie może wystąpić anoreksja.
Mogą wystąpić reakcje nadwrażliwości.
W bardzo rzadkich przypadkach mogą również wystąpić objawy neurologiczne (drgawki, drżenia, ataksja, pobudzenie) i reakcje anafilaktyczne.
Częstotliwość występowania działań niepożądanych przedstawia się zgodnie z poniższą regułą:
Badania laboratoryjne u szczurów i szynszyli nie wykazały działania teratogennego, fetotoksycznego lub toksycznego dla ciężarnej samicy. Ponieważ bezpieczeństwo nie zostało ocenione u ciężarnych
kotek, a enrofloksacyna przenika do mleka matki, stosowanie tego produktu leczniczego weterynaryjnego nie jest zalecane w okresie ciąży i laktacji.
Połączenie produktu leczniczego weterynaryjnego (enrofloksacyny) z chloramfenikolem, antybiotykami makrolidowymi lub tetracyklinami może wywoływać działanie antagonistyczne. Jednoczesne podawanie substancji zawierających magnez lub glin może zmniejszać wchłanianie enrofloksacyny. Te produkty lecznicze weterynaryjne należy podawać w odstępie dwóch godzin. Jednoczesne podawanie teofiliny wymaga starannego monitorowania, ponieważ stężenie teofiliny w surowicy może wzrosnąć.
Należy unikać jednoczesnego stosowania z digoksyną, ponieważ fluorochinolony mogą zwiększać biodostępność digoksyny.
Równoczesne podawanie fluorochinolonów może nasilać działanie doustnych leków przeciwzakrzepowych.
Jednoczesne podawanie fluorochinolonów w połączeniu z niesteroidowymi lekami przeciwzapalnymi (NLPZ) u zwierząt może prowadzić do drgawek z powodu potencjalnych interakcji farmakodynamicznych w OUN.
U zwierząt poddanych nawodnieniu należy unikać nadmiernej zasadowości moczu.
Podanie doustne.
Produkt leczniczy weterynaryjny należy podawać bezpośrednio na tylną część języka zwierzęcia, a nie razem z karmą.
Dawka wynosi 5 mg enrofloksacyny na kg masy ciała raz dziennie przez 5 kolejnych dni. Odpowiada to 0,2 ml produktu leczniczego weterynaryjnego na kg masy ciała raz dziennie przez 5 kolejnych dni. W chorobach przewlekłych i ciężkich czas leczenia można wydłużyć do 10 dni.
Leczenie należy ponownie przeanalizować, jeśli po 3 dniach leczenia nie obserwuje się poprawy klinicznej.
Aby zapewnić prawidłowe dawkowanie, należy jak najdokładniej określić masę ciała, aby uniknąć przedawkowania lub podania zbyt niskiej dawki.
Nie przekraczać zalecanej dawki. Rycina 1: Podawanie produktu
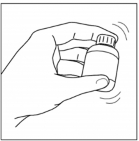
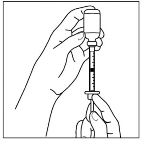
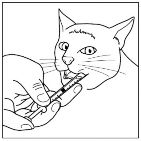
Przed użyciem silnie wstrząsać przez 15 sekund
Pobrać strzykawką odpowiednią dawkę
Podawać bezpośrednio na tył języka
Aby uniknąć zanieczyszczenia krzyżowego, nie należy używać tej samej strzykawki u różnych zwierząt. Zatem jedną strzykawkę należy stosować tylko u jednego zwierzęcia. Po podaniu strzykawkę należy umyć wodą z kranu i przechowywać razem z produktem leczniczym weterynaryjnym w pudełku tekturowym.
Do każdego opakowania produktu leczniczego weterynaryjnego dołączona jest strzykawka o pojemności 3 ml z podziałką co 0,1 ml.
Nie przekraczać zalecanej dawki. W przypadku przedawkowania mogą wystąpić zaburzenia przewodu pokarmowego (wymioty, biegunka lub ślinotok) lub zmiany w OUN (rozszerzenie źrenic, ataksja). W ciężkich przypadkach może być konieczne przerwanie leczenia.
Wykazano, że po otrzymaniu dawek większych niż zalecane obserwowano uszkodzenie oczu u kotów. Przy dawkach 20 mg/kg masy ciała dziennie lub wyższych toksyczny wpływ na siatkówkę może u kota prowadzić do nieodwracalnej ślepoty.
W celu zmniejszenia wchłaniania enrofloksacyny zaleca się jednoczesne podawanie leków zobojętniających, które zawierają magnez lub glin.
Nie dotyczy
Grupa farmakoterapeutyczna: Środki przeciwbakteryjne do stosowania ogólnego, fluorochinolony Kod ATC vet: QJ01MA90
Mechanizm działania
Dwa enzymy niezbędne w replikacji i transkrypcji DNA, gyraza DNA i topoizomeraza IV, zostały zidentyfikowane jako cele molekularne fluorochinolonów. Docelowa inhibicja jest spowodowana przez niekowalentne wiązanie cząsteczek fluorochinolonów do tych enzymów. Ruch widełek replikacyjnych i kompleksów translacyjnych ulega zahamowaniu przez kompleksy enzym-DNA- fluorochinolon, a inhibicja syntezy DNA i mRNA wywołuje zjawiska prowadzące do szybkiej, zależnej od stężenia leku śmierci bakterii patogennych. Mechanizm działania enrofloksacyny jest bakteriobójczy, a aktywność bakteriobójcza zależy od stężenia.
Spektrum przeciwbakteryjne
Enrofloksacyna wykazuje działanie przeciwbakteryjne wobec następujących bakterii Gram-dodatnich i Gram-ujemnych wrażliwych na enrofloksacynę: Staphylococcus spp., Escherichia coli, Haemophilus spp. oraz Pasteurella spp.
Rodzaje i mechanizmy oporności
Stwierdzono, że oporność na fluorochinolony pochodzi z pięciu źródeł: (i) mutacji punktowych w genach kodujących gyrazę DNA i (lub) topoizomerazę IV, prowadzących do zmian odpowiedniego enzymu, (ii) zmian przepuszczalności błony komórkowej bakterii Gram-ujemnych dla leku, (iii) mechanizmów usuwania leków, (iv) oporności uwarunkowanej plazmidem i (v) białek chroniących gyrazę. Wszystkie mechanizmy prowadzą do obniżenia wrażliwości bakterii na fluorochinolony.
Często występuje oporność krzyżowa na antybiotyki z klasy fluorochinolonów. Instytut Standardów Klinicznych i Laboratoryjnych (CLSI) ustalił weterynaryjne punkty graniczne dla enrofloksacyny, aby umożliwić międzynarodowo zharmonizowaną ocenę danych MIC (minimalnego stężenia hamującego).
Dla kotów CLSI ustaliło wartości graniczne enrofloksacyny S (wrażliwość): ≤0,5 µg/ml, I: 1–2 µg/ml i R (oporność): ≥4 μg/ml w przypadku infekcji skóry i tkanek miękkich.
Enrofloksacyna wykazuje wysoką ogólną biodostępność po podaniu doustnym wynoszącą >80%. Po podaniu doustnym maksymalne stężenie substancji czynnej osiągane jest po około godzinie.
Fluorochinolony w dużym stopniu dyfundują do płynów ustrojowych i tkanek, osiągając stężenia wyższe niż w osoczu. Ponadto są szeroko dystrybuowane do skóry, kości i nasienia, docierają do przedniej i tylnej komory oka; przekraczają barierę łożyskową i barierę krew-mózg. Gromadzą się również w fagocytach (makrofagi pęcherzykowe, neutrofile). Wiązanie enrofloksacyny z białkami w surowicy wynosi 40%.
Metabolizm różni się w zależności od gatunku i wynosi około 50–60%. Metabolizm enrofloksacyny na poziomie wątroby powoduje powstanie aktywnego metabolitu, jakim jest cyprofloksacyna.
Wydalanie odbywa się przez żółć i nerki, przy czym te ostatnie stanowią drogę główną. Wydalanie nerkowe odbywa się przez filtrację kłębuszkową, a także aktywną sekrecję kanalikową poprzez pompy anionowe.
Kwas sorbinowy (E200) Karmeloza sodowa Guma ksantan Polisorbat 80
Aromat wołowy Woda oczyszczona
Ponieważ nie wykonywano badań dotyczących zgodności, tego produktu leczniczego weterynaryjnego nie wolno mieszać z innymi produktami leczniczymi weterynaryjnymi.
Okres ważności produktu leczniczego weterynaryjnego zapakowanego do sprzedaży: 2 lata Okres ważności po pierwszym otwarciu opakowania bezpośredniego: 1 miesiąc
Brak specjalnych środków ostrożności dotyczących przechowywania.
Butelka z polietylenu o wysokiej gęstości (HDPE), zamykana gwintowanym korkiem zabezpieczającym przed dostępem dzieci wykonanym z polipropylenu (PP) i zatyczką z polietylenu o niskiej gęstości (LDPE) z doustną strzykawką dozującą z cylindrem z HDPE.
Wielkość opakowania:
Pudełko tekturowe zawierające 1 butelkę o pojemności 8,5 ml i strzykawkę doustną o pojemności 3 ml
Niewykorzystany produkt leczniczy weterynaryjny lub jego odpady należy usunąć w sposób zgodny z obowiązującymi przepisami.
LIVISTO Int’l, S.L.
Av. Universitat Autònoma, 29
08290 Cerdanyola del Vallès (Barcelona) Hiszpania
Nr pozwolenia:
Data wydania pierwszego pozwolenia na dopuszczenie do obrotu:











